Mekanik og Termodynamik Dispositioner
|
|
|
- Holger Krog
- 7 år siden
- Visninger:
Transkript
1 Mekanik og Termodynamik Dispositioner Michael Lind Mortensen, illio 20. januar 2011
2 Indhold 1 Dynamik og energi for rotationel bevægelse Disposition Detaljer Rotationel bevægelse - Perspektiv Kinetisk energi af et stift roterende legeme Inertimomentet Kraftmoment Rotationel analog til Newtons 2. lov Kombineret translatorisk og rotationel bevægelse Arbejde og effekt Impulsmoment og gyroskopet Disposition Detaljer Impulsmoment Sammenhæng med kraftmoment Samlede størrelse af impulsmoment for et legeme Impulsmomentbevarelse Gyroskopet Mekanisk ligevægt og elasticitet Disposition Detaljer Ligevægt Tyngdepunkt Elasticitet Begrænsninger ved Hookes lov Gravitation og planetbevægelse Disposition Detaljer Newtons Gravitationslov Vægt og vægtløshed Gravitationel Potentiel Energi Sorte huller Satelitbaner Keplers love Periodisk bevægelse Disposition Detaljer Periodiske bevægelser
3 5.2.2 Simpel harmonisk bevægelse Energien i harmonisk bevægelse Penduler Dæmpede svingninger Fluid mekanik Disposition Detaljer Densitet og Tryk Dybde og Pascals lov Opdrift Flow Turbulens og viskositet Kontinuitetslignignen Bernoullis ligning Reynolds tal & Poiseuilles lov Temperatur, termisk udvidelse, varme og faseovergange Disposition Detaljer Temperatur Termisk udvidelse Varme Faseovergange Kinetisk gasteori og tilstandsligninger Disposition Detaljer Tilstandsligninger Idealgasligningen Van der Waals gasligning pv-diagrammer Kinetisk gasteori Udledelse af trykformel Energi i kinetisk gasteori Anvendelse: Varmekapacitet Krafterne mellem to molekyler Faseovergange Varmekapacitet for gasser og faste stoffer, C P og C V Disposition Detaljer Varmekapacitet
4 9.2.2 Estimering af molær varmekapacitet vha. kinetisk gasteori Varmekapacitet af en idealgas Termodynamikkens første hovedsætning, termodynamiske processer Disposition Detaljer Termodynamikkens 1. hovedsætning Termodynamiske processer Termodynamik og idealgasser Termodynamikkens anden hovedsætning, Carnot-cyklen, entropi Disposition Detaljer Reversible og irreversible processer Varmemaskinen og dens effektivitet Otto-cyklen Kølemaskinen og dens effektivitet Entropi Termodynamikkens 2. hovedsætning Carnot-cyklen
5 1 Dynamik og energi for rotationel bevægelse 1.1 Disposition 1. Rotationel bevægelse - Perspektiv Paralleller til linear mekanik Korte definitioner Stift legeme 2. Kinetisk energi af et stift roterende legeme Husk def. Inertimoment 3. Inertimomentet Kan slås op i bogen Parallel-akse Teoremet Kort nævn Vinkelret-akse Teoremet 4. Kraftmoment Vektordefinition Udregning af kraftmomentet 5. Rotationel analog til Newtons 2. lov Husk: Gælder kun for stift legeme. 6. Kombineret translatorisk og rotationel bevægelse Kinetisk energi Rullende friktion 7. Arbejde og effekt 1.2 Detaljer Her følger detaljerne for denne givne disposition Rotationel bevægelse - Perspektiv Nu hvor emnet handler om rotationel bevægelse, så lad os starte med at få de mest basale definitioner på plads her. 5
6 Paralleller til linear mekanik Rotationel bevægelse har mange ligheder imellem sig og linear mekanik. Faktisk kan de samme formler fra linear mekanik mere eller mindre bruges her, såfremt man blot laver en simpel variabelomskrivning som følger: x θ v ω a α m I Hvor den sidste ovenfor er Inertimomentet I, som jeg kommer ind på senere. Det betyder følgende formler for konstant-acceleration fra linear mekanik: x = x 0 + v 0x t a xt 2 x x 0 = 1 2 (v x + v 0x )t v x = v 0x + a x t v 2 x = v 2 0x + 2a x (x x 0 ) Bliver til følgende i rotationel bevægelse med konstant acceleration: θ = θ 0 + ω 0z t α zt 2 θ θ 0 = 1 2 (ω z + ω 0z )t ω z = ω 0z + α z t ω 2 z = ω 2 0z + 2α z (θ θ 0 ) Herudover gælder der samme sammenhæng mellem position, hastighed og acceleration som normalt, altså at (om en rotationel akse z): ω z = θ z = dθ dt α z = ω z = dω z dt = d2 θ dt 2 6
7 Korte definitioner Udover sammenhængen med linear mekanik, så er der også en række vigtige grundlæggende definitioner vi lige kort skal opsummere. Da alle definitioner i rotationel bevægelse bygger på (9.1): θ = s r Hvor s er længden af en bue på cirklen i cirkelbevægelsen. Så skal man være opmærksom på at alle formler antager vinkler opskrives i radianer og intet andet. Ellers fås forkerte resultater. Moving on.. Hastigheden af et givent punkt på et stift legeme der roteres er som følgende: v = rω Hvorved punkter ind mod centrum har en lavere linear hastighed end længere ude på legemet. Vær opmærksom på her, at der med ω menes skalarværdien af ω z. Altså kan ω aldrig være negativ. Hastighedsvektoren v er altid en tangent til cirklen med retning i rotationsretningen. Udover denne definition har vi også a tan og a rad, henholdsvis den tangentielle og centripetale acceleration. Den tangentielle acceleration a tan er altid parallel til hastighedsvektoren v og bidrager til at ændre magnituden af hastighedsvektoren (i.e. den absolutte hastighed). a tan defineres derfor som ændring i hastighed over tid: a tan = dv dt = r dω dt = rα Hvor vi har indsat udtrækket for v ovenfor. a rad, som altid peger ind mod rotationsaksen, er forbundet til ændringer af hastighedsvektorens retning og kan udledes til at være: a rad = v2 r (1) = ω 2 r (2) 7
8 Stift legeme Et stift legeme er en idealisering af virkelige legemer, hvor man ignorerer effekter af deformering. Sagt på en anden måde betyder det, at afstanden mellem to punkter på legemet er den samme uafhængig af bevægelse. Et legeme vil ofte kunne antages at være et stift legeme, såfremt det bevæger sig med en non-relativistisk hastighed (i.e. markant mindre end lysets hastighed). Denne idealisering gør visse beregninger nemmere og udledninger, så som beregning af den kinetiske energi Kinetisk energi af et stift roterende legeme Et stift legeme er en masse i bevægelse, hvorved den har en kinetisk energi. Denne energi kan udregnes vha. vinkelhastigheden ω, samt konceptet af Inertimomentet I. En formel for kinetisk energi bestående af disse komponenter kan findes ved at forestille os legemet som bestående af en mængde partikler med masser m 1, m 2,..., m n og vinkelrette distancer r 1, r 2,..., r n til rotationsaksen. Som vi så tidligere, så når et stift legeme roterer, så er hastigheden af det i te partikel: v i = r i ω Hvor ω er vinkelhastigheden af det stive legeme. Alle partikler har samme ω da legemet ellers ikke ville være stift, men har varierende v i og r i. Vi kan så opskrive den kinetiske energi af hver af disse partikler således: K i = 1 2 m iv 2 i = 1 2 m ir 2 i ω 2 Hvor vi har indsat formlen for v i ovenfor. Den totale kinetiske energi K for det stive legeme er nu summen af alle partiklers kinetiske energi, altså: K = i = i K i 1 2 m ir 2 i ω 2 = 1 2 ( i m i r 2 i )ω 2 Udtrykket i parantes ovenfor er nu det vi kalder Inertimomentet I, altså summen af alle partiklers masse gange deres kvadrerede afstand til rotationsaksen. 8
9 Man kan altså opskrive den kinetiske energi af et stift roterende legeme som: K = 1 2 Iω2 Hvor I så afhænger af legemets form, samt rotationsaksen Inertimomentet Inertimomentet har således stor betydning for den kinetiske energi i rotationsbevægelsen. Vi ved også, at et legemes kinetiske energi svarer til den mængde arbejder skulle til for at sætte den i bevægelse. Så vi kan se at jo større inertimoment, jo sværere er det at sætte en rotation i gang, men ligeledes jo sværere er det at stoppe den igen. Værdier for I kan findes i bogen, men disse er for legemer der er uniforme - altså hvor densiteten antages at være den samme overalt i det faste materiale af legemet. Det gør at man blot kan placere rotationsaksen ned igennem midten af legemet og så bruge en simpel værdi for I som f.eks. I = 1 2 MR2 for en solid cylinder. I virkeligheden vil uniform densitet ofte være en urealistisk antagelse og i virkeligheden har et legeme mangle inertimomenter, alt afhængig af rotationsaksen der vælges. Parallel-akse Teoremet Vælges en anden rotationsakse P end ned gennem massecentrum CM, så kan inertimomentet her nemt udregnes vha. Parallel-akse teoremet således: I P = I CM + Md 2 Hvor M er massen af legemet og d er distancen mellem P og CM. Beviset for dette teorem udelades grundet tilgængelig tid Kraftmoment Nu vi har set på hvordan rotationel bevægelse fungerer statisk med konstant acceleration ved et stift legeme, så lad os nu gå videre og kigge på dynamiken i rotationel bevægelse, startende med konceptet af et kraftmoment, eller Torque, som det kaldes på engelsk. Kraftmomentet er i hvor høj grad en given kraft har tendens til at rotere et legeme omkring en akse. Ligesom der i linear mekanik skal bruges en 9
10 kraft for at skubbe eller hive et legeme i bevæglse, så skal der her bruges et kraftmoment for at hive eller skubbe på en løftestangs-arm for at skabe en rotation omkring aksen. I den sammenhæng er ikke blot størrelsen af kraften og retningen vigtig, men også hvor den bliver pålagt. Dette illustreres af ovenstående tegning. Her kan vi se 3 forskellige krafter pålagt en skruenøgle, hvor det er tydeligt kraft F b ville være den mest effektive, hvorimod en kraft som kraft F c ville være helt nyttesløs. Et kraftmoment skal således bruge en løftestangsarm, en retning og en magnitude af kraften, hvorved vi kan opskrive definitionen af kraftmomentvektoren således: τ = r F Hvor F er kraftvektoren, r er positionsvektoren til punktet hvorpå kraftvektoren påføres og τ er det resulterende kraftmoment. Vi kan således også se, at τ er vinkelret i forhold til både r og F, og dens præcise retning kan findes vha. højre-hånds reglen. En illustration af kraftmoment konceptet kan ses her: 10
11 Hvis man så vil udregne magnituden af dette kraftmoment τ så kan det gøres på 3 forskellige måder: τ = F l τ = F r sin(φ) τ = F tan r Hvor l = r sin(φ) er løftestangsarmen, F er magnituden af kraftvektoren F og F tan er det tangentielle komponent af F vinkelret på r. Her skal man dog først beslutte sig for hvilken retning af kraftmoment er positiv (i.e. er med uret eller mod uret den positive retning). Enheden for kraftmoment er Newton meter (N m), hvilket ofte skrives som Joule (J) når vi taler om energi eller arbejde. Men da det her hverken handler om energi eller arbejde, så noterer man blot kraftmoment som Newton meter Rotationel analog til Newtons 2. lov Med definitionen på et kraftmoment på plads, så kan vi nu gå videre og udlede en af de fundamentale sætninger i rotationel dynamik af stive legemer. Vi vil vise at vinkelaccelerationen af et roterende stift legeme er direkte propertionel til summen af alle kraftmoment-komponenter langs rotationsaksen. Denne proportionalitetsfaktor er Inertimomentet I. Vi prøver altså på at vise følgende: τz = Iα z Hvis vi forstiller os vi har et legeme bestående af et stort antal partikler, hver med masse m i og distance r i til rotationsaksen z. Så kan vi bruge disse til at bevise ovenstående. Vi tager udgangspunkt i partikel 1 med masse m 1 og afstand r 1 til rotationsaksen. Den resulterende kraft på denne partikel har et komponent F 1,rad 11
12 i den radiale retning, et komponent F 1,tan der tangerer cirklen med radius r 1 hvori partiklen bevæger sig og et komponent F 1z langs rotationsaksen. Situationen er illustreret herunder: Vi kan se at kun F 1,tan bidrager med et kraftmoment mht. z-aksen, hvorved vi bruger Newtons anden lov herpå: F 1,tan = m 1 a 1,tan Vi ved fra tidligere, at vi kan udtrykke den tangentielle acceleration som a tan = rα, hvorved ovenstående bliver: F 1,tan = m 1 r 1 α z Vi ganger herefter begge sider med r 1, hvorved vi får: F 1,tan r 1 = m 1 r 2 1α z Vi kan nu se, delen ovenfor med m 1 r 2 1 er det samme som I 1, altså inertimomentet for den partikel. Derved får vi: τ 1z = I 1 α z = m 1 r 2 1α z Denne opstilling kunne vi så lave for alle partikler i legemet og tage summen heraf som følgende: τiz = ( m i r 2 i )α z Den venstre side af ligningen er nu det samlede kraftmoment mht. rotationsaksen på alle partikler og den højre side er I = m i ri 2, det samlede inertimoment for legemet omkring rotationsaksen, ganget med vinkelaccelerationen, som er den samme for alle partikler i legemet da det er et stift legeme. 12
13 Altså har vi i sidste ende: τz = Iα z Som er den rotationelle analog af Newtons 2. lov for et stift legeme. Vi kan ligeledes se at denne konklusion passer overens med vores initielle kommentarer ang. parallelerne til linear mekanik (i.e. det at kunne bytte m om med I og a om med α.) Her bør det nævnes at a z skal angives i rad/s 2 grundet vi udledte den fra a tan = rα z, samt at τ z kun indeholder eksterne kraftmomenter, da interne kraftmomenter imellem partikler udligner hinanden pga. Newtons 3. lov og antagelsen om et stift legeme. (i.e. Interne krafter som ethvert par af partikler udøver på hinanden i et stift legeme, er lig med hinanden og modsatrettede) Kombineret translatorisk og rotationel bevægelse Indtil videre har vi kun kigget på situationer med en stationær rotationel akse. Men hvad nu hvis rotationsaksen bevæger sig? I sådan et tilfælde taler vi om, at legemet laver en kombineret translatorisk og rotationel bevægelse. Når man skal beskrive sådanne situationer, så ved vi (fra bogen) at man til enhver tid kan beskrive enhver bevægelse af et stift legeme, som en kombination af translatorisk bevægelse af massecentrumet og rotationel bevægelse om en akse igennem massecentrumet. Kinetisk energi Hvor vi godt nok ikke har tænkt os at forsøge et bevis for at ovenstående gælder i alle tilfælde af bevægelse, så kan vi dog lave et bevis for at det gælder for den kinetiske energi af et stift legeme med både translatorisk og rotationel bevægelse. I tilfælde af kombineret translatorisk og rotationel bevægelse, så vil den kinetiske energi af legemet bestå af den kinetiske energi for bevægelsen af massecentrum, samt den kinetiske energi for rotation omkring en akse igennem massecentrum. Altså er den samlede kinetiske energi: Dette kan vi bevise: K = 1 2 Mv2 cm I cmω 2 For at bevise ovenstående skal vi først tænke på det stive legeme som værende bestående en en stor mængde partikler. Hver af disse partikler har så igen en masse m i og en linear hastighedsvektor v i. 13
14 Denne hastighedsvektor v i er så vektorsummen af hastighedsvektoren for massecentrumet, samt hastighedsvektoren af partiklen relativ til massecentrumet, altså: v i = v cm + v i Den kinetiske energi af denne partikel er så den velkendte 1 2 m ivi 2, som vi også kan skrive som: K i = 1 2 m i( v i v i ) Tager vi nu vektorsummen skreven ovenfor, så kan vi omskrive dette til: K i = 1 2 m i( v cm v i ) ( v cm v i ) = 1 2 m i( v cm v cm + 2v cm i + v i v i ) = 1 2 m i(vcm 2 + 2v cm v i + v i 2 ) Vi har altså nu et udtryk for den kinetiske energi af en partikel. For at få den samlede kinetiske energi må vi så summere henover alle partikler. Dette gør vi ved at udtrykke de enkelte dele af ovenstående udregning som separate summer og trække fælles faktorer udenfor summerne: K = K i = ( 1 2 m ivcm) 2 + (m i v cm v i ) + ( 1 2 m iv i 2 ) = 1 2 ( m i )vcm 2 + v cm ( m i v i ) + ( 1 2 m iv i 2 ) Her kan vi så se at m i bare bliver til M da det er summen af alle partiklers masser. Det midterste term går helt ud da m i v i er M gange hastighedsvektoren for massecentrum relativt til sig selv, hvilket er 0 pr. definition. Og sidst men ikke mindst har vi det sidste term, som er identisk til det vi allerede har vist til at være den kinetiske energi for et stift roterende legeme, altså: ( 1 2 m iv 2 i ) = 1 2 I cmω 2 Vi får derved i sidste ende, at den samlede kinetiske energi er: K = 1 2 Mv2 cm I cmω 2 14
15 Rolling without slipping Et vigtigt eksempel på kombineret translatorisk og rotationel bevægelse er rolling without slipping eller rulning uden at glide på grimt dansk. Rolling without slipping går ud på, at f.eks. et hjul ikke skrider imens det roteres og fører en bil fremad. For at der er rolling without slipping, så skal der være øjeblikkelig stilstand (i.e. v 1 = 0 der hvor hjulet er i kontakt med vejen, således den ikke glider.) Vi kalder den resulterende hastighedsvektor på dette sted for v 1, hvor v 1 er i kontakt med vejen relativt i forhold til massecentrum og hvor v 1 er det rotationelle komponent, som så derved må have samme magnitude som v cm, men med omvendt fortegn. Hvis hjulets radius er R og vinkelhastigheden er ω, så er magnituden af v 1 = Rω, hvorved vi skal have: Situationen er illustreret herunder: v cm = Rω Rullende friktion Et andet problem indenfor rotationelle bevægelser er konceptet af rullende friktion. Lad os antage vi har en perfekt stiv sfære rullende ned af en perfekt stiv hældning. Vi ville her have en situation hvor normalkraften passerer op igennem centrum af sfæren og derved ikke skaber noget kraftmoment, og grundet der ikke er nogen glidning ved kontaktpunktet, så vil friktion ikke udføre noget arbejde på sfæren. En mere realistisk situation er dog, at sfæren eller hældningen er deformerbar til en vis grad, så der derved vil dannes et form for pile up 15
16 foran sfæren. Dette pile up resulterer i at kontaktfladen nu ikke blot er et punkt, men nu nærmere et helt område, hvor normalkraften og friktionen så arbejder imod sfæren ved at normalkraften skaber et modsatrettet kraftmoment og friktionen skaber glidning, således mekanisk energi går tabt. Kombinationen af disse effekter er det vi kalder rullende friktion. Konceptet illustreres herunder, omend deformeringen er voldsomt overdrevet (i virkeligheden kan vi oftest ignorere effekter fra rullende friktion): Arbejde og effekt Sidst men ikke mindst skal vi kigge lidt på det at udøve et arbejde på et roterende legeme. Lad os forestille os vi har en tangentiel kraft F tan der udøves på kanten af en roterende disk. Denne disk roterer så en infinitesimal vinkel dθ omkring en fastsat akse i løbet af et infinitesimalt tidsinterval dt. Arbejdet dw der udøves af F tan når et punkt på diskens kant bevæger sig en distance ds er: dw = F tan ds Hvis dθ måles i radianer, så bliver ds = Rdθ og vi får: dw = F tan Rdθ Som vi kan se er F tan R nu det kraftmoment τ z der udøves af kraften F tan, så vi får: dw = τ z dθ Det totale arbejde W udført af dette kraftmoment under en vinkelafvigelse fra θ 1 til θ 2 er så: W = θ2 θ 1 τ z dθ 16
17 Hvis kraftmomentet er konstant for vinkelafvigelsen θ = θ 2 θ 1 så kan følgende formel benyttes i stedet: W = τ z θ Arbejde W har her enheder af Joules. Når man udfører et arbejde på et roterende stift legeme, så resulterer det i en forøgelse af den kinetiske energi, svarende til mængden af arbejde udført. Dette kan bevises ret nemt. Tager vi τ z til at være det resulterende kraftmoment på et legeme, så har vi, at τ z = Iα z jvf. den rotationelle analog af Newtons 2. lov. Vi kan så bruge dette til at modificere integralet i formlen for W : τ z dθ = (Iα z )dθ = I dω z dt dθ = I dθ dt dω z = Iω z dω z Siden vi bestemte τ z til at det resulterende kraftmoment, så er integralet i formlen for W det totale arbejde der udføres på det rotationelle stive legeme. Formlen bliver således: W tot = ω2 ω 1 Iω z dω z = 1 2 Iω Iω2 1 Ændringen i et roterende stift legemes kinetiske energi svarer altså til det arbejde der udføres herpå udefra. Ud fra definitionen af arbejde W på roterende legemer, kan man også definere effekten P. Man tager bare følgende: dw = τ z dθ Og dividerer begge sider med dt således man får: dw dt = τ z dθ dt 17
18 Hvor P = dw dt, altså arbejde pr. tid. Og hvor ω z = dθ dt, således vi får: P = τ z ω z Altså har vi, at når et kraftmoment τ z arbejder på et legeme, der roterer med vinkelhastighed ω z, så er dets effekt (arbejde pr. tid) lig med produktet af τ z og ω z. 18
19 2 Impulsmoment og gyroskopet 2.1 Disposition 1. Impulsmoment Definition 2. Sammenhæng med kraftmoment Ændring af impulsmoment pr. tid er ækvivalent med kraftmoment 3. Samlede størrelse af impulsmoment for et legeme Husk: symmetriakse påkrævet Ændring af total impulsmoment pr. tid er ækvivalent med summen af kraftmomenter 4. Impulsmomentbevarelse 5. Gyroskopet Anvendelser Præcession 2.2 Detaljer Præcessions vinkelhastigheden Her følger detaljerne for denne givne disposition Impulsmoment Vi skal til dette emne kigge på konceptet af impulsmoment og gyroskopet. Impulsmoment er den rotationsmæssige ækvivalent af impuls p = m v i linear mekanik. Definition For en partikel med masse m, hastighedsvektor v, impuls p = m v og en positionsvektor r for et selvvalgt origo O, så er impulsmomentet L defineret som: L = r p = r m v Værdien for impulsmomentet afhænger altså af det valgte origo O og enhederne for L er kg m 2 /s. Konceptet illustreres herunder, med impulsmomentet vinkelret på xy-planet (fordi m v er i xy-planet og krydseproduktet giver en vektor vinkelret på planet): 19
20 Hvilken retning impulsmomentet er i kan findes vha. højre-hånds reglen. Magnituden af et impulsmoment L kan nu udregnes som: L = mvl = mvr sin(φ) Hvor l er den vinkelrette linje fra linjen af v til origo O, som vist på illustrationen. Dette l fungerer så som løftestangs-arm for impulsvektoren p ligesom med kraftmoment, som er defineret som τ = r F Sammenhæng med kraftmoment Denne sammenhæng med kraftmoment er også yderst relevant her, da vi kan vise at ændringstakten (i.e. ændring pr. tid) af impulsmoment af en partikel er lig med kraftmomentet for den resulterende kraft der udøves på den. Dette kan vi se ved at differentiere L i forhold til tid: dl ( ) ( d r dt = dt m v + r m d v ) dt = ( v m v) + ( r m a) Det første led ovenfor bliver 0 da det indeholder vektorproduktet af v med sig selv, så det led går ud. I det andet led derimod kan vi erstatte m a med F hvorved vi får udtrykket for kraftmoment: d L dt = r F = τ For en partikel arbejdet på af en resulterende kraft F. 20
21 2.2.3 Samlede størrelse af impulsmoment for et legeme Vi kan nu bruge udtrykket for magnituden af impulsmomentet til at bestemme det totale impulsmoment for et stift legeme roterende omkring z-aksen med vinkelhastighed ω. Situationen er illustreret herunder: Vi starter altså med at tage en tynd skive af legemet liggende i xy-planet. Hver partikel heri bevæger sig så rundt i en cirkel med centrum i origo og dens hastighedsvektor v i = r i ω er så konstant vinkelret på positionsvektoren r i. Derved har vi at vinklen φ = 90, hvorved sin(90 ) = 1, så udtrykket for magnituden af impulsmomentet for partiklen bliver: L i = m i v i r i = m i (r i ω)r i = m i r 2 i ω Ud fra tegningen kan vi se, at retningen af impulsmomentet så er ud af papiret (i.e. z+) grundet højre-hånds reglen. Det samlede impulsmoment af denne tynde skive af legemet er nu summen af impulsmomenter for alle partikler, altså: L = L i = ( m i r 2 i )ω 21
22 Hvor vi kan se det første led, nemlig summen ovenfor, er definitionen på det såkaldte inertimoment I, således vi kan omskrive ovenstående til: L = Iω Hvor I er inertimomentet af skiven omkring z-aksen. Altså kan vi udregne det samlede impulsmoment for denne tynde skive vha. ovenstående og vil kunne gøre det for alle andre tynde skiver parallelle til xy-planet. Men hvad nu hvis et punkt ikke er i xy-planet, således r for det punkt har et z-komponent. Så vil impulsmomentet herpå nemlig have et komponent der er vinkelret på z-aksen. For at løse dette skal vi antage, at z-aksen er en såkaldt symmetriakse, altså hvor to punker på hver sin side af aksen med samme distance er identiske. Ved at gøre dette sikrer vi, at hvor enkelte partikler på hver side af aksen kan have impulsmomenter der ikke peger i retning af rotationsaksen, så vil deres vektorsum gør det. Dette illustreres herunder: Således kan vi sige, at har vi et stift legeme der roterer omkring en symmetriakse, så kan vi udregne det totale impulsmoment som: L = I ω Analog til før kan vi igen udregne ændringen af impulsmoment pr. tid for en mængde partikler, hvilket er summen af alle kraftmomenter på de partikler, eller: τ = d L dt Hvor summen ovenfor vel og mærke kun indeholder eksterne kraftmomenter, da de interne annulerer hinanden grundet Newtons 3. lov. 22
23 Hvis dette system af partikler er et stift legeme roterende om en symmetriakse z, så er L z = Iω z og I er konstant. Derudover hvis aksen har en fast retning, så vil vektorne L og ω kun ændre sig i magnitude, men ikke i retning. I det tilfælde får vi så at: τ = d L z dt = I d ω z dt = Iα z Hvilket er den rotationelle analog af Newtons 2. lov. Hvis vi arbejder med en situation hvor vi har et stift legeme, men ikke har en symmetriakse. Så vil L generelt ikke være paralellel til rotationsaksen. I stedet vil enkelte partiklers impulsmomenter L i forme en kegle omkring rotationsaksen hvorved der skal et eksternt resulterende kraftmoment til at holde rotationen i gang. Denne situation illustreres herunder: Impulsmomentbevarelse Konceptet af impulsmomentet former basisen for konceptet af impulsmomentbevarelse, som er en lov der gælder for alle niveaur, helt fra atomart niveau op til bevægelser af galakser. Princippet følger direkte af: τ = d L dt For hvis τ = 0, så må d L dt således opskrive dette som: = 0 og L må derved være konstant. Vi kan 23
24 Når det resulterende eksterne kraftmoment der udøves på systemet er 0, så er det totale impulsmoment af systemet konstant og bevaret. Dette resultat kender vi fra ting som en isskøjteløber der roterer omkring sig selv (z-aksen), hvor den eneste eksterne kraft på hende er hendes vægt, som ikke udøver et kraftmoment i forhold til z-aksen. Lad os så antage hun til at starte med har hendes arme og ben ude, hvorved hendes inertimoment I cm = I 1 er stort, og så hun pludselig vælger at trække arme og ben til sig, resulterende i et væsentligt mindre inertimoment I cm = I 2. Denne ændring sker imens hun stadig intet eksternt kraftmoment har på hende, hvorved L z = I cm ω z er konstant, så den eneste mulighed er at hendes vinkelhastighed ω z forøges når hendes inertimoment I cm formindskes, da: Gyroskopet I 1 ω 1z = I 2 ω 2z Sidst men ikke mindst skal vi kigge lidt på gyroskopet, som er en enhed til at måle og vedligeholde orientering. Vi kender dem fra en række forskellige ting i dagligdagen, som f.eks. store ting som i fly (til automatpiloten), men også i mindre ting som en Wii Remote og visse telefoner som iphone 4 og Motorole Droid Pro. På illustrationen nedenfor kan ses et simpelt gyroskop: Hvis vi i dette tilfælde holder aksen med svinghjulet horisontal og så giver slip, så vil vi se at den falder til jorden grundet tyngdekraften på svinghjulet (i.e. w). Tager vi i stedet først og roterer svinghjulet inden vi giver slip, så vil den derimod ikke falde, men i stedet sandsynligvis bevæge svinghjulet rundt om z-aksen i en jævn cirkulær bevægelse. Denne ikke-intuitive bevægelse kaldes Precession. 24
25 Præcession For at forstå præcession skal vi huske konceptet af impulsmomentbevarelse med formlen: τz = d L dt Lad os starte med at bruge denne til at undersøge situationen hvor svinghjulet ikke bevæger sig på forhånd. Vi tager origo O til at være pivoten og antager af svinghjulet er symmetrisk, med masse M og inertimoment I omkring svinghjulets akse. Svinghjulets akse er initielt x-aksen. De eneste eksterne krafter på gyroskopet er normalkraften n der udøves på pivoten (som vi forresten antager er friktionsløs) og vægten w på svinghjulet der udøves ved dets massecentrum i en afstand på r fra pivoten. Normalkraften udøver intet kraftmoment på pivoten og vægten udøver et kraftmoment τ i y-retningen. Initielt er der ingen rotation og det initielle impulsmoment L i er 0. Fra formlen for impulsmomentbevarelse har vi, at i et kort tidsinterval dt efter dette, er ændringen d L af impulsmomentet: d L = τdt Denne ændring er i y-retningen, da τ er i y-retningen. For hvert yderligere tidsinterval dt vil impulsmomentet ændre sig med yderligere d L i y-retningen fordi kraftmomentet er konstant. Dette konstant stigende horisontale impulsmoment betyder, at gyroskopet roterer ned ad hurtigere og hurtigere rundt om y-aksen indtil den rammer standen eller bordet den står på. Ændringen af impulsmomentet kan illustreres således for x og y: Hvis vi nu i stedet kigger på hvad der vil ske hvis svinghjulet oprindeligt var i bevægelse, så har vi et initielt impulsmoment L i der ikke er 0 og siden svinghjulet roterer omkring dens symmetriakse, så følger L i også denne akse. Men hver ændring af impulsmomentet d L er vinkelret på denne akse, da τ = r w er vinkelret på denne akse. Dette resulterer i en ændring af L, men ikke i dens magnitude. Resultatet er derved, at aksen ikke falder og at aksen med svinghjulet roterer rundt om z-aksen. Dette kan ses herunder: 25
26 Som vi også kan se er ændringen af L i for hver iteration således, at den nye L i+1 = L i + d L, som er en infinitesimal ændring, hvorved kun retning og ikke magnitude ændres. Derved vil gyroskopet præcessisere rundt, teoretisk set for evigt under antagelsen af en friktionsløs pivot. Præcessions vinkelhastigheden Den infinitesimale ændring d L = τdt resulterer altså blot i at svinghjulets akse roteres en lille vinkel dφ som vist herunder: Denne vinkel dφ kan så skrives som dφ = d L L, og ændringsraten med hvilken aksen bevæger sig er så dφ dt, som vi kalder præcessions vinkelhastigheden Ω og skriver som: Ω = dφ dt = d L L dt = τ z L z = wr Iω 26
27 Altså er præcessions vinkelhastigheden omvendt proportional til vinkelhastigheden af spinnet omkring aksen, således et hurtigt spindende svinghjul resulterer i et gyroskop der præcissere langsomt og det at formindske spinnet får præcisseringen til at gå hurtigere. Vi kan desuden se, at forøger vi vægten af svinghjulet, så skulle præcessionen gerne være hurtigere. En antagelse vi har lavet ved gennemgangen er gyroskopet er dog, at L kun er associeret med spinnet af svinghjulet, hvilket egentlig ikke er sandt da der også vil være et vertikalt komponent af impulsmomentet ved præcessionen. Vi kan dog ignorere dette faktum såfremt præcessions vinkelhastigheden Ω er markant mindre end vinkelhastigheden på svinghjulet ω, hvilket vi fint kan antage da store værdier af ω resulterer i små værdier af Ω. Var det ikke tilfældet ville vi dog opleve effekter heraf som en hoppen op og ned, hvor den jævne cirkelbevægelse ikke længere ville være tilstede. Et komplet schematic på et gyroskop kan ses herunder: 27
28 3 Mekanisk ligevægt og elasticitet 3.1 Disposition 1. Ligevægt 1. betingelse F = 0 2. betingelse τ = 0 for ethvert punkt Statisk ligevægt 2. Tyngdepunkt Reminder: Massecentrum udledning Bevis: Massecentrum lig med Tyngdepunkt Find tyngdepunktet og Støtteområde 3. Elasticitet Stress, Strain og Elastisitetsmodulus Tensile stress Bulk stress Shear stress 4. Begrænsninger ved Hookes Lov 3.2 Detaljer Proportionalitetsgrænsen Elastiskse grænse Plastik deformation, Plastik adfærd og Permanent sæt. Fracture Point/Breaking Point Elastisks Hysterese Her følger detaljerne for denne givne disposition Ligevægt Vi har i mange emner brugt meget tid på at diskutere hvordan legemer bevæger sig i respons til de krafter der arbejder på dem. Men ofte vil vi hellere have et legeme er stabilt og bliver stående hvor det skal uden at accelerere. Et legeme der gør det siger vi er i ligevægt. For at et legeme er i ligevægt er der 2 betingelser der skal gælde. 28
29 1. betingelse Den første betingelse siger at vektorsummen af alle eksterne krafter udført på legemet skal være 0. Dette kan skrives således i vektorform: F = 0 Eller således for de enkelte komponenter Fx = 0 Fy = 0 Fz = 0 2. betingelse Den anden betingelse siger, at legemet ikke må have nogen tendens til at ville rotere. Dette kommer af, at et stift legeme der ikke roterer omkring et givent punkt har intet impulsmoment omkring det punkt, altså at L = 0. Hvis legemet ikke skal begynde at rotere, så skal ændringsraten af impulsmomentet, d L dt også være 0. Det betyder altså at τ = 0 for ethvert punkt, ellers er der ikke ligevægt. Statisk ligevægt For at der er ligevægt skal både betingelse 1 og 2 være opfyldt. Men der kan sagtens være ligevægt selvom legemet er i bevægelse. F.eks. er et fly i ligevægt såfremt det flyver fremad med konstant hastighed, retning og højde. Hvis et legeme står helt stille og opfylder betingelse 1 og 2, så siger vi det er i statisk ligevægt. Flyet er derved ikke i statisk ligevægt Tyngdepunkt I mange ligevægtsproblemer er den primære kraft der udøves på et objects dens vægt. Vægten kommer selvfølgelig af tyngdekraften, som w = m g, og er distribueret udover hele legemet. Så hvordan udregner vi et kraftmoment af vægten? Jo, det gør vi ved at antage, at alt vægten er placeret i et punkt, kaldet tyngdepunktet. Tyngdeaccelerationen g falder med højden, men hvis vi kan ignorere dette fald (grundet højden af legemet), så kan vi antage at et legemes tyngdepunkt er det samme som dens massecentrum. 29
30 Reminder: Massecentrum udledning Blot lige for at få det på plads inden vi går videre, så kan vi lige udlede hvad værdien for massecentrum er. For en mængde n af partikler med masser m 1, m 2,..., m n og koordinater (x 1, y 1, z 1 ), (x 2, y 2, z 2 ),..., (x n, y n, z n ), så kan vi udregne koordinater for massecentrum som: x cm = m 1x 1 + m 2 x m n x n i = m ix i m 1 + m m n i m i i m iy i y cm = m 1y 1 + m 2 y m n y n m 1 + m m n = z cm = m 1z 1 + m 2 z m n z n m 1 + m m n = i m i i m iz i i m i Hvilket til sammen laver en positionsvektor r cm, som så er vores massecentrum: i r cm = m i r i i m i Bevis: Massecentrum lig med Tyngdepunkt Hvis vi så nu forestiller os kraftmomentet fra tyngdekraften på et arbitrært legeme som set herunder: 30
31 Vi antager tyngdeaccelerationen g er den samme ved ethvert punkt af legemet. Hver partikel i legemet oplever nu en gravitationelt kraft og den totale vægt af legemet er summen af alle disse partiklers vægt. En typisk partikel i legemet har masse m i og vægt w i = m i g. Hvis r i er positionsvektoren for denne partikel i forhold til et arbitrært origo O, så er kraftmoment vektoren τ i af vægten w i i forhold til O følgende: τ i = r i w i = r i m i g Det totale kraftmoment for alle partikler er så: n τ = τ i i = r 1 m 1 g + r 2 m 2 g r i m i g = (m 1 r 1 + m 2 r m n r n ) g ( n ) = m i r i g i Tager vi nu det her og dividerer med n i m i, samt ganger med M, så får vi: ni m i r i ni m i M g Ser vi på resultatet her, så kan vi se at den første del blot er positionsvektoren r cm og anden del er vægten af hele legemet w = M g. Derved får vi at ovenstående bliver: τ = ni m i r i ni m i M g = r cm w Det totale gravitationelle kraftmoment er altså det samme som havde alt vægten været placeret i massecentrum, som vi kalder tyngepunktet. Vi får derved følgende sætning: Hvis g har samme værdi på alle punkter af et legeme, så er dets tyngdepunkt lig med dets massecentrum. 31
32 Find tyngdepunktet og Støtteområde Hvis vi ikke arbejder med en simpel form, så kan det ofte være nødvendigt at bruge andre midler end massecentrum til at vurdere tyngdepunktet. En nem eksperimentiel fremgangsmåde er at hænge et objekt op fra en finger e.lign. Her tegner man så en streg ned fra ophængningspunktet, vender objektet om og gør det for et andet punkt også. Derved får man 2 linjer der mødes et givent sted. Der hvor de mødes er der hvor tyngdepunktet er. En anden måde at gøre det på er hvis et givent objekt har flere støttepunkter, som f.eks. 2 snore det hænger i eller 2 hjul på en vej. Her er tyngepunktet så et sted imellem disse støttepunkter hvis legemet er i ligevægt. Er det ikke dette vil det pågældende legeme vælte, som f.eks. for de 3 køretøjer herunder, hvor kun den første er i ligevægt: Elasticitet Det bringer os så videre til anden del af spørgsmålet, nemlig elasticitet. Hvor stive legemer gør visse beregninger og udledninger nemmere, så er det en idealiseret model der ikke reelt holder i virkeligheden. I virkeligheden kan legemer deformeres i mindre eller højere grad, alt afhængig af materiale. Der er grundlæggende 3 måder hvorpå vi kan få deformation: Tensile stress: Hvor legemet bliver strakt eller sammenpresset vha. krafter der udøves på dets ender. Bulk stress: Hvor legemet bliver presset fra alle sider, som legemer i en væske. Shear stress: Hvor legemet bliver revet fra hinanden vha. modsatrettede krafter der udøves på hver side af legemet (f.eks. en saks igennem et bånd) For hver af disse måder har vi to koncepter: 32
33 Stress: Beskriver styrken af den kraft der skaber deformationen, på en kraft pr. enhedsareal s basis Strain: Beskriver den resulterende deformation. Når stress og strain er små nok, så vil vi ofte se at de to er direkte proportionale, hvor deres proportionalitetskonstant så kaldes for en elastisk modulus. Dette generelle mønster kan formuleres således: Stress Strain = Elastisitetsmodulus Ovenstående mønster er det vi kalder Hooke s lov, som dog ikke er en lov, da det kun gælder i et begrænset antal tilfælde, som jeg vil komme ind på om lidt. Vi har oftests set Hooke s lov som formuleringen til brug ved strækning og sammentrækning af fjedre, altså: F = kx Men den gælder også for andre ting end fjedre, omend den på ingen måde gælder generelt. Tensile stress Lad os starte med at kigge på tensile stress. Tensile Stress, eller trækspænding, er hvor et legeme trækkes eller presses i dets ender, som vist for objektet herunder: 33
34 Vi har altså en trækningskraft F der trækker objektet med ligelig magnitude i modstridende retninger, hvorved der sker en deformation i form af l oveni den eksisterende længde l 0. Vi siger at objektet er i spænding. Tensile stress defineres så, som denne kraft F over tværsnitsarealet af objektet, altså: Tensile stress = F A Enheden af Tensile stress er så Pascal (P a), hvilket er lig med 1N/m 2. Objektet ovenfor får således en ny længde l = l 0 + l, hvor at strækningen har fundet sted i hele objektet og ikke blot i enderne. Vi siger derfor nu at objektet har oplevet et strain, som er: Tensile strain = l l 0 l 0 = l l 0 Da Tensile strain er forholdet mellem to længder er det en enhedsløs værdi. Eksperimenter har vist, at for tilstrækkeligt små værdier for tenstile stress, så er stress og strain proportionale. Elasticitetsmodulusen ved Tensile stress kalder vi Young s modulus og den defineres som: Tensile Stress Y = Tensile Strain = F /A l/l 0 = F l 0 A l Enhenden af Young s Modulus er så Pascal (P a) og jo større værdi for Young s Modulus jo sværere er det at strække et givent materiale da der skal en stor stress til for at pålægge et bestemt strain. Hvis objektet ikke bliver trukket, men i stedet presset, så vær opmærksom på alt det ovenstående stadig gælder, omend l nu går den anden vej selvfølgelig. Dette koncept ses herunder: 34
35 Bulk Stress Hvis vi så kigger på Bulk stress nu, så er den anderledes i det, at alt presset kommer ligeligt fra alle sider, hvilket resulterer i objektet bliver presset til en mindre volumen. Man kalder således ofte også bulk stress for volume stress, og bulk strain for volumen strain. Hvis et givent objekt er nedsunket i en væske, så udøver væsken en kraft direkte vinkelret på objektet fra alle sider. Kraften F pr. areal som væsken udøver på objektet kaldes for trykket p i en væske: p = F A For en given væske forøges trykket i væsken pr. dybde, således der er forskel på trykket når objektet lige akkurat er nedsunket i væsken og ved 200 meters dybde. Dette tryk resulterer så i en volumen deformering, hvor volume stress er forskellen i tryk p og volume strain er den forholdsmæssige ændring i volumen V for objektet, i forhold til den oprindelige volumen V 0, altså: Volumen strain = V V 0 Ligesom med Tensile strain, så er Volumen strain et enhedsløst tal. Når Hookes Lov gælder, så er elasticitetsmodulusen her så Bulk modulus, 35
36 eller Volumen modulus: Volume Stress B = Volume Strain = p V/V 0 Vi skriver minus foran udtrykket da V altid er negativ og p altid er positiv. Konceptet kan ses herunder: Det reciproke af bulk modulusen kaldes Kompressabilitet og betegnes k: k = 1 B = V/V 0 p = 1 V 0 V p Kompressabilitet er altså det fraktionelle fald i volumen pr. enheds stigning af tryk. Enheden for Kompressabilitet er P a 1. For at et materiale gælder der så, at jo mindre bulk modulus og jo højere kompressabilitet, jo nemmere er det at sammenpresse et materiale til mindre volumen.. 36
37 Shear stress Sidst men ikke mindst har vi shear stress, hvor et objekt deformeres vha. to modsatrettede tangentielle krafter, som trækker objektet i to forskellige retninger. Et eksempel er en saks der klipper et bånd over. En illustration af konceptet kan ses herunder: Vi har altså at shear stress er defineret således: Shear stress = F A Altså som det tryk der pålægges tangentielt i begge retninger ud fra objektet med tværsnitsareal A. Enheden for Shear stress er kraft pr. enhedsareal. Shear strain er således forholdet mellem forskydningen x skabt af shear stress og den transverse dimension h, altså: Shear strain = x h Igen er strain her et enhedsløst tal. Hvis Hookes lov gælder har vi så den såkaldte shear modulus, som så er: Shear Stress S = Shear Strain = F /A x/h = F h A x Shear modulus værdier er typisk 1 3 til 1 2 størrelse af Young s modulus, og det bør nævnes, at Shear stress, shear strain og shear modulus kun giver mening for faste stoffer. 37
38 3.2.4 Begrænsninger ved Hookes lov Sidst men ikke mindst, lad os kigge på nogle begrænsninger ved Hookes Lov. Hookes Lov, omend nyttig, gælder kun for et begrænset område. Der er selvfølgelig den simple overvejelse, at Hookes lov ikke kan gælde generelt, da vi derved ikke ville kunne knække ting eller rive ting i stykker. Så der er helt sikkert et break point af en art, men vi kan faktisk være mere præcis end det. Vi kan undersøge Hookes Lovs gyldighed, ved at plotte Stress i forhold til Strain, for et givent materiale under spænding. Det er hvad der er gjort herunder: Som vi kan se gælder Hookes Lov kun op til det vi kalder Proportionalitetsgrænsen (Proportional limit), hvorefter Stress og Strain ikke længere er proportionelle. Vi snakker altså under 1% deformering hvor Hookes Lov gælder, derefter gælder den ikke. Fra det punkt af fejler Hookes Lov, og efter den Elastiske grænse, som også vises på grafen, så vil en given deformering af materialet være permanent og eventuelt fjernelse af spændingen til det punkt vil ikke lede strain ned til 0% igen. Man har altså pålagt materialet så meget stress, at det i sidste ende er blevet permanent deformeret. Denne adfærd kaldes for Plastikadfærd og resulterer i et nyt Permanent sæt, i.e. et nyt startpunkt for Strain hvis materialet bliver udsat for spænding påny. Alt yderligere spænding efter den elastiske grænse vil resultere det man kalder Plastisk deformering og ved et vis punkt vil selve materialet begynde at falde fra hinanden til trods for stress holdes konstant, eller sågar falder. Det er det vi ser til sidst på grafen. Desuden kan også ses at der defineres et Fracture point, Breaking point eller hvad man nu vil kalde det. Det er det tidspunkt til hvilket materialet vil decideret knække. Alt afhængig af hvor tæt dette punkt er på den 38
39 Elastiske grænse kalder vi materialet for Duktilt eller Skrøbeligt. Materialet i grafen ovenfor er f.eks. Duktilt, hvorimod noget som strenge på en guitar er Skrøbelige. Sidst men ikke mindst kan ses Stress vs. Strain plottet nedenfor for vulkaniseret gummi: Plottet viser at hvor gummiet tager en given mængde stress for at nå til et bestemt strain, så skal den bruge mindre for at komme tilbage. Der skal altså mere kraft til for at deformere materialet end der skal til for at det kommer tilbage til dets initielle tilstand. Sådanne materialer er yderst nyttige i shock absorberende enheder. Konceptet hvorved ovenstående virker hedder Elastisks Hysterese. 39
40 4 Gravitation og planetbevægelse 4.1 Disposition 1. Newtons Gravitationslov 2. Vægt og vægtløshed Tilsyneladende vægtløshed (kredsløb) 3. Gravitationel potentiel energi Escape speed 4. Sorte huller Schwartzchild radius 5. Satelitbaner Udledning af hastighed, periode og mekanisk energi 6. Keplers love 4.2 Detaljer 1. lov: Ellipsebaner (kort) 2. lov: Sekterhastighed 3. lov: Omløbstid (kort) Bevægelse om fælles massemidtpunkt Her følger detaljerne for denne givne disposition Newtons Gravitationslov Dette emner handler om gravitation og planetbevægelse, så lad os starte med at kigge på den grundlæggende lov inden for dette felt, nemlig Newtons Gravitationslov. Newton siger, at enhver partikel i universet tiltrækker enhver anden partikel i universet med en kraft der er direkte proportionel til produktet af masserne af disse partikler og invers proportionelt til kvadratet af distancen imellem dem - eller som formel: F g = Gm 1m 2 r 2 Hvor F g er magnituden af gravitationskraften på begge partikler m 1 og m 2, og G er gravitationskonstanten, som udelukkende afhænger af det enhedssystem vi bruger (SI eller CGS f.eks). Konceptet illustreres herunder: 40
41 Det betyder således, at vi til enhver tid påvirkes af gravitationskraften fra alle partikler i universet, men fordi ting som kæmpemæssige stjerner er så langt væk, så er deres påvirkning af os negligjerbar. I stedet er blot påvirkningen af jorden dominerende for objekter på jorden og solen, vores stjerne, er dominerende for jorden selv. Newtons Gravitationslov betyder også, at jorden til enhver tid løfter sig op imod os hvis vi falder imod den. Men fordi dens masse er så meget større end vores, så er dens acceleration så meget mindre, hvorved denne effekt ikke er visuelt påviselig. Vi omtalte ovenfor gravitationsloven som værende gældende for 2 partikler, men den gælder i lige så høj grad for 2 sfæriske symmetriske massedistributioner, da resultatet her er det samme som havde deres masser været samlet i deres massemidtpunkter. Dette gælder dog kun hvis det ene af de to objekter vi måler for er uden for den andens sfære, da vi ellers har effekter fra masser på begge sider (i.e. beregningen gælder ikke hvis en partikel er halvvejs inde mod jordens centrum, da der her også er masse på vej ud mod overfladen). Så hvis vi modellerer jorden som et sfærisk symmetrisk legeme med masse m E, så kan vi udregne den kraft den udøver på en partikel eller et andet sfærisk symmetrisk legeme med masse m og distance r imellem deres massemidtpunkter, som: F g = Gm Em r 2 Alt dette kan bevises, omend jeg ikke har tænkt mig at forsøge det. Beviset står i bogen. Konceptet illusteres dog herunder: 41
42 At dette resultat er nyttigt kan nemt ses ved at observere, at alle større himelske objekter er sfæriske. Det bliver de nemlig hen af vejen af sig selv hvis massen er stor nok, da alle partikler forsøger at tiltrække hinanden og minimere distancerne imellem sig, hvorved legemer naturligt vil forsøge at forme sig til en sfære. Dette fænomen er mindre til stede i små himelske objeter som kometer og små måner, da masserne her er for små Vægt og vægtløshed Det bringer os så videre til konceptet af vægt. Hvor man på jorden, i normale tilfælde, ville betegne vægten som den gravitationelle kraft der pålægges et objekt grundet dens masse og tyngdeaccelerationen (i.e. w = m g), så er en mere korrekt betegnelse: Vægten af et legeme er den totale gravitationelle kraft udført på legemet af alle andre legemer i universet Grunden til vores simple betegnelse virker er, at vi nær jordens overflade kan ignorere effekten fra andre legemer i universet, da de bidrager i negligjerbar grad sammenlignet med jorden. Ligeledes ville vi kunne ignorere effekten fra jorden, hvis vi havde stået på månen f.eks. Hvis vi igen modellerer jorden som et sfærisk symmetrisk legeme, med radius R E og masse m E, så kan vi udregne vægten w for et mindre legeme 42
43 med massen m ved jordens overflade (i.e. R E fra centrum af jorden), som: w = F g = Gm Em R 2 E Her kan vi se at det er samme grundlæggende formel som den vi benænvte først, hvorved vi kan trække m væk og se at tyngdeaccelerationen ved jordens overflade må være: g = Gm E R 2 E Vi kan således også tage formlen for vægt ovenfor og erstat R E med r, således vi kan udregne hvad vægten af et givent legeme er i en afstand r fra centrum af jorden: w = F g = Gm Em r 2 Vægten af et legeme falder altså omvendt proportionalt med kvadratet af dets afstand til jordens centrum. Vægtløshed Det er dog ikke af denne grund, at astronauter i kredsløb om jorden virker vægtløse. Man kunne tro det ud fra ovenstående, men for reelt have have vægt 0 skulle en astronaut være uendeligt langt fra enhver anden masse, således dennes samlede eksterne gravitationelle krafter var 0. I stedet skyldes den tilsyneladende vægtløshed hos astronauter i kredsløb, at de i virkeligheden er i gang med frit fald omkring jorden. Den tilsyneladende vægt af en person i kredsløb om jorden er w = w 0 ma rad = m g 0 ma rad Hvor w 0 er vægten havde personen stået stille på jordens overflade og a rad er den centripetale acceleration, der peger ind mod centrum af den jævne cirkulære bevægelse (i.e. jorden). Vi ved så her, at hvis personen er i kredsløb om jorden, så er med tyngdeaccelerationen g 0, i.e.: g 0 = og den tilsyneladende vægt er derved a rad w = m g 0 ma rad = 0 a rad lig Derved er en person i kredsløb om jorden tilsyneladende vægtløs. Dette gælder uanset formen af kredsløb omkring jorden og gælder uanset om personen er i kredsløb alene eller inde i et rumfartøj. 43
44 4.2.3 Gravitationel Potentiel Energi Det bringer os så videre til et koncept vi skal bruge, nemlig den gravitationelle potentielle energi. Vi har det simple udtryk for potentiel energy, nemlig U = mgy. Men dette udtryk antager vi har en fastbestemt retning og magnitude af den gravitationelle kraft, hvilket vi ved vi ikke har grundet Newtons gravitationslov: F g = Gm Em r 2 Hvor tyngdekraften afhænger af afstanden til jordens centrum r. Vi skal derfor have et nyt udtryk for gravitationel potentiel energi, som vi får ved at antage vi har et legeme med masse m udenfor jordens sfære og så udregner det arbejde W grav der udøves af den gravitationelle kraft når legemet bevæger sig direkte væk fra eller hen mod jordens centrum fra r = r 1 til r = r 2. Det arbejde er givet ved: W grav = r2 r 1 F r dr Hvor F r er det radiale komponent af gravitationskraften F, altså komponenten med retning direkte ud fra centrum af jorden. Da F peger indad mod jordens centrum, så er F r altid negativ. Det er altså blot den negative ækvivalent af F g, i.e.: F r = Gm Em r 2 Så hvis vi nu tager dette udtryk og indsætter for F r i formlen for W grav, så får vi: W grav = r2 r 1 F r dr = Gm E m = Gm Em r 2 r2 r 1 dr r 2 Gm Em r 1 Dette kan vi så bruge til at udtrykke den tilsvarende gravitationelle potentielle energi U, da W grav = U 1 U 2. Hvis vi kigger på udtrykket ovenfor, kan vi så se, at den gravitationelle potentielle energi må være: U = Gm Em r Vi kan således se, at bevæger et legeme sig væk fra jorden vil r forøges, 44
45 den gravitationelle kraft udøver negativt arbejde og U forøges. Når legemet bevæger sig mod jorden vil r formindskes, den gravitationelle kraft udøver positivt arbejde og U formindskes. Dette illustreres også ud fra grafen herunder: Vi kan nu bruge generelle energirelationer sammen med dette, til at udlede forskellige ting vi har behov for, som f.eks. escape speed for jorden. Escape speed Escape speed, eller undvigelseshastigheden, som det hedder på dansk, er den minimum hastighed der skal til for at et legeme kan flygte fra en planet fuldstændig. Vha. formlen for gravitationel potentiel energi og formlen for energibevarelse, kan vi finde et udtryk for undvigelseshastigheden for jorden som følger. Vi starter med energibevarelsen hvor punkt 1 er det sted hvor legemet sendes afsted fra (f.eks. en kanon) med en given hastighed v 1. Ved dette punkt er distancen til jordens centrum r 1 = R E og massen af legemet er m. Punkt 2 er så et sted uendeligt langt fra jorden med r 2 = og v 2 = 0. Vi har altså: K 1 + U 1 = K 2 + U 2 Hvor K 1 er den normale formel for kinetisk energi, U 1 er den gravitationelle potentielle energi og både K 2 og U 2 er 0, da vi ikke ønsker der skal være mere kinetisk energi tilbage ved r 2 = og fordi U 2 hertil er defineret til at 45
46 være 0. Ergo får vi: ( 1 2 mv2 1 + Gm ) Em = 0 R E 2Gm E v 1 = R E Hvilket er jordens undvigelseshastighed. Erstattes m E og R E med ækvivalente værdier for andre planeter, så kan det også bruges til at udregne undvigelseshastigheden for disse Sorte huller Det bringer os så videre til sorte huller. Sorte huller er interessante himmelske legemer i det at de er så massive på så lille et område, at deres graviation gør intet kan undslippe dem - ikke engang lys. Dette opstår når undvigelseshastigheden for det pågældende legeme er så høj, at det overstiger lysets hastighed. Ud fra formlen for undvigelseshastighed kan vi se, at undvigelse kun afhænger af massen og af radius af et givet legeme, og altså ikke af det materiale der forsøger at slippe væk fra legemet. Schwarzchilds radius Har vi således et sfærisk legeme med masse M, så kan vi udregne til hvilken radius legemet skal være mindre end for at blive et sort hul. Denne radius kaldes for Schwarzchilds radius (R S ) og kan udledes vha. Einsteins generelle relativitetsteori. Den kan også findes, lidt ved en tilfældighed, ved at sætte v i formlen for undvigelseshastighed til lysets hastighed c og løse for radiusen R, således man får: 2GM c = R S R S = 2GM c 2 Så hvis et givent sfærisk, ikke-roterende, legeme med masse M har en radius mindre end R S, så kan intet - selv ikke engang lys, undvige fra legemet. Desuden vil alt inden for en radius af R S fra centrum af det sorte hul blive trukket mod det sorte hul i sådan en grad at det ikke kan undvige. Kanten hvortil R S går kaldes for Event Horizon af det sorte hul. 46
47 Da lys ikke kan slippe ud fra sorte huller, så kan man ikke observere dem direkte. I stedet observerer man hvorledes deres gravitationskraft påvirker andre legemer i nærheden af dem o.lign. Eksempelvis mener man der eksisterer et enormt sort hul i centrum af mælkevejen. Noget man har observeret ved at se hvorledes en del andre objekter roterer omkring dette tilsyneladende usynlige objekt Satelitbaner Vi har allerede talt om hvorledes satellitter holder dem selv i kredsløb og hvorfor det ikke er ægte vægtløshed, men jeg har til gengæld intet sagt om hvilken hastighed et kredsløb har, hvad perioden for et kredsløb er e..er hvad den totale mekaniske energi er for et kredsløb. Vi har et satelitkredsløb om jorden herunder: Som vi kan se er accelerationen vinkelret i forhold til hastighedsvektoren, hvorved hastigheden er konstant i en jævn cirkelbevægelse (OBS: Dette eksempel er for cirkulære kredsløb, omend principperne også gælder for ikkecirkulære kredsløb). Satelittens acceleration har magnituden a rad = v2 r og er altid rettet indad mod cirklens centrum. Den resulterende gravitationskraft på en satelit med masse m er: F g = Gm Em r 2 Og har samme retning som accelerationen. 47
48 Tager vi nu og benytter Newtons anden lov (i.e. F = m a) så har vi: Hvorefter vi isolerer for v: Gm E m r 2 v = = mv2 r Gm E r Som er hastigheden for en satelit i en given afstand r fra jordens centrum. Dette udtryk bringer os så direkte videre til udtrykket for perioden af en satelits kredsløb. Hvis vi opskriver hastigheden v som distancen 2πr vandret i en revolution, divederet med perioden T, så kan vi bruge det til at udregne T : v = 2πr T T = 2πr v r = 2πr Gm E = 2πr3/2 GmE Altså kan vi se at større kredsløb resulterer i langsommere hastigheder and længere perioder - hvilket er hvad vi intuitivt forventede. Sidst men ikke mindst kan vi udregne den komplette mekanisk energi E = K + U for et cirkulært kredsløb direkte: E = K + U = 1 ( 2 mv2 + Gm ) Em r = 1 ( ) GmE Gm Em 2 r r = Gm Em 2r Den mekaniske energi i et cirkulært kredsløb er altså negativ og lig med halvdelen af den potentielle energi Keplers love Sidst men ikke mindst skal vi kigge kort på Keplers 3 love. 48
49 Fælles for dem alle er, at Kepler selv fandt frem til dem emperisk og at de så senere er blevet bevist af Newton til at være udledninger fra hans generelle 3 love og gravitationsloven. At forsøge bevis af noget som helst af dette har jeg dog ikke tænkt mig. I stedet nævnes blot de 3 love herunder: 1. lov: Ellipsebaner Keplers første lov siger, at alle planeter bevæger sig i elliptiske kredsløb, med solen som et fokus af ellipsen. Konceptet illustreres herunder: En cirkel er så et special-case af en ellipse. Vi har altså her en planet P der er i kredsløb omkring solen S, hvor S så blot er et andet fokuspunkt hvor der ikke er noget. Halvstoraksen a er halvdelen af bredden i kredsløbet og ea er distancen mellem hvert fokuspunkt og centrum af ellipsen. e er her eccentriciteten for kredsløbet, hvor e = 0 betyder en cirkulær bevægelse og hvor de fleste planeter i virkeligheden har tæt på cirkulære bevægelser (f.eks. e = for Venus). Det punkt hvor P er tættest på solen kalder vi Perihelion og det sted hvor den er længst fra kalder vi for Aphelion. Der gælder nu, at for hvert punkt på ellipsen vil summen af distancerne S til P og S til P være den samme. Newton har senere bevist at de eneste mulige lukkede kredsløb er ellipser og cirkler, hvorved Kepler havde ret. 2. lov: Sektorhastighed Keplers 2. lov siger, at linjen fra solen til en given planet spænder ligelig areal i ligelig tid. 49
50 Hvad det betyder er, at arealet en planet spænder med solen for 2 instanser af planetens position over en given tid, er den samme for den samme tidsforskel et andet sted i kredsløbet. Konceptet vises herunder: Dette kan også mere præcist formuleres som at der i det lille tidsinterval dt, i en linje fra solen S til planeten P drejes en vinkel dθ. Området der spændes af dette har længden r, længden på kredsløbsstykket rdθ og derved arealet da = 1 2 r2 dθ. Dette ses nedenfor: Denne udspænding af areal pr. tid kaldes for sektorhastigheden og skrives som: da dt = 1 dθ r2 2 dt Keplers 2. lov siger således at sektorhastigheden er den samme for alle punkter af kredsløbet. Dette sker ved at r er lille når planeten er tæt på solen, hvorimens dθ dt og vice-versa når planeten er langt fra solen. Det kan også vises at konklusionen om at sektorhastigheden er konstant betyder at impulsmomentet i forhold til solen er konstant, omend jeg ikke vil vise dette. 3. lov: Omløbstid Keplers 3., og sidste, lov siger at perioden af planeterne er proportional til længden af den halvestorakse for dets kredsløb i 3/2. Eller skrevet mere matematisk: T = 2πa3/2 GmS 50
51 Dette er blot en mere generel udgave af den vi allerede har vist for cirkulære kredsløb og så med ændringen af m E til m S da det her er solen vi er i kredsløb omkring og ikke jorden. Bevægelse om fælles massemidtpunkt Som en sidste bemærkning skal siges, at vi igennem alt dette har antaget at solen (o.lign. stjerner) er faste legemer der forbliver på samme position konstant. Det kan naturligvis ikke være tilfældet, da en planet udøver en gravitationel kraft på solen med samme styrke men modsat retning, hvorved solen trækkes mod planeten. Så i virkeligheden har vi, at planeterne og solen roterer om et fælles central massemidtpunkt, der ligger tæt ved solen. Konceptet illustreres herunder: Grunden til vi kan ignorere denne effekt er, at solens masse er ca. 750 gange større end den totale masse af alle planeter i hele solsystemet. Derved vil solen ikke variere kraftigt fra dette massemidtpunkt. Viden om denne rotation omkring et massemidtpunkt er dog blevet brugt af astronomer til at detektere planeter omkring stjerner, simpelthen ved at detektere denne slingring (wobbling) af stjernen, så hvor den for vores beregningsmæssige interesser er ligegyldig, så hjælper den til at detektere nye planeter o.lign. objekter omkring stjerner. 51
52 5 Periodisk bevægelse 5.1 Disposition OBS: Her kunne også siges noget om tvungne oscilleringer og resonans, men i så fald holder jeg det til hvad jeg kan fra hukommelsen. 1. Periodiske bevægelser Genoprettende krafter Amplitude, Periode, Frekvens og Vinkelfrekvens 2. Simpel harmonisk bevægelse Definition x(t) diff ligning (+hastighed/acceleration) Periode og frekvens 3. Energien i harmonisk bevægelse 4. Penduler Det simple pendul Det fysiske pendul 5. Dæmpede svingninger Over-, under- og kritisk dæmpning Energien 6. Definition af dæmpning (diff. lign) 5.2 Detaljer Her følger detaljerne for denne givne disposition Periodiske bevægelser Dette emne omhandler konceptet af periodiske bevægelser. En periodisk bevægelse opstår når vi har en forskydning fra ligevægtstilstanden og en genoprettende kraft der forsøger at bringe systemet tilbage til ligevægt. Et typisk eksempel er en fjeder der trækkes ud fra dens ligevægtstilstand og så gives slip fra. Her vil vi se at en genoprettende kraft vil forsøge at trække fjederen tilbage mod ligevægt. Når den når til denne ligevægtstilstand vil der ikke være nogen krafter der udøves på den i den retning, men fordi den allerede er i bevægelse vil den overskyde ligevægtstilstanden og gå mod venstre indtil accelerationen i den anden retning har sænket dens hastighed 52
53 tilstrækkeligt til den ændrer retning. Denne oscilering frem og tilbage sker i teorien for evigt, hvis det ikke var pga. friktion. Konceptet illustreres herunder: Amplitude, Periode, Frekvens og Vinkelfrekvens Vi har en række betegnelser/koncepter i periodiske bevægelser. Amplitude: Amplituden af en bevægelse, skrevet A, er den maksimale forskydning bevægelsen kan lave i en given retning. Det er altid en positiv værdi og en komplet cyklus defineres som vandringen fra A, igennem O (ligevægt), til A, tilbage igennem O og tilbage til A. En vandring fra A til A kaldes en halvcyklus. Periode: Perioden T er tiden for en cyklus. Den er altid positiv. 53
54 Frekvens: Frekvensen f er antallet af cykluser pr. sekund. Enheden for frekvens er Hz. Vinkelfrekvens: Vinkelfrekvensen ω = 2πf og har enheden rad/s. Vinkelfrekvensen bør ikke misforstås for at være vinkelhastigheden ω, omend den i visse tilfælde fungerer sådan. Vi kan desuden se forholdet mellem T og f er reciprokt: f = 1 T T = 1 f Samt at definitionen for vinkelfrekvens kan skrives som: ω = 2πf = 2π T Simpel harmonisk bevægelse Det bringer os så videre til konceptet af en simpel harmonisk bevægelse. En simpel harmonisk bevægelse er en hvor den genoprettende kraft er direkte proportional til forskydningen fra ligevægt. Et eksempel på dette er en ideal fjeder ved Hooke s lov: F x = kx Hvor x er forskydningen og k er en kraftkonstant med enheden N/m. Harmonisk bevægelser er vigtige, ikke fordi konstruktionen er bredt gældende i virkeligheden, men fordi mange typer bevægelser kan antages at være simple harmoniske bevægelser, hvorved det giver en god approksimation, såfremt amplituden er lille nok. I tilfældet med Hookes lov må amplituden f.eks. ikke være så stor, at Hookes lov ikke længere er i effekt, hvilket den kun er i et ret begrænset felt af det mulige stress du kan pålægge en fjeder. Bruges Newtons 2. lov på Hookes lov får vi nu: F = ma = m d2 x dt 2 = kx Hvor vi kan dividere med m på begge sider og få et udtryk for accelerationen: a x = d2 x dt 2 = k m x Vi har altså en differentialligning vi kan løse for at finde en funktion for x afhængig af tiden x(t). 54
55 x(t) diff ligning For at finde en funktion for x(t) skal vi finde et x for hvilket den anden afledte heraf er k mx. Da vi ved x skal oscilere i cykluser fra A til A og tilbage igen, så kan vi regne ud vi skal bruge en eller anden oscillerende funktion, som en sinusfunktion eller cosinusfunktion. Vi skal desuden bruge at: k ω = m ω 2 = k m Den rigtige løsning til differentialligningen er som følger, hvilket vi kan verificere: x = A cos(ωt + φ) Hvor A er amplituden, ω er vinkelfrekvensen, t er tiden og φ er faseforskydelsen (i.e. vandret forskydelse). Propper vi den ind i vores differentialligning ovenfor kan vi verificere hvorvidt det er en korrekt løsning. Så vi opskriver lige de to differentialer i forhold til t herunder: x = dx dt = ωa sin(ωt + φ) x = d2 x dt 2 = ω2 A cos(ωt + φ) Hvor vi desuden har v x = x og a x = x, forhåbentligt. Indsætter vi udtrykket i differentialligningen, og bruger formlerne for ω ovenfor, så får vi d 2 x dt 2 = k m x ω 2 A cos(ωt + φ) = k m x k m A cos(ωt + φ) = k m x Og da x = A cos(ωt + φ) er de to udtryk lig med hinanden, hvorved vi har verificeret at det er en korrekt løsning. Et plot for x(t) ses herunder: 55
56 Periode og frekvens Som tidligere nævnt er perioden T og frekvensen f reciproke af hinanden, altså at: f = 1 T T = 1 f Men når vi ved frekvensen er antal cykluser pr. sekund, så kan vi også skrive den om til følgende for en simpel harmonisk bevægelse: f = ω 2π = 1 k 2π m Hvilket leder til følgende udtryk for perioden T i en simpel harmonisk bevægelse: T = 1 f = 2π ω = 2π m k Altså kan vi se, at jo større masse m, jo lavere acceleration og derved jo længere tid til at gennemføre en komplet cyklus. Desuden kan vi se en stivere fjeder (i.e. en med højere k) udøver mere pres ved en given forskydning x hvorved accelerationen mod ligevægt bliver større, hastigheden bliver større og perioden T bliver mindre. En anden vigtig observation er også, at ingen af ovenstående udtryk indeholder amplituden A, men kun masse m og kraftkonstanten k. I simpel harmonisk bevægelse er perioden og frekvensen nemlig uafhængig af amplituden A, da større A betyder forskydningen er større, hvilket betyder den restorerende kraft er kraftigere, hvorved den gennemsnitlige hastighed over hele cyklusen forøges. NTS: Angular SHM Note-to-self: Der findes en rotationel ækvivalent af Hookes lov for en spiralfjerder brugt i ure o.lign. Beskrivelse og løsning for denne er 100% det samme som for normal simpel harmonisk bevægelse, blot med omregningen fra linear mekanik til rotationel mekanik, i.e. F x = kx bliver τ z = κθ og Θ i 56
57 stedet for amplituden A., således forskydningen θ skrives som: θ = Θ cos(ωt + φ) Der bliver sikkert ikke spurgt til det, men just in case Energien i harmonisk bevægelse Da de eneste krafter der udøves horisontalt i ovenstående harmonisk bevægelse er fjederkraften og da de vertikale krafter udøver intet arbejde på fjederen (i.e. de udligner hinanden), så er den totale mekaniske energi af systemet bevaret. Vi kan altså sige at vi har energibevarelse i systemet, hvorved E = K +U er konstant (OBS: U er den elastiske potentielle energi fra sektion 7.2): E = 1 2 mv2 x kx2 = constant Vi kan således se at E ved x = A (i.e. top amplituden) er 100% potentiel, og ved x = 0 er 100% kinetisk, men siden vi har energibevarelse, så er energien ved x = A den samme som ovenstående, således vi kan skrive: E = 1 2 mv2 x kx2 = 1 2 ka2 = constant Vi kan verificere gyldigheden af dette statement ved at indsætte værdierne for v x og x ovenfor, bruge ω 2 = k m og huske på at sin2 (α)+cos 2 (α) = 1, således: E = 1 2 mv2 x kx2 = 1 2 m [ ωa sin(ωt + φ)]2 + 1 k [A cos(ωt + φ)]2 2 = 1 2 ka2 sin 2 (ωt + φ) ka2 cos 2 (ωt + φ) = 1 2 ka2 Nedenfor er et plot af energien i forhold til forskydning x. Som vi kan se er E = K + U konstant: 57
58 5.2.4 Penduler Der findes andre ting end lige netop fjedre der er approksimationsmæssigt harmoniske bevægelser. To eksempler på dette er det simple pendul og det fysiske pendul. Det simple pendul Det matematiske pendul er en idealiseret model hvor vi har et objekt hængende fra en masseløs, ustrækkelig streng. Objektet har masse m og bevæger sig i en cirkulær bane med L som længden af strengen og bevæger sig en vinkel θ hvilket resulterer i en buelængde på x = Lθ. Konceptet illustreres herunder: 58
59 Den restorerende kraft er i dette tilfælde så det tangentielle komponent til den resulterende kraft: F θ = mg sin θ Men som vi kan se er den altså ikke proportionel til forskydningen x = Lθ, så hvorfor er dette alligevel et eksempel på harmonisk bevægelse? Fordi θ og sin(θ) for små vinkler er meget tæt på hinanden. Tager vi f.eks. θ = 0.1 rad (ca. 6 ), så er sin(θ) = , altså kun 0.2% anderledes. Så med den approksimation kan man i stedet skrive den restorerende kraft op som: F θ = mgθ = mg x L = mg L x Hvor den i den sidste variant ovenfor ligner Hookes lov mistænkeligt meget, blot hvor k = mg L. Fra det kan vi udregne vinkelfrekvensen, frekvensen og perioden til at være: k ω = m = mg/l g m = L f = ω 2π = 1 2π g L T = 2π ω = 1 f = 2π L g Her kan man lægge mærke til, at massen m ikke indgår i nogen af ovenstående formler. Det skyldes at den restorerende kraft er proportional til m hvorved Newtons 2. lov kommer til at have m på begge sider, hvorved de udligner hinanden. Det er samme begrundelse der ligger bag hvorfor ting med forskellige masser falder med samme hastighed i et vacuum. Endnu engang vær dog opmærksom på, at ovenstående kun gælder for små vinkler, som illustreret herunder: 59
60 Det fysiske pendul Det fysiske pendul er ethvert reelt pendul med en krop af en bestemt størrelse, modsat det idealiserede simple pendul hvor vi antager al massen er samlet et sted. Jeg vil ikke gå i detaljer om hvordan det fysiske pendul virker, men princippet her er dog det samme. Det fysiske pendul er approksimerbart simpelt harmonisk såfremt vi arbejder med små vinkler. (Note-to-self: Det er basalt set bare som det simple pendul, men med den rotationelle terminologi i stedet - i.e. τ z i stedet for F x, I i stedet for m o.lign.) En illustration af det fysiske pendul er herunder: Dæmpede svingninger Som en af de sidste ting vil jeg lige snakke om dæmpede svingninger. Alle oscilleringssystemer vi har talt om ovenfor er idealiseret i den forstand, at de blankt ignorere ting som friktion o.lign. I virkeligheden vil der altid være en dæmpning af en svingning, hvor man vil se et fald i amplituden over tid. Udover vores normale F x = kx så får vi altså også en yderligere dæmpningningskraft fra friktion F x = bv x, hvor b er styrken af dæmpningskraften (minustegnet er der fordi dæmpningen altid skal være i negativ retning af hastigheden). Skriver vi dette op som den resulterende kraft og bruger 60
61 Newtons 2. lov, så får vi: Fx = kx bv x kx bv x = ma x kx b dx dt = x md2 dt 2 Vi har altså nu en differentialligning hvortil vi skal bruge et udtryk for x for at få en ny x(t). Denne løsning x er: x = Ae (b/2m)t cos(ω t + φ) Og vinkelfrekvensen ω er: ω = k m b2 4m 2 Som vi kan se afviger x(t) ovenfor i forhold til hvordan den er uden dæmpning. Amplituden A ganges med en faldende eksponentiel faktor baseret på tid, b og m, således jo større værdier for b, jo større dæmpning. Over-, under- og kritisk dæmpning Desuden kan vi se at ω vil blive 0 for b = 2 km: k m b2 4m 2 k m (2 km) 2 4m 2 k m k m = 0 Når ω = 0 kalder vi det for kritisk dæmpning, fordi systemet ikke længere vil oscillere og nu bare falder tilbage til ligevægt med det samme. Til sammenligning har vi andre tilstande som f.eks. overdæmpning, hvor b > 2 km hvorved oscilleringen går tilbage til ligevægt langsommere end ved kritiske dæmpning (den vil sidde og vibrere omkring ligevægten). Vi har, sidst men ikke mindst, underdæmpning som er den normale situation hvor amplituden bliver mindre for hver cyklus. Forskellige niveauer af dæmpning er plottet i følgende graf af x over t: 61
62 Energien Modsat for det idealistiske tilfælde, så er den mekaniske energi dog ikke bevaret når vi indkorporerer dæmpning. Tager vi udtrykket for total mekanisk energi igen, så har vi: E = 1 2 mv2 x kx2 For at finde denne energis ændring over tid differentierer vi i forhold til t: de dt = mv dv x x dt + kxdx dt Det første differentiale her er så a x og det næste er v x, hvorved vi får: de dt = mv xa x + kxv x = v x (ma x + kx) Fra de første formler med dæmpning havde vi at: ma x = kx bv x ma x + kx = bv x Hvilket vi kan indsætte, således vi får: de dt = v x( bv x ) = bv 2 x Derved kan vi altså se, at den samlede mekaniske energi falder i forhold til dæmpningsfaktoren b. 62
63 6 Fluid mekanik 6.1 Disposition OBS: Han spørger sikkert om Reynolds tal og Poiseuilles lov, derfor har jeg kort skrevet om dem til sidst 1. Densitet og Tryk Definitioner (tryk og densitet) 2. Dybde og Pascals love 3. Opdrift 4. Flow Overfladespænding Ideal væske Flow lines, Flow tubes Steady flow, Streamline, Laminar flow og Turbulent flow 5. Turbulens og viskositet 6. Kontinuitetslignignen Bevis den. 7. Bernoullis ligning Bevis den. 6.2 Detaljer Her følger detaljerne for denne givne disposition Densitet og Tryk I dette emne skal vi kigge på fluid mekanik, eller væskemekanik, startende med 2 grundlæggende definitioner, nemlig densitet og tryk. Densitet Densiteten af et homogent materiale er defineret som massen m pr. enheds volumen V, eller: ρ = m V Det er dog ikke alle materialer der er homogene (f.eks. jorden.. eller os), så der vil vi typisk udregne en gennemsnitlig densitet i stedet. Enheden for densitet er kg/m 3. 63
64 Tryk Når en væske er i stilstand udøver den en kraft vinkelret på enhver overflade i kontakt med den, som f.eks. et legeme nedsunket i væsken. Hvis vi definerer et lille styk af en flade i væsken med areal da, så siger vi at en vinkelret normalkraft df udøver ligelig kraft på begge sider af denne flade, som vist herunder: Vi definerer således tryk som normalkraften pr. enhed areal, eller: p = df da Hvis trykket er det samme på alle punkter af en flade i væsken (i.e. fladen ikke er så stor af den vandrer igennem store dybder), så er trykket på denne samlede flade: p = F A SI-enheden er tryk er Pascal (Pa), som er N/m 2. Man har desuden defineret enheden atmosfærisk tryk (p a ), som er trykket ved havets overflade og svarer til 1atm = P a eller ca bar. Når der pålægges et tryk i en væske vil vi opleve legemers volumen i den væske bliver mindre. Dette skyldes bulk stress eller volumen stress, skaber en deformering. Dette bliver et problem hvis man ikke er skabt til at fungere i væksen, f.eks. hvis et menneske opholder sig i 500 meters dybde. Det lægger faktisk op til et interessant eksperiment, som de kære Mythbusters lavede for lidt tid siden. De tog en gammeldags dykkerdragt (sådan en med rør op til overfladen for at få luft) og så lavede de en fake-person ud af grisekød og puttede ham i denne dragt. De nedsank herefter denne 64
65 til ca. 90 meters dybde, alt imens de sørgede for at udligne trykket udefra vha. tryk indefra. Når denne dragt så var nede i ca. 90 meters dybde, så cuttede de luften derned til, således trykket indefra forsvandt og i løbet af relativt få sekunder, så havde trykket fra vandet omkring dragten presser hele denne mand op i hjelmen med blod og indvolde udover det hele. Hele denne person blev altså knust helt op i hjelmen og hjelmen flækkede tilmed. Så hvis der er en ting jeg har lært af det afsnit, så var det: Ik lav grin med væsketryk! Det kan dræbe grusomt og voldsomt Dybde og Pascals lov Det bringer os videre til tryks dybdeafhængighed og Pascals lov. Hvis vi kunne antage vægten af en væske var negligjerbar, så ville trykket være det samme overalt i væsken. Det kan vi bare umiddelbart ikke, da der er stor forskel på trykket ved vandoverfladen og 5 km højde, og der er stor forskel på vandoverfladen og 500 meters dybde i vand. Tryk afhængig af dybde Så vi skal udlede en sammenhæng mellem trykket ρ i en væske i stilstand og den lodrette elevation y vi har i væsken, dette kaldes også for Pascals første lov. Vi starter med at overveje et tyndt element af væske (nærmest som en kasse) nede i en samlet større væske. Dette tynde element, eller skive, har tykkelse dy, bunden og toppen af elementet har begge arealet A og elementets bund og top er henholdsvis i elevation y og y + dy i forhold til bunden af væsken. Volumen af væskeelementet er derved dv = Ady, massen er dm = ρdv = ρady og vægten er dw = dmg = ρgady. Sidst men ikke mindst er trykket under elementet p hvorved den samlede kraft på bunden er pa og trykket ovenpå elementet er p+dp, hvorved den samlede nedadgående kraft er (p+ dp)a. Et samlede overblik over situationen og et frit-legeme diagram er herunder: 65
66 Vi ved vækseelementet er i ligevægt da væsken ellers ikke ville være i stilstand, så der skal gælde at summen af krafter i y-aksen skal være 0, altså Fy = 0, hvorved vi kan opskrive situationen således: pa (p + dp)a pgady = 0 pa (p + dp)a pgady A = 0 A p (p + dp) pgdy = 0 dp pgdy = 0 pgdy = dp dp dy = pg Altså kan vi se, at forøges y så falder p, hvilket er forventeligt da vi satte y = 0 til at være bunden af væsken. Så hvis p 1 og p 2 er trykket ved henholdsvis elevation y 1 og y 2, samt g og ρ holdes konstant, så har vi: p 2 p 1 = ρg(y 2 y 1 ) Ofte vil vi dog hellere tætte elevation i forhold til dybden af en position i væksen fremfor afstanden til bunden, så vi kan skrive denne formel om. Hvis vi tager punkt 1 til at være et arbitrært niveau i en væske og lader p være trykket til det sted, så tager vi punkt 2 til at være overfladen af væsken hvor trykket er p 0. Dybden af punkt 1 under væskens overflade er 66
67 så h = y 2 y 1 og formlen bliver så: p 0 p = ρg(y 2 y 1 ) = ρgh p = p 0 + ρgh Så trykket i en væske afhænger altså kun af dybden, densiteten, tyngdeaccelerationen og trykket ved overfladen af væsken. Formen af beholderen med væsken er derved ligegyldig. En illustration af ovenstående omskrivning af formlen er her: Pascals lov Formlen ovenfor med trykket afhængig af dybden siger så også, at vi kan forøge trykket i en væske ved at forøge overfaldetrykket. Dette kan vi naturligvis ikke gøre ved verdenshavene f.eks. men for en væske i et stempel f.eks. kan man. Denne overvejelser er grundlaget bag en anden af Pascals love, som siger: Tryk tilført til en indelukket væske/gas forbedeles uformindsket til enhver del af væsken/gassen og væggene af den omkringliggende beholder Tager vi eksemplet med en hydralisk lift, så har vi en sådan opstilling nedenfor: 67
68 Vi har altså en lille kraft pålagt den lille overflade, som så skaber et tryk der bliver fordelt i hele væsken, hvorved den resulterer i en større kraft på den større overflade, eller skrevet op som en formel: Hvorved kraften F 2 bliver: p = F 1 A 1 = F 2 A 2 F 2 = A 2 A 1 F 1 Altså har hydralikliften fungeret som en kraft multiplikationsenhed, der har ganten en faktor svarende på forskellen mellem arealer på kraften Opdrift Vi iler videre og tager fat på Opdrift. Opdrift er et koncept coined af Archimedes. Ifølge Archimedes er opdrift: Når et legeme er komplet eller delvist nedsunket i en væske vil væsken udøve en opadgående kraft på legemet svarende til vægten af den væske legemet har forskudt. Vi kan nemt argumentere for dette er korrekt. Lad os forestille os et arbitrært stykke væske i stilstand nede i den samlede væske. Væskestykke har masse m og derved vægt w = mg. Den komplette væske er i stilstand, derved må summen af alle y-komponenter af kraft være 0. Så for at balancere vægten ud må der være en opadgående kraft B (for bouyancy), med samme magnitude som w. 68
69 Erstattes hele dette væskeelement med et tilsvarende fast element i den forstand at vægten er den samme og formen er den samme, så vil alle krafterne også være de samme, hvorved der stadig vil være en opdriftskraft og det faste element vil være i ligevægt. Hvis elementet derimod vejede mere end den væske den forskød, så ville den ikke være i ligevægt, men i stedet synke nedad, da vægten af den derfor vil være større end opdriftskraften, som har magnitude af vægten af vandet der forskydes, ikke af elementet det forskydes af. Konceptet ses herunder: Generelt kan man sige, at alting med densitet lavere end væsken bør have opdrift (i.e flyde) og alt med større densitet end væsken bør synke. Overfladespænding Relateret hertil er konceptet af en overfladespænding. Overfladespænding er noget vi ser når insekter tilsyneladende lander på vand, eller ved det at vi kan lade en papirclip flyde på vand, til trods for dens densitet er sådan at den ikke burde kunne flyde. Overfladespænding eksisterer fordi væskemolekylerne tiltrækkes af hinanden og hvor et væskemolekyle nede i væsken tiltrækkes ligeligt i alle retninger, og derved er i ligevægt, så er det ikke tilfældet for en molekyle ved overfladen. Ved overfladen bliver molekylet tiltrukket af volumen af væske og har derfor tendens til at strække sit overfladeareal ud, hvorved der kommer spænding på hele overfladen. Konceptet illustreres herunder: 69
70 6.2.4 Flow Det bringer os så videre til konceptet af flow i en væske eller en gas. Flow af væsker og gasser er generelt ekstremt kompliceret, men vi kan bruge nogle idealiserede modeller for at forsøge at analysere på flows. En typisk idealisering er at fokusere på ideal væske, som er væsker der er ukompresselige således densiteten af dem ikke kan ændre sig og hvor de ydermere har ingen intern friktion (i form af viskositet). Det er selvfølgelig en idealisering og den holder ikke reelt i virkeligheden, omend det er en tæt på korrekt approksimation for væsker og den kan bruges for visse situationer med gasser (OBS: hvis forskellene i tryk i forskellige dele af kassen ikke er for store). Antagelsen om ingen intern friktion kan generelt ikke tages i praksis men virker for nu. Friktion skyldes viskositet, som er en form af shear stress når to lag af væske glider henover hinanden i f.eks. et rør e.lign. Et flow deles så yderligere op i nogle logiske dele: Flow line: En flow line er den vej en individual partikel bevæger sig i flowet. Flow tubes: Flow lines der passerer gennem et givent imaginert område i væsken former en flow tube. Dette koncept illustreres herunder 70
71 Derudover er der desuden en række koncepter for et flow: Ideal væske: Et ideal væske var som sagt en ukompresselig væske hvor densitet er konstant og der er ingen intern friktion (viskositet) Steady flow: Et steady flow er et hvor de overordnede flow mønstre ikke ændrer sig over tid. Det vil sige partiklerne i et flow overordnet set følger de samme flow lines og et map af væskehastigheder til forskellige positioner vil forblive konstante. I et steady flow kan enkelte flow lines i en flow tube heller ikke bryde ud af flow tubens imaginære vægge. Sreamline: Et streamline er en kurve hvor hvilket dens tangent til enhver tid peger i retning af det overordnede flows hastighdsvektor. Hvis flow mønstre ændrer sig over tid vil flow lines og streamlines ikke passe sammen, hvorved vi ikke kan have et steady flow (da de her altid er identiske). Laminar flow: Et laminart flow er et hvor tilstødende lag af væske glider nemt forbi hinanden og flowet er et steady flow. Turbulent flow: Som kontrast hertil er et turbulent flow et hvor der ikke er noget fastsat flow mønster og mønsteret konstant ændrer sig Turbulens og viskositet Hvor der er situationer hvor viskositet og turbulens kan ignoreres, så er det langt fra alle tilfælde. Så inden vi går videre bør vi lige hurtigt notere disse to koncepter og hvordan de fungerer. Viskositet Viskositeten af en væske er dens interne friktion, hvor en del af væsken kan modarbejde den anden dels bevægelse. Det er grunden til det er hårdt at ro i en kano f.eks., men det er på samme tid også grunden til du overhovedet kan. Ligesom når du ruller noget ned af en skrænt, så skal der være friktion for at det roterer, ligeledes skal der være viskositet i en væske for at den gør modstand når du prøver på at manipulere den. 71
72 Viskositeten bliver ofte også omtalt som hvor tyktflydende en væske er, så f.eks. vand er mindre tyktflydende en honning og honning er mindre tyktflydende end lava. Viskositeten giver os nogle interessante effekter når en væske stor viskositet presses igennem et rør. Her vil vi nemlig opleve at væsken har tendens til at sætte sig fast på overfladen af røret, således vi vil se at der er forskel på hastigheden af de enkelte dele af flowet i røret. Konceptet er illusteret herunder: Den maksimale hastighed af væsken er derved i centrum af røret, hvorimod hastigheden ude ved kanterne er 0 fordi væsken klæber til overfladen. Man kan se det som at væsken er bygget op af en række flow tubes der hver især udøver friktion på hinanden, således man i mange tilfælde skal pålægge ekstra tryk på en beholder med en tyktflydende væske og tyngdekraften ikke er nok. Når man gør det med f.eks. en ketchup flaske, så bruger man Pascals lov da man netop pålægger et pres, som resulterer i et forhøjet tryk ved en anden overflade. I min gennemgang af Bernoullis ligning om lidt ignorerer vi dog disse effekter, men det er vigtigt at pointere resultaterne fra Bernoullis ligning ikke gælder hvis viskositet skal tages med i betragtning. Turbulens Turbulens i et flow er noget der sker hvis hastigheden af flowet når over en given kritisk værdi, således flowet ikke længere er laminart. Når et flow bliver turbulent kommer det til at bevæge sig højst irregulert og vil ændre mønster ofte. Hvorvidt en væske (eller gas) har tendens til at blive turbulent kommer an på dens viskositet. Jo højere viskositet, jo mindre tendens til at blive turbulent. Men antaget viskositeten ikke er mikroskopisk, så er den primære kilde til turbulent flow hvis flowet når over en given kritisk hastighed. Et flow kan 72
73 sagtens være laminart ved lave hastigheder, og så blive turbulent ved højere. Det ser vi f.eks. herunder for røg der kommer op fra nogle insense lys, hvor flowet starter med at være laminart, men så skifter og bliver turbulent når en given hastighed er nået Kontinuitetslignignen Med det på plads kan vi tage fat i kontinuitetsligningen. Kontinuitetsligningen bygger på, at massen af en væske ikke ændrer sig når den er i et flow. Illustrationen ovenfor er den grafiske illustration der skal bruges til udledninging. Vi ser på en del af et flow tube mellem to stationære tværsnit med arealer A 1 og A 2. Flow hastighederne ved disse sektioner er henholdsvis v 1 og v 2. Inten flow linje bryder udenfor væggen af flow tuben og ingen bryder ind, da flow hastighedsvektoren er tangent til væggen. 73
74 I løbet af et lille tidsinterval dt bevæger væsken ved A 1 sig distancen v 1 dt, så en cylinder af væske med højde v 1 dt og volument dv 1 = A 1 v 1 dt flyder ind i tuben igennem A 1. I løbet af dette tidsinterval vil en cylinder af volumen dv 2 = A 2 v 2 dt have flydt ud af tuben igennem A 2. Hvis vi så antager vi har en idealvæske, så har vi samme densitet ρ over det hele. Massen af væske dm 1 der flyder ind i røret ved A 1 i tiden dt er så dm 1 = ρa 1 v 1 dt. Ligeledes er massen af væske dm 2 der flyder ud af røret ved A 2 i samme tidspunkt dm 2 = ρa 2 v 2 dt. For et steady flow ved vi, at den totale masse ie tuben er konstant, således dm 1 = dm 2. Opskriver vi dette får vi: dm 1 = dm 2 ρa 1 v 1 dt = ρa 2 v 2 dt Eller: A 1 v 1 dt = A 2 v 2 dt Fordi ρ er konstant. Av ovenfor kaldes så for Volume flow rate, altså hvor meget volumen pr. tid tværsnittet af tuben tager ind., i.e.: Av = dv dt Mass flow rate er så hvor meget masse pr. tid tværsnittet af tuben tager ind, i.e. og fås ved bare at gange ρ på igen: Mass flow rate = dv dt ρ = ρav Kontinuitetsligningen fortæller os altså, at volume flow rate og mass flow rate har samme værdi hele vejen langs en given tube. Og hvis tværsnitsarealet af tuben formindkes, så vil hastigheden forøges for at sikre volume flow rate og mass flow rate stadig er den samme. 74
75 6.2.7 Bernoullis ligning Det bringer os videre til den sidste ligning jeg vil kigge på, nemlig Bernoullis ligning, som bygger videre på Kontinuitetsligningen. Ifølge kontinuitetsligningen kan hastigheden variere i et flow. Trykket kan dog også variere, alt afhængig af om højden af flowet ændrer sig og trykket afhænger ligeledes også af hastigheden af flowet. Bernoullis ligning beskriver denne sammenhæng mellem tryk, flow hastighed og højde for flows der er idealvæsker, i.e. fast densitet og ingen viskositet. Vi starter lige med at skrive Bernoullis ligning op, så kan vi udlede den bagefter. Bernoullis ligning siger: p 1 + ρgy ρv2 1 = p 2 + ρgy ρv2 2 For at udlede Bernoullis ligning skal vi bruge work-energy teoremet dw = dk + du. Vi har så følgende situation: Så vi har væske der til en eller anden initiel tid ligger imellem de 2 tværsnit a og c. Hastighederne ved disse steder er henholdsvis v 1 og v 2. I det korte tidsinterval dt bevæger væsken der initielt er ved a sig fra a til b (en distance på ds 1 = v 1 dt) og væsken der initielt er ved c bevæger sig fra c til d (en distance på ds 2 = v 2 dt). Grundet Kontinuitetsligningen ved vi, at Volume flow rate er den samme for tværsnittene A 1 og A 2, hvorved 75
76 volumen der passerer tværsnittene er dv = A 1 ds 1 = A 2 ds 2. Nu kan vi så udregne arbejdet der udøves på væskeelementet i løbet af tiden dt. Vi har antaget der ingen viskositet er, så de eneste ikke-gravitationelle krafter i spil er trykket fra væsken omkring væskeelementet. Trykket ved de 2 ender A 1 og A 2 er henholdsvis p 1 og p 2, således trykket på ved a på tværsnittet er pa 1 og det modsatrettede tryk ved d på tværsnittet er pa 2 (OBS: det modarbejder bevægelsen af væsken). Det resulterende arbejde er derved: dw = p 1 A 1 ds 1 p 2 A 2 ds 2 = (p 1 p 2 )dv Fordi dv var dv = A 1 ds 1 = A 2 ds 2, hvorved de to går ud med hinanden. Arbejdet dw er grundet andre krafter end tyngdekraften, så den er lig med en ændring i total mekanisk energi for væskeelementet. Den mekaniske energi for væskesektionen b til c ændrer sig ikke, så lad os kigge på a til b og c til d. I begyndelsen af dt vil væsken imellem a og b have volumen A 1 ds 1, masse ρa 1 ds 1 og kinetisk energi 1 2 ρa 1ds 1 v1 2 I slutningen af dt vil væsken imellem c og d have den kinetiske energi 1 2 ρa 2ds 2 v2 2. Den resulterende kinetiske energi de i tidsintervallet dt er derved: dk = 1 2 ρa 2ds 2 v ρa 1ds 1 v 2 1 = 1 2 ρdv v ρdv v2 1 = 1 2 ρdv (v2 2 v 2 1) Og så mht. til den potentielle energi, der har vi ved begyndelsen af dt at den potentielle energi for massen mellem a og b er dmgy 1 = ρdv gy 1 og ved slutningen af dt at massen mellem c og d har den potentielle energi dmgy 2 = ρdv gy 2. Den resulterende ændring i potentiel energi du i tidsintervallet dt er derved: du = ρdv gy 2 ρdv gy 1 = ρdv g(y 2 y 1 ) 76
77 Kombineres alle disse udtryk i work-energy teoremet fås: dw = dk + du (p 1 p 2 )dv = 1 2 ρdv (v2 2 v 2 1) + ρdv g(y 2 y 1 )..Divider dv ud p 1 p 2 = 1 2 ρ(v2 2 v 2 1) + ρg(y 2 y 1 ) Hvor vi så kan rykke alle elementer med index 1 til venstre og alle elementer med index 2 til højre, og så får vi Bernoullis ligning: p 1 + ρgy ρv2 1 = p 2 + ρgy ρv Reynolds tal & Poiseuilles lov Vi kopierer bare direkte fra noterne, af hensyn til tid: Love om væsker I Young & Freedman kapitel 14 udledtes først Pascals lov, der relaterer trykket i forskellige højder i en fluid med konstant massetæthed ρ: p 2 p 1 = ρg(y 2 y 1 ) Denne lov gælder dog kun for en stationær væske, og for at beskrive en væske, der bevæger sig, må vi ty til Bernoullis ligning. Denne relaterer trykket, højden og væskens hastighed for to punkter på en flow tube p 1 + ρgy ρv2 1 = p 2 + ρgy ρv2 2 og reducerer til Pascals lov, hvis væsken står stille. Bernoullis ligning er udledt under den antagelse, at den mekaniske energi er bevaret, og er således ikke gyldig, hvis der er friktion i væsken eller mellem væsken og dens omgivelser. I det udleverede uddrag fra lærebogen Mekanik, betragtes laminar strømning i et rør med radius R, længde L og trykkene p 1 og p 2 i hver ende. Her udledes, at hastighedsprofilen har den funktionelle form v(r) = 1 4η ( p1 p 2 L ) (R 2 r 2 ) 77
78 hvor η er viskositeten af væsken. Ved at integrere v(r) op over hele tværsnittet af røret kan man således finde den samlede volumenstrøm kendt som Poiseuilles lov. Q = πr4 8η ( ) p1 p 2 Reynolds tal Følgende er taget direkte fra Wikipedia pga. tidsmangel: Reynolds tal, også kaldet Reynolds konstant, er en vigtig dimensionsløs enhed indenfor strømningsmekanikken. Tallet bruges til at forudsige om en strømning bliver laminar eller turbulent. For cirkulære rør gælder det, at en strømning bliver laminar, hvis Reynolds tal er under 580, og turbulent, når Reynolds tal er over 750. Reynolds tal beregnes for cirkulære rør som: L Re = v mr h η hvor v m er middelhastigheden af flowet, R h er den hydrauliske radius (hydraulisk diameter divideret med 2) og η er væskens viskositet. Reynolds tal er opkaldt efter Osborne Reynolds, som fremsatte begrebet i
79 7 Temperatur, termisk udvidelse, varme og faseovergange 7.1 Disposition 1. Temperatur Temperatur, Termisk Ligevægt, Insulatorer & Ledere Termodynamikkens 0. lov 2. Termisk udvidelse 3. Varme Lineær udvidelse Volumen udvidelse Visning af sammenhæng mellem α og β Termisk stress Varme vs. Temperatur Specifikke varmekapacitet Konduktion, konvektion og varmestråling 4. Faseovergang Definition 7.2 Detaljer Smelte og fordampningsvarme Sublimering, Overophedning- og overnedkøling Her følger detaljerne for denne givne disposition Temperatur Emnet her handler om en hel del ting, nemlig temperatur, termisk udvidelse, varme og faseovergange. Vi starter med at kigge på nogle grundlæggende principper Temperatur, Termisk Ligevægt, Insulatorer & Ledere En temperatur er noget vi måler ud fra en given variabel der ændrer sig grundet varmepåvirkning. Det kan f.eks. være volumen af væske der udvider sig grundet varmepåvirkning, eller et tryk der forøges mm. Alle disse giver os mulighed for at måle et kvantitativt tal, som tallet for temperaturen. 79
80 Dette gør vi så vha. et såkaldt termometer, som vi f.eks. kunne finde på at nedsænke i en kop varm kaffe. Når vi så gør det vil kaffen og termometeret udveksle varmeenergi indtil de når samme temperatur og derved er i det man kalder Termisk ligevægt. Altså taber kaffen egentlig lidt varme når temperaturen måles. Det skal siges, at det egentlig ikke er kaffens temperatur man måler, men derimod termometerets. Vi sørger blot for termometeret opnår termisk ligevægt, hvorefter vi ser hvad termometerets temperatur er. Havde der været en såkaldt insulator imellem termometeret og kaffen, så havde de udvekslet varmeenergi langsommere, hvorved kaffen ville kunne have holdt på varmen længere tid (omend den ville have tabt varmeenergi til alle andre områder i nærheden, men det ser vi bort fra lige nu). En ideal insulator er så en insulator hvor der tillades ingen varmeenergi udveksling, hvorved systemet aldrig kan komme til termisk ligevægt. Sådan en insulator er dog bare en idealisering, da ingen sådan insulator eksisterer. Termodynamikkens 0. lov En vigtig grundlæggende sætning fra thermodynamikken bygger på det her med insulatorer og idealle insulatorer. Sætningen lyder som følger: Hvis C initielt er i termisk ligevægt med både A og B, så er A og B i termisk ligevægt med hinanden Altså en form for termodynamisk transitivitet (i.e. A er i termisk ligevægt med C, som er i termisk ligevægt med B, ergo A er i termisk ligevægt med C). Måden man viser dette på er ved at observere tre systemet A, B og C der initiel ikke var i termisk ligevægt, og så placere dem i en ideelt insulerende box med en ideel insulator mellem A og B og termiske ledere (i.e. en der tillader termisk udveksling igennem sig) imellem C og begge af de andre systemer. Dette illustreres herunder: 80
81 Herefter venter man til C er i termisk ligevægt med A og B, og spørgsmålet er nu om A og B er i termisk ligevægt også. Det kan man så tjekke ved ar rykke konstruktionen rundt så C adskilles fra A og B med en ideel insulator og A og B sættes sammen med en leder, som herunder: Og hvis Termodynamikkens 0. lov så gælder, så skulle der helst ikke ske noget.. hvilket der heller ikke gør, ifølge de eksperimenter som bogen refererede i hvert fald (OBS: Dog ikke lige helt sikker på hvordan de har testet det eftersom ideel insulatorer ikke eksisterer.. men det er sikkert bare insulatorer der i praksis er ideele de har brugt, da de først udveksler varme efter ekstremt lang tid). Her kan det også nævnes at C i den første opstilling kommer til at have samme temperatur som A og B, så havde det været et termometer kunne man have målt A og B s temperatur sådan, simpelthen ved at vente til der kom termisk ligevægt. Havde C kun været i kontakt med en af A eller B havde resultatet igen været det samme, da ligevægt først ville opnås når de havde samme temperatur. Ergo har vi også kriteriet for termisk ligevægt: To systemer er i termisk ligevægt hvis og kun hvis de har samme temperatur Termisk udvidelse Det bringer os så videre til konceptet af termisk udvidelse. De fleste materialer udvider sig når de udsættes for temperaturstigning. Hvordan de udvider sig kommer dog helt an på materialet. Der er grundlæggende to typer termisk udvidelse, nemlig lineær udvidelse og volumen udvidelse: Lineær udvidelse Lineær termisk udvidelse er hvor alle lineære dimensioner af et objekt udvider sig som resultat af temperaturændringen. 81
82 Lad os forestille os vi har en stav af et givent materiale, hvor denne stav har længden L 0 ved en eller anden initiel temperatur T 0 (f.eks. stuetemperatur). Når temperaturen så ændrer sig med T, så ændrer længden sig med T. Eksperimentielle resultater har vist at hvis bare T ikke er større end ca. 100K, så er L direkte proportionel til T og til startlængden L 0. Den lineære termiske udvidelse er så: L = αl 0 T Hvor α er koefficienten for lineær expansion og afhænger af materialet (i.e. jo mindre den er, jo mindre termisk udvidelse). Enhenden for α er K 1. Lineær expansion sker i alle lineære dimensioner (med få undtagelser i virkeligheden), så eksempelvis huller i materialer udvider sig også udad som illustreret herunder: Expansionen kan også forklares på molekylebasis hvis vi ser krafterne mellem atomer som værende fjedre. Vi ved atomer har krafter der tiltrækker dem til hinanden, men kommer to atomer så tæt på hinanden at deres elektronbaner overlapper vil krafterne imellem dem være frastødende. Der er således en ligevægtsafstand herinde imellem hvor to atomer kan danne et molekyle, og hvis disse atomer afviger blot lidt fra denne ligevægtstilstand vil de oscillere. Hvert atom vibrerer altså omkring denne ligevægtstilstand. Når temperaturen så stiger, så vil energien og amplituden af denne vibration forøges. 82
83 Krafterne imellem atomerne (som vi her kigger på som strenge) er ikke symmetriske, i den forstand at de er nemmere at strække end at sammenpresse. Så af den grund vil vi se at amplituden af vibrationen forøges og den gennemsnitlige distance mellem atomer forøges - resultatet heraf er termisk udvidelse langs alle lineære dimensioner. Konceptet illustreres herunder: Volumen udvidelse Det bringer os så videre til den anden type af termisk udvidelse, nemlig volumen udvidelse. Både faste stoffer og væsker laver en volumen udvidelse når de udsættes for temperaturændringer. Ligesom med lineær udvidelse gælder der, at hvis T ikke er for stor (ca. op til 100 K), så er forøgelsen i volumen V approksimerbart proportional med både temperaturændringen T og den initielle volumen V 0 : V = βv 0 T Konstanten β kaldes så for koefficienten for volumen udvidelse og varierer afhængig af materiale. Enheden er K 1. For væsker vil de desuden typisk være væsentligt større, således væsker generelt udvider volumen mere ved temperaturændring end faste stoffer gør. Ligesom med α for lineær udvidelse, så varierer β også afhængig af start temperaturen og gælder kun for relativt lave hastigheder. Visning af sammenhæng mellem α og β Der er en generel sammenhæng mellem koefficienten for volumen udvidelse og koefficienten for lineær udvidelse, når vi taler om faste stoffer. For at finde frem til denne sammenhæng antager vi en terning af materiale med længde L, således volumen V = L 3. Ved den initielle temperatur har vi så startværdierne V 0 og L 0. 83
84 Når temperaturen bliver hævet med dt vil sidelængderne forøges med dl og volumen forøges med en mængde dv givet ved: dv = dv dl dl = 3L2 dl Nu erstatter vi L og V med deres initielle værdier L 0 og V 0. Desuden bruger vi formlen for lineær udvidelse. Vi har således at dl er: dl = αl 0 dt Siden V 0 = L 3 0, betyder det at dv også kan udtrykkes som: dv = 3L 2 0αL 0 dt = 3αV 0 dt Dette er konsistent med den infinitesimale version af formlen for volumen udvidelse dv = βv 0 dt, hvis og kun hvis: β = 3α Termisk stress Termisk udvidelse er dog ikke uden sine konsekvenser. Hvis vi holder et givent materiale fast i en position så det ikke kan udvide- eller sammentrække sig, og det så herefter udsættes for en temperaturændring, så får vi såkaldt termisk stress. Dette er yderst problematisk i sådanne ting som brokonstruktion, da vi på den ene side gerne vil holde beton og metal fast, men på den anden side heller ikke vil risikere materialet tager skade eller decideret går i stykker pga. termisk stress. For at udregne den termiske stress på et materiale vi holder fast, så udregner vi mængden med hvilkent materialet ville udvide sig (hvis det kunne) og finder herefter stress niveauet der skal til for at føre det tilbage til dets oprindelige dimensioner. Lad os forestille os vi har en stang med længde L 0 og tværsnitareal A. Denne holdes nu til en konstant længde, alt imens temperaturen sænkes (i.e. T < 0), hvilket resulterer i tensile stress (i.e. fordi den prøver på at trække sig sammen men ikke kan). Den forholdsmæssige ændringen i længden hvis staven havde været fri til at sammentrække sig er: ( ) L = α T L 0 termisk Både L og T er her negativ. Spændingen (Tension) må altså forøges med en mængde F så det lige akkurat er nok til at generere en tilsvarende 84
85 men omvendt forholdsmæssig ændring i længden. Denne forholdsmæssige ændring i længden kan udregnes fra Young s Modulus: Y = F/A L/L 0 ( ) L L 0 spænding = F AY Da det vi gerne vil opnå er, at den totale forholdsmæssige ændring i længden er 0, så kan vi sætte op at summen af disse ændringer skal være 0: ( ) L L 0 termisk ( ) L + L 0 spænding Herefter isolerer vi tensile stress i denne og får: = α T F AY = 0 α T F AY = 0 F A = Y α T Hvilket er den termiske stress. Så hvis T er negativ, så er F og F/A positive, således en trækkraft (tensile force) er nødvendig for at vedligeholde dens længde. Hvis T derimod er positiv, så er F og F/A negative, hvorved den nødvendige kraft er kompressende. Hvis der er forskelle i temperaturen i et legeme, så kan det yderligere forværre termisk stress. Det ses ofte til daglig hvis man smider en isterning i et glas vand eller hvis man hælder kogende vand ned i en glasskål. Her vil man ofte se, at glaskålen knækker fordi de kolde og varme områder af glasset skaber så meget termisk stress imellem sig at glasset flækker Varme Det bringer os så videre til konceptet af varme. Hvis vi nedsænker noget koldt i noget varmt, f.eks. en ske i en kop te, så vil der påbegynde en udveksling af varmeenergi indtil disse to genstande er i termisk ligevægt (i.e. det varme te har fået lidt lavere temperatur og skeen har samme temperatur som teen). Denne udveksling af energi kaldes for varmestrøm eller varmeoverførsel. Det er vigtigt at pointere forskellen på varme og temperatur her. Temperatur er en kvantitativ måling af niveauet af hotness eller coldness. 85
86 Det afhænger altså af tilstanden af det man forsøger at måle det på. I modsætning hertil er varme noget der udveksles. Systemer kan udveksle varme i form af varmeoverførsel af energi, men et system har ikke en varme i den forstand. Man kan tilføje varme til et system ved at tilføje energi i en eller anden forstand, hvorved temperaturen vil stige. Men varme er altså en slags energi der udveksles og ikke en iboende egenskab af legemer. Specifikke varmekapacitet Lad os gå videre og kigge på hvordan vi så måler denne varme. Vi bruger symbolet Q som mængden af varme. Vi har så, at mængden af varme Q der skal til for at hæve temperaturen af en masse m af et givent materiale fra T 1 til T 2, er approksimerbart proportional til temperaturændringen T = T 2 T 1. Det er desuden proportional til massen af materialet. Dette betyder altså at hvis du ville varme vand til te, så vil du skulle tilføre dobbelt så meget varme hvis du tager 2 kopper, som hvis du tager en for samme temperaturinterval. Alt afhængig af materiale tager det også mere eller mindre energi at hæve temperaturen. For vand tager det 4190J at hæve temperaturen 1 K, men kun 910J at hæve temperaturen af aluminium med 1 K. Sætter vi alt dette sammen får vi forholdet: Q = mc T hvor c er en værdi vi kalder den Specifikke varmekapacitet, og som varierer fra materiale til materiale. Man siger c er den varmemængde i J der skal til for at forøge temperaturen af et stof med 1 K. Specifik varmekapacitet varierer også afhængig af temperatur, men i relativt lille grad, således vi oftests ignorer denne variation. Nedenfor er plottet denne variation for vand: 86
87 Konduktion, Konvektion og Varmestråling Nu vi så har kigget på hvordan en given nødvendig varmeenergi Q udregnes, så kan vi lige hurtigt kigge på hvordan man så ville overføre varmeenergi mellem systemer. Overordnet er der 3 muligheder: Konduktion, Konvektion og Varmestråling. Konduktion Varmeoverførsel grundet konduktion opstår når en del af et legeme bliver opvarmet (f.eks. af en flamme eller lignende) og den varme så vandrer igennem materialet. Det er f.eks. konduktion der finder sted når en ske nedsænkes i varm te og skeen bliver varm. På det atomare niveau fungerer konduktion ved at atomer i de varmere regioner har mere kinetisk energi i gennemsnit, hvorved de vibrerer og maser deres køligere naboer, hvilket overfører noget af deres energi. Disse bliver så også varmere og maser deres naboer, hvorved denne proces bliver ved indtil systemerne er i termisk ligevægt. Metaler har så den yderligere fordel, at de kan bruge deres såkaldte frie elektroner til at lette konduktionen af varme. Dette har så også den bivirkning at en metalstang ved 293 K vil føles koldere end en træpind ved 293 K. Dette skyldes ikke at metallet er koldere, men nærmere fordi varmen fra dine hænder nemmere kan føres ind i metallet, hvorved du vil føle en køling i hånden imens du forsøger at komme i termisk ligevægt med metallet. Ved konduktion definerer vi desuden værdien Varmeledningsevne k som er materialets evne til at lede varme ved konduktion. En god leder har således høj værdi for k, hvor en god insulator har lav værdi for k. (Og en ideal insulator har k = 0) Konvektion En anden måde at overføre varmeenergi på er igennem konvektion. Konvektion er varmeoverførsel vha. bevægelser af væsker fra en region af et legeme til et andet. Der findes mange eksempler på konvektionssystemer som kølesystemet i biler eller dit eget blod. I tilfælde af konvektionen ikke sker naturligt med ved en pumpe, så kaldes det en påtvunget konvektion. Det er f.eks. tilfældet for vores blodomløb, der kræver hjertet til at føre blodet rundt og derved føre temperaturstigninger rundt i kroppen. 87
88 Det er også konvektion der er i spil når jeg forsøger at varme vandet i mit badekar op igen, efter at have siddet der i flere timer. Det nye varme vand vil så sprede sig blandt det køligere, indtil vandet samlet er nået til en ny termisk ligevægt med mig. Varmestråling En sidste mulighed er varmeoverførsel ved varmestråling. Varmestråling er den varmeoverførsel der kommer fra elektromagnetiske bølger, lys osv. Det er altså den varmeoverførsel der er tilstede hvis de to involverede legemer ikke er i en væske sammen og ikke fysisk rør ved hinanden (luft er et dårlig medie til konduktion, så den varmeoverførsel virker kun hvis legemerne er fysisk forbundet). Eksempler på varmestråling er lys fra solen (og stjerner generelt), en grill, en pære, mit 42 fjernsyn, radiatorer og meget meget mere. Alt afhængig af temperatur bruges forskellige typer stråling: ca. 295 K: Alle varmekilder (inkl. levende ting) udsender energi i form af infrarød stråling, når vi er omkring en stuetemperatur. (hvis de ikke gjorde ville vi ikke kunne bruge heat-vision f.eks.). Intet af dette lys er synligt dog. ca K: Ved denne temperatur er det stadig primært infrarød stråling, men temperaturen er dog på en sådan måde, at en vis mængde af strålingen bliver synlig stråling, således legemet der afgir det kommer til at forekomme rødglødende. ca K: Ved denne temperatur er legemet så opvarmet, at det vil forekomme hvidglødende og den primære stråling vil komme fra visuelt lys. Denne temperatur er der hvor glødetråden i en glødelampe er Faseovergange Det bringer os så til det sidste jeg vil snakke om, nemlig faseovergange. Definition En faseovergang er når et materiale går fra en materialefase til en anden, f.eks. fra væske til gas eller fra fast stof til vækse. Hvis vi har noget is ved K (0 grader Celcius - frysepunktet for vand) og normal atmosfærisk tryk, så hvis vi tilføjer varmeenergi hertil, så vil temperaturen ikke stige over K. I stedet vil dele af isen blive til vand og resten af isen vil forblive is. Tog vi nu og tilførte varme til isen stille og roligt, således termisk ligevægt bibeholdes nogenlunde, så ville alt isen smelte inden temperaturen steg 88
89 fra K. Altså kræver det ekstra varmeenergi at lave en faseovergang. Smelte- og fordampningsvarme Varmen pr. enhed masse der skal til for at skifte fase til/fra fast og flydende kaldes for Smeltevarmen (Heat of fusion) og skrives som L f. For at smelte en masse m af materiale med smeltevarme L f kræves der så Q varmeenergi givet ved: Q = ±ml f Plus/Minus delen skyldes at processen er reversibel. Hvis vi vil fryse en masse m af materiale skal vi fjerne varmeenergi fra systemet. Udover dette har hvert materiale et smeltepunkt, som er det samme niveau som dets frysepunkt. Har et materiale denne temperatur kan man se den situation at væske og fast stof eksisterer på samme tid i samme legeme - dette kalder vi for faseligevægt. Denne præcis samme konstruktion gælder for faseskift mellem væske og gas, hvor vi i stedet definerer et fordampningsvarme L v (i.e. v for vapor), hvorved vi skal bruge varmeenergi Q for at lave en masse m af materiale om fra væske til gas hvis fordampningsvarmen er L v : Q = ±ml v Plus/Minus delen skyldes igen at processen er reversibel og igen har alle materialer også et kogepunkt, hvor et legeme med denne temperatur igen oplever faseligevægt. Faseligevægten ved faseskift fra væske til gas er dog typisk noget længerevarende, da det kræver relativt lidt energi at bringe en væske til dens kogepunkt, men meget energi at få dannet hele væsken om til gas. Et plot af temperatur T over tid for vand vises herunder, hvor varmeenergi er blevet tilføjet med jævn hastighed: 89
90 Som vi kan se er temperaturen ved faseovergange konstant (antaget trykket er det). Sublimering, Overophedning- og overnedkøling Sidst men ikke mindst har vi koncepterne af sublimering, verophedning og overnedkøling. Sublimering er når et materiale går direkte fra fast form til gas. Til dette har vi en værdi Sublimeringsvarmen L s, som er den varme pr. enheds masse der skal til for at lave materialet om fra fast form til gas. Eksempler på materialer der er sublime er tøris, der tydeligt går direkte fra fast stof til gas, selv ved stuetemperatur og normalt atmosfærisk tryk. Overophedning er når en væske bliver opvarmet til over ens normale kogepunkt, således at den mindste forstyrrelse af væsken resulterer i lokal kogning med bobler til følge. Grunden til væsken kan nå til dette forhøjede kogepunkt uden at se ud til at koge er, at overfladespændingen forhindrer den normale dannelse af bobler og udgydelse af damp. Resultat er, at hvis du bryder denne overfladespænding imens væsken er overophedet, så kan du risikere en pludselig eksplosion af damp og vand grundet den lokale kogning. Det er et koncept der ofte tales om i forhold til opvarmning af vand i mikrobølgeovne, da det her kan forekomme at væsken kommer over kogepunktet uden det er tydeligt ved at kigge på den. Overnedkøling er så når noget som meget rent vand køles ned til adskillige grader under frysepunktet uden at fryse (noget som normal vand ikke 90
91 kan). Den resulterende tilstand kaldes for en overnedkølet tilstand. Hvis vandet herefter irriteres eller små støvpartikler e.lign. falder ned i det, så vil det øjeblikkeligt krystalisere i løbet af et sekund eller mindre. 91
92 8 Kinetisk gasteori og tilstandsligninger 8.1 Disposition OBS: Han viste til spørgetime tiltræknings-/frastrødnings kraften mellem to atomer, så det kan tænkes han spørger om det. Derfor er grafen herfor placeret sidst i spørgsmålet. Det samme er grafen for et pt diagram for faseovergange. 1. Tilstandsligninger Tilstandsvariable 2. Idealgasligningen Empirisk udledelse Antagelser (høj T, lavt p) Udledning af densitet Idealgasligningen for konstant masse 3. Van der Waals gasligning 4. pv-diagrammer Tjek om en gas følger idealgasligningen Kritisk temperatur (T c ) 5. Kinetisk gasteori Formål (hvorfor bruge den) Antagelser 6. Udledelse af trykformel Hastigheder Antallet af kollisioner Impulsændring Korrektion for hastighedsantagelse 7. Energi i kinetisk gasteori Kinetisk energi af n mol af en ideal gas Kinetisk energi af en molekyle 8. Anvendelse: Varmekapacitet Find dk og dq og sæt lig med hinanden, isoler C V. Frihedsgrader (monoatomer 3/2R, diatomer 5/2R, polyatomer 7/2R) 92
93 8.2 Detaljer Her følger detaljerne for denne givne disposition Tilstandsligninger Det her emne omhandler de termiske effekter på et system, baseret ud fra en række modeller for virkeligheden, kaldet tilstandsligninger. Tilstandsvariabel En tilstandsvariabel er en given variabel der beskriver tilstanden af et system, det kan være tryk p, densitet ρ, temperatur T eller noget helt flere. Samler man sådanne tilstandsvariabler i en ligning der beskriver sammenhængen mellem dem, så har man lavet en tilstandsligning. Tilstandsligninger kan bruges som approksimationer på virkeligheden for at forudsige nogle ting omkring stoffer og eventuelt aktivt skabe et stof med bestemte egenskaber man ønsker Idealgasligningen En af de mest simple tilstandsligninger er den for en idealgas. Vi kan nemt udlede gasligningen emperisk fra de resultater bogen taler om er fundet gennem eksperimenter. Empirisk udledelse Hvis vi starter med massen af en gas, så fremfor at regne i masse direkte, så vil vi hellere regne ud fra antallet af mol n, hvor sammenhængen mol n og den totale masse m tot er: m tot = nm hvor M er molarmassen (i.e. massen pr mol for et stof). Eksperimenter på gasser har ledt til en række konklusioner: Volumen V er proportional til antallet af mol n. (I.e. hvis vi fordobler antallet af mol og holder tryk og temperatur konstant, så vil V fordobles) Volumen V er omvendt proportional til det absolutte tryk p. (I.e hvis trykket fordobles imens n og T holdes fast, så vil gassen blive sammenpresset til halvdelen af volumen) - altså er pv konstant når n og T er det. Trykket p er proportional til den absolutte temperatur T. (I.e. hvis vi fordobler den absolutte temperatur T, imens vi holder V og n konstant, 93
94 så vil trykket fordobles) - altså er p lig med T gange en konstant når n og V er konstant. Hvis vi samler det her i et udtryk får vi idealgasligningen: pv = nrt hvor R er en proportionalitetskonstant kaldet gaskonstanten, som har samme værdi for alle gasser antaget høje nok temperaturer. Den bedst kendte værdi for R er R = 8.314J/mol K Antagelser Idealgasligningen er en approksimation på virkligheden, altså en idealiseret model. Derved gælder den kun under visse antagelser. Disse antagelser er: Højt T og lavt p: Idealgasligningen er bedst approksimerende hvis temperaturen af gassen er meget høj og gassen på samme tid har lavt tryk, således gas molekyler er langt fra hinanden og bevæger sig hurtigt. Ingen volumen: Idealgasligningen antager desuden at alle molekyler i en gas kan opfattes som punkter, altså således de ikke har nogen volumen. Kun kinetisk energi: Idealgasligningen antager derudover også, at molekyler kun har energi i form af deres kinetiske energi. Ingen vekselvirkning: Idealgasligningen tanger at molekyler ikke interagerer med hinanden, således kollisoner af molekyler er ligegyldige. Hvis en gas ikke opfører sig som en idealgas så kan dette ses ved at plotte et pv-diagram, som jeg vil kigge på hurtigt om lidt. Udledning af densitet Hvis vi hellere vil udtrykke idealgasligningen i form af den totale masse, så kan vi indsætte n = mtot M på n s plads: pv = m tot M RT Hvis vi nu observerer at densitet udregnes som ρ = m tot /V, så kan vi omskrive ovenstående ved at få ρ = m tot /V til at stå alene således: ρ = m tot /V = pm RT Som så er udtrykket for densiteten af en idealgas. 94
95 Idealgasligningen for konstant masse Observerer vi yderligere, at for et konstant antal mol n, så er nr konstant. Men det betyder også at pv/t er konstant, da de afhænger indbyrdes af hinanden. Derved kan man for samme gas i to forskellige tilstande med konstant masse (i.e. konstant n) opskrive følgende sammenhæng: På den måde går R f.eks. ud. p 1 V 1 T 1 = p 2V 2 T 2 = konstant Van der Waals gasligning Idealgasligningen er dog på ingen måde perfekt og der er flere andre gasligninger man kunne bruge. En af disse er Van der Waals gasligning der forsøger at kompensere for fejlkilder i den såkaldte kinetiske gasteori, som jeg kommer ind på om lidt. Specifikt er problemet at den kinetisk gasteori ignorerer masserne af molekylerne i sig selv, samt de tiltrækningskrafter der er imellem dem. Det betyder at under visse omstændigheder, så vil trykket vurderes højere i gassen end det reelt er grundet tiltrækningskrafter molekylerne imellem der trækker dem sammen. Van der Waals gasligning ser således ud: ( ) p + an2 V 2 (V nb) = nrt Så forskellen mellem Van der Waals gasligning og idealgasligningen er de korrektioner der laves på p og V. a og b ovenfor er emperiske konstanter, afhængig af gassen, hvor b er volumen af en mol af molekyler for gassen og a er en konstant der afhænger af tiltrækningskraften mellem atomer i et mol af molekyler af gassen. Den totale volumen af molekylerne er derved nb, så fratrukket den samlede volumen giver det V nb volumen at bevæge sig på. Faldet i tryk grundet tiltrækningskraften molekyler imellem er proportional til n 2 /V 2, hvorved approksimationsevnen af Van der Waals gasligningen afhænger af denne sammenhæng. Er n V tilstrækkelig lille (i.e. gassen er fortyndet) så er den gennemsnitlige distance mellem molekyler så stor, at korrektionen opnået af Van der Waals gasligningen er ligegyldig. Som eksempel kan tages CO 2 hvor idealgasligningen siger et mol af en idealgas ved K, med tryk p = 1atm fylder V = m 3, så vil 95
96 Van der Waals gasligning kun vurderer 532 Pa lavere end idealgasligningen hvorved volumen vil være 0.5% større pv-diagrammer Som jeg talte om tidligre så kan man benytte pv-diagrammer (tryk over volumen) til at vurdere hvorvidt en gas er en idealgas eller el. Man kan i det hele taget bruge pv-diagrammer til at visualisere et systems afhængighed af tryk, volumen og temperatur for forudvalgte temperaturkonstante kurver. Hver kurve i et sådan pv-diagram kaldes så en isoterm, hvor man typisk rækkefølgen af isotermer ud fra lavest til højest temperatur. Et eksempel på et pv-diagram for en idealgas ses herunder: Her kan man tydeligt se at p, T og V er indbyrdes afhængig på en ren og pæn måde, hvor man direkte kan aflæse volumen ud fra værdier p og T. Som kontrast hertil kan man lave et pv-diagram for en gas der ikke opfylder idealgasligningen, hvorved den vil se mere ud som følger: Hvor T c er den såkaldte kritiske temperatur, hvilket er temperaturen hvor faseovergange ikke længere finder sted uanset ændring af tryk eller volumen. 96
97 Under denne temperatur kan vi se, at der er områder hvor vi kan forøge volumen af gassen uden at overøge trykket. Det er de såkaldte faseligevægtstilstande hvor der sker faseovergang mellem gas og væske. Ligeledes kan vi se at når en gas er blevet lavet om til en væske grundet lav volumen og temperatur, så skal der pludselig ekstremt meget tryk til for at kompresse volumen ned yderligere, da det er væsentligt sværere at kompresse en væske end en gas. Sidst men ikke mindst kan vi se, at isotermen for temperaturen T 4 opfører sig nærmest ligesom en idealgas isoterm, hvilket er i overensstemmelse med vores antagelser om modellen, netop af idealgasligningen er en fin approksimation antaget høje temperaturer Kinetisk gasteori Det bringer os så videre til et af hovedemner i dette spørgsmål, nemlig kinetisk gasteori. Hvor en tilstandsligning beskriver sammenhængen mellem forskellige tilstandsvariabler, så beskriver en gasteori en molekylær model - altså en model for hvordan molekyler fungerer i en gas, hvorfra man så kan udlede tilstandsligninger til en sådan gasteori. En gasteori har også stor nytte i forhold til at kunne designe stoffer med forskellige ønskede egenskaber, eller forudsige forskellige egenskaber på baggrund af teoretisk viden om molekylerne. Vi skal kigge på den nogenlunde simple kinetiske gasteori, som er en molekylærmodel for en idealgas. Antagelser Den kinetiske gasteori repræsenterer en gas som bestående af et stort antal partikler der flyver rundt i en lukket beholder. Vi repræsenterer altså molekyler som punkter, som jeg også tidligere har nævnt. Vi har en række antagelser i modellen: 1. En beholder med volumen V indholder et stort antal N af identiske molekyler, hver med masse m. 2. Molekylerne opfører sig som punkt partikler, hvorved deres størrelse er lille sammenlignet med den gennemsnitlige afstand imellem dem og sammenlignet med dimensionerne af beholderen. 3. Molekylerne er i konstant bevægelse og overholder Newtons bevægelseslove. 4. Hver molekyle kolliderer til tider med beholderens vægge, hvor disse kollisioner er perfekt elastiske (i.e. ingen kinetisk energi går tabt) 97
98 5. Beholderens vægge er perfekt stive, uendeligt massive og bevæger sig ikke. Med disse antagelser på plads kan vi gå videre med selve modellen Udledelse af trykformel Vi starter med at udlede en formel for trykket. For god ordens skyld skriver vi lige formlen op først: p = F A = Nmv2 x V For at udlede denne formel skal vi kigge på hvordan tryk opstår i kassen. Tryk opstår i en gas når molekylerne kolliderer med omkringliggende legemer, i dette tilfælde en lukket beholder. Der er altså en direkte sammenhæng mellem antallet af kollisioner og trykket det giver. Når en molekyle i kinetisk gasteori kolliderer med væggen vil det vinkelrette hastighedsvektor-komponent blive flipped, således det får modsat retning men samme magnitude (i.e. kollision med de lodrette vægge giver flipning af x-komponent v x ). Dette vises herunder: Målet er nu at finde antallet af kollisioner pr. enheds tid for et givent areal A af væggen. Herefter kan vi finde den totale impulsændring associeret med de her kollisioner og fra det udregne den kraft der skal til for at skabe denne impulsændring. Herfra kan vi så udlede en formel for trykket. Til at starte med antager vi alle molekyler i gassen har samme magnitude af deres x-komponent af hastighed v x. Det er som sådan ikke en korrekt 98
99 antagelse, men fint nok for vores udledning her. Vi kan korrigere resultatet bagefter. Som sagt har vi, at for hver kollision med væggen vil det vinkelrette hastighedsvektor-komponent blive flipped, hvorved kollisioner med en vertikal væg flipper hastighedsvektoren fra v x til + v x. Derved har vi en ændring i impuls fra m v x til +m v x og den samlede ændring i impuls er derved m v x ( m v x ) = 2m v x Hvis en molekyle vil kollidere med et givent vægareal A i løbet af det korte tidsinterval dt, så må afstanden fra molekylen til væggen, i starten af dt, ikke være mere end v x dt og molekylen skal være på vej mod væggen. Så antallet af molekyler der kolliderer med et givent vægareal A i tiden dt, svarer til mængden af molekyler i en cylender med baseareal A og længde v x dt, hvor molekylernes hastighedsvektors x-kompoent peger mod væggen. Volumen af denne cylinder er så A v x dt og antaget antallet af molekyler pr. volumen er uniform, så betyder det antallet af molekyler i cylineren er: ( ) N (A v x dt) V I gennemsnit vil halvdelen af disse til enhver tid have retning mod væggen, så antallet af kollisioner med A i tidsrummet dt er: ( ) 1 N (A v x dt) 2 V Vi viste før, at en kollision betyder 2m v x impulsændring, så den samlede impulsændring for kollisionerne i cylinderen er: dp x = 1 ( ) N (A v x dt)(2m v x ) 2 V = NAmv2 xdt V Tager vi herefter ændringen af impuls over tid, så får vi: dp x dt = NAmv2 x V Ifølge Newtons 2. lov svarer ændringen i impuls til kraften der udøves af vægarealet A på molekylerne. Ved Newtons 3. lov har vi så, at der må være en modsatrettede og lige stor kraft den anden vej, hvilket er den kraft molekylerne udøver på vægarealet A. 99
100 Da tryk er er magnituden af den kraft der udøves på væggen pr. enheds areal, så får vi at trykket er: p = F A = Nmv2 x V Trykket p afhænger altså af antallet af molekyler pr. volumen (N/V ), massen af molekylet og hastigheden af molekylerne. Korrektion for hastighedsantagelse Som nævnt før, så var det en ukorrekt antagelse at sige hastigheden af alle molekyler i x-komponentet var v x. Vi kunne dog have rettet det ved at samle alle molekyler med samme x-komponent magnitude v x i grupper og så udregnet de enkelte deles bidrag til trykket. Resultatet af dette er dog bare at erstatte v x 2 med v x 2 av i formlen for trykket. Grundet vores model, så kan vi dog antage de enkelte komponenter af hastighedsvektoren er det samme. Hvis vi vil udregne hastigheden af en molekyle, så udregner vi blot: v 2 = vx 2 + vy 2 + vz 2 hvor vi kan tage gennemsnittet heraf over alle molekyler: (v 2 ) av = (vx) 2 av + (vy) 2 av + (vz) 2 av Og da de er de samme betyder det, at: (v 2 x) av = 1 3 (v2 ) av Med den ændring bliver trykformlen ovenfor til: p = 1 3 Nm(v2 ) av V Energi i kinetisk gasteori Vi kigger nu på energien i den kinetiske gasteori. 100
101 Kinetisk energi af n mol af en ideal gas Fra udtrykket for tryk kan vi så finde et udtryk for den gennemsnitlige translatoriske kinetiske energi af n mol af ideal gas. Vi starter med: p = 1 3 Nm(v2 ) av V som er trykformlen med hastighedskorrektionen. Denne kan vi så skrive om til: pv = 1 3 Nm(v2 ) av = 2 3 N [ m(v 2 ) av ] Det sidste led i klammerne ligner nu mistænkeligt meget den translatoriske kinetiske energi af et enkelt molekyle og N er antallet af molekyler. Derved får vi at ovenstående bliver pv = 2 3 K tr Hvis vi nu sammenligner dette med idealgasligningen, så havde vi der pv = nrt. For at de to formler er i overensstemmelse må den gennemsnitlige translatoriske kinetiske energi af n mol af ideal gas således være: K tr = 3 2 nrt Vi kan altså se her, at den kinetiske energi er direkte proportional til temperaturen T Kinetisk energi af en molekyle Fra ovenstående kan man også finde den kinetiske energi af et molekyle, hvor jeg dog ikke har tænkt mig at gøre dette. I stedet skrives blot resultatet: K tr N = 1 2 m(v2 ) av = 3 2 kt hvor k er Boltzmanns konstant, som er konstant for alle stoffer. Altså kan vi se den gennemsnitlige translatoriske kinetiske energi af et molekyle kun afhænger af temperaturen og ikke at hverken volumen, masse, typen af molekyle e.lign. 101
102 8.2.8 Anvendelse: Varmekapacitet Nu vi har kigget på gasteorier, så kan vi se hvad sådan en reelt kan bruges til. Vha. en gasteori kan vi forsøge at forudsige forskellige egenskaber ved et givent stof. I dette tilfælde molar varmekapaciteten, med konstant volumen, af et materiale C V. Vi starter med at kigge på udtrykket for en translatoriske kinetiske energi ovenfor, nemlig: K tr = 3 2 nrt Ved en lille hævelse af temperaturen dt her, vil vi altså se en lille hævelse af den kinetiske energi dk tr, således: dk tr = 3 2 nrdt Fra definitionen af molar varmekapacitet har vi desuden et udtryk for dq med temperaturændring dt : dq = nc V dt hvor dq er den varmeenergi der skal til for at ændre temperaturen dt. Så hvis K tr repræsenterer den samlede molekylære energi (som den simple kinetisk gasteori antager), så skal dq og dk tr være lig med hinanden, hvorved vi kan skrive dem op og isolere C V : nc V dt = 3 2 nrdt C V = 3 2 R Altså skulle den molare varmekapacitet ved konstant volumen, ifølge den kinetiske gasteori, være lig med 3 2R for alle gasser der kan repræsenteres som punkter. Frihedsgrader Resultatet ovenfor er forbavsende spot on når det kommer til monoatomare gasser, altså gasser hvor atomer ikke er bundet til hinanden. Men ved diatomare gasser (i.e. 2 atomer er bundet til hinanden) og polyatomare gasser (i.e. adskillige atomer er bundet til hinanden), er det langt fra. Dette skyldes at diatomer og polyatomer har flere frihedsgrader, således de har flere komponenter der spiller ind i deres kinetiske energi. Det være sig 102
103 f.eks. kinetiske energi ved rotation (i.e. fordi atomer kan rotere om hinanden i et molekyle) og vibration imellem dem. Mængden af frihedsgrader svarer til antallet af de komponenter der skal til at for at forklare en molekyles bevægelse fuldstændig. Konceptet der er i spil her hedder Equipartition of Energy (obs: hvis der findes en oversættelse kunne jeg ikke finde den). Konceptet siger, at for hver komponent af bevægelse, er der en associeret kinetisk energi af 1 2 kt, hvor k er Boltzmanns konstant. For et monoatomer molekyle er det derved 3 frihedsgrader (de 3 x,y og z komponenter af hastighedsvektoren), for diatomare molekyler kommer yderligere to med for rotation og for polyatomare molekyler kommer der yderligere 2 igen for polyatomere pga. vibrationen. Derved får vi følgende molare varmekapaciteter jvf. Equipartition of Energy: C V = 3 2 R C V = 5 2 R C V = 7 2 R (monoatomar) (diatomar) (polyatomar) Den molare varmekapacitet er dog varmeafhængig, således der for visse molekyler vil opstå flere frihedsgrader som temperaturen stiger. Dette koncept er illustreret ved grafen herunder der plotter C V overfor T for hydrogen gas H 2. Vibration kan således også bidrage til energien for diatomare gasser, såfremt temperaturen bare er høj nok. 103
104 OBS: For god ordens skyld kan nævnes at C V for faste stoffer går mod C V = 3R for tilstrækkeligt store temperaturer. Dette kaldes for Dulong og Petits regel Krafterne mellem to molekyler To molekyler kan ses som værende to objekter der på den ene side tiltrækker hinanden men på den anden side frastøder hinanden hvis de kommer for tæt på. Vi kan plotte denne tiltræknings-/frastødningskraft som vist herunder. Denne graf er udelukkende med fordi jeg ved forelæseren kunne finde på at spørge om det. Relateret hertil er Van der Waals interaktionen, som gælder for diatomare molekyler, som vi har fået en formel der kan approksimere. Denne formel ser således ud: [ (R0 ) 1 ( ) ] 6 R0 U = U r r Hvor U 0 er en positiv konstant i enhed J. R 0 er ligevægtsafstanden mellem to atomer og r er den nuværende afstand. Hvis to atomer er meget langt fra hinanden, så er U = 0 og hvis de er i ligevægtsafstanden så er U = U
105 Kraften fra det første atom på det sidste er så den negativt afledede af den potentielle energi ovenfor: F r = du dr = 12 U [ (R0 ) 1 ( ) ] 7 0 R0 3 R 0 r r Potentiel energi og kraft er plottet for Van der Waals interaktionen og vores approksimationen herunder: Faseovergange Dette ekstra afsnit er udelukkende med for hurtigt at kunne skimme faseovergangenes afhængighed af tryk og temperatur, i form af et pt diagram, som det herunder: Som vi kan se er den kritiske temperatur T c med på grafen, som er det punkt hvor faseovergange ikke længere finder sted ved forøgelsen af trykket. T c for vand er f.eks K. Ligeledes er der det såkaldte Triple point, som er et særligt sted hvor stoffets fast, flydende og gasform kan eksistere på samme tid. Resten af grafen skulle gerne være rimelig selvforklarende. 105
106 9 Varmekapacitet for gasser og faste stoffer, C P og C V 9.1 Disposition 1. Varmekapacitet Def. Varme Varmemængde og specifik varmekapacitet Molær varmekapacitet C V og C P 2. Estimering af molær varmekapacitet vha. kinetisk gasteori Kort om kinetisk gasteori (Formål, Antagelser, Kort om udledning af tryk) Kinetisk energi af n mol af en ideal gas Kinetisk energi af en molekyle Find dk og dq og sæt lig med hinanden, isoler C V. Frihedsgrader Dulonge og Petits regel 3. Varmekapacitet af en idealgas Termodynamikkens 1. hovedsætning (kort) Idealgas: Indre energi afhænger kun af T Forskellen mellem C V og C P. Udledning af sammenhængen mellem C V Forholdet mellem C V og C P (γ) og C P 9.2 Detaljer Her følger detaljerne for denne givne disposition Varmekapacitet I dette spørgsmål skal vi kigge på konceptet af varmekapacitet. Så lad os starte med at kigge på konceptet af varme: 106
107 Def. Varmemængde Hvis vi nedsænker noget koldt i noget varmt, f.eks. en ske i en kop te, så vil der påbegynde en udveksling af varmeenergi indtil disse to genstande er i termisk ligevægt (i.e. det varme te har fået lidt lavere temperatur og skeen har samme temperatur som teen). Denne udveksling af energi kaldes for varmestrøm eller varmeoverførsel. Det er vigtigt at pointere forskellen på varme og temperatur her. Temperatur er en kvantitativ måling af niveauet af hotness eller coldness. Det afhænger altså af tilstanden af det man forsøger at måle det på. I modsætning hertil er varme noget der udveksles. Systemer kan udveksle varme i form af varmeoverførsel af energi, men et system har ikke en varme i den forstand. Man kan tilføje varme til et system ved at tilføje energi i en eller anden forstand, hvorved temperaturen vil stige. Men varme er altså en slags energi der udveksles og ikke en iboende egenskab af legemer. Varmemængde og specifik varmekapacitet Lad os gå videre og kigge på hvordan vi så måler denne varme. Vi bruger symbolet Q som mængden af varme. Vi har så, at mængden af varme Q der skal til for at hæve temperaturen af en masse m af et givent materiale fra T 1 til T 2, er approksimerbart proportional til temperaturændringen T = T 2 T 1. Det er desuden proportional til massen af materialet. Dette betyder altså at hvis du ville varme vand til te, så vil du skulle tilføre dobbelt så meget varme hvis du tager 2 kopper, som hvis du tager en for samme temperaturinterval. Alt afhængig af materiale tager det også mere eller mindre energi at hæve temperaturen. For vand tager det 4190J at hæve temperaturen 1 K, men kun 910J at hæve temperaturen af aluminium med 1 K. Sætter vi alt dette sammen får vi forholdet: Q = mc T hvor c er en værdi vi kalder den Specifikke varmekapacitet, og som varierer fra materiale til materiale og har enheden J/kg K (i.e. varme pr. masse pr. temperaturændring). Man siger c er den varmemængde i J der skal til for at forøge temperaturen af et stof med 1 K. Specifik varmekapacitet varierer også afhængig af temperatur, men i relativt lille grad, således vi oftests ignorer denne variation. Nedenfor er plottet denne variation for vand: 107
108 Molær varmekapacitet Relateret hertil er konceptet af molær varmekapacitet. Det kan til tider være mere praktisk at notere masse som en mængde af mol n fremfor en masse m tot af materiale, hvor molarmassen M så er massen pr. mol for et givent materiale, således masse kan opskrive som: m = nm Tager vi samme formel som til specifik varmekapacitet og indsætter vores nye m, så får vi: Q = nmc T Hvor Mc så oftests skrives som C som vi kalder den molære varmekapacitet. Altså bliver formlen: Q = nc T Q er så her den varmetilførsel der skal til for at ændre temperaturen af n mol med T Kelvin. Den molære varmekapacitet C har så enheden J/molK (i.e. varme pr. mol pr. temperaturændring). Reel måling af den molære varmekapacitet (og den specifikke for den sags skyld) kan være enormt svært at gøre eksperimentielt. Vi vil kun kigge på det teoretisk her. Har man først den ene varmekapacitet, så følger den anden selvfølgelig naturligt, da C = Mc, men har man ikke det må man bruge andre metoder. Hvis man forsøger at måle varmekapaciteten for et fast materiale, så vil man ofte gøre det for konstant tryk, således det man egentlig måler er den molære varmekapacitet under konstant tryk C P (og den tilsvarende c p for specifik varmekapacitet). Dette er ofte nemmest at gøre, da man bare kan antage materialet er ved atmosfærisk tryk, hvilket i mange tilfælde vil være 108
109 sandt for de fleste materialer. En gas derimod er svær at holde ved konstant tryk, så derfor holder man i stedet den ved konstant volumen, ved f.eks. at holde gassen i en lukket beholer. Derved måler man i virkeligheden den molære varmekapacitet ved konstant volumen, C V (ellre c V for den specifikke varmekapacitet). For faste stoffer er forskellen mellem C V og C P tilstede men ikke markant, men for gasser er den betydningsfuld. Forskellen mellem disse to kommer jeg ind på lidt senere Estimering af molær varmekapacitet vha. kinetisk gasteori Det bringer os så videre til en metode hvormed vi kan estimere den molære varmekapacitet af et molekyle teoretisk - vi kan benytte en gasteori. Jeg vil ikke bruge alt for lang tid på at forklare den kinetiske gasteori i dette emne, men vil dog sige hovedtrækkene i hvordan man udleder formlen for tryk og så mere eller mindre bare skrive translatorisk kinetisk energi af n mol af en idealgas og translatorisk kinetisk energi af et gasmolekyle op. Det er denne sidste sætning for translatorisk kinetisk energi for et gasmolekyle vi skal bruge. Hvor en tilstandsligning beskriver sammenhængen mellem forskellige tilstandsvariabler, så beskriver en gasteori en molekylær model - altså en model for hvordan molekyler fungerer i en gas, hvorfra man så kan udlede tilstandsligninger til en sådan gasteori. En gasteori har også stor nytte i forhold til at kunne designe stoffer med forskellige ønskede egenskaber, eller forudsige forskellige egenskaber på baggrund af teoretisk viden om molekylerne. Vi skal kigge på den nogenlunde simple kinetiske gasteori, som er en molekylærmodel for en idealgas. Antagelser Den kinetiske gasteori repræsenterer en gas som bestående af et stort antal partikler der flyver rundt i en lukket beholder. Vi repræsenterer altså molekyler som punkter, som jeg også tidligere har nævnt. Vi har en række antagelser i modellen: 1. En beholder med volumen V indholder et stort antal N af identiske molekyler, hver med masse m. 2. Molekylerne opfører sig som punkt partikler, hvorved deres størrelse er lille sammenlignet med den gennemsnitlige afstand imellem dem og 109
110 sammenlignet med dimensionerne af beholderen. 3. Molekylerne er i konstant bevægelse og overholder Newtons bevægelseslove. 4. Hver molekyle kolliderer til tider med beholderens vægge, hvor disse kollisioner er perfekt elastiske (i.e. ingen kinetisk energi går tabt) 5. Beholderens vægge er perfekt stive, uendeligt massive og bevæger sig ikke. Med disse antagelser på plads kan vi gå videre med selve modellen. Udledelse af trykformel Vi starter med at udlede en formel for trykket. For god ordens skyld skriver vi lige formlen op først: p = F A = Nmv2 x V For at udlede denne formel skal vi kigge på hvordan tryk opstår i kassen. Tryk opstår i en gas når molekylerne kolliderer med omkringliggende legemer, i dette tilfælde en lukket beholder. Der er altså en direkte sammenhæng mellem antallet af kollisioner og trykket det giver. Når en molekyle i kinetisk gasteori kolliderer med væggen vil det vinkelrette hastighedsvektor-komponent blive flipped, således det får modsat retning men samme magnitude (i.e. kollision med de lodrette vægge giver flipning af x-komponent v x ). Dette vises herunder: 110
111 Målet er nu at finde antallet af kollisioner pr. enheds tid for et givent areal A af væggen. Herefter kan vi finde den totale impulsændring associeret med de her kollisioner og fra det udregne den kraft der skal til for at skabe denne impulsændring. Herfra kan vi så udlede en formel for trykket. Til at starte med antager vi alle molekyler i gassen har samme magnitude af deres x-komponent af hastighed v x. Det er som sådan ikke en korrekt antagelse, men fint nok for vores udledning her. Vi kan korrigere resultatet bagefter. Som sagt har vi, at for hver kollision med væggen vil det vinkelrette hastighedsvektor-komponent blive flipped, hvorved kollisioner med en vertikal væg flipper hastighedsvektoren fra v x til + v x. Derved har vi en ændring i impuls fra m v x til +m v x og den samlede ændring i impuls er derved m v x ( m v x ) = 2m v x Hvis en molekyle vil kollidere med et givent vægareal A i løbet af det korte tidsinterval dt, så må afstanden fra molekylen til væggen, i starten af dt, ikke være mere end v x dt og molekylen skal være på vej mod væggen. Så antallet af molekyler der kolliderer med et givent vægareal A i tiden dt, svarer til mængden af molekyler i en cylender med baseareal A og længde v x dt, hvor molekylernes hastighedsvektors x-kompoent peger mod væggen. Volumen af denne cylinder er så A v x dt og antaget antallet af molekyler pr. volumen er uniform, så betyder det antallet af molekyler i cylineren er: ( ) N (A v x dt) V I gennemsnit vil halvdelen af disse til enhver tid have retning mod væggen, så antallet af kollisioner med A i tidsrummet dt er: ( ) 1 N (A v x dt) 2 V Vi viste før, at en kollision betyder 2m v x impulsændring, så den samlede impulsændring for kollisionerne i cylinderen er: dp x = 1 ( ) N (A v x dt)(2m v x ) 2 V = NAmv2 xdt V Tager vi herefter ændringen af impuls over tid, så får vi: dp x dt = NAmv2 x V 111
112 Ifølge Newtons 2. lov svarer ændringen i impuls til kraften der udøves af vægarealet A på molekylerne. Ved Newtons 3. lov har vi så, at der må være en modsatrettede og lige stor kraft den anden vej, hvilket er den kraft molekylerne udøver på vægarealet A. Da tryk er er magnituden af den kraft der udøves på væggen pr. enheds areal, så får vi at trykket er: p = F A = Nmv2 x V Trykket p afhænger altså af antallet af molekyler pr. volumen (N/V ), massen af molekylet og hastigheden af molekylerne. Korrektion for hastighedsantagelse Som nævnt før, så var det en ukorrekt antagelse at sige hastigheden af alle molekyler i x-komponentet var v x. Vi kunne dog have rettet det ved at samle alle molekyler med samme x-komponent magnitude v x i grupper og så udregnet de enkelte deles bidrag til trykket. Resultatet af dette er dog bare at erstatte v x 2 med v x 2 av i formlen for trykket. Grundet vores model, så kan vi dog antage de enkelte komponenter af hastighedsvektoren er det samme. Hvis vi vil udregne hastigheden af en molekyle, så udregner vi blot: v 2 = v 2 x + v 2 y + v 2 z hvor vi kan tage gennemsnittet heraf over alle molekyler: (v 2 ) av = (v 2 x) av + (v 2 y) av + (v 2 z) av Og da de er de samme betyder det, at: (v 2 x) av = 1 3 (v2 ) av Med den ændring bliver trykformlen ovenfor til: p = 1 3 Nm(v2 ) av V Vi kigger nu på energien i den kinetiske ga- Energi i kinetisk gasteori steori. 112
113 Kinetisk energi af n mol af en ideal gas Fra udtrykket for tryk kan vi så finde et udtryk for den gennemsnitlige translatoriske kinetiske energi af n mol af ideal gas. Vi starter med: p = 1 3 Nm(v2 ) av V som er trykformlen med hastighedskorrektionen. Denne kan vi så skrive om til: pv = 1 3 Nm(v2 ) av = 2 3 N [ m(v 2 ) av ] Det sidste led i klammerne ligner nu mistænkeligt meget den translatoriske kinetiske energi af et enkelt molekyle og N er antallet af molekyler. Derved får vi at ovenstående bliver pv = 2 3 K tr Hvis vi nu sammenligner dette med idealgasligningen, så havde vi der pv = nrt. For at de to formler er i overensstemmelse må den gennemsnitlige translatoriske kinetiske energi af n mol af ideal gas således være: K tr = 3 2 nrt Vi kan altså se her, at den kinetiske energi er direkte proportional til temperaturen T Kinetisk energi af en molekyle Fra ovenstående kan man også finde den kinetiske energi af et molekyle, hvor jeg dog ikke har tænkt mig at gøre dette. I stedet skrives blot resultatet: K tr N = 1 2 m(v2 ) av = 3 2 kt hvor k er Boltzmanns konstant, som er konstant for alle stoffer. Altså kan vi se den gennemsnitlige translatoriske kinetiske energi af et molekyle kun afhænger af temperaturen og ikke at hverken volumen, masse, typen af molekyle e.lign. 113
114 Estimering af molær varmekapacitet Nu vi har kigget på den kinetiske gasteori, så kan vi se hvad sådan den reelt kan bruges til. Vha. den kinetiske gasteori kan vi forsøge at forudsige molar varmekapaciteten, med konstant volumen, af et materiale C V. Vi starter med at kigge på udtrykket for en translatoriske kinetiske energi ovenfor, nemlig: K tr = 3 2 nrt Ved en lille hævelse af temperaturen dt her, vil vi altså se en lille hævelse af den kinetiske energi dk tr, således: dk tr = 3 2 nrdt Fra definitionen af molar varmekapacitet har vi desuden et udtryk for dq med temperaturændring dt : dq = nc V dt hvor dq er den varmeenergi der skal til for at ændre temperaturen dt. Så hvis K tr repræsenterer den samlede molekylære energi (som den simple kinetisk gasteori antager), så skal dq og dk tr være lig med hinanden, hvorved vi kan skrive dem op og isolere C V : nc V dt = 3 2 nrdt C V = 3 2 R Altså skulle den molare varmekapacitet ved konstant volumen, ifølge den kinetiske gasteori, være lig med 3 2R for alle gasser der kan repræsenteres som punkter. Frihedsgrader Resultatet ovenfor er forbavsende spot on når det kommer til monoatomare gasser, altså gasser hvor atomer ikke er bundet til hinanden. Men ved diatomare gasser (i.e. 2 atomer er bundet til hinanden) og polyatomare gasser (i.e. adskillige atomer er bundet til hinanden), er det langt fra. Dette skyldes at diatomer og polyatomer har flere frihedsgrader, således de har flere komponenter der spiller ind i deres kinetiske energi. Det være sig f.eks. kinetiske energi ved rotation (i.e. fordi atomer kan rotere om hinanden 114
115 i et molekyle) og vibration imellem dem. Mængden af frihedsgrader svarer til antallet af de komponenter der skal til at for at forklare en molekyles bevægelse fuldstændig. Konceptet der er i spil her hedder Equipartition of Energy (obs: hvis der findes en oversættelse kunne jeg ikke finde den). Konceptet siger, at for hver komponent af bevægelse, er der en associeret kinetisk energi af 1 2 kt, hvor k er Boltzmanns konstant. For et monoatomer molekyle er det derved 3 frihedsgrader (de 3 x,y og z komponenter af hastighedsvektoren), for diatomare molekyler kommer yderligere to med for rotation og for polyatomare molekyler kommer der yderligere 2 igen for polyatomere pga. vibrationen. Derved får vi følgende molare varmekapaciteter jvf. Equipartition of Energy: C V = 3 2 R C V = 5 2 R C V = 7 2 R (monoatomar) (diatomar) (polyatomar) Den molare varmekapacitet er dog varmeafhængig, således der for visse molekyler vil opstå flere frihedsgrader som temperaturen stiger. Dette koncept er illustreret ved grafen herunder der plotter C V overfor T for hydrogen gas H 2. Vibration kan således også bidrage til energien for diatomare gasser, såfremt temperaturen bare er høj nok. 115
116 Dulong og Petits regel Hvis vi nu ikke har at gøre med en gas, men derimod et fast stof, så ved vi hvert atom er bundet til hinanden i og omkring deres ligevægtsposition. Man kan se det som at der er fjedre imellem hvert atom i et molekyle og atomerne så kan vibrere omkring dette ligevægtspunkt. Dette illustreres nedenfor: Hvert atom har så 3 frihedsgrader (grundet de 3 komponenter af deres hastighedsvektorer). Ifølge Equipartition of Energy reglen, så betyder det de hver især har kinetisk energi 1 3kT hvor k er Boltzmanns konstant. Udover dette har de dog også potentiel energi fra deres elastiske deformation, som er lig med deres kinetiske energi, da vibrationrene tilnærmelsesvis er en harmonisk bevægelse (i.e. den gennemsnitlige kinetiske energi i et atom er lig med den gennemsnitlige potentielle energi). Derved kan vi forvente at hvert atom har gennemsnitlig 3 2kT kinetisk energi og gennemsnitlig 3 2kT potentiel energi, hvorved den samlede energi er 3kT pr atom. Det leder derved til en molær varmekapacitet på: Hvilket numerisk er: C V = 3R C V = 3(8.314J/mol K) = 24.9J/mol K Hvilket gælder for et ideelt monoatomart fast stof (f.eks. Aluminium, Bly osv... men ikke f.eks. Stål), antaget temperaturen er høj nok. Dette kaldes også for Dulong og Petits regel. Ved lave temperaturer vil Equipartition of Energy ikke gælde, hvorved den molære varmekapacitet er væsentligt lavere. For alle monoatomere stoffer gælder Dulong og Petits regel dog hvis temperaturen blot er høj nok, som denne graf herunder illusterer: 116
117 9.2.3 Varmekapacitet af en idealgas Det bringer os så videre til den sidste del her, hvor jeg vil tale om varmekapacitet af en idealgas. Termodynamikkens 1. hovedsætning (kort) For at kunne tale om varmekapaciteten i en idealgas, samt forholdet mellem C V og C P, så skal vi først lige kigge på nogle principper i Termodynamikkens 1. hovedsætning. Et termodynamisk system Et termodynamisk system er enhver samling af objekter der er relevante at opfatte som værende et system og som har potentiale til at udveksle energi med sine omgivelser. Et system i denne forstand skal altså kunne omtales som en enhed, således den kan have en tilstand eller state. Derved kan vi beskrive systemet vha. tilstandsvariabler og sammenhængen mellem disse vha. en tilstandsligning. En proces der ændrer denne tilstand kalder vi så for en termodynamisk proces. Arbejde og Varmestrøm Energirelationerne i enhver termodynamisk proces omtaler vi så som en varmemængde Q som tilføres til eller fjernes fra et system og en arbejdsmængde W som laves af eller på systemet. Hvis varmemængden Q er positiv er det varme ind i systemet og hvis den er negativ er det ud af systemet (0 betyder selvfølgelig ligevægt). Hvis 117
118 arbejdsmængden W er positiv betyder det arbejde udført af systemet på omgivelserne og hvis den er negativ betyder det arbejde udført på systemet (f.eks. hvis en gas bliver kompresset af dens omgivelser). Konceptet vises herunder: Fortegnet for W er i dette tilfælde anderledes end for mekanik, hvor W var mængden af arbejde udført på legemet fra andre krafter, hvormed positiv W var det vi ser som negativ W her. Det er dog konventionen for termodynamik, så det er den vi følger. Indre energi og Termodynamikkens 1. hovedsætning Siden alle materialer beståer af atomer og molekyler, og hver af disse har en kinetisk energi og en potentiel energi defineret for dem, så kan vi definere den indre energi af et termodynamisk system som værende summen af den kinetiske energi for alle partikler heri, samt summen for den potentielle energi af alle partikler heri. Dette gælder dog kun potentielle energier der rent faktisk opstår som følger af interaktion mellem systemet og dets omgivelser, og ikke f.eks. gravitationel potentiel energi. Vi bruger symbolet U for indre energi og en ændring af tilstanden for et system kan så ske at ændre den indre energi fra en startværdi U 1 til en slutværdi U 2 hvorved ændringen i indre energi er: U = U 2 U 1 118
119 Selvom at summere over kinetisk og potentiel energi er den rigtige, eller mest virklighedsnære, måde at tælle indre energi op på, så er de dog ikke en særlig operationel måde. Af den grund definerer man i stedet den indre energi som forskellen mellem varmemænden Q og arbejdet W, således vi får sammenhængen vi kalder termodynamikkens 1. hovedsætning: U = Q W Som vi så til tider hellere vil arbejde med som: Q = U + W Vi får altså en konstruktion hvor det at tilføje varmeenergi Q til et system forøger dets indre energi med U og det at udføre arbejde W formindsker den indre energi med U. Eksempler på dette vises for 3 systemer herunder: Spørgsmålet er så nu, om vi vha. indre energi har løst problemet med flere stier til samme tilstande. Det kan vi ikke umiddelbart svare på teoretisk, men eksperimentielt nævner bogen at alle resultater på dette har været klare og utvetydige: Indre energi U = Q W er sti-uafhængig. Ændringen i indre energi af et system i løbet af en termodynamisk proces afhænger udelukkende af den initielle og den endelige tilstand, ikke af stien imellem dem. Idealgas: Indre energi afhænger kun af T Da vi kigger på idealgasser her, så skal vi også bruge en observation ang. indre energi i idealgasser. For idealgasser gælder der nemlig den sammenhæng, at den interne energi U kun afhænger af temperaturen og ikke af hverken volumen eller tryk. 119
120 Vi kan argumentere for dette faktum vha. et eksempel. Kigger vi på et fri ekspansion eksperiment, så har vi en termisk isoleret beholder med stive vægge og hvor beholderen er delt op i to dele vha. en partition. Et af disse kamre har så en idealgas og den anden er lavet om til et vacuum. Når denne partition brydes vil gassen udvide sig for at fylde begge kamre. Denne udvidelse udfører intet arbejde da udvidelsen ikke flytter på væggene og der sker ingen varmeføring igennem isoleringen. Så både Q og W er 0 og den indre energi U er derved konstant. Konceptet vises herunder: Indtil videre er ovenstående gældende for alle materialer, ikke blot gasser. Ser vi på temperaturændringen, så kan vi overveje hvorvidt en fri-ekspansion som ovenstående resulterer i en temperaturændring? Vi kan således opskrive konsekvenserne herunder: Ja: Hvis en fri-ekspansion resulterer i en temperaturændring, alt imens den indre energi forbliver den samme, så må det betyde den interne energi afhænger af både temperatur og tryk, eller temperatur og volumen, men helt sikkert ikke temperatur alene. Nej: Hvis en fri-ekspansion derimod ikke resulterer i en temperaturændring, så ved vi den indre energi U kun afhænger af temperaturen T, da U holdes konstant til trods for p og V alt imens ændrer sig. Eksperimenter har undersøgt det her for lav-densitets gasser og deres temperatur ændrede sig ikke! Sådan en gas er grundlæggende en idealgas, hvorved vi kan konstatere generelt for idealgasser: Den indre energi U af en idealgas afhænger udelukkende af dens temperatur T og ikke dens tryk p eller volumen V OBS: For ikke-idealgasser vil en fri-ekspansion ofte resulterer i et fald i temperatur til trods for konstant indre energi U. Det skyldes at U ikke blot afhænger af temperatur her. Det er tydeligt hvis du ser på atomer i 120
121 en gas, da deres interne energi er summen af potentiel energi og kinetisk energi. Når gassen udvider sig forøges afstanden mellem atomer, hvorved den potentielle energi forøges. Men fordi den indre energi ikke må ændre sig, så må den kinetiske energi falde, og den kinetiske energi har direkte sammenhæng til temperaturen af en gas. Forskellen mellem C V og C P Som jeg sagde under gennemgangen af molær varmekapacitet, så har vi 2 eksperimentielle måder at måle varmekapacitet på. Vi kan måle varmekapaciteten ved konstant volumen, således vi finder den molære varmekapacitet ved konstant volumen C V, eller vi kan måle varmekapaciteten ved konstant tryk, således vi finder den molære varmekapacitet ved konstant tryk C P. At forsøge at finde C V giver mest mening for gasser (i.e. det er nemt at placere gassen i en beholder og på den måde begrænse volumen), hvor at finde C P giver mest mening for faste stoffer (i.e. det er nemt at styre trykket ved faste stoffer). Vi forestiller os nu C V og C P for en idealgas. For at måle C V ville vi hæve temperaturen af en ideal gas imens den var i en stiv container med konstant volumen (note: vi ignorerer altså termisk expansion af containeren). For at måle C P derimod ville vi lade en gassen udvide sig lige akkurat nok for at holde trykket konstant med temperaturstigningen. Disse to C V og C P er nu forskellige grundet Termodynamikkens 1. hovedsætning. I en konstant-volumen temperaturstigning udfører systemet intet arbejde W og ændringen i indre energi er derved U = Q. I en konstant-tryk temperaturstigning derimod udfører systemet et arbejde når volumen bliver forøget, ellers kunne trykket ikke forblive konstant, grundet idealgaslignigen p = nrt/v. Ifølge Termodynamikkens 1. hovedsætning betyder det, at varmemængden Q bliver: Q = U + W Da indre energi i en idealgas udelukkende afhænger af temperaturen T, så vil en given stigning i temperatur resulterer i den samme stigning i indre energi U uanset proces. Derved kan vi se, at C P varmekapaciteten må være større end C V varmekapaciteten, da der skal bruges ekstra energi for at lave arbejdet W der skal bruges til udvidelsen. Vi har altså at C P > C V. 121
122 Dette koncept vises også herunder som et pv-diagram, hvor vi tydeligt kan se begge når til samme sluttemperatur T 2 og slut indre energi U 2, men C P processen skal bruge mere varmeenergi for at nå dertil pga. arbejdet W : OBS: En undtagelse hertil er hvis W er negativt (f.eks. ved vand mellem 0 og 4 grader Celcius, hvor volumen formindskes ved opvarmning). I det tilfælde er C P < C V. Men generelt forøges volumen ved opvarmning, hvorved C P > C V gælder for det meste. Udledning af sammenhængen mellem C V og C P Så vi ved nu at C P > C V, men kan vi se noget mere præcist om hvor meget større. Det viser sig, at det kan vi sagtens. Vi starter med at kigge på konstant volumen tilfældet C V. Vi placerer n mol af en idealgas ved temperatur T i en konstant-volumen container. Vi sætter den herefter i termisk kontakt med et varmere legeme. En infinitesimal mængde varme dq vil herefter flyde ind i gassen og dens temperatur stiger med en infinitesimal mængde dt. Vi har desuden definitionen på molær varmekapacitet ved konstant volumen, som siger: dq = nc V dt Vi ved så processen her hæver trykket af gassen, men gassen udfører intet arbejde (dw = 0) fordi volumen er konstant. Termodynamikkens 1. hovedsætning i differentialform er så: dq = du + dw Siden vi ved dw = 0, så bliver dq = du og vi kan nu omskrive formlen for molær varmekapacitet til: du = nc V dt 122
123 Hvis vi så nu kigger på konstant tryk situationen med C P og med samme temperaturændring dt, så placerer vi den samme gas i en cylinder med et stempel således vi kan regulerer den løbende akkurat nok til at holde konstant tryk når gassen udvider sig. Endnu engang sætter vi denne i kontakt med et varmere legeme og når varme strømmer ind i gassen vil gassen udvide sig ved konstant tryk og gassen udfører et arbejde. Ved definitionen af C P har vi at molær varmekapacitet for konstant tryk er: dq = nc P dt Arbejdet der udføres for at udvide gassen er så dw = pdv. Dette arbejde kan vi også udtrykke i form af idealgasligningen pv = nrt, men fordi p er konstant så er ændringen i V proportional til ændringen i T, så vi kan skrive: dw = pdv = nrdt Vi har nu værdier for dw, du og dq, så vi indsætter dem i Termodynamikkens 1. hovedsætning: dq = du + dw nc P dt = nc V dt + nrdt Her er det vigtigt at pointere, at vi kun kan indsætte du = nc V dt fordi den indre energi af en idealgas kun afhænger af temperaturen uanset proces. Normalvis ville vi ikke kunne da C V er molær varmekapaciteten for konstant volumen, og volumen er ikke konstant her. vi: Tager vi nu det sidste udtryk her og dividerer hvert led med ndt, så får C P = C V + R Altså er C P større end C V idealgasser. med præcis konstanten R, såfremt vi taler om Det skal siges denne sammenhæng ikke gælder generelt, da ikke alt kan betegnes som en idealgas, men selv ved mange normale gasser er det en fin approksimation, der kun giver nogle få procents afvigelse fra realiteten. 123
124 Forholdet mellem C V og C P (γ) Sidst men ikke mindst kan man definere forholdet mellem C V og C P som forholdet mellem varmekapaciteter, som vi skriver som gamma (γ): γ = C P C V Ligesom man kan forudsige værdier for C V og C P, så kan man også forudsige værdier for γ, som f.eks. for en ideal monoatomar gas med C V = 3 2 R: Hvorved γ bliver: C P = C V + R = 3 2 R + R = 5 2 R γ = C P C V = 5 2 R 3 2 R = 5 3 = 1.67 Hvilket passer med tabelværdier for γ. Noget estimeringen for en diatomar version også gør (γ = 1.40) 124
125 10 Termodynamikkens første hovedsætning, termodynamiske processer 10.1 Disposition 1. Et termodynamisk system 2. Arbejde og Varmestrøm Udledning af arbejde i volumenændring Visualisering af arbejde i pv-diagrammer Veje mellem termodynamiske tilstande 3. Indre energi & Termodynamikkens 1. hovedsætning Indre energi og 1. hovedsætning Cykliske processer og isolerede systemer 4. Termodynamiske processer Den adiabatiske proces Den isochore proces Den isotermiske proces Den isobare proces 5. Termodynamik og idealgasser 10.2 Detaljer Idealgas: Indre energi afhænger kun af T Forskellen mellem C V og C P. Sammenhængen mellem C V Forholdet mellem C V og C P (γ) Den adiatiske proces for en idealgas og C P (resultat) Udledning af sammenhæng mellem V og T Her følger detaljerne for denne givne disposition Termodynamikkens 1. hovedsætning Dette emner handler om en af de fundamentale sætninger i termodynamikken, nemlig Termodynamikkens 1. hovedsætning. Der er også en Termodynamikkens 0. hovedsætning, men det vil vi ikke gennemgå noget om her - det kan der findes noget om tidligere i dispositionerne. 125
126 Et termodynamisk system Et termodynamisk system er enhver samling af objekter der er relevante at opfatte som værende et system og som har potentiale til at udveksle energi med sine omgivelser. Et system i denne forstand skal altså kunne omtales som en enhed, således den kan have en tilstand eller state. Derved kan vi beskrive systemet vha. tilstandsvariabler og sammenhængen mellem disse vha. en tilstandsligning. En proces der ændrer denne tilstand kalder vi så for en termodynamisk proces. Arbejde og Varmestrøm Energirelationerne i enhver termodynamisk proces omtaler vi så som en varmemængde Q som tilføres til eller fjernes fra et system og en arbejdsmængde W som laves af eller på systemet. Hvis varmemængden Q er positiv er det varme ind i systemet og hvis den er negativ er det ud af systemet (0 betyder selvfølgelig ligevægt). Hvis arbejdsmængden W er positiv betyder det arbejde udført af systemet på omgivelserne og hvis den er negativ betyder det arbejde udført på systemet (f.eks. hvis en gas bliver kompresset af dens omgivelser). Konceptet vises herunder: Fortegnet for W er i dette tilfælde anderledes end for mekanik, hvor W var mængden af arbejde udført på legemet fra andre krafter, hvormed 126
127 positiv W var det vi ser som negativ W her. Det er dog konventionen for termodynamik, så det er den vi følger. Udledning af arbejde i volumenændring Vi kan så nu udlede et udtryk for mængden af arbejde der skal til for at udføre en ændring af volumen i en cylinder med et stempel, som vist herunder: Som vi kan se har cylinderen et tværsnitsareal på A hvorved kraften der udøves på dette areal er F = pa. Når stemplet så rykkes en infinitesimal distance dx, så udføres følgende infinitesimale mængde arbejde: dw = F dx = padx Men da Adx er volumen af denne forøgelse, så kan vi også skrive dette om til: dw = pdv I en ændring af volumen fra V 1 til V 2 giver det så følgende udtryk for arbejdet W : W = V2 V 1 Hvorved vi skal have et udtryk for trykket p, da trykket typisk kan variere. pdv Hvis trykket holdes konstant bliver udtrykket for W i stedet til: W = p(v 2 V 2 ) Visualisering af arbejde i pv-diagrammer Arbejdet W kan også visualiseres i et pv-diagram ved at notere start og slut tryk på en isoterm, samt start og slut volumen. Herefter vil arbejdet W være arealet under kurven. Tre eksempler vises herunder: 127
128 Alt afhængig om det er en volumen udvidelse eller kompression, så vil arealet enten være henholdsvis positivt eller negativt. Veje mellem termodynamiske tilstande Når et termodynamisk system skifter tilstand, så gør den det ligesom vi så ved pv-diagrammerne for arbejde, simpelthen ved at skifte til en anden position på den isoterm (eller på en anden isoterm). Men man kunne så spørge sig selv, har den vej man tager igennem tilstandende betydning for mængden af arbejde W og varmemængden Q? Hvis man kigger på nedenstående eksempel, så har vi en situation hvor vi ønsker at gå fra tilstand 1 til tilstand 2 Der er så 3 måder vi kan gøre det på her, startende fra tilstande 1 med tryk p 1 og volumen V 1 og gående mod tilstand 2 med tryk p 2 og volumen V 2 : 1. Vi kunne holde trykket p 1 konstant imens vi udvider systemets volumen til V 2 således vi ville være ved tilstand 3, hvorefter vi holder volumen V 2 konstant imens vi sænker trykket (sandsynligvis ved at sænke temperaturen) indtil vi når til tilstand 2. At gøre det på den måde ville give arealet under kurven i arbejde W : 128
129 2. Vi kunne også gøre det ved at sænke trykket fra p 1 til p 2 (igen sandsynligvis ved at sænke temperaturen) og så lade systemet udvide sin volumen indtil vi når tilstand 2 med volumen V 2. Så ville arbejde W være volumen under den mindre vandrette kurve. 3. En sidste mulighed var at sænke tryk og volumen simultant, for derved at tage den kurvede rute. Det ville så give arbejde W svarende til arealet under den kurve. Vi kan altså se mængden af arbejde W afhænger meget af hvilken rute vi tager, hvorved vi må konkludere, at det ikke giver mening at tale om arbejde W som en tilstandsvariabel, ligesom det ikke giver mening at tale om varmemængde Q på den måde. 129
130 I stedet definerer vi noget kaldet den indre energi af et termodynamisk system. Indre energi og 1. hovedsætning Siden alle materialer beståer af atomer og molekyler, og hver af disse har en kinetisk energi og en potentiel energi defineret for dem, så kan vi definere den indre energi af et termodynamisk system som værende summen af den kinetiske energi for alle partikler heri, samt summen for den potentielle energi af alle partikler heri. Dette gælder dog kun potentielle energier der rent faktisk opstår som følger af interaktion mellem systemet og dets omgivelser, og ikke f.eks. gravitationel potentiel energi. Vi bruger symbolet U for indre energi og en ændring af tilstanden for et system kan så ske at ændre den indre energi fra en startværdi U 1 til en slutværdi U 2 hvorved ændringen i indre energi er: U = U 2 U 1 Selvom at summere over kinetisk og potentiel energi er den rigtige, eller mest virklighedsnære, måde at tælle indre energi op på, så er de dog ikke en særlig operationel måde. Af den grund definerer man i stedet den indre energi som forskellen mellem varmemænden Q og arbejdet W, således vi får sammenhængen vi kalder termodynamikkens 1. hovedsætning: U = Q W Som vi så til tider hellere vil arbejde med som: Q = U + W Vi får altså en konstruktion hvor det at tilføje varmeenergi Q til et system forøger dets indre energi med U og det at udføre arbejde W formindsker den indre energi med U. Eksempler på dette vises for 3 systemer herunder: 130
131 Spørgsmålet er så nu, om vi vha. indre energi har løst problemet med flere stier til samme tilstande. Det kan vi ikke umiddelbart svare på teoretisk, men eksperimentielt nævner bogen at alle resultater på dette har været klare og utvetydige: Indre energi U = Q W er sti-uafhængig. Ændringen i indre energi af et system i løbet af en termodynamisk proces afhænger udelukkende af den initielle og den endelige tilstand, ikke af stien imellem dem. Cykliske processer og isolerede systemer To special cases for Termodynamikkens 1. hovedsætning er lige værd at nævne. Cykliske processer: En proces er cyklisk hvis den før eller siden leder tilbage til dens initielle tilstand, hvorved den har skabt en loop. Da sluttilstanden er den samme som den initielle tilstand, så må den samlede ændring i indre energi være nul, i.e. U = 0. Ergo gælder der, at U 1 = U 2 og at Q = W - altså skal alt arbejde udført kompenseres for vha. varmeenergi ind i systemet. Isolerede systemer: Et isoleret system er et der udøver intet arbejde på dets omgivelser og som har ingen varmestrøm til eller fra sine omgivelser. For enhver proces i et isoleret system gælder der så, at W = Q = 0 og derved at U 2 = U 1 = U = 0 - altså kan man sige at den indre energi i et isoleret system er konstant Termodynamiske processer Der er overordnet 4 forskellige typer processer i termodynamikken: Adiabatiske processer, isochore processer, isotermiske processer og isobare processer. Et hurtigt overblik over de forskellige processer og hvordan de skifter fase er herunder i form af et pv-diagram for en konstant mængde ideal gas: 131
132 Stien hver proces følger hedder henholdsvis en adiabat, en isochor, en isobar og en isoterm. Adiabatisk processer En adiabatisk proces kan blive opsummeret hurtigt som en ingen varme proces, da processen ikke kan tilføre eller fjerne varmeenergi fra et system. Altså er Q = 0. Man kan opnå dette i praksis ved enten at isolere systemet så processer på det sker tilnærmelsesvist adiabatisk eller ved at udføre processen over så kort tid at hvad varmeoverførsel der måtte være er negligjerbar. For alle adiabatiske processer gælder der altså (grundet termodynamikkens 1. hovedsætning): U = W Når et system udvider sig adiabatisk er W positiv hvorved den indre energi formindskes, hvor det modsatte sker hvis W er negativ ved kompression. Man kan vise at en adiabatisk proces i en idealgas altid vil hæve temperaturen hvis den kompresser systemet og altid vil sænke temperaturen hvis den udvider systemet. Det bevis vil jeg kigge på senere. Man kan se en adiabatisk proces på et pv-diagram som den der altid vandrer fra isoterm til isoterm, således dens kurve altid er stejlere end isotermerne den krydser med. Isochore processer En isochorisk proces kan hurtigt opsummeres som konstant volumen processen. Som navnet antyder så er det en proces hvor volumen holdes 132
133 konstant, hvorved der ikke kan udføres noget arbejde - i.e. W = 0. Derved får vi for Termodynamikkens 1. hovedsætning: U = Q Ved en isochorisk proces gemmes alt tilført varmeenergi altså som indre energi. Et eksempel på en isochorisk proces er det at varme en gas i en konstantvolumen beholder. Da en isochor proces har konstant volumen, så vandrer den kun vertikalt på et pv-diagram, som set ovenfor. Isotermiske processer En isotermisk proces kan hurtigt opsummeres som konstant temperatur processen. For at en proces skal være isoterm skal varmeenergi ind og ud af systemet vandre så langsomt, at termisk ligevægt bibeholdes. Generelt holdes ingenting fast i en isotermisk proces og man kan identificere dem på pvdiagrammer som de hyperbler der er plottet for forskellige temperaturer. En isotermisk proces vandrer altså blot ned af en af disse hyperbler. For visse systemer vil man se, at den indre energi afhænger udelukkende af temperaturen T og ikke af tryk eller volumen. Det er f.eks. tilfældet for en idealgas, som jeg vil snakke om om lidt. Isobare processer En isobarisk proces kan hurtigt opsummeres som konstant tryk processen. Som navnet antyder holdes trykket konstant. Det betyder ikke noget for om systmet kan udføre arbejde eller udveksle varmeenergi, men det betyder derimod at det bliver væsentligt nemmere at udregne arbejde W, da tryk p derved er konstant. Så arbejde W udregnes pludseligt som: W = p(v 2 V 1 ) Et eksempel på en isobar proces er det at koge vand ved konstant tryk. En isobar proces kan identificeres på et pv-diagram som den der vandrer horisontalt (den kan ikke vandre vertikalt, da trykket er konstant). 133
134 Termodynamik og idealgasser Termodynamikkens 1. hovedsætning har nogle interessante konsekvenser i forhold til idealgasser og påvirker bl.a. forholdet mellem de molære varmekapaciteter C P (varmekapacitet ved konstant tryk) og C V (varmekapacitet ved konstant volumen). Desuden har adiabatiske processer ved idealgaser det konkrete forhold, at en udvidelse af volumen altid resulterer i et temperaturfald og en kompression af volumen altid resulterer i en temperaturstigning. Vi starter dog med en vigtig detalje omkring den indre energi i en idealgas. Idealgas: Indre energi afhænger kun af T Da vi kigger på idealgasser her, så skal vi også bruge en observation ang. indre energi i idealgasser. For idealgasser gælder der nemlig den sammenhæng, at den interne energi U kun afhænger af temperaturen og ikke af hverken volumen eller tryk. Vi kan argumentere for dette faktum vha. et eksempel. Kigger vi på et fri ekspansion eksperiment, så har vi en termisk isoleret beholder med stive vægge og hvor beholderen er delt op i to dele vha. en partition. Et af disse kamre har så en idealgas og den anden er lavet om til et vacuum. Når denne partition brydes vil gassen udvide sig for at fylde begge kamre. Denne udvidelse udfører intet arbejde da udvidelsen ikke flytter på væggene og der sker ingen varmeføring igennem isoleringen. Så både Q og W er 0 og den indre energi U er derved konstant. Konceptet vises herunder: Indtil videre er ovenstående gældende for alle materialer, ikke blot gasser. Ser vi på temperaturændringen, så kan vi overveje hvorvidt en fri-ekspansion som ovenstående resulterer i en temperaturændring? Vi kan således opskrive konsekvenserne herunder: 134
135 Ja: Hvis en fri-ekspansion resulterer i en temperaturændring, alt imens den indre energi forbliver den samme, så må det betyde den interne energi afhænger af både temperatur og tryk, eller temperatur og volumen, men helt sikkert ikke temperatur alene. Nej: Hvis en fri-ekspansion derimod ikke resulterer i en temperaturændring, så ved vi den indre energi U kun afhænger af temperaturen T, da U holdes konstant til trods for p og V alt imens ændrer sig. Eksperimenter har undersøgt det her for lav-densitets gasser og deres temperatur ændrede sig ikke! Sådan en gas er grundlæggende en idealgas, hvorved vi kan konstatere generelt for idealgasser: Den indre energi U af en idealgas afhænger udelukkende af dens temperatur T og ikke dens tryk p eller volumen V OBS: For ikke-idealgasser vil en fri-ekspansion ofte resulterer i et fald i temperatur til trods for konstant indre energi U. Det skyldes at U ikke blot afhænger af temperatur her. Det er tydeligt hvis du ser på atomer i en gas, da deres interne energi er summen af potentiel energi og kinetisk energi. Når gassen udvider sig forøges afstanden mellem atomer, hvorved den potentielle energi forøges. Men fordi den indre energi ikke må ændre sig, så må den kinetiske energi falde, og den kinetiske energi har direkte sammenhæng til temperaturen af en gas. Forskellen mellem C V og C P Som jeg sagde under gennemgangen af molær varmekapacitet, så har vi 2 eksperimentielle måder at måle varmekapacitet på. Vi kan måle varmekapaciteten ved konstant volumen, således vi finder den molære varmekapacitet ved konstant volumen C V, eller vi kan måle varmekapaciteten ved konstant tryk, således vi finder den molære varmekapacitet ved konstant tryk C P. At forsøge at finde C V giver mest mening for gasser (i.e. det er nemt at placere gassen i en beholder og på den måde begrænse volumen), hvor at finde C P giver mest mening for faste stoffer (i.e. det er nemt at styre trykket ved faste stoffer). Vi forestiller os nu C V og C P for en idealgas. For at måle C V ville vi hæve temperaturen af en ideal gas imens den var i en stiv container med konstant volumen (note: vi ignorerer altså termisk expansion af containeren). For at måle C P derimod ville vi lade en gassen udvide sig lige akkurat nok for at holde trykket konstant med temperaturstigningen. 135
136 Disse to C V og C P er nu forskellige grundet Termodynamikkens 1. hovedsætning. I en konstant-volumen temperaturstigning udfører systemet intet arbejde W og ændringen i indre energi er derved U = Q. I en konstant-tryk temperaturstigning derimod udfører systemet et arbejde når volumen bliver forøget, ellers kunne trykket ikke forblive konstant, grundet idealgaslignigen p = nrt/v. Ifølge Termodynamikkens 1. hovedsætning betyder det, at varmemængden Q bliver: Q = U + W Da indre energi i en idealgas udelukkende afhænger af temperaturen T, så vil en given stigning i temperatur resulterer i den samme stigning i indre energi U uanset proces. Derved kan vi se, at C P varmekapaciteten må være større end C V varmekapaciteten, da der skal bruges ekstra energi for at lave arbejdet W der skal bruges til udvidelsen. Vi har altså at C P > C V. Dette koncept vises også herunder som et pv-diagram, hvor vi tydeligt kan se begge når til samme sluttemperatur T 2 og slut indre energi U 2, men C P processen skal bruge mere varmeenergi for at nå dertil pga. arbejdet W : OBS: En undtagelse hertil er hvis W er negativt (f.eks. ved vand mellem 0 og 4 grader Celcius, hvor volumen formindskes ved opvarmning). I det tilfælde er C P < C V. Men generelt forøges volumen ved opvarmning, hvorved C P > C V gælder for det meste. 136
137 Udledning af sammenhængen mellem C V og C P Så vi ved nu at C P > C V, men kan vi se noget mere præcist om hvor meget større. Det viser sig, at det kan vi sagtens. Vi starter med at kigge på konstant volumen tilfældet C V. Vi placerer n mol af en idealgas ved temperatur T i en konstant-volumen container. Vi sætter den herefter i termisk kontakt med et varmere legeme. En infinitesimal mængde varme dq vil herefter flyde ind i gassen og dens temperatur stiger med en infinitesimal mængde dt. Vi har desuden definitionen på molær varmekapacitet ved konstant volumen, som siger: dq = nc V dt Vi ved så processen her hæver trykket af gassen, men gassen udfører intet arbejde (dw = 0) fordi volumen er konstant. Termodynamikkens 1. hovedsætning i differentialform er så: dq = du + dw Siden vi ved dw = 0, så bliver dq = du og vi kan nu omskrive formlen for molær varmekapacitet til: du = nc V dt Hvis vi så nu kigger på konstant tryk situationen med C P og med samme temperaturændring dt, så placerer vi den samme gas i en cylinder med et stempel således vi kan regulerer den løbende akkurat nok til at holde konstant tryk når gassen udvider sig. Endnu engang sætter vi denne i kontakt med et varmere legeme og når varme strømmer ind i gassen vil gassen udvide sig ved konstant tryk og gassen udfører et arbejde. Ved definitionen af C P har vi at molær varmekapacitet for konstant tryk er: dq = nc P dt Arbejdet der udføres for at udvide gassen er så dw = pdv. Dette arbejde kan vi også udtrykke i form af idealgasligningen pv = nrt, men fordi p er konstant så er ændringen i V proportional til ændringen i T, så vi kan skrive: dw = pdv = nrdt 137
138 Vi har nu værdier for dw, du og dq, så vi indsætter dem i Termodynamikkens 1. hovedsætning: dq = du + dw nc P dt = nc V dt + nrdt Her er det vigtigt at pointere, at vi kun kan indsætte du = nc V dt fordi den indre energi af en idealgas kun afhænger af temperaturen uanset proces. Normalvis ville vi ikke kunne da C V er molær varmekapaciteten for konstant volumen, og volumen er ikke konstant her. vi: Tager vi nu det sidste udtryk her og dividerer hvert led med ndt, så får C P = C V + R Altså er C P større end C V idealgasser. med præcis konstanten R, såfremt vi taler om Det skal siges denne sammenhæng ikke gælder generelt, da ikke alt kan betegnes som en idealgas, men selv ved mange normale gasser er det en fin approksimation, der kun giver nogle få procents afvigelse fra realiteten. Forholdet mellem C V og C P (γ) Sidst men ikke mindst kan man definere forholdet mellem C V og C P som forholdet mellem varmekapaciteter, som vi skriver som gamma (γ): γ = C P C V Ligesom man kan forudsige værdier for C V og C P, så kan man også forudsige værdier for γ, som f.eks. for en ideal monoatomar gas med C V = 3 2 R: Hvorved γ bliver: C P = C V + R = 3 2 R + R = 5 2 R γ = C P C V = 5 2 R 3 2 R = 5 3 = 1.67 Hvilket passer med tabelværdier for γ. Noget estimeringen for en diatomar version også gør (γ = 1.40) 138
139 Den adiatiske proces for en idealgas Hvis vi nu kigger på hvordan en adiabatisk proces ville fungere i en idealgas, så kan vi observere en række ting. Først og fremmest, siden det er en adiabatisk proces, så er varmeudvekslingen med omgivelser Q = 0. Det er selvfølgelig en idealisering, da det ikke kan være tilfældet, men processer kan være tilnærmelsesvist adiabatiske hvis et system er meget velisoleret eller hvis processen er så hurtig at varmeudveksling ikke når at forekomme i nogen betydelig grad. Siden Q = 0, så er ændringen af den indre energi U = W. Når en gas udvider sig i denne proces, så vil det altså udføre positivt arbejde, som vil betyde fald i indre energi og derved fald i temperatur. Så hvis starttilstanden a er på en isotherm i et pv-diagram, så vil sluttilstanden b være på en lavere isotherm, som vist på nedenstående pv-diagram. Ud fra samme logik, vil en kompression af gassen resulterer i negativt arbejde W, hvorved ændringen af indre energi U er positiv og temperaturen stiger. I så fald vandrer vi fra en lavere isotherm til en højere. Et eksempel på en adiabatisk proces er når man åbner en colaflaske, så vil gassen lige ovenover væsken udvide sig så hurtigt at det er en tilnærmelsesvis adiabatisk proces, hvorved arbejdet W er positivt, ændringen i indre energi U er negativ og temperaturen falder så voldsomt at gassen kondenserer som en lille sky. Udledning af sammenhæng mellem V og T Vi kan udlede en sammenhæng mellem volumen V og temperaturen T for en 139
140 infinitesimal adiabatisk proces i en idealgas, for derved at undersøge hvordan udvidelse og kompression påvirker temperaturen. Vi ved fra tidligere at en idealgas indre energi udelukkende afhænger af temperaturen, således vi kan opskrive en infinitesimal ændring af den indre energi, uafhængig af proces, som: du = nc V dt Derudover har vi, at arbejdet der udføres under processen er dw = pdv og den indre energi for en adiabatisk proces er du = dw. Vi har derfor: nc V dt = pdv Hvis vi nu gerne vil fjerne tryk fra formlen (da vi leder efter sammenhængen mellem V og T ), så kan vi bruge idealgasligningen p = nrt/v og indsætte: nc V dt = nrt V Rykker vi lidt rundt på det så får vi: dv dt T + R C V dv V = 0 Delen med R C V ovenfor kan så udtrykkes på baggrund af forholdet mellem C V og C P kaldet γ: R C V = C P C V C V Indsætter vi det ovenfår får vi så: = C P C V 1 = γ 1 dt T + (γ 1)dV V = 0 Fordi γ > 1 for alle idealgasser, så betyder at dt og dv altid vil have modsatte fortegn, hvilket betyder en stigning i temperatur altid vil betyde et fald i volumen, og en stigning i volumen altid vil betyde et fald i temperatur. Så vi har altså, at dv > 0 (udvidelse) betyder fald i temperatur og dv < 0 (kompression) betyder stigning i temperatur. Vi kan udlede et sammenhæng her der er lidt nemmere at arbejde med, ved at integere ovenstående, så vi får: ln T + (γ 1) ln V = konstant ln T + ln V γ 1 = konstant ln(t V γ 1 ) = konstant 140
141 Og så fordi logaritmen ikke ændrer på forholdet mellem dem, så får vi: T V γ 1 = konstant For den initielle tilstand 1 og sluttilstand 2 kan vi så opskrive: T 1 V γ 1 1 = T 2 V γ 1 2 Som gælder for adiabatiske processer på en idealgas. Man kan også gå videre og vise at ovenstående til sidst kan laves til en formel for arbejde i en adiabatisk proces med idealgasser. Men det har jeg dog ikke tænkt mig. For god ordens skyld ser formlen dog sådan her ud: W = nc V (T 1 T 2 ) 141
142 11 Termodynamikkens anden hovedsætning, Carnotcyklen, entropi Disposition 1. Reversible og irreversible processer 2. Varmemaskinen og dens effektivitet Generelt Effektiviteten 3. Otto-cyklen Effektiviteten af Otto-cyklen 4. Kølemaskinen og dens effektivitet 5. Entropi Generelt Effektiviteten af kølemaskinen Eksempel: Køleskab Definition af entropi Makroskopisk vs. mikroskopisk syn 6. Termodynamikkens 2. hovedsætning Kelvin-Planck s definition Clausius definition Entropi definitionen 7. Carnot-cyklen 2 isoterme og 2 adiabatiske Vis pv diagram Effektiviteten af Carnot-cyklen Carnots kølemaskine Carnot i forhold til 2. hovedsætning 8. Entropi igen (unfinished) Entropi i en reversibel proces Entropi i en irreversibel proces Entropi i en cyklisk proces 142
143 11.2 Detaljer Her følger detaljerne for denne givne disposition Reversible og irreversible processer Emnet her handler om termodynamikkens 2. hovedsætning, som modsat den første ikke handler om givne egenskaber ved ting i termodynamikken, men derimod nærmere sætter begrænsninger op for hvad der er muligt og hvad der ikke er muligt. I vores snak om termodynamikkens 2. hovedsætning skal vi først kigge på konceptet af reversible og irreversible processer. En irreversibel proces er alle virkelige processer vi ser i naturen. Strømmen af varme fra et varmt til et koldt område er en irreversible proces. Fri ekspansion af en gas er en irreversibel proces. Friktion fra bevægelser hvor den mekaniske energi omdannes til varme er irreversible. Et yderligere eksempel er er en isblok ved K vi propper i en varm metalbox. Metalboxen og isen vil udveksle varme indtil de når termisk ligevægt hvorefter de vil stoppe. Denne proces kan ikke gå den anden vej, ergo er den ikke reversible. Mere eller mindre alle virkelige processer man kan komme i tanke om er irreversible. Reversible processer er så lige netop det modsatte. Altså idealiseringer vi ikke ser i naturen, men som vi kan skabe vha. ydre påvirkning. Et system der gennemgår en reversible proces er altid tæt på at være i termodynamisk ligevægt med sig selv og omgivelserne, hvor en ændring af tilstanden af et sådan system så kan modvirkes vha. en infinitesimal ændring i tilstanden af systemet. En reversible proces er en idealisering der aldrig reelt kan opnås i den virkelige verden, da ændringer ikke kan ske på et system hvis det er i termodynamisk ligevægt. Men hvis vi holder temperatur og trykændringer meget små, så kan vi holde systemer tæt på termodynamisk ligevægt, hvorved vi kan lave processerne næsten helt reversible. Reversible processer kaldes også til tider for ligevægtsprocesser. Læg dog mærke til, at store ændringer som fri ekspansion o.lign. ikke kan løses vha. en infinitesimal ændring af tilstanden af systemet, hvorved sådan en handling altid vil være irreversibel. Et eksempel på en reversible proces kunne igen være en isblok i en metalboks ved K, hvor metalboksen denne gang har samme temperatur, således vi kan forhøje eller formindske temperaturen af boksen med en in- 143
144 finitesimal mængde dt, hvor vi så vil kunne smelte og genfryse vandet ved varmeoverførsel til og fra boksen. Boks-eksemplerne vises herunder: Varmemaskinen og dens effektivitet En af de primære ting vi ønsker at opnå i nutidens verden er skabelsen af mekanisk energi igennem anden energi. F.eks. skabelsen af mekanisk energi igennem en forbrændingsmotor så vi kan køre vores biler, eller skabelsen af energi igennem atomkraft så vi kan få el. En typisk nutidig måde at skabe energi på er ved at forbrænde et eller andet for derved at skabe mekanisk energi. En maskine der gør dette kaldes en varmemaskine. En varmemaskine er enhver maskine der transformerer varme delvist om til arbejde eller mekanisk energi. Den simpleste form for maskine vi kan analysere er en hvor materialet der arbejdes på går igennem en cyklisk proces, således materialet slutter i samme tilstand som det startede. Et eksempel på dette er en dampturbine hvor vand bruges om og om igen. Et andet eksempel er en forbrændingsmotor, hvor brændstof godt nok ikke bruges igen, men hvor processen konstant bliver gentaget fra samme udgangspunkt, antaget tilstrækkelig brændstof. Et skematisk energi-flow diagram kan forklare de grundlæggende principper i en varmemaskine, som vist herunder: 144
145 Vi har altså en proces hvor maskinen absorberer varme Q H fra en kilde med relativ høj temperatur T H, udfører noget mekanisk arbejde W på det og afviser en vis varmemængde Q C til en kilde med lavere temperatur T C. Disse kilder kalder vi typisk for reservoirer. Vi antager disse reservoirers er tilstrækkeligt store til at de ikke ændrer temperatur selvom vi absorberer og giver varme fra/til dem. Da en cyklisk varmemaskinen starter og slutter i samme tilstand, så er den initielle og sluttende indre energi den samme. Ifølge termodynamikkens 1. hovedsætning U = Q W kræves det at enhver cyklisk proces opfylder: Altså skal Q = W. U = 0 = Q W Vi har desuden nogle konventioner i forhold varmemængdernes fortegn, hvor vi siger varme væk fra arbejdsområdet ud i et reservoir er negativ og varme ind i arbejdsområdet fra et reservoir er positiv. For en varmemaskine betyder det Q H er positiv og Q C er negativ. Disse værdier Q H og Q C er mængden af varme absorberet og afvist i løbet af en cyklus, så den resulterende varme pr. cyklus er: Q = Q H + Q C = Q H ] [Q C ] Som vi omtalte ovenfor, så grundet termodynamikkens 1. hovedsætning, så er Q = W for en cyklisk proces, hvorved arbejdet W bliver: W = Q = Q H + Q C = Q H Q C 145
146 Effektiviteten af en varmemaskine Optimalt set ville vi selvfølgelig gerne lave al varmen fra Q H om til arbejde W, men dette kan vi ikke grundet thermodynamikkens 2. hovedsætning, som jeg kommer ind på om lidt. Et sådan system ville være som det følgende, hvor vi bare ignorerer tabet til Q C : Men vi kan dog forsøge at gøre maskinen så effektiv som mulig ved at forøge de vi kalder den termiske effektivitet e af maskinen. Den termiske effektivitet defineres som mængden af arbejde W over mængden af absorberet varme Q H : e = W Q H Altså beskriver den termiske effektivtet hvor stor en brøkdel af energien er røget til reelt arbejde. Denne værdi er aldrig 1, da ingen maskine kan opnå 100% effektivtet. Indsætter vi nu vores værdier for W i termisk effektivtetsformlen, så kan vi opskrive den termiske effektivtet af en varmemaskine således: e = W = Q = 1 + Q C = 1 Q C Q H Q H Q H Q H Otto-cyklen Otto-cyklen er en idealiseret model der beskriver de termodynamiske processer i en forbrændingsmotor. En forbrændingsmotor fungerer ved at en blanding af luft og benzindamp bliver ført ind i en cylinder igennem en ventil, imens et stempel inde 146
147 i cylinderen trækkes nedad fra en startvolumen på V til en slutvolumen på rv, hvor r kaldes for kompressionsforholdet, der typisk ligger mellem 8 og 10 for moderne motorer. Herefter lukkes ventilen og stemplet føres op til volumen V igen, således der sker en adiabatisk kompression af gassen i cylinderen. Herefter antændes gassen vha. et tændrør, hvilket resulterer i en tilnærmelsesvis adiabatisk udvidelse af gassen således stemplet ryger ned til rv igen og derved udfører arbejde. Til sidst føres åbnes en udstødningsventil og forbrændingsprodukterne føres ud herigennem, hvorefter cyklussen starter forfra med nyt intake. Hele processen illustreres herunder: Otto cyklen er som sagt en idealiseret model på dette, hvor et pvdiagram for modellen vises herunder: 147
148 Som vi kan se tages blandingen af benzindamp og vand ind ved punkt a og kompresses adiabatisk til punkt b, Varme Q H tilføjes herefter til systemet vha. afbrænding langs bc, hvilket resulterer i en pludselig adiabatisk udvidelse og slagtilfælde på stemplet på cd. Gassen bliver herefter nedkølet til omkring temperaturen udenfor imellem da, og restprodukterne udsendes herefter igennem udstødningsrøret. Effektiviteten af Otto-cyklen Vi kan udregne effektiviteten af Otto-cyklen ved at observere bc og da er konstant volumen, således Q H og Q C kan udregnes ud fra Q = nc V T. Altså har vi: Q H = nc V (T c T b ) Q C = nc V (T a T d ) Hvor Q H > 0 og Q C < 0. Indsætter vi nu dem i udtrykket for effektivitet af en varmemaskine, så kan vi skrive som følger (vi eliminerer fælles faktoren nc V ): e = Q H + Q C = (nc V (T c T b )) + (nc V (T a T d )) = T c T b + T a T d Q H (nc V (T c T b )) T c T b For at simplificere det her udtryk yderligere, så kan vi benytte os af volumentemperatur sammenhængen i en adiabatisk proces for en ideal-gas, som siger: T 1 V γ 1 1 = T 2 V γ 1 2 Hvilket vi for dette tilfælde kan skrive for de to adiabatiske processer ab og cd således med konstant volumen rv i udvidet tilstand og V i sammenpresset tilstand: T a (rv ) γ 1 = T b (V ) γ 1 T d (rv ) γ 1 = T c (V ) γ 1 T a r γ 1 = T b T d r γ 1 = T c De her udtryk for T c og T b kan vi så indsætte i effektivitetsformlen således vi får: e = T c T b + T a T d T c T b = T dr γ 1 T a r γ 1 + T a T d T d r γ 1 T a r γ 1 = (T d T a )(r γ 1 1) (T d T a )r γ 1 148
149 Dividerer vi så fællesfaktoren (T d T a ) ud, så får vi effektiviteten: e = 1 1 r γ 1 Som vi kan se er effektiviteten dårligere end 1 (obviously), hvor hvis vi indsatte værdier som r = 8 og γ = 1.4 (i.e forholdet mellem C V og C P således γ = C P C V ), så ville vi få en effektivitet på e = 0.56 altså 56% effektivitet. Dette viser dog ikke effektiviteten af en forbrændingsmotor i virkeligheden da Otto-cyklen blankt ignorerer friktion, antager blandingen af luft og benzindamp opfører sig som en idealgas, ignorerer turbulens, tab af varme til motorens dele og omgivelserne mm. I virkeligheden har de fleste benzinmotorer en effektivitet på ca. 35%. - Og derudover er der affaldsprodukter i form af CO (carbonoxid), som forurene igennem udstødningen. Man kunne være fristet til at forøge r for at få bedre effektivitet, men i praksis kan den typisk ikke hæves over 10 da det resulterer i så meget sammenpresning af gassen at når den antændes så eksploderer den fremfor at brænde jævnt. Derved ødelægger man moteren når vi taler en benzinmotor Kølemaskinen og dens effektivitet Nu vi har kigget på en varmemaskine, så kan vi også kigge på det modsatte tilfælde, nemlig hvor vi forsøger at køle noget ned vha. en kølemaskine. En kølemaskine er blot en varmemaskine der arbejder modrettet. Den tager varme fra et koldt sted (typisk inde i et køleskab f.eks.) og giver det til et varmere sted (typisk luften i rummet hvor kølemaskinen står). Hvor en varmemaskinen genererer et resulterende output af W arbejde, så kræver en kølemaskine et input af W arbejde (typisk i form af strøm fra en stikkontakt e.lign.). Så vi har altså for en kølemaskine at: Q H = Q H W = W I.e. arbejde og og energi til den varme kilde er negativ fordi det går ud af systemet fremfor ind. Ud fra termodynamikkens 1. hovedsætning for en cyklisk proces kan vi så skrive: Q H + Q C W = 0 Q H = Q C W 149
150 Hvor vi så kan omskrive det absolut til at være: Q H = Q C + W Altså har vi generelt, at den varme der gives i varme til varmekilden altid er større end den varme vi tager fra Q C. Af den grund kan man f.eks. heller ikke køle ens hus ved at holde et køleskab åbent, da den ville varme rummet mere end den kølte det. Et flow-diagram for en kølemaskine er herunder: Effektiviteten af en kølemaskine Modsat en varmemaskine så gælder det ikke her om at maksimere arbejdet W på baggrund af Q H. I stedet handler det her om at få så meget varme fra Q C man kan på W arbejde. Forholdet vi ønsker at kigge på er derfor Q C / W - jo større det forhold er, jo mere effektiv en kølemaskine. Vi kan altså opskrive effektiviteten for en kølemaskine således: K = Q C W = Q C Q H Q C Et eksempel på en kølemaskine er det velkendte køleskab, som der vises en schematic for herunder: 150
151 Hvor en kompresser tager væsken der netop har opsamlet varme Q C fra køleskabet, sætter højt tryk på det så det bliver væsentligt varmere og bevæger sig langs kondensatoren indtil det når til ekspansionsventilen hvor dets volumen forøges kraftigt, hvilket resulterer i en øjeblikkelig nedkøling således det kan gå igennem fordamperen i køleskabet igen og tage varme fra materialerne derinde Entropi Selvom bogen gør det lidt omvendt, så vil jeg lige hurtigt nævne hvad entropi går ud på konceptuelt, for ordentligt at kunne forklare termodynamikkens 2. hovedsætning. Definitionen på entropi Vi kan se entropi som en kvantitativ måde at måle mængden af uorden eller randomness i et system på. Hvis man udfører en given irreversible proces på et system, så vil man derved permanent forøge mængden af randomness i et system. Det være sig f.eks. en fri ekspansion af en gas, hvor molekyler spredes ud over et større område, hvilket forøger mængdne af uorden i deres positionsbestemmelse. Ligeledes forøges entropi ved opvarmning, da et system havde en sortering af varme og kolde områder før opvarmning og efter opvarmning er i termisk ligevægt, hvorved denne sortering forsvinder. Makroskopisk vs. mikroskopisk syn Man kan se på mængden af entropi fra et makroskopisk og et mikroskopisk syn. 151
152 For at snakke om det mikroskopisk skal man dog først tale om makroskopiske og mikroskopisk tilstande. Et eksempel som bogen laver på det er det at kaste N mønter, hvor halvdelen lander med krone og den anden halvdel med plat. Den makroskopisk tilstand af system vil du netop beskrive på den måde, netop som N mønter hvor N/2 landede som plat (eller krone). Den mikroskopiske tilstand af systemet derimod, taler om tilstanden af enkelte komponenter. Altså at mønt 1 blev krone, mønt 2 blev plat osv. Der er altid mange mikroskopisk tilstande der svarer til den samme makroskopiske tilstand. Så som for N = 4 mønter, der er der 6 måder hvorpå der kan være et lige antal kroner og plat. Set fra det makroskopiske synspunkt er det et og det samme, men set fra et mikroskopisk synspunkt forøges mængden af mulige tilstande med en 2 N for hver hævelse af N. Vi siger således at den makroskopiske tilstand af et system er den, for hvilket der svarer til flest mikroskopiske tilstande. I.e. der er flere mikroskopiske tilstande ved lige antal kroner og plat end ved kun krone (obs: der er kun 1 uanset hvad). Da entropi er en kvantitativ måde at måle uorden på, så kan vi sige at jo flere tilstande vi har, jo mere uorden. Derved bliver den makroskopiske tilstand altid den for hvilket uorden, i.e. entropi, er størst. Eller sagt som bogen siger det: For ethvert system, så er den mest sandsynlige makroskopiske tilstand den for hvilket der eksisterer det største antal tilsvarende mikroskopiske tilstande, hvilket også er den makroskopiske tilstand med den største uorden og den største entropi Vi kan også opskrive det her matematisk ved at sige w er mængden af mulige mikroskopiske tilstande, hvorved entropien for en given makroskopisk tilstand bliver: Hvor k er Boltzmanns konstant. S = k ln(w) Egentlig giver det ikke mening at tale om entropi som et absolut term, men derimod om forskellen mellem start og sluttilstanden mht. entropi. Derfor vil man typiske skrive ovenstående om til: S = S 2 S 1 = k ln(w 1 ) k ln(w 2 ) = k ln( w 2 w 1 ) 152
153 Så forskellen i entropi mellem to systemer er nu forskellen i antal af mikroskopiske tilstande. Et eksempel på forøgelsen af antal mikroskopiske tilstande ses herunder ved fri ekspansion: Termodynamikkens 2. hovedsætning Med de her to typer maskiner og grundlæggende forståelse for entropi på plads, så bringer det os til selve humlen i det her spørgsmål - nemlig Termodynamikkens 2. hovedsætning. Termodynamikkens 2. hovedsætning er egentlig flere sætninger i en, da det samme kan siges på flere ækvivalente måder. Tager vi dem en efter en, så har vi først Kelvin-Planck definitionen: Kelvin-Planck definitionen Kelvin-Planck definitionen på termodynamikkens 2. hovedsætning siger: Det er umuligt for et system at gennemgå en proces hvormed den absorberer varme fra et reservoir ved en bestemt temperatur og konverterer dette 100% til mekanisk energi, hvor systemet slutter i den samme tilstand den startede i Altså siger Kevin-Planck definitionen at at alle maskiner har et tab til omgivelserne og ingen har 100% effektivitet. Begrundelsen for hvorfor dette holder generelt er, at skabes energi igennem en eller anden proces, så skabes det vha. en organiseret makroskopisk bevægelse, men resultatet er en forøgelse af tilfældig bevægelse af molekyler i legemet. Vi kan få noget af denne organisation tilbage vha. noget som en varmemaskine, men kun noget af det, da det at få det hele tilbage ville betyde vi kunne gå fra en tilstand med mere entropi til en med mindre, i.e. 153
154 vælge en makroskopisk tilstand der ikke har det største antal mikroskopiske tilstande. Det ved vi, ud fra ovenstående diskussion, at vi ikke kan. Clausius definition En alternativ definition på termodynamikkens 2. hovedsætning får vi fra Clausis, der siger: Det er umuligt for en proces at have som dets eneste resultat, overførslen af varme fra et koldere til et varmere legem Clausius definition siger altså at en kølemaskine altid vil skulle bruge ekstern arbejde (strøm) for at kunne fungere. Du kan ikke lave en der uden videre fører varmenergi fra et koldt til et varmt legeme. En sådan idealistisk maskine kaldes en arbejdsløs kølemaskine. Dette statement er ækvivalent til Kelvin-Planck definitionen omend det måske ikke er så direkte tydeligt. Brundelsen ligger i, at vi kan tage den ene definition og bruge den andens maskine til at skabe henholdsvis en 100% effektiv maskine eller en arbejdsløs kølemaskine. Konceptet illustreres herunder: 154
155 Entropy definitionen En sidste definition springer ud af konceptet af entropi. Entropi-defitionen siger: Når alle systemer der tager del i en proces inkluderes, så vil entropien enten forblive konstant eller forøges Eller omformuleret: Der findes ingen proces for hvilket den totale entropi falder, når alle systemkomponenter i processen inkluderes Hvilket giver intuitivt mening ud fra vores diskussion om entropi ovenfor samt diskussionen af den første formulering af termodynamikkens 2. hovedsætning Carnot-cyklen Ifølge termodynamikkens 2. hovedsætning kan vi altså ikke lave en maskine der er 100% effektiv. Men hvor tæt på kan man mon komme? Det er der en Sadi Carnot der rent faktisk satte sig til at finde ud af for mange er siden og resultatet var følgende: Carnot-cyklen, som den kaldes, bruger udelukkende reversible processer, da det at konvertere arbejde til varme er en irreversible proces og en varmemaskine forsøger at konvertere noget af dette tilbage igen. Ved kun at benytte reversible processer kan der så ideelt set opnås større effektivitet. 155
156 Varmestrøm ved et temperaturfald er en irreversible proces, hvorved varmeoverførsel i Carnotcyklen kun må finde sted når systemerne der vil overføre varme har samme temperatur, i.e. når Carnotcyklen absorberer varme fra T H reservoiret, så skal moteren allerede være ved temperatur T H, og ligeledes når det uderskydende afgives til T C, så skal moteren have temperatur af T C. Så altså enhver proces der involverer varmeoverførsel skal være isotermisk ved T H eller T C. Ligeledes så når moteren ikke har temperatur T H eller T C så skal hævning eller sænkning af denne temperatur foregå ved en adiabatisk proces, da den ikke må modtage varme fra noget reservoir. Vi har altså at alle processer i en Carnotcykel skal være reversible og derved skal alle tilstande også være i termodynamisk og mekanisk ligevægt. Cyklens trin Vi fokuserer her på en Carnot-cykel der bruger en idealgas i en cylinder med et stempel, omend resultaterne generaliserer udover idealgasser. Cyklens trin forklares herunder: 1. Gassen udvides isotermisk ved temperatur T H ved at absorbere varme fra Q H, hvorefter adgangen til T H lukkes. 2. Gassen udvides yderligere adiabatisk indtil temperaturen T C opnås i motoren. 3. Gassen kompresses isotermisk ved temperatur T C og afgiver varme Q C til det kolde reservoir, hvorefter adgang til T C lukkes igen. 4. Gassen kompresses ydereliger adiabatisk tilbage til dens initielle tilstand med temperatur T H. Processen vises herunder, sammen med et pv-diagram: 156
157 Effektiviteten af Carnot-cyklen Vi kan udregne effektiviteten af Carnot-cyklen i det specialtilfælde at gassen indeni er en idealgas. Vi skal altså finde forholdet Q C /Q H, for at kunne udregne e. Vi behøver altså kun se på de segmenter af processen der interagerer med reservoirene, altså ab og cd. For en idealgas har vi, at den indre energi U udelukkende afhænger af temperaturen T og ikke af hverken tryk p eller volumen V. Derved ved vi også, at U er konstant i enhver isotermisk proces, da temperaturen her holdes konstant. Ergo: Isotermiske processer: U = 0 Q = W Desuden har vi fra en opgave i bogen, at arbejdet for en isotermisk expansion ved temperatur T H er: W = nrt H ln( V b V a ) Vi kan derved udregne arbejdet i del ab til at være: ( ) Vb Q H = W ab = nrt H ln V a 157
158 Og ligeledes for del cd: Q C = W cd = nrt C ln ( ) Vd V c = nrt C ln ( ) Vc Fordi V d er mindre end V c bliver Q C negativ (i.e. Q C = Q C ). Forholdet mellem Q H og Q C er så: Q C Q H = ( TC T H ) ln(vc /V d ) ln(v b /V a ) Her kan vi igen bruge sammenhængen mellem tempetur og volumen for en adiabatisk proces med en idealgas, altså: T 1 V γ 1 1 = T 2 V γ 1 2, hvilket her bliver: T H V γ 1 b T H Va γ 1 = T C V γ 1 c = T C V γ 1 d Dividerer vi den første af disse med den anden får vi: V γ 1 b V γ 1 a = V c γ 1 V γ 1 d V b V a = V c V d Altså kan vi se at de to logaritmer i vores udtryk er lig med hinanden, hvorved de går ud og vi får: V d Eller: Q C Q H = T C T H Q C Q H = T C T H Vi kan herefter tage dette resultat og indsætte i formlen for effektivitet, hvorefter vi får effektiviteten af Carnots maskine til at være: e carnot = 1 Q C = 1 T C = T H T C T H Q H Altså siger dette resultat, at effektiviteten af Carnots maskine afhænger af forskellen mellem T H og T C. Jo større forskel, jo større effektivitet. Hvor det kunne se ud til man kunne få en effektivitet på 100% ved at sætte T C = 0, så kan det dog ikke lade sig gøre. T H 158
159 Carnots kølemaskine Fordi ethvert trin af Carnots varmemaskine er reversibel, så kan man blot vende processen om, hvorefter man har en kølemaskine. Effektiviteten af denne kølemaskine kan så findes ved først at omskrive effektiviteten K således: K = Q C Q H Q C = Q C / Q H 1 Q C / Q H Nu kan vi så indsætte vores resultat Q C / Q H = T C /T H heri og få: T C K carnot = T H T C Her gælder det modsat varmemaskinen om at forskellen skal være lille. Jo mindre forskel, jo mere effektiv kølemaskine. At det er sådan kommer naturligt af, at man bruger energi på at pumpe vand tilbage igennem systemet og udvide det så det gøres koldt. Jo mindre temperaturforskel der skal bruges, jo mindre kompresser og ekspansionsventil. Carnot i forhold til 2. hovedsætning Carnot-cyklen leder til en reformulering af 2. hovedsætning som: Ingen maskine kan være mere effektiv end en Carnot maskine der arbejder mellem samme to temperaturer Denne sætning er sand, da vi ellers ville kunne bruge en Carnot kølemaskine sammen med en mere effektiv maskine, til at skabe en 100% effektiv varmemaskine. Konceptet i dette bevis er vist herunder: 159
Rapport uge 48: Skråplan
 Rapport uge 48: Skråplan Morten A. Medici, Jonatan Selsing og Filip Bojanowski 2. december 2008 Indhold 1 Formål 2 2 Teori 2 2.1 Rullebetingelsen.......................... 2 2.2 Konstant kraftmoment......................
Rapport uge 48: Skråplan Morten A. Medici, Jonatan Selsing og Filip Bojanowski 2. december 2008 Indhold 1 Formål 2 2 Teori 2 2.1 Rullebetingelsen.......................... 2 2.2 Konstant kraftmoment......................
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 9 sider Skriftlig prøve, torsdag den 24. maj, 2007, kl. 9:00-13:00 Kursus navn: Fysik 1 Kursus nr. 10022 Tilladte hjælpemidler: Alle hjælpemidler er tilladt. "Vægtning":
Danmarks Tekniske Universitet Side 1 af 9 sider Skriftlig prøve, torsdag den 24. maj, 2007, kl. 9:00-13:00 Kursus navn: Fysik 1 Kursus nr. 10022 Tilladte hjælpemidler: Alle hjælpemidler er tilladt. "Vægtning":
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 4 sider Skriftlig prøve, den 29. maj 2006 Kursus navn: Fysik 1 Kursus nr. 10022 Tilladte hjælpemidler: Alle "Vægtning": Eksamenssættet vurderes samlet. Alle svar
Danmarks Tekniske Universitet Side 1 af 4 sider Skriftlig prøve, den 29. maj 2006 Kursus navn: Fysik 1 Kursus nr. 10022 Tilladte hjælpemidler: Alle "Vægtning": Eksamenssættet vurderes samlet. Alle svar
Theory Danish (Denmark)
 Q1-1 To mekanikopgaver (10 points) Læs venligst den generelle vejledning i en anden konvolut inden du går i gang. Del A. Den skjulte metalskive (3.5 points) Vi betragter et sammensat legeme bestående af
Q1-1 To mekanikopgaver (10 points) Læs venligst den generelle vejledning i en anden konvolut inden du går i gang. Del A. Den skjulte metalskive (3.5 points) Vi betragter et sammensat legeme bestående af
Skråplan. Esben Bork Hansen Amanda Larssen Martin Sven Qvistgaard Christensen. 2. december 2008
 Skråplan Esben Bork Hansen Amanda Larssen Martin Sven Qvistgaard Christensen 2. december 2008 1 Indhold 1 Formål 3 2 Forsøg 3 2.1 materialer............................... 3 2.2 Opstilling...............................
Skråplan Esben Bork Hansen Amanda Larssen Martin Sven Qvistgaard Christensen 2. december 2008 1 Indhold 1 Formål 3 2 Forsøg 3 2.1 materialer............................... 3 2.2 Opstilling...............................
INERTIMOMENT for stive legemer
 Projekt: INERTIMOMENT for stive legemer Formålet med projektet er at træne integralregning og samtidig se en ikke-triviel anvendelse i fysik. 0. Definition af inertimoment Inertimomentet angives med bogstavet
Projekt: INERTIMOMENT for stive legemer Formålet med projektet er at træne integralregning og samtidig se en ikke-triviel anvendelse i fysik. 0. Definition af inertimoment Inertimomentet angives med bogstavet
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Fredag d. 2. juni 2017 kl
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Fredag d. 2. juni 2017 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Fredag d. 2. juni 2017 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Arbejdet på kuglens massemidtpunkt, langs x-aksen, er lig med den resulterende kraft gange strækningen:
 Forsøgsopstilling: En kugle ligger mellem to skinner, og ruller ned af den. Vi måler ved hjælp af sensorer kuglens hastighed og tid ved forskellige afstand på rampen. Vi måler kuglens radius (R), radius
Forsøgsopstilling: En kugle ligger mellem to skinner, og ruller ned af den. Vi måler ved hjælp af sensorer kuglens hastighed og tid ved forskellige afstand på rampen. Vi måler kuglens radius (R), radius
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 11 sider Skriftlig prøve, lørdag den 12. december, 2015 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
Danmarks Tekniske Universitet Side 1 af 11 sider Skriftlig prøve, lørdag den 12. december, 2015 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 11 Skriftlig prøve, torsdag den 8 maj, 009, kl 9:00-13:00 Kursus navn: Fysik 1 Kursus nr 100 Tilladte hjælpemidler: Alle hjælpemidler er tilladt "Vægtning": Besvarelsen
Danmarks Tekniske Universitet Side 1 af 11 Skriftlig prøve, torsdag den 8 maj, 009, kl 9:00-13:00 Kursus navn: Fysik 1 Kursus nr 100 Tilladte hjælpemidler: Alle hjælpemidler er tilladt "Vægtning": Besvarelsen
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 11 sider Skriftlig prøve, lørdag den 22. august, 2015 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
Danmarks Tekniske Universitet Side 1 af 11 sider Skriftlig prøve, lørdag den 22. august, 2015 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
Udledning af Keplers love
 Udledning af Keplers love Kristian Jerslev 8. december 009 Resumé Her præsenteres en udledning af Keplers tre love ud fra Newtonsk tyngdekraft. Begyndende med en analyse af et to-legeme problem vil jeg
Udledning af Keplers love Kristian Jerslev 8. december 009 Resumé Her præsenteres en udledning af Keplers tre love ud fra Newtonsk tyngdekraft. Begyndende med en analyse af et to-legeme problem vil jeg
Fysik 2 - Den Harmoniske Oscillator
 Fysik 2 - Den Harmoniske Oscillator Esben Bork Hansen, Amanda Larssen, Martin Qvistgaard Christensen, Maria Cavallius 5. januar 2009 Indhold 1 Formål 1 2 Forsøget 2 3 Resultater 3 4 Teori 4 4.1 simpel
Fysik 2 - Den Harmoniske Oscillator Esben Bork Hansen, Amanda Larssen, Martin Qvistgaard Christensen, Maria Cavallius 5. januar 2009 Indhold 1 Formål 1 2 Forsøget 2 3 Resultater 3 4 Teori 4 4.1 simpel
Faldmaskine. , får vi da sammenhængen mellem registreringen af hullerne : t = 2 r 6 v
 Faldmaskine Rapport udarbejdet af: Morten Medici, Jonatan Selsing, Filip Bojanowski Formål: Formålet med denne øvelse er opnå en vis indsigt i, hvordan den kinetiske energi i et roterende legeme virker
Faldmaskine Rapport udarbejdet af: Morten Medici, Jonatan Selsing, Filip Bojanowski Formål: Formålet med denne øvelse er opnå en vis indsigt i, hvordan den kinetiske energi i et roterende legeme virker
Matematisk modellering og numeriske metoder. Lektion 13
 Matematisk modellering og numeriske metoder Lektion 3 Morten Grud Rasmussen 9. november 25 Divergens af et vektorfelt [Sektion 9.8 og.7 i bogen, s. 43]. Definition af og og egenskaber for divergens Lad
Matematisk modellering og numeriske metoder Lektion 3 Morten Grud Rasmussen 9. november 25 Divergens af et vektorfelt [Sektion 9.8 og.7 i bogen, s. 43]. Definition af og og egenskaber for divergens Lad
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Fredag d. 8. juni 2018 kl
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Fredag d. 8. juni 2018 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Fredag d. 8. juni 2018 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Fysik i billard. Erik Vestergaard
 Fysik i billard Erik Vestergaard 2 Erik Vestergaard www.matematikfysik.dk Erik Vestergaard, 2010. Billeder: Forside: istock.com/aviad Desuden egne illustrationer Erik Vestergaard www.matematikfysik.dk
Fysik i billard Erik Vestergaard 2 Erik Vestergaard www.matematikfysik.dk Erik Vestergaard, 2010. Billeder: Forside: istock.com/aviad Desuden egne illustrationer Erik Vestergaard www.matematikfysik.dk
Tallene angivet i rapporten som kronologiske punkter refererer til de i opgaven stillede spørgsmål.
 Labøvelse 2, fysik 2 Uge 47, Kalle, Max og Henriette Tallene angivet i rapporten som kronologiske punkter refererer til de i opgaven stillede spørgsmål. 1. Vi har to forskellige størrelser: a: en skive
Labøvelse 2, fysik 2 Uge 47, Kalle, Max og Henriette Tallene angivet i rapporten som kronologiske punkter refererer til de i opgaven stillede spørgsmål. 1. Vi har to forskellige størrelser: a: en skive
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Tirsdag d. 27. maj 2014 kl
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Tirsdag d. 27. maj 2014 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Tirsdag d. 27. maj 2014 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Mandag d. 11. juni 2012 kl. 9 00-13 00
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Mandag d. 11. juni 2012 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Mandag d. 11. juni 2012 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 13 sider Skriftlig prøve, lørdag den 23. maj, 2015 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
Danmarks Tekniske Universitet Side 1 af 13 sider Skriftlig prøve, lørdag den 23. maj, 2015 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
Anvendelser af integralregning
 Anvendelser af integralregning I 1600-tallet blev integralregningen indført. Vi skal se, hvor stærkt et værktøj det er til at løse problemer, som tidligere forekom uoverstigelige. I matematik-grundbogen
Anvendelser af integralregning I 1600-tallet blev integralregningen indført. Vi skal se, hvor stærkt et værktøj det er til at løse problemer, som tidligere forekom uoverstigelige. I matematik-grundbogen
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 8 sider Skriftlig prøve, den 24. maj 2005 Kursus navn: Fysik 1 Kursus nr.: 10022 Tilladte hjælpemidler: Alle hjælpemidler tilladt. "Vægtning": Besvarelsen vægtes
Danmarks Tekniske Universitet Side 1 af 8 sider Skriftlig prøve, den 24. maj 2005 Kursus navn: Fysik 1 Kursus nr.: 10022 Tilladte hjælpemidler: Alle hjælpemidler tilladt. "Vægtning": Besvarelsen vægtes
Kræfter og Energi. Nedenstående sammenhæng mellem potentiel energi og kraft er fundamental og anvendes indenfor mange af fysikkens felter.
 Kræfter og Energi Jacob Nielsen 1 Nedenstående sammenhæng mellem potentiel energi og kraft er fundamental og anvendes indenfor mange af fysikkens felter. kraften i x-aksens retning hænger sammen med den
Kræfter og Energi Jacob Nielsen 1 Nedenstående sammenhæng mellem potentiel energi og kraft er fundamental og anvendes indenfor mange af fysikkens felter. kraften i x-aksens retning hænger sammen med den
Kræfter og Arbejde. Frank Nasser. 21. april 2011
 Kræfter og Arbejde Frank Nasser 21. april 2011 c 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Bemærk: Dette er
Kræfter og Arbejde Frank Nasser 21. april 2011 c 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Bemærk: Dette er
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Tirsdag d. 31. maj 2016 kl
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Tirsdag d. 31. maj 2016 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Tirsdag d. 31. maj 2016 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 10 sider Skriftlig prøve, lørdag den 23. maj, 2015 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
Danmarks Tekniske Universitet Side 1 af 10 sider Skriftlig prøve, lørdag den 23. maj, 2015 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE
 KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE Fysik 2, Klassisk mekanik 2 - ny og gammel ordning Vejledende eksamensopgaver 16. januar 2008 Tilladte hjælpemidler: Medbragt litteratur, noter
KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE Fysik 2, Klassisk mekanik 2 - ny og gammel ordning Vejledende eksamensopgaver 16. januar 2008 Tilladte hjælpemidler: Medbragt litteratur, noter
Dynamik. 1. Kræfter i ligevægt. Overvejelser over kræfter i ligevægt er meget vigtige i den moderne fysik.
 M4 Dynamik 1. Kræfter i ligevægt Overvejelser over kræfter i ligevægt er meget vigtige i den moderne fysik. Fx har nøglen til forståelsen af hvad der foregår i det indre af en stjerne været betragtninger
M4 Dynamik 1. Kræfter i ligevægt Overvejelser over kræfter i ligevægt er meget vigtige i den moderne fysik. Fx har nøglen til forståelsen af hvad der foregår i det indre af en stjerne været betragtninger
Harmonisk oscillator. Thorbjørn Serritslev Nieslen Erik Warren Tindall
 Harmonisk oscillator Thorbjørn Serritslev Nieslen Erik Warren Tindall November 27, 2007 Formål At studere den harmoniske oscillator, som indgår i mange fysiske sammenhænge. Den harmoniske oscillator illustreres
Harmonisk oscillator Thorbjørn Serritslev Nieslen Erik Warren Tindall November 27, 2007 Formål At studere den harmoniske oscillator, som indgår i mange fysiske sammenhænge. Den harmoniske oscillator illustreres
z j 2. Cauchy s formel er værd at tænke lidt nærmere over. Se på specialtilfældet 1 dz = 2πi z
 Matematik F2 - sæt 3 af 7 blok 4 f(z)dz = 0 Hovedemnet i denne uge er Cauchys sætning (den der står i denne sides hoved) og Cauchys formel. Desuden introduceres nulpunkter og singulariteter: simple poler,
Matematik F2 - sæt 3 af 7 blok 4 f(z)dz = 0 Hovedemnet i denne uge er Cauchys sætning (den der står i denne sides hoved) og Cauchys formel. Desuden introduceres nulpunkter og singulariteter: simple poler,
En sumformel eller to - om interferens
 En sumformel eller to - om interferens - fra borgeleo.dk Vi ønsker - af en eller anden grund - at beregne summen og A x = cos(0) + cos(φ) + cos(φ) + + cos ((n 1)φ) A y = sin (0) + sin(φ) + sin(φ) + + sin
En sumformel eller to - om interferens - fra borgeleo.dk Vi ønsker - af en eller anden grund - at beregne summen og A x = cos(0) + cos(φ) + cos(φ) + + cos ((n 1)φ) A y = sin (0) + sin(φ) + sin(φ) + + sin
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 14 sider Skriftlig prøve, lørdag den 12. december, 2015 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
Danmarks Tekniske Universitet Side 1 af 14 sider Skriftlig prøve, lørdag den 12. december, 2015 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE
 KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE Fysik 2, Klassisk Mekanik 2 Skriftlig eksamen 23. januar 2009 Tilladte hjælpemidler: Medbragt litteratur, noter og lommeregner Besvarelsen må
KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE Fysik 2, Klassisk Mekanik 2 Skriftlig eksamen 23. januar 2009 Tilladte hjælpemidler: Medbragt litteratur, noter og lommeregner Besvarelsen må
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side af 7 Skriftlig prøve, tirsdag den 6. december, 008, kl. 9:00-3:00 Kursus navn: ysik Kursus nr. 00 Tilladte hjælpemidler: Alle hjælpemidler er tilladt. "Vægtning": Besvarelsen
Danmarks Tekniske Universitet Side af 7 Skriftlig prøve, tirsdag den 6. december, 008, kl. 9:00-3:00 Kursus navn: ysik Kursus nr. 00 Tilladte hjælpemidler: Alle hjælpemidler er tilladt. "Vægtning": Besvarelsen
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Tirsdag d. 11. august 2015 kl
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Tirsdag d. 11. august 2015 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Tirsdag d. 11. august 2015 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og
Vektorfunktioner. (Parameterkurver) x-klasserne Gammel Hellerup Gymnasium
 Vektorfunktioner (Parameterkurver) x-klasserne Gammel Hellerup Gymnasium Indholdsfortegnelse VEKTORFUNKTIONER... Centrale begreber... Cirkler... 5 Epicykler... 7 Snurretoppen... 9 Ellipser... 1 Parabler...
Vektorfunktioner (Parameterkurver) x-klasserne Gammel Hellerup Gymnasium Indholdsfortegnelse VEKTORFUNKTIONER... Centrale begreber... Cirkler... 5 Epicykler... 7 Snurretoppen... 9 Ellipser... 1 Parabler...
KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE
 KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE Fysik 2, Klassisk mekanik 2 - ny og gammel ordning Skriftlig eksamen 25. januar 2008 Tillae hjælpemidler: Medbragt litteratur, noter og lommeregner
KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE Fysik 2, Klassisk mekanik 2 - ny og gammel ordning Skriftlig eksamen 25. januar 2008 Tillae hjælpemidler: Medbragt litteratur, noter og lommeregner
1. Kræfter. 2. Gravitationskræfter
 1 M1 Isaac Newton 1. Kræfter Vi vil starte med at se på kræfter. Vi ved fra vores hverdag, at der i mange daglige situationer optræder kræfter. Skal man fx. cykle op ad en bakke, bliver man nødt til at
1 M1 Isaac Newton 1. Kræfter Vi vil starte med at se på kræfter. Vi ved fra vores hverdag, at der i mange daglige situationer optræder kræfter. Skal man fx. cykle op ad en bakke, bliver man nødt til at
Vektorer og lineær regression
 Vektorer og lineær regression Peter Harremoës Niels Brock April 03 Planproduktet Vi har set, at man kan gange en vektor med et tal Et oplagt spørgsmål er, om man også kan gange to vektorer med hinanden
Vektorer og lineær regression Peter Harremoës Niels Brock April 03 Planproduktet Vi har set, at man kan gange en vektor med et tal Et oplagt spørgsmål er, om man også kan gange to vektorer med hinanden
Studieretningsopgave
 Virum Gymnasium Studieretningsopgave Harmoniske svingninger i matematik og fysik Vejledere: Christian Holst Hansen (matematik) og Bodil Dam Heiselberg (fysik) 30-01-2014 Indholdsfortegnelse Indledning...
Virum Gymnasium Studieretningsopgave Harmoniske svingninger i matematik og fysik Vejledere: Christian Holst Hansen (matematik) og Bodil Dam Heiselberg (fysik) 30-01-2014 Indholdsfortegnelse Indledning...
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Torsdag d. 8. august 2013 kl
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Torsdag d. 8. august 2013 kl. 9 00 13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Torsdag d. 8. august 2013 kl. 9 00 13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Vektorer og lineær regression. Peter Harremoës Niels Brock
 Vektorer og lineær regression Peter Harremoës Niels Brock April 2013 1 Planproduktet Vi har set, at man kan gange en vektor med et tal. Et oplagt spørgsmål er, om man også kan gange to vektorer med hinanden.
Vektorer og lineær regression Peter Harremoës Niels Brock April 2013 1 Planproduktet Vi har set, at man kan gange en vektor med et tal. Et oplagt spørgsmål er, om man også kan gange to vektorer med hinanden.
Afstande, skæringer og vinkler i rummet
 Afstande, skæringer og vinkler i rummet Frank Villa 2. maj 202 c 2008-20. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Indhold
Afstande, skæringer og vinkler i rummet Frank Villa 2. maj 202 c 2008-20. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Indhold
Her skal vi se lidt på de kræfter, der påvirker en pil når den affyres og rammer sit mål.
 a. Buens opbygning Her skal vi se lidt på de kræfter, der påvirker en pil når den affyres og rammer sit mål. Buen påvirker pilen med en varierende kraft, der afhænger meget af buens opbygning. For det
a. Buens opbygning Her skal vi se lidt på de kræfter, der påvirker en pil når den affyres og rammer sit mål. Buen påvirker pilen med en varierende kraft, der afhænger meget af buens opbygning. For det
Afstande, skæringer og vinkler i rummet
 Afstande, skæringer og vinkler i rummet Frank Nasser 9. april 20 c 2008-20. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her.
Afstande, skæringer og vinkler i rummet Frank Nasser 9. april 20 c 2008-20. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her.
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Torsdag d. 9. juni 2011 kl
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Torsdag d. 9. juni 2011 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Torsdag d. 9. juni 2011 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Viskositets indflydelse på dynamikken af en væskefyldt cylinder
 Viskositets indflydelse på dynamikken af en væskefyldt cylinder Udarbejdet af: Casper Weile, Christian Kjeldbjerg Kristensen, Jesper Olsen, Kim Bonde Jensen, Mikkel Sakse Bennetsen og Nanna Kerlauge Projektrapport,
Viskositets indflydelse på dynamikken af en væskefyldt cylinder Udarbejdet af: Casper Weile, Christian Kjeldbjerg Kristensen, Jesper Olsen, Kim Bonde Jensen, Mikkel Sakse Bennetsen og Nanna Kerlauge Projektrapport,
KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE
 KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE Fysik 2, Klassisk Mekanik 2 Skriftlig eksamen 16. april 2009 Tilladte hjælpemidler: Medbragt litteratur, noter og lommeregner Besvarelsen må
KØBENHAVNS UNIVERSITET NATURVIDENSKABELIG BACHELORUDDANNELSE Fysik 2, Klassisk Mekanik 2 Skriftlig eksamen 16. april 2009 Tilladte hjælpemidler: Medbragt litteratur, noter og lommeregner Besvarelsen må
Elementær Matematik. Trigonometriske Funktioner
 Elementær Matematik Trigonometriske Funktioner Ole Witt-Hansen Indhold. Gradtal og radiantal.... sin x, cos x og tan x... 3. Trigonometriske ligninger...3 4. Trigonometriske uligheder...5 5. Harmoniske
Elementær Matematik Trigonometriske Funktioner Ole Witt-Hansen Indhold. Gradtal og radiantal.... sin x, cos x og tan x... 3. Trigonometriske ligninger...3 4. Trigonometriske uligheder...5 5. Harmoniske
David Kallestrup, Aarhus School of Engineering, SRP-forløb ved Maskinteknisk retning 1
 1 Pendul David Kallestrup, Aarhus School of Engineering, SRP-forløb ved Maskinteknisk retning 1 1.1 Hvad er et pendul? En matematiker og en ingeniør ser tit ens på mange ting, men ofte er der forskelle
1 Pendul David Kallestrup, Aarhus School of Engineering, SRP-forløb ved Maskinteknisk retning 1 1.1 Hvad er et pendul? En matematiker og en ingeniør ser tit ens på mange ting, men ofte er der forskelle
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Torsdag d. 23. august 2012 kl
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Torsdag d. 23. august 2012 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Torsdag d. 23. august 2012 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og
Stamoplysninger til brug ved prøver til gymnasiale uddannelser
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Lærer(e) Termin hvori undervisningen afsluttes: Maj 2013 (12/13) Københavns
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Lærer(e) Termin hvori undervisningen afsluttes: Maj 2013 (12/13) Københavns
MATEMATIK A-NIVEAU. Kapitel 1
 MATEMATIK A-NIVEAU Vejledende eksempler på eksamensopgaver og eksamensopgaver i matematik, 01 Kapitel 1 016 MATEMATIK A-NIVEAU Vejledende eksempler på eksamensopgaver og eksamensopgaver i matematik 01
MATEMATIK A-NIVEAU Vejledende eksempler på eksamensopgaver og eksamensopgaver i matematik, 01 Kapitel 1 016 MATEMATIK A-NIVEAU Vejledende eksempler på eksamensopgaver og eksamensopgaver i matematik 01
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 11 sider Skriftlig prøve, tirsdag den 24. maj, 2016 Kursus navn Fysik 1 Kursus nr. 10024 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
Danmarks Tekniske Universitet Side 1 af 11 sider Skriftlig prøve, tirsdag den 24. maj, 2016 Kursus navn Fysik 1 Kursus nr. 10024 Varighed: 4 timer Tilladte hjælpemidler: Alle hjælpemidler tilladt "Vægtning":
Stamoplysninger til brug ved prøver til gymnasiale uddannelser
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Lærer(e) Termin hvori undervisningen afsluttes: maj-juni 2015 (14/15)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Lærer(e) Termin hvori undervisningen afsluttes: maj-juni 2015 (14/15)
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Tirsdag d. 2. juni 2015 kl
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Tirsdag d. 2. juni 2015 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Tirsdag d. 2. juni 2015 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Formelsamling til Fysik B
 Formelsamling til Fysik B Af Dann Olesen og Søren Andersen Hastighed(velocity) Densitet Tryk Arbejde Definitioner og lignende Hastighed, [ ] Strækning, [ ] Volumen(rumfang), [ ] Tryk, [ ] : Pascal Kraft,
Formelsamling til Fysik B Af Dann Olesen og Søren Andersen Hastighed(velocity) Densitet Tryk Arbejde Definitioner og lignende Hastighed, [ ] Strækning, [ ] Volumen(rumfang), [ ] Tryk, [ ] : Pascal Kraft,
Danmarks Tekniske Universitet
 Danmarks Tekniske Universitet Side 1 af 9 sider Skriftlig prøve, lørdag den 13. december, 2014 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle tilladte hjælpemidler på
Danmarks Tekniske Universitet Side 1 af 9 sider Skriftlig prøve, lørdag den 13. december, 2014 Kursus navn Fysik 1 Kursus nr. 10916 Varighed: 4 timer Tilladte hjælpemidler: Alle tilladte hjælpemidler på
Analytisk geometri. Et simpelt eksempel på dette er en ret linje. Som bekendt kan en ret linje skrives på formen
 Analtisk geometri Mike Auerbach Odense 2015 Den klassiske geometri beskæftiger sig med alle mulige former for figurer: Linjer, trekanter, cirkler, parabler, ellipser osv. I den analtiske geometri lægger
Analtisk geometri Mike Auerbach Odense 2015 Den klassiske geometri beskæftiger sig med alle mulige former for figurer: Linjer, trekanter, cirkler, parabler, ellipser osv. I den analtiske geometri lægger
Undervisningsplan Udarbejdet af Kim Plougmann Povlsen d. 2015.01.19 Revideret af
 Undervisningsplan Udarbejdet af Kim Plougmann Povlsen d. 2015.01.19 Revideret af Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Termin hvori undervisningen afsluttes:
Undervisningsplan Udarbejdet af Kim Plougmann Povlsen d. 2015.01.19 Revideret af Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Termin hvori undervisningen afsluttes:
Opgave 1 Opskriv følgende vinkler i radianer 180, 90, 135, 270, 60, 30.
 Opgaver Polære koordinater Opgave 1 Opskriv følgende vinkler i radianer 180, 90, 15, 70, 60, 0. Opgave Bestem sin π Opgave. Et punkt p i xy-planen er givet ved de kartesiske koordinater,. Bestem p s polære
Opgaver Polære koordinater Opgave 1 Opskriv følgende vinkler i radianer 180, 90, 15, 70, 60, 0. Opgave Bestem sin π Opgave. Et punkt p i xy-planen er givet ved de kartesiske koordinater,. Bestem p s polære
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser
 Undervisningsbeskrivelse 2015.09.22 Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin 2014-2016 Institution HANSENBERG Gymnasium Uddannelse Fag og niveau Lærer(e) Hold Htx Fysik A John
Undervisningsbeskrivelse 2015.09.22 Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin 2014-2016 Institution HANSENBERG Gymnasium Uddannelse Fag og niveau Lærer(e) Hold Htx Fysik A John
Stamoplysninger til brug ved prøver til gymnasiale uddannelser
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Lærer(e) Termin hvori undervisningen afsluttes: maj-juni 2011 (10/11)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Lærer(e) Termin hvori undervisningen afsluttes: maj-juni 2011 (10/11)
Vinkelrette linjer. Frank Villa. 4. november 2014
 Vinkelrette linjer Frank Villa 4. november 2014 Dette dokument er en del af MatBog.dk 2008-2012. IT Teaching Tools. ISBN-13: 978-87-92775-00-9. Se yderligere betingelser for brug her. Indhold 1 Introduktion
Vinkelrette linjer Frank Villa 4. november 2014 Dette dokument er en del af MatBog.dk 2008-2012. IT Teaching Tools. ISBN-13: 978-87-92775-00-9. Se yderligere betingelser for brug her. Indhold 1 Introduktion
Matlab script - placering af kran
 Matlab script - placering af kran 1 Til at beregne den ideelle placering af kranen hos MSK, er der gjort brug af et matlab script. Igennem dette kapitel vil opbygningen af dette script blive gennemgået.
Matlab script - placering af kran 1 Til at beregne den ideelle placering af kranen hos MSK, er der gjort brug af et matlab script. Igennem dette kapitel vil opbygningen af dette script blive gennemgået.
Projektopgave 1. Navn: Jonas Pedersen Klasse: 3.4 Skole: Roskilde Tekniske Gymnasium Dato: 5/ Vejleder: Jørn Christian Bendtsen Fag: Matematik
 Projektopgave 1 Navn: Jonas Pedersen Klasse:.4 Skole: Roskilde Tekniske Gymnasium Dato: 5/9-011 Vejleder: Jørn Christian Bendtsen Fag: Matematik Indledning Jeg har i denne opgave fået følgende opstilling.
Projektopgave 1 Navn: Jonas Pedersen Klasse:.4 Skole: Roskilde Tekniske Gymnasium Dato: 5/9-011 Vejleder: Jørn Christian Bendtsen Fag: Matematik Indledning Jeg har i denne opgave fået følgende opstilling.
Aalborg Universitet. Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik. Torsdag d. 7. august 2014 kl
 Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Torsdag d. 7. august 2014 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Aalborg Universitet Skriftlig eksamen i Grundlæggende Mekanik og Termodynamik Torsdag d. 7. august 2014 kl. 9 00-13 00 Ved bedømmelsen vil der blive lagt vægt på argumentationen (som bør være kort og præcis),
Opgaveformuleringer til studieprojekt - Matematik og andet/andre fag:
 Opgaveformuleringer til studieprojekt - Matematik og andet/andre fag: Fag: Matematik/Historie Emne: Det gyldne snit og Fibonaccitallene Du skal give en matematisk behandling af det gyldne snit. Du skal
Opgaveformuleringer til studieprojekt - Matematik og andet/andre fag: Fag: Matematik/Historie Emne: Det gyldne snit og Fibonaccitallene Du skal give en matematisk behandling af det gyldne snit. Du skal
Udledning af den barometriske højdeformel. - Beregning af højde vha. trykmåling. af Jens Lindballe, Silkeborg Gymnasium
 s.1/5 For at kunne bestemme cansatsondens højde må vi se på, hvorledes tryk og højde hænger sammen, når vi bevæger os opad i vores atmosfære. I flere fysikbøger kan man læse om den Barometriske højdeformel,
s.1/5 For at kunne bestemme cansatsondens højde må vi se på, hvorledes tryk og højde hænger sammen, når vi bevæger os opad i vores atmosfære. I flere fysikbøger kan man læse om den Barometriske højdeformel,
Newtons love - bevægelsesligninger - øvelser. John V Petersen
 Newtons love - bevægelsesligninger - øvelser John V Petersen Newtons love 2016 John V Petersen art-science-soul Indhold 1. Indledning og Newtons love... 4 2. Integration af Newtons 2. lov og bevægelsesligningerne...
Newtons love - bevægelsesligninger - øvelser John V Petersen Newtons love 2016 John V Petersen art-science-soul Indhold 1. Indledning og Newtons love... 4 2. Integration af Newtons 2. lov og bevægelsesligningerne...
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2020 Institution Rybners-HTX (Teknisk gymnasium), Rybners Uddannelse Fag og niveau Lærer(e) Hold HTX
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2020 Institution Rybners-HTX (Teknisk gymnasium), Rybners Uddannelse Fag og niveau Lærer(e) Hold HTX
Resumé fra sidst. Stjernerne i bulen er mere metalrige end i skiven
 Galakser 2014 F3 1 Resumé fra sidst Mælkevejen består grundlæggende af en skive, en bule og en halo. Solen befinder sig sammen med spiralarmene i skiven i en afstand af ca. 8.0 kpc fra centrum af galaksen.
Galakser 2014 F3 1 Resumé fra sidst Mælkevejen består grundlæggende af en skive, en bule og en halo. Solen befinder sig sammen med spiralarmene i skiven i en afstand af ca. 8.0 kpc fra centrum af galaksen.
Matematiske hjælpemidler. Koordinater. 2.1 De mange bredder.
 2. Matematiske hjælpemidler. Koordinater. 2.1 De mange bredder. 2.1 I Figur 1.1 i kapitel 1 er der vist et ideelt Kartesiske eller Euklidiske koordinatsystem, med koordinater ( X, Y, Z) = ( X 1, X 2, X
2. Matematiske hjælpemidler. Koordinater. 2.1 De mange bredder. 2.1 I Figur 1.1 i kapitel 1 er der vist et ideelt Kartesiske eller Euklidiske koordinatsystem, med koordinater ( X, Y, Z) = ( X 1, X 2, X
Formelsamling til fysik 11. Sebastian B. Simonsen, Asger B. Hansen og Lykke Pedersen
 Formelsamling til fysik 11 Sebastian B. Simonsen, Asger B. Hansen og Lykke Pedersen 1 CONTENTS 2 Contents 1 Kap.1 - The foundation af Classical Mechanics (1) 4 1.1 Galileo (2).............................
Formelsamling til fysik 11 Sebastian B. Simonsen, Asger B. Hansen og Lykke Pedersen 1 CONTENTS 2 Contents 1 Kap.1 - The foundation af Classical Mechanics (1) 4 1.1 Galileo (2).............................
1. Bevægelse med luftmodstand
 Programmering i TI nspire. Michael A. D. Møller. Marts 2018. side 1/7 1. Bevægelse med luftmodstand Formål a) At lære at programmere i Basic. b) At bestemme stedbevægelsen for et legeme, der bevæger sig
Programmering i TI nspire. Michael A. D. Møller. Marts 2018. side 1/7 1. Bevægelse med luftmodstand Formål a) At lære at programmere i Basic. b) At bestemme stedbevægelsen for et legeme, der bevæger sig
Andengradsligninger. Frank Nasser. 11. juli 2011
 Andengradsligninger Frank Nasser 11. juli 2011 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Indhold 1 Introduktion
Andengradsligninger Frank Nasser 11. juli 2011 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Indhold 1 Introduktion
Tilhørende: Robert Nielsen, 8b. Geometribog. Indeholdende de vigtigste og mest basale begreber i den geometriske verden.
 Tilhørende: Robert Nielsen, 8b Geometribog Indeholdende de vigtigste og mest basale begreber i den geometriske verden. 1 Polygoner. 1.1 Generelt om polygoner. Et polygon er en figur bestående af mere end
Tilhørende: Robert Nielsen, 8b Geometribog Indeholdende de vigtigste og mest basale begreber i den geometriske verden. 1 Polygoner. 1.1 Generelt om polygoner. Et polygon er en figur bestående af mere end
Andengradsligninger. Frank Nasser. 12. april 2011
 Andengradsligninger Frank Nasser 12. april 2011 c 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Bemærk: Dette
Andengradsligninger Frank Nasser 12. april 2011 c 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Bemærk: Dette
Formelsamling i astronomi. Februar 2016
 Formelsamling i astronomi. Februar 016 Formelsamlingen er ikke komplet det bliver den nok aldrig. Men måske kan alligevel være til en smule gavn. Sammenhæng mellem forskellige tidsenheder Jordens sideriske
Formelsamling i astronomi. Februar 016 Formelsamlingen er ikke komplet det bliver den nok aldrig. Men måske kan alligevel være til en smule gavn. Sammenhæng mellem forskellige tidsenheder Jordens sideriske
Rækkeudvikling - Inertialsystem. John V Petersen
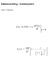 Rækkeudvikling - Inertialsystem John V Petersen Rækkeudvikling inertialsystem 2017 John V Petersen art-science-soul Vi vil undersøge om inertiens lov, med tilnærmelse, gælder i et koordinatsytem med centrum
Rækkeudvikling - Inertialsystem John V Petersen Rækkeudvikling inertialsystem 2017 John V Petersen art-science-soul Vi vil undersøge om inertiens lov, med tilnærmelse, gælder i et koordinatsytem med centrum
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Termin Juni 119 Institution Erhvervsskolerne Aars Uddannelse Fag og niveau Lærere Hold Fysik B Michael Stenner (mst) Patrick Bøgsted Sørensen (pbs) 1k18 1k18 htx Forløbsoversigt
Undervisningsbeskrivelse Termin Juni 119 Institution Erhvervsskolerne Aars Uddannelse Fag og niveau Lærere Hold Fysik B Michael Stenner (mst) Patrick Bøgsted Sørensen (pbs) 1k18 1k18 htx Forløbsoversigt
Impuls og kinetisk energi
 Impuls og kinetisk energi Peter Hoberg, Anton Bundgård, and Peter Kongstad Hold Mix 1 (Dated: 7. oktober 2015) 201405192@post.au.dk 201407987@post.au.dk 201407911@post.au.dk 2 I. INDLEDNING I denne øvelse
Impuls og kinetisk energi Peter Hoberg, Anton Bundgård, and Peter Kongstad Hold Mix 1 (Dated: 7. oktober 2015) 201405192@post.au.dk 201407987@post.au.dk 201407911@post.au.dk 2 I. INDLEDNING I denne øvelse
Hvorfor bevæger lyset sig langsommere i fx glas og vand end i det tomme rum?
 Hvorfor bevæger lyset sig langsommere i fx glas og vand end i det tomme rum? - om fysikken bag til brydningsindekset Artiklen er udarbejdet/oversat ud fra især ref. 1 - fra borgeleo.dk Det korte svar:
Hvorfor bevæger lyset sig langsommere i fx glas og vand end i det tomme rum? - om fysikken bag til brydningsindekset Artiklen er udarbejdet/oversat ud fra især ref. 1 - fra borgeleo.dk Det korte svar:
Grafmanipulation. Frank Nasser. 14. april 2011
 Grafmanipulation Frank Nasser 14. april 2011 c 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Bemærk: Dette er
Grafmanipulation Frank Nasser 14. april 2011 c 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Bemærk: Dette er
Pointen med Differentiation
 Pointen med Differentiation Frank Nasser 20. april 2011 c 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Bemærk:
Pointen med Differentiation Frank Nasser 20. april 2011 c 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Bemærk:
RKS Yanis E. Bouras 21. december 2010
 Indhold 0.1 Indledning.................................... 1 0.2 Løsning af 2. ordens linære differentialligninger................ 2 0.2.1 Sætning 0.2............................... 2 0.2.2 Bevis af sætning
Indhold 0.1 Indledning.................................... 1 0.2 Løsning af 2. ordens linære differentialligninger................ 2 0.2.1 Sætning 0.2............................... 2 0.2.2 Bevis af sætning
Lineære systemer med hukommelse.
 Lineær Response Teori. I responseteorien interesserer man sig for, hvad der kan siges generelt om sammenhængen mellem input φ(t) og output γ(t) for et system. Valg af variable. Det betragtede systems forskellige
Lineær Response Teori. I responseteorien interesserer man sig for, hvad der kan siges generelt om sammenhængen mellem input φ(t) og output γ(t) for et system. Valg af variable. Det betragtede systems forskellige
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2016 Institution Uddannelse Fag og niveau Lærer(e) Hold Rybners htx Fysik A Lars Husum (lmh) FYSIK 3.A.
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2016 Institution Uddannelse Fag og niveau Lærer(e) Hold Rybners htx Fysik A Lars Husum (lmh) FYSIK 3.A.
Notesæt - Eksempler på polær integration
 Notesæt - Eksempler på polær integration Mikkel Findinge Bemærk, at der kan være sneget sig fejl ind. Kontakt mig endelig, hvis du skulle falde over en sådan. Dette dokument forsøger blot at forklare,
Notesæt - Eksempler på polær integration Mikkel Findinge Bemærk, at der kan være sneget sig fejl ind. Kontakt mig endelig, hvis du skulle falde over en sådan. Dette dokument forsøger blot at forklare,
Jævn cirkelbevægelse udført med udstyr fra Vernier
 Fysikøvelse - Erik Vestergaard www.matematikfysik.dk 1 Jævn cirkelbevægelse udført med udstyr fra Vernier Formål Formålet med denne øvelse er at eftervise følgende formel for centripetalkraften på et legeme,
Fysikøvelse - Erik Vestergaard www.matematikfysik.dk 1 Jævn cirkelbevægelse udført med udstyr fra Vernier Formål Formålet med denne øvelse er at eftervise følgende formel for centripetalkraften på et legeme,
Faldmaskine. Esben Bork Hansen Amanda Larssen Martin Sven Qvistgaard Christensen. 23. november 2008
 Faldmakine Eben Bork Hanen Amanda Laren Martin Sven Qvitgaard Chritenen 23. november 2008 Indhold Formål 3 2 Optilling 3 2. Materialer............................... 3 2.2 Optilling...............................
Faldmakine Eben Bork Hanen Amanda Laren Martin Sven Qvitgaard Chritenen 23. november 2008 Indhold Formål 3 2 Optilling 3 2. Materialer............................... 3 2.2 Optilling...............................
Opdrift i vand og luft
 Fysikøvelse Erik Vestergaard www.matematikfysik.dk Opdrift i vand og luft Formål I denne øvelse skal vi studere begrebet opdrift, som har en version i både en væske og i en gas. Vi skal lave et lille forsøg,
Fysikøvelse Erik Vestergaard www.matematikfysik.dk Opdrift i vand og luft Formål I denne øvelse skal vi studere begrebet opdrift, som har en version i både en væske og i en gas. Vi skal lave et lille forsøg,
Besvarelser til Calculus Ordinær eksamen - Efterår - 8. Januar 2016
 Besvarelser til Calculus Ordinær eksamen - Efterår - 8. Januar 16 Mikkel Findinge Bemærk, at der kan være sneget sig fejl ind. Kontakt mig endelig, hvis du skulle falde over en sådan. Dette dokument har
Besvarelser til Calculus Ordinær eksamen - Efterår - 8. Januar 16 Mikkel Findinge Bemærk, at der kan være sneget sig fejl ind. Kontakt mig endelig, hvis du skulle falde over en sådan. Dette dokument har
Deformation af stålbjælker
 Deformation af stålbjælker Af Jimmy Lauridsen Indhold 1 Nedbøjning af bjælker... 1 1.1 Elasticitetsmodulet... 2 1.2 Inertimomentet... 4 2 Formelsamling for typiske systemer... 8 1 Nedbøjning af bjælker
Deformation af stålbjælker Af Jimmy Lauridsen Indhold 1 Nedbøjning af bjælker... 1 1.1 Elasticitetsmodulet... 2 1.2 Inertimomentet... 4 2 Formelsamling for typiske systemer... 8 1 Nedbøjning af bjælker
π er irrationel Frank Nasser 10. december 2011
 π er irrationel Frank Nasser 10. december 2011 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Indhold 1 Introduktion
π er irrationel Frank Nasser 10. december 2011 2008-2011. Dette dokument må kun anvendes til undervisning i klasser som abonnerer på MatBog.dk. Se yderligere betingelser for brug her. Indhold 1 Introduktion
Lavet af Ellen, Sophie, Laura Anna, Mads, Kristian og Mathias Fysikrapport blide forsøg Rapport 6, skråt kast med blide Formål Formålet med f
 Rapport 6, skråt kast med blide Formål Formålet med forsøget er at undersøge det skrå kast, bl.a. med fokus på starthastighed, elevation og kastevidde. Teori Her følger der teori over det skrå kast Bevægelse
Rapport 6, skråt kast med blide Formål Formålet med forsøget er at undersøge det skrå kast, bl.a. med fokus på starthastighed, elevation og kastevidde. Teori Her følger der teori over det skrå kast Bevægelse
Institut for Matematik, DTU: Gymnasieopgave. Arealmomenter
 Arealmomenter af. og. orden side Institut for Matematik, DTU: Gymnasieopgave Arealmomenter Teori: Se lærebøgerne i faget Statiske konstruktionsmodeller og EDB. Se også H&OL bind,., samt bind appendix.3,
Arealmomenter af. og. orden side Institut for Matematik, DTU: Gymnasieopgave Arealmomenter Teori: Se lærebøgerne i faget Statiske konstruktionsmodeller og EDB. Se også H&OL bind,., samt bind appendix.3,
Bevægelsens Geometri
 Bevægelsens Geometri Vi vil betragte bevægelsen af et punkt. Dette punkt kan f.eks. være tyngdepunktet af en flue, et menneske, et molekyle, en galakse eller hvad man nu ellers har lyst til at beskrive.
Bevægelsens Geometri Vi vil betragte bevægelsen af et punkt. Dette punkt kan f.eks. være tyngdepunktet af en flue, et menneske, et molekyle, en galakse eller hvad man nu ellers har lyst til at beskrive.
Statik og styrkelære
 Bukserobot Statik og styrkelære Refleksioner over hvilke styrkemæssige udfordringer en given last har på den valgte konstruktion. Hvilke ydre kræfter påvirker konstruktionen og hvor er de placeret Materialer
Bukserobot Statik og styrkelære Refleksioner over hvilke styrkemæssige udfordringer en given last har på den valgte konstruktion. Hvilke ydre kræfter påvirker konstruktionen og hvor er de placeret Materialer
