Vejledning om biomedicinske forsøg
|
|
|
- Martin Andresen
- 7 år siden
- Visninger:
Transkript
1 Vejledning om biomedicinske forsøg Denne vejledning er henvendt til læger og andre fagpersoner, der deltager i planlægningen og afviklingen af biomedicinske forsøg med mennesker. Publikationen indeholder praktiske anvisninger vedrørende de videnskabsetiske aspekter ved biomedicinske forskningsprojekter. Beskrivelsen dækker alle faser fra den indledende planlægning af projekter til kontrol med løbende projekter og opfølgende information til forsøgspersoner. Vejledningen omfatter blandt andet: Planlægning af biomedicinske forsøg Forskerens etiske overvejelser Anmeldelse til de videnskabsetiske komiteer Krav til information og samtykke Særlige forsøgssituationer og stedfortrædende samtykke Opfølgning på forsøg De videnskabsetiske komiteers kontrol med godkendte forskningsprojekter. Vejledningen er knyttet til Forskningsministeriets bekendtgørelse om information og samtykke ved inddragelse af forsøgspersoner i biomedicinske forskningsprojekter, der er optrykt som bilag til publikationen. Vejledning om biomedicinske forsøg
2 Vejledning om biomedicinske forsøg Vejledning om information og samtykke ved inddragelse af forsøgspersoner i biomedicinske forskningsprojekter og om anmeldelse og bedømmelse af forskningsprojekter i det videnskabsetiske komitésystem Forskningsministeriet November 2000
3 Vejledning om biomedicinske forsøg Vejledning om information og samtykke ved inddragelse af forsøgspersoner i biomedicinske forskningsprojekter og om anmeldelse og bedømmelse af forskningsprojekter i det videnskabsetiske komitésystem Publikationen kan købes ved henvendelse til: Statens Information Postboks København K Tlf Fax E-post sp@si.dk Pris ved løssalg 60,- kroner inkl. moms Publikationen kan også hentes på Forskningsministeriets hjemmeside ISBN (Internet): Udgivet af: Forskningsministeriet Bredgade København K Tlf Fax E-post fsk@fsk.dk Tryk: K. Larsen & Søn A/S Oplag: ISBN:
4 INDHOLD 7 Indledning 9 Det videnskabsetiske komitésystem 9 Formål og opgaver 9 Opbygning 11 Grundlæggende etiske overvejelser 13 Hvilke forskningsprojekter er omfattet? 14 Biomedicinske forskningsprojekter 14 Forsøg med kliniske behandlingsmetoder 15 Nærmere afgrænsning af biomedicinsk forskning 16 Komiteernes kompetence 16 Registerforskningsprojekter 18 Spørgeskemaundersøgelser 19 Biobanker med organisk materiale 19 Forsøg med menneskelige kønsceller, befrugtede æg og fostre 20 Forsøg med ubefrugtede æg 21 Forsøg med sæd
5 21 Forsøg med befrugtede æg og fostre 22 Tvivl om anmeldelsespligten 22 Anmeldelse til Datatilsynet 23 Hvad skal forsøgsprotokollen indeholde? 27 Den normale forsøgssituation 29 Den særlige forsøgssituation 33 Udformning af information til forsøgspersoner 34 Formelle krav til informationen 35 Informationens indhold 43 Supplerende information til forsøgspatienter 45 Krav til forsøgspersoners samtykke 45 Generelle krav 47 Stedfortrædende samtykke 49 Forskning på mindreårige 49 Varigt inhabile 49 Midlertidigt inhabile 50 Samtykke fra institutionsanbragte, frihedsberøvede og lignende 51 Forskning på døde
6 51 Efterfølgende samtykke 53 Opdatering af information og samtykke 53 Nyt vedrørende forsøgspersonen 54 Nyt vedrørende forsøget 55 Kontrol med forskningsprojekter 55 Database som grundlag for kontrol 55 Kontrol af forsøgets gennemførelse 57 Kontrol af information til forsøgspersoner 57 Kontrol af økonomiske oplysninger 59 Bilag 1: Bekendtgørelse om information og samtykke ved inddragelse af forsøgspersoner i biomedicinske forskningsprojekter
7 6
8 INDLEDNING Denne vejledning udstedes af Forskningsministeriet og er resultatet at et udvalgsarbejde, som har haft deltagelse af repræsentanter for Den Centrale Videnskabsetiske Komité. Vejledningen bygger på bestemmelserne i lov nr. 503 af 24. juni 1992, jf. lovbekendtgørelse nr. 69 af 8. januar 1999, om et videnskabsetisk komitésystem og behandling af biomedicinske forskningsprojekter ( komitéloven eller loven herefter) og bekendtgørelse af 12. oktober 2000 om information og samtykke ved inddragelse af forsøgspersoner i biomedicinske forskningsprojekter ( bekendtgørelsen herefter). Bekendtgørelsen er optrykt som bilag til denne publikation. Vejledningen bygger desuden på de principper for biomedicinske forsøgs anmeldelse og tilladelse, som hidtil er fremgået af Den Centrale Videnskabsetiske Komités rekommendationer. Vejledningen retter sig først og fremmest til de videnskabsetiske komiteer, der skal bedømme og godkende biomedicinske forskningsprojekter. Derudover er vejledningen tænkt som et praktisk hjælpemiddel til de forskere, der udfører biomedicinske forskningsprojekter. Formålet med vejledningen er at udfylde de retligt bindende rammer, der fremgår af komitéloven og bekendtgørelsen. Vejledningen indeholder derfor, ud over en nøjere beskrivelse af regelgrundlaget, en række praktiske retningslinier, der er umiddelbart anvendelige for tilrettelæggelsen af biomedicinske forskningsprojekter, og som er nødvendige for et sikre en etisk forsvarlig behandling af forsøgspersoner. Desuden beskrives en række praktiske forhold vedrørende biomedicinske forsøgs anmeldelse og tilladelse. For yderligere information henvises til de regionale videnskabsetiske komiteer. 7
9 8
10 DET VIDENSKABSETISKE KOMITÉSYSTEM Formål og opgaver Komitéloven har til formål at fastlægge de retlige rammer for den videnskabsetiske bedømmelse af biomedicinske forskningsprojekter. Det videnskabsetiske komitésystems opgave er at sikre beskyttelsen af forsøgspersoner, der deltager i biomedicinske forskningsprojekter, samtidig med at der skabes mulighed for udvikling af ny, værdifuld viden. Beskyttelsen af forsøgspersoner er således det centrale formål med de videnskabsetiske komiteers virksomhed. De videnskabsetiske komiteer godkender biomedicinske forskningsprojekter på baggrund af forskeres forudgående anmeldelse. Forskeren skal indsende en forsøgsprotokol, som beskriver forsøget og de etiske problemer, forsøget kan medføre. Komiteerne påser, at forskningsprojekter afvikles i overensstemmelse med den meddelte tillladelse. Komiteerne følger desuden løbende udviklingen inden for den biomedicinske forskning og virker for udbredelsen af kendskabet til de etiske problemer, der kan være forbundet hermed. Opbygning Det videnskabsetiske komitésystem består af et antal regionale komiteer og en central komité. Den regionale komité nedsættes af amtsrådet (herunder Frederiksberg og Københavns kommunalbestyrelser) eller i samarbejde mellem flere amtsråd. 9
11 En regional komité består af mindst syv medlemmer, hvoraf de tre indstilles af Statens Sundhedsvidenskabelige Forskningsråd. Skønner amtsrådet, at hensynet til komiteens virke, projekternes antal eller andre grunde taler derfor, kan antallet af komitémedlemmer udvides til 9, 11, 13 eller 15. I givet fald udvides antallet af medlemmer indstillet af Statens Sundhedsvidenskabelige Forskningsråd til henholdsvis fire, fem, seks eller syv. Der er således altid en overvægt af lægpersoner i komiteerne. Medlemmerne er udpeget for den kommunale valgperiode, og genudpegning kan ske én gang. Den regionale komité vælger selv sin formand og næstformand. Den Centrale Videnskabsetiske Komité er nedsat af forskningsministeren. Komiteen består af to medlemmer udpeget af hver af de regionale komiteer. Forskningsministeren og sundhedsministeren udpeger derudover hver to medlemmer. Den Centrale Videnskabsetiske Komité vælger selv sin formand og næstformand. 10
12 GRUNDLÆGGENDE ETISKE OVERVEJELSER Hovedformålet med bekendtgørelsen og vejledningen er at opstille klare og entydige regler for beskyttelsen af forsøgspersoner i forsøgssituationen. Reglerne bygger på den grundlæggende antagelse, at ethvert menneske er i besiddelse af en personlig integritet - forstået som en menneskelig værdighed - som skal respekteres. Myndige, habile mennesker besidder tillige en personlig selvbestemmelsesret eller autonomi, der er en helt nødvendig forudsætning for deltagelse i et biomedicinsk forsøg. Hvis forsøgspersonens autonomi på den ene eller anden måde er begrænset, skal der være særligt stærke argumenter for at gennemføre forskning på den pågældende. Hvis en sådan tilladelse alligevel gives, skal en ekstra beskyttelse af forsøgspersonen træde i kraft under forsøgets afvikling. I bekendtgørelsen opstilles en række krav, der alle skal være opfyldt, før man kan tale om et frivilligt, informeret samtykke. For det første skal forsøgspersonen have tilstrækkelige forudsætninger for at kunne forstå informationen og konsekvenserne af forsøgsdeltagelsen. For det andet skal forsøgspersonen modtage information om forsøget, således at vedkommende er tilstrækkeligt informeret til at kunne foretage sit valg. Endelig skal samtykket være frivilligt, hvilket vil sige, at det skal være afgivet uden nogen form for manipulation eller pression. Det skal fremhæves, at ikke alene lovens og bekendtgørelsens detaljerede regler, men også disse bagvedliggende principper altid bør være præsente hos forskeren. Til tider vil forskerens og forsøgspersonens interesser være modsatrettede. Forskeren kan have sin opmærksomhed rettet mod selve forskningsprojektet og måske særligt mod målet om opnåelsen af ny viden, hvorimod forsøgspersonen ofte vil have en snævrere interesse, typisk i en afhjælpelse af den pågældendes sygdom. Der påhviler i disse 11
13 situationer forskeren et ansvar for altid at lade omsorgen for forsøgspersonen gå forud for forskningsprojektet. Forskerens etiske overvejelser skal fremgå af et særligt afsnit i det materiale vedrørende projektet, der indsendes til den videnskabsetiske komité (se afsnittet Hvad skal forsøgsprotokollen indeholde? herom). 12
14 HVILKE FORSKNINGSPROJEKTER ER OMFATTET? Ifølge komitélovens 6, stk. 1, skal ethvert biomedicinsk forskningsprojekt, der indebærer forsøg på a. levendefødte menneskelige individer, b. menneskelige kønsceller, der agtes anvendt til befrugtning, menneskelige befrugtede æg, fosteranlæg og fostre, c. væv, celler og arvebestanddele fra mennesker, fostre og lignende og d. afdøde anmeldes til den regionale videnskabsetiske komité for det område, hvori den projektansvarlige virker. Ifølge lovens 6, stk. 2, gælder det samme for forskningsprojekter, hvori biomedicinsk forskning udgør en væsentlig bestanddel af det samlede projekt. Spørgeskemaundersøgelser og registerforskningsprojekter skal ifølge komitélovens 6, stk. 3, kun anmeldes, såfremt projektet indeholder et væsentligt element af biomedicinsk forskning eller udgør en del af et projekt, som indeholder et væsentligt element af biomedicinsk forskning, og såfremt projektet for den enkelte forsøgsperson indebærer sundhedsmæssige risici eller på anden måde kan være til belastning for den pågældende forsøgsperson. Pilotforsøg behandles videnskabsetisk på samme måde som andre forsøg. Ved pilotforsøg, -serie eller -projekt forstås her den indledende del af en planlagt undersøgelse, som hviler på en forsøgsprotokol, og som gennemføres som led i en initial afprøvning af metoder, sikkerhed, procedurer og så videre i forbindelse med projekter. I det følgende omtales nærmere, hvilke krav der skal være opfyldt, for at et projekt skal anmeldes til en regional videnskabsetisk komité. 13
15 Biomedicinske forskningsprojekter Kun biomedicinske forskningsprojekter, eller projekter hvori biomedicinsk forskning udgør en væsentlig bestanddel, skal anmeldes til en videnskabsetisk komité. Ved biomedicin forstås, jf. bekendtgørelsens 2, stk. 1, den disciplin, der som sit genstandsfelt har menneskets biologiske og psykologiske processer samt menneskelige sygdommes opståen, udbredelse, forebyggelse, diagnostik og behandling. Ved forskningsprojekt forstås en planlagt virksomhed, der har til formål at opnå en generel viden, som kan komme flere personer til gode end blot de deltagende forsøgspersoner. Det fremgår af ovenstående, at der for anmeldelsespligtige biomedicinske forskningsprojekter tillige skal være tale om forsøg på 1. levendefødte menneskelige individer, 2. menneskelige kønsceller, der agtes anvendt til befrugtning, menneskelige befrugtede æg, fosteranlæg og fostre, 3. væv, celler og arvebestanddele fra mennesker, fostre og lignende, eller 4. afdøde. Forskning på blod, sekreter med videre er også omfattet af dette. Forsøg med kliniske behandlingsmetoder 14 Som det fremgår af definitionen herover, er et forskningsprojekt blandt andet karakteriseret ved, at det frembringer ny original viden. Når en forsker overvejer, om en ny behandling skal anmeldes som et projekt til en videnskabsetisk komité, eller om den nye behandling kan ibrugtages (behandlingsforsøg), bør der derfor lægges afgørende vægt på, om eventuelle foreliggende oplysninger eller undersøgelser allerede på en
16 tilfredsstillende måde belyser den nye behandlings effekt, bivirkninger og risici. Anmeldelse til en videnskabsetisk komité og udarbejdelse af en protokol kan undlades, hvis der foreligger omfattende kliniske erfaringer, der på en overbevisende måde belyser effekt, bivirkninger og ricisi ved behandlingen. Hvis dette ikke er tilfældet, skal der udarbejdes en protokol vedrørende behandlingen, og behandlingen anmeldes til den videnskabsetiske komité. Hvis der er tvivl om de faglige resultater, der ligger til grund for indførelse af en ny behandling, bør der altid udarbejdes en forsøgsprotokol, og projektet/behandlingen bør anmeldes til en videnskabsetisk komité. Hvis der i forbindelse med den nye behandlings indførelse samtidig iværksættes undersøgelser eller andre procedurer, der er mere indgribende end hensynet til det bedst mulige behandlingsresultat tilsiger, bør projektet anmeldes til en videnskabsetisk komité. I Sundhedsstyrelsens vejledning af 2. juli 1999 om indførelse af nye behandlinger i sundhedsvæsenet findes yderligere eksempler på, hvornår anvendelsen af nye kliniske behandlingsmetoder kræver et formelt forsøgsregi og dermed anmeldelse til det videnskabsetiske komitésystem. Nærmere afgrænsning af biomedicinsk forskning Alle projekter, der befinder sig inden for biomedicin og forskning som ovenfor defineret, skal anmeldes til en videnskabsetisk komité. Dette indebærer, at projekter inden for samfundsvidenskab, sociologi med videre, der ikke indeholder væsentlige elementer af biomedicin, som altovervejende hovedregel ikke skal anmeldes. 15
17 Komiteerne vurderer konkret, hvorvidt forskningsprojekter med hovedvægten inden for antropologi, tilfredshedsundersøgelser, personaladfærdsundersøgelser, sundhedsøkonomiske beregninger med videre er anmeldelsespligtige. Tilsvarende skal medicinalstatistik, administrative opgørelser, medicinsk teknologivurdering, kvalitetssikring og ny behandling (behandlingsforsøg) med videre, som i udgangspunktet ikke henhører under forskning som ovenfor defineret, normalt ikke anmeldes. Undervisningsopgaver med videre kan være omfattet af definitionen af biomedicinsk forskning, og komiteerne vurderer konkret, hvorvidt sådanne er anmeldelsespligtige. Komiteerne anvender et ensartet bedømmelsesgrundlag, uanset hvilken faggruppe der skal udføre projektet. Komiteernes kompetence Komiteerne har ifølge loven alene kompetence til at godkende forskningsprojekter, der foregår i Danmark, og hvor projektlederen har sit arbejdssted her i landet. Hvis et projekt foregår både i og udenfor Danmark, skal alene den del af projektet, der foregår i Danmark, godkendes af en dansk videnskabsetisk komité og efter komitélovens bestemmelser. Anmeldelsen skal ske til den regionale komité, hvor projektlederen har sit arbejdssted. Registerforskningsprojekter 16 Registerforskningsprojekter skal kun anmeldes til en regional videnskabsetisk komité, såfremt projektet eller en del heraf indeholder et væsentligt element af biomedicinsk forskning, og såfremt projektet indebærer sundhedsmæssige risici eller på anden måde kan være til belastning for den enkelte forsøgsperson.
18 Biobanker er den overordnede betegnelse for alle informationssamlinger, som hidrører fra sundhedsvæsenets kliniske arbejde med eller udforskning af mennesket og dets sygdomme, hvad enten de indeholdes med ord, tal, DNA-koder, antigener, antistoffer, morfologiske, biokemiske, fysiologiske eller biofysiske karakteristika. Forskningsprojekter, som betjener sig af udtræk fra biobanker, er som udgangspunkt at betragte som registerforskning. Dette betyder blandt andet, at komiteerne i særlige tilfælde kan dispensere fra lovens informations- og samtykkekrav, jf. komitélovens 8, stk. 3. Hvis der er en direkte forbindelse mellem biobanken og forskning, for eksempel hvor biobanken er opbygget med et konkret forskningsprojekt for øje, skal forsøgspersoner som udgangspunkt afgive informeret samtykke til deltagelse efter bekendtgørelsens almindelige regler herom. Oprettelsen af nye biobanker med tanke på senere anvendelse til forskningsformål skal straks anmeldes til Datatilsynet. Først ved en senere anvendelse i et konkret projekt skal dette anmeldes til en videnskabsetisk komité (om biobanker med organisk materiale, se afsnittet Biobanker med organisk materiale ). Ved oprettelse af en række biobanker er det ikke på forhånd afgjort, om disse senere skal anvendes i forskningsmæssig sammenhæng. For at give patienten mulighed for at tage stilling til, om oplysninger og materiale, der er indsamlet i forbindelse med behandlingen af patienten, senere kan indgå i et forsøg, bør patienten i forbindelse med behandlingen gives mulighed for at afslå dette. Ifølge lov om patienters retsstilling 29, stk. 1, kan oplysninger om enkeltpersoners helbredsforhold, øvrige rent private forhold og andre fortrolige oplysninger fra patientjournaler med videre videregives til en forsker til brug for et konkret biomedicinsk forskningsprojekt, såfremt der er meddelt tilladelse til projektet efter komitéloven. Denne bestemmelse har dog ikke indflydelse på, hvorvidt den videnskabsetiske 17
19 komité vil stille krav om indhentelse af informeret samtykke i forbindelse med registerforskningsprojekter. Er der tale om, at der skal indhentes et efterfølgende samtykke fra patienter, som tidligere har udleveret sådanne oplysninger i forbindelse med behandling, skal de sundhedspersoner, der har behandlet de pågældende, give tilladelse til at der rettes henvendelse til forsøgspersonerne, jf. lov om patienters retsstilling 29, stk. 3. Spørgeskemaundersøgelser Spørgeskemaundersøgelser skal kun anmeldes til en regional videnskabsetisk komité, såfremt projektet eller en del heraf indeholder et væsentligt element af biomedicinsk forskning, og såfremt projektet indebærer sundhedsmæssige risici eller på anden måde kan være til belastning for den enkelte forsøgsperson. Ved belastning forstås også psykiske gener, social stigmatisering og tilsvarende. Spørgeskemaundersøgelser eller strukturerede interviews, som indeholder helbredsmæssige spørgsmål til personer, der ikke er udvalgt fra helbredsregistre, men for eksempel ved tilfældigt udtræk fra CPRregisteret eller lignende, og hvor besvarelserne er anonymiserede, skal ikke anmeldes til komitésystemet. Det samme gælder for efterundersøgelser og lignende, som er aftalt med patienter ved deres normale kontakt med sundhedsvæsenet, og hvor også muligheden for efterfølgende personlig henvendelse er aftalt. Anonyme tabellariske gengivelser af resultaterne af sådanne efterundersøgelser kræver heller ikke en forudgående komitéanmeldelse. 18
20 Biobanker med organisk materiale Biobanker som indeholder organisk materiale i bunden form eller lignende vil normalt være knyttet til et konkret forskningsprojekt og anmeldes sammen med dette. Projekter der anvender udtræk af biobanker baseret på andet end bogstaver og tal skal altid anmeldes til en videnskabsetisk komité. Undtaget herfra er dog efterundersøgelser, diagnostisk revision og lignende, som enten er planlagt ved patientens forudgående kontakt med sundhedsvæsenet, eller som uden at være planlagt alene tjener behandling, prognosticering eller forebyggelsesmuligheder for den enkelte patient. Forsøg med menneskelige kønsceller, befrugtede æg og fostre Regler om adgangen til at forske på menneskelige kønsceller og befrugtede æg findes i lov nr. 460 af 10. juni 1997 om kunstig befrugtning i forbindelse med lægelig behandling, diagnostik og forskning med videre og i bekendtgørelse nr. 728 af 17. september 1997 om kunstig befrugtning. Biomedicinske forsøg på befrugtede menneskelige æg samt på kønsceller, der agtes anvendt til befrugtning, er, jf. 25 i lov om kunstig befrugtning, kun tilladt, hvis de har til formål at forbedre in vitro-befrugtning eller lignende teknikker med henblik på at fremkalde en graviditet, eller de har til formål at forbedre teknikker til genetisk undersøgelse af et befrugtet æg med henblik på at fastslå, om der foreligger en alvorlig arvelig sygdom eller en væsentlig kromosomabnormitet (præimplantationsdiagnostik). 19
21 Sådanne forskningsprojekter er anmeldelsespligtige i forhold til det videnskabsetiske komitésystem, jf. 27, stk. 2, i lov om kunstig befrugtning. Som udgangspunkt gælder de samme regler om information og samtykke i forbindelse med forskning på menneskelige kønsceller som for øvrige biomedicinske forsøg. Forsøg med ubefrugtede æg Kvinden skal allerede i forbindelse med afgivelsen af samtykke til opbevaring af ubefrugtede æg være oplyst om konsekvenserne af opbevaringen, jf. 2 og 3 i bekendtgørelse om kunstig befrugtning. Der bør således som udgangspunkt foreligge et udtrykkeligt skriftligt samtykke vedrørende anvendelsen af kvindens æg til befrugtning og/ eller forskning. Hvor der foreligger et sådant generelt samtykke til forskning, kan komiteerne godkende anvendelsen af æggene for et efterfølgende biomedicinsk forskningsprojekt, uden at forsøgspersonen informeres og afgiver konkret samtykke. Hvis kvinden ikke har afgivet et generelt samtykke til forskning, skal der indhentes et efterfølgende samtykke til anvendelsen af æggene i det konkrete forskningsprojekt. Er kvinden anonym, og foreligger der ikke et generelt eller specielt samtykke til forskning, kan æggene ikke anvendes hertil. Er der tale om, at æg udtages direkte til et forskningsprojekt, skal kvinden gives fuld information og afgive konkret samtykke efter reglerne i bekendtgørelsens kapitel 3. 20
22 Forsøg med sæd Hvor sæd doneres anonymt til sædbanker, skal donor i forbindelse med donationen gøres bekendt med konsekvenserne af donation, herunder at sæden kan anvendes til forskningsformål, jf. 14 i bekendtgørelse om kunstig befrugtning. Der bør således også her som udgangspunkt foreligge et udtrykkeligt skriftligt samtykke vedrørende anvendelsen af sæden til enten opnåelse af graviditet eller til forskningsformål. Hvor der foreligger et sådant generelt samtykke til forskning, kan komiteerne godkende anvendelsen af sæden for et efterfølgende biomedicinsk forskningsprojekt, uden at forsøgspersonen informeres og afgiver konkret samtykke efter reglerne i bekendtgørelsens kapitel 3. Hvor der ikke ved donationen foreligger et generelt samtykke til forskning, skal et konkret informeret samtykke fra donor - hvis dette ikke er umuliggjort af anonymitet - indhentes efterfølgende. Et konkret samtykke efter reglerne i bekendtgørelsens kapitel 3 bør indhentes, hvor sæd specielt opbevares med henblik på egen partners eller andres graviditet, med mindre manden allerede i forbindelse med afgivelsen også har afgivet samtykke til forskningsformål. Hvor sæd doneres til konkrete forskningsprojekter, skal der gives fuld information og afgives konkret samtykke efter reglerne i bekendtgørelsens kapitel 3. Forsøg med befrugtede æg og fostre Forskning på befrugtede æg og fostre kræver et samtykke fra moderen. I det omfang forældrene indgår i ægteskab eller ægteskabslignende forhold, bør der dog tillige indhentes samtykke fra faderen. Dette gælder vejledende, hvad enten det befrugtede æg/fosteret befinder sig i eller uden for moderen. 21
23 Tvivl om anmeldelsespligten Ved tvivl om et projekts anmeldelsespligt efter komitéloven bør den ansvarlige forsker kontakte den regionale videnskabsetiske komité. Anmeldelse til Datatilsynet Alle forskningsprojekter med følsomme personoplysninger skal efter persondataloven tillige anmeldes til Datatilsynet. Projekter der udføres for private dataansvarlige skal have Datatilsynets tilladelse, inden projektet kan påbegyndes. For projekter, der udføres for offentlige institutioner, skal Datatilsynets udtalelse være indhentet forinden. Væsentlige ændringer i projekter skal anmeldes til Datatilsynet og kan kræve tilsynets forudgående tilladelse eller udtalelse. 22
24 HVAD SKAL FORSØGSPROTOKOLLEN INDEHOLDE? Inden de videnskabsetiske komiteer kan bedømme et konkret forskningsprojekt, skal den projektansvarlige forsker indsende en forsøgsprotokol. Ved firmainitieret forskning er det den klinisk ansvarlige forsker, der indsender protokollen. Forsøgsprotokollen skal som altovervejende hovedregel indeholde: a. En projektbeskrivelse (se nedenfor). b. Oplysninger om information til forsøgspersoner, herunder kopi af skriftlig information og samtykkeerklæring samt oplysninger om retningslinier for afgivelse af mundtlig information (se afsnittet Udformning af information til forsøgspersoner og Krav til forsøgspersoners samtykke herom). c. Et resumé af projektbeskrivelsen, udformet i et for lægpersoner forståeligt sprog. d. En udfyldt videnskabsetisk anmeldelsesblanket. Hele forsøgsprotokollen skal være affattet på dansk, med mindre særlige forhold gør sig gældende. Ved større internationale multicenterundersøgelser, hvor danske centre/afdelinger kun bidrager med et mindre antal forsøgspersoner, kan der efter omstændighederne accepteres et fyldigt dansk resumé af en fremmedsproget forsøgsprotokol. Projektbeskrivelsen, som er en del af forsøgsprotokollen, skal indeholde følgende: a. Beskrivelse af forsøgets formål: Problemstilling og hypotese. 23
25 b. Beskrivelse af forsøgets baggrund: Kort litteraturgennemgang, eventuelt suppleret med en egentlig litteraturliste. Hvis et lignende projekt tidligere er udført, skal forskeren oplyse herom og begrunde en gentagelse af forsøget. c. Beskrivelse og vurdering af forsøgets etiske aspekter: Afsnittet skal som minimum bestå af en vurdering af forsøgets forudsigelige risici, bivirkninger og ulemper sammenholdt med de forventede fordele for forsøgspersonerne eller andre. Herunder vurderes konsekvenserne for forsøgspersonens pårørende. Afsnittet skal munde ud i en konklusion, der godtgør at forventede gavnlige virkninger opvejer forudsigelige risici, ulemper med videre. Hensynet til forsøgspersonernes integritet og autonomi skal danne udgangspunkt for overvejelserne (se afsnittet Grundlæggende etiske overvejelser herom). d. Oplysninger vedrørende forsøgspersonerne og eventuelle kontrolpersoner: Inklusions- og eksklusionskriterier, personernes antal, køn, alder, hvorvidt der er tale om raske forsøgspersoner, gravide, ammende, ansatte i sundhedssektoren eller medicinalindustrien, indsatte i fængsler, værnepligtige og så videre. Der skal redegøres for, hvor og hvordan forsøgspersonerne rekrutteres. Der skal gives en særskilt begrundelse, hvis projektet omfatter særlige forsøgssituationer, for eksempel ved inddragelsen af mindreårige, bevidstløse, psykotiske, udviklingshæmmede, demente eller personer i særlige afhængighedsforhold (se afsnittet Den særlige forsøgssituation ). 24 e. Redegørelse for afgivelse af mundtlig information og indhentelse af samtykke.
26 f. Redegørelse for de benyttede metoder: Beskrivelse af eventuelle indgreb på forsøgspersoner, bilag til løbende og anden dataindsamling (spørgeskemaer og lignende). Det skal samtidig angives, om forskeren anonymiserer eller destruerer personidentificerbare data og prøver ved projektets afslutning eller på et andet angivet tidspunkt. g. Beskrivelse af risici, bivirkninger, komplikationer og ulemper for forsøgspersonerne, om muligt med angivelse af den forventede hyppighed af de enkelte bivirkninger med videre. h. Beskrivelse af sikkerhedsforanstaltninger ved forsøget. i. Beskrivelse af forsikringsforhold. j. Angivelse af sted(er) for forsøgets udførelse. k. Forsøgets forventede varighed: Begyndelses- og afslutningstidspunkt. l. Angivelse af et eventuelt honorar til forsøgspersonerne. m. Hvis der ydes økonomisk støtte udefra til forsøget: En redegørelse for støtten med oplysning om navne på støttegivere, det samlede støttebeløb, støttebeløb fra enkelte støttegivere, samt måden hvorpå støtten indgår i forsøget, herunder om støtten udbetales som en fast sum eller som et vederlag pr. forsøgsperson. Det oplyses desuden, om støtten udbetales direkte til den for projektet ansvarlige forsker, til dennes afdeling/institut, til en fælles forskningsfond eller andet, om forskeren i øvrigt har en økonomisk tilknytning til private støtteydere, samt hvordan et eventuelt overskydende støttebeløb anvendes. n. Eventuelle regler, retningslinier, aftaler med videre vedrørende publikation. Ved godkendelse af forsøg skal den videnskabsetiske komité sikre sig, at der er fri publikationsret. Den Centrale Videnskabsetiske Komité har fastsat særlige retningslinier herfor. 25
27 26
28 DEN NORMALE FORSØGSSITUATION I bekendtgørelsen sondres der mellem normale og særlige forsøgssituationer. Med henblik på at afklare hvilke regler der finder anvendelse på et konkret forskningsprojekt, bør den ansvarlige forsker allerede inden projektets iværksættelse nøje overveje karakteren af de forsøg, som det pågældende projekt indebærer, herunder specielt om der i løbet af projektet vil forekomme særlige forsøgssituationer. Ved normale forsøgssituationer forstås, jf. bekendtgørelsens 4, forsøg, hvor der udelukkende er tale om inddragelse af myndige og habile forsøgspersoner, som selv er i stand til at modtage og forstå informationen samt afgive et frivilligt samtykke til deltagelse i forsøg. Tre væsentlige kriterier er indbygget i denne definition: 1. Personligt myndig forsøgsperson. Kravet om personlig myndighed indebærer, at der i den normale forsøgssituation er tale om en forsøgsperson, der er mindst 18 år gammel. 2. Habil forsøgsperson. Kravet om habilitet indebærer, at den pågældende person skal være beslutningskompetent. Dette krav er for eksempel ikke opfyldt, hvis personen er bevidstløs eller mentalt hæmmet. 3. Frivilligt samtykke. Kravet om et frivilligt samtykke indebærer, at den pågældende ikke for eksempel på grund af institutionsanbringelse, frihedsberøvelse eller ansættelsesforhold må formodes at kunne være påvirket af pres, tvang eller svig i forbindelse med afgivelse af samtykke til forsøgsdeltagelse. 27
29 Reglerne om den særlige forsøgssituation tager omvendt højde for tilfælde, hvor et eller flere af disse kriterier ikke er opfyldt. For normale forsøgssituationer gælder, foruden bekendtgørelsens kapitel 2 og de generelle bestemmelser i bekendtgørelsens kapitel 1 og 6, kun de almindelige regler om information og samtykke i bekendtgørelsens kapitel 3. Ifølge bekendtgørelsens 5 skal komiteen ved bedømmelsen af normale forsøgssituationer sikre, at der er foretaget en grundig risikovurdering af forsøget, inden dette kan afvikles. Risikovurderingen omfatter en vurdering af bivirkninger såvel som af risici i snæver forstand. Bekendtgørelsen og vejledningens forståelse af risici og bivirkninger er beskrevet i afsnittet Informationens indhold herunder. I normale forsøgssituationer som defineret herover må risici og bivirkninger hverken i sig selv eller i forhold til projektets forudselige fordele have et uforsvarligt omfang, jf. lovens 8, stk. 1, nr. 1. Det betyder, at forskeren og den videnskabsetiske komité i sin bedømmelse af projektet både skal vurdere forsøgets risici i sig selv, det vil sige uden hensyn til eventuelle fordele, og i forhold til projektets forudselige fordele for forsøgspersoner, for andre og for forskningen. Hverken den absolutte eller den relative risiko må være uforsvarlig. En øvre grænse for, hvad der kan forsvares, følger allerede af lægelovens 6, stk. 1, hvorefter lægen har pligt til i sin gerning at udvise omhu og samvittighedsfuldhed. En mere konkret øvre grænse i risikovurderingen er, at raske forsøgspersoner i normale forsøgssituationer kun må udsættes for risici, der kan karakteriseres som minimale. 28 I forbindelse med inddragelsen af patienter som forsøgspersoner i normale forsøgssituationer kan der imidlertid være tale om, at en højere risiko kan være acceptabel, når dette er forbundet med en mulig helbredsmæssig fordel for forsøgspersonen.
30 DEN SÆRLIGE FORSØGSSITUATION Den særlige forsøgssituation foreligger, jf. bekendtgørelsens 13, stk. 1, hvor en forsøgsperson på grund af alder, sindstilstand, bevidstløshed, udviklingshæmning eller lignende er ude af stand til at afgive informeret samtykke. Desuden omfatter den særlige forsøgssituation forsøg med personer, som er beslutningskompetente, men som på grund af institutionsanbringelse, frihedsberøvelse, ansættelsesforhold eller lignende kan være udsat for et særligt pres, og derfor ikke med sikkerhed kan formodes at afgive et frivilligt samtykke til forsøgsdeltagelse. For forsøgspersoner, som er ude af stand til at afgive informeret samtykke, finder reglerne om stedfortrædende samtykke i bekendtgørelsens anvendelse. For forsøgspersoner, der befinder sig i situationer, hvor der kan opstå formodning om, at personen kan komme under pres for forsøgsdeltagelse, er der et særligt behov for at sikre frivilligheden bag deltagelsen i forsøget. Her finder de skærpede informations- og samtykkekrav i bekendtgørelsens 20 anvendelse. For alle særlige forsøgssituationer gælder det, at kravene til risikovurdering, nytte for forsøgspersonen med videre i bekendtgørelsens 14 skal være opfyldt, før disse forsøg kan iværksættes. Ved bedømmelsen af særlige forsøgssituationer skal de videnskabsetiske komiteer inden godkendelsen sikre, at projektet ikke med tilsvarende nytte kan gennemføres ved anvendelse af normale forsøgssituationer. Komiteerne skal herefter sikre, at projektet har udsigt til direkte at gavne den enkelte forsøgsperson. Endelig skal komiteen vurdere forholdet mellem nytte og risici. De direkte, påregnelige fordele for forsøgspersonen skal være meget store for 29
31 at kunne begrunde en risiko, der svarer til hvad der kan accepteres i den normale forsøgsssituation, jf. bekendtgørelsens 5. Det fremgår af dette, at komiteerne foretager en skærpet risiko- og nyttevurdering af de særlige forsøgssituationer. I visse tilfælde er det muligt at godkende særlige forsøgssituationer, der ikke honorerer enkeltkravet om, at projektet direkte skal gavne den enkelte forsøgsperson. Ifølge bekendtgørelsens 14, stk. 2, er det muligt at godkende forsøg med umyndige eller inhabile personer, selv om projektet ikke har udsigt til direkte at gavne forsøgspersonen. Yderligere forudsætninger herfor er dog, 1. at forskningsprojektet kun kan gennemføres ved inddragelse af personer omfattet af den pågældende sygdom eller tilstand, 2. at projektet har udsigt til at kunne overføre meget store fordele til den patientgruppe, som omfattes af den samme sygdom eller tilstand som forsøgspersonen, samt 3. at forsøget højest indebærer minimale risici for forsøgspersonen. Alle tre forudsætninger skal være opfyldt, for at projektet kan godkendes. Ligeledes er det, jf. bekendtgørelsens 14, stk. 3, i ganske særlige tilfælde muligt at inddrage raske forsøgspersoner i særlige forsøgssituationer, selv om projektet ikke har udsigt til direkte at gavne forsøgspersonen. En yderligere forudsætning er her, at forsøget højest medfører ganske ubetydelige risici og minimal gene for forsøgspersonen. 30 Denne bestemmelse vil især kunne finde anvendelse ved inddragelse af børn, hvor der altid på grund af de pågældendes umyndighed vil være
32 tale om særlige forsøgssituationer. Undtagelsen kan også finde anvendelse ved inddragelse af myndige og beslutningskompetente forsøgspersoner, hvor frivilligheden til deltagelse kan drages i tvivl. 31
33 32
34 UDFORMNING AF INFORMATION TIL FORSØGSPERSONER Inden informationssamtalen bør forskeren træffe aftale med forsøgspersonen om tid og sted for en sådan. Dette gælder, med mindre der er tale om helt akutte omstændigheder, eller med mindre andet taler herimod, for eksempel hvor en forsøgsperson ønskes som medvirkende i et forsøg på baggrund af en diagnose, som den pågældende endnu ikke har fået forelagt. Inden informationssamtalen oplyses det også, at der er tale om en forespørgsel om deltagelse i et videnskabeligt forsøg, at forsøgspersonen vil få betænkningstid efter afgivelsen af information, samt at den pågældende har ret til at medbringe en bisidder ved informationssamtalen. Herved gives mulighed for, at den pågældende kan nå at træffe aftale med tredjemand om dette. Selve informationssamtalen bør være nøje planlagt og foregå i uforstyrrede fysiske rammer. Forsøgspersonen skal gives tilstrækkelig tid til at læse den skriftlige information, lytte til den mundtlige beskrivelse og stille spørgsmål til projektet. Ved forsøg, som opklarer forsøgspersoners helbredstilstand, eventuelle sygdom eller disposition for visse sygdomme, skal forskeren allerede inden informationssamtalen være opmærksom på, at forsøgspersonen ifølge bekendtgørelsens 10 har ret til at frasige sig viden om sådanne fremkomne oplysninger. I disse tilfælde skal informationssamtalen planlægges således, at der tages højde for forsøgspersonens ret til at frasige sig information af den nævnte karakter. Er der tale om et længerevarende forsøg, bør den projektansvarlige allerede fra forsøgets begyndelse overveje, hvordan en eventuel senere nødvendig opdatering af informationen kan arrangeres (se afsnittet om Opdatering af information og samtykke ). 33
35 Formelle krav til informationen Forsøgspersoner eller deres stedfortrædere skal både informeres skriftligt og mundtligt, jf. bekendtgørelsens 6, stk. 1. Informationen skal gives, uden at forsøgspersonen anmoder herom. Den skriftlige information til forsøgspersoner skal godkendes af komiteen sammen med en beskrivelse af retningslinierne for mundtlig information. Informationen til forsøgspersoner skal meddeles i et letforståeligt sprog uden tekniske eller værdiladede vendinger, jf. bekendtgørelsens 6, stk. 2. Ved afgivelsen af mundtlig information skal afgiveren sikre sig og har ansvaret for, at forsøgspersonen har forstået indholdet i informationen, inden forsøget iværksættes. Informationen bør gives på en hensynsfuld måde, der er tilpasset den enkelte forsøgspersons forhold såsom alder, social status, uddannelsesniveau med videre. Informationen må ikke medføre, at forsøgspersonen uden forudgående varsel får præsenteret oplysninger, som denne ikke ønsker, for eksempel for cancerpatienter en meget dårlig prognose, eller for personer med arvelige sygdomme i familien oplysning om, at man er bærer af et gen forbundet med en alvorlig arvelig sygdom. Informationen gives af den for projektet ansvarlige forsker eller en af denne dertil bemyndiget person med tilknytning til projektet. Ansvaret for en rigtig og fyldestgørende information til forsøgspersonerne hviler på afgiveren. Den projektansvarlige skal sikre sig, at de personer, hvortil afgivelsen af den mundtlige informationen delegeres, er grundigt informeret om projektet og besidder de fornødne faglige og psykologiske kvalifikationer. 34
36 Informationens indhold Bekendtgørelsens 7 og 8 indeholder de retlige minimumskrav til den skriftlige information. I det følgende beskrives opbygningen af bekendtgørelsens krav og forskerens prioritering af kravene i det konkrete informationsmateriale. Herefter foretages en detaljeret gennemgang af kravene. Bekendtgørelsens indholdsmæssige krav til informationen er opbygget således: 7, stk. 1, nr. 1-6 omhandler krav til information om det konkrete forsøgs indhold, 7, stk. 1, nr. 7-9 omhandler information om forsøgspersonens rettigheder, 7, stk. 1, nr omhandler information om tavshedspligt, aktindsigt, erstatningsmuligheder med videre, 7, stk. 2 omhandler særlige oplysninger til forsøgspatienter, og 8 omhandler krav til information om projekters økonomiske støtte. Informationen skal ikke nødvendigvis udformes i den nævnte rækkefølge. Forskeren bør i stedet vurdere, hvilke oplysninger som er mest relevante for det pågældende forsøg. Disse bør fremgå først af den skriftlige information. Oplysningen om, at der er tale om en forespørgsel om deltagelse i et videnskabeligt forsøg eller forskningsprojekt, bør dog altid fremgå allerførst af informationsmaterialet. 35
37 Både den skriftlige og mundtlige information bør være klar og præcis, således at væsentlige informationer ikke drukner i en overdreven informationsmængde. Alle bekendtgørelsens krav til informationens indhold skal opfyldes. Det er imidlertid ikke et krav, at alle punkterne fremgår af den konkret udarbejdede informationsskrivelse. De punkter, som fremgår af bekendtgørelsens 7, stk. 1, nr. 1-9, og 8 bør dog altid indgå i den konkrete informationsskrivelse. Derimod kan informationskravene i 7, stk. 1, nr opfyldes ved beskrivelse i en generel folder. I forsøg, der for eksempel kun omfatter forsøgspersonernes afgivelse af en blodprøve, kan den konkrete informationsskrivelse reduceres til de mest relevante punkter; øvrige punkter kan fremgå af en generel folder. I det følgende omtales de enkelte indholdsmæssige krav til informationen nærmere. 1. Forespørgsel om deltagelse i et videnskabeligt forsøg eller forskningsprojekt. Af det første punkt i den skriftlige information skal det fremgå, at der er tale om en forespørgsel om deltagelse i et videnskabeligt forsøg eller forskningsprojekt. Det bør klart fremgå, at der således ikke er tale om rutine, diagnostisk undersøgelse eller behandling. 2. Forsøgets formål og metode. Formål og metode skal forklares for forsøgspersonen i et let forståeligt sprog uden unødige medicinske fagudtryk. Beskrivelsen skal være nøgtern og ikke skabe forventning om resultater, der ikke er realistiske. Informationen skal indeholde oplysning om anvendelse af og navnene på godkendte og ikke godkendte lægemidler med videre, 36
38 anvendelse af randomisering, blindpræparater og behandlingsfri perioder, jf. bekendtgørelsens 7, stk. 1, nr. 2. Desuden skal forsøgspersonen informeres om forsøgets generelle fremgangsmåde, herunder om anvendelsen af invasive undersøgelsesmetoder. Det bør oplyses, hvor mange forsøgspersoner der indgår, og hvorvidt der er tale om forsøgspatienter eller raske forsøgspersoner. 3. Bivirkninger, risici, komplikationer og ulemper. Der skal gives oplysninger om kendte og forudsigelige bivirkninger, risici, komplikationer og ulemper ved forsøget. Det skal herudover oplyses, at der kan være uforudsigelige risici knyttet til deltagelse i biomedicinske forsøg. Bivirkninger Bivirkninger er utilsigtede effekter af anvendelsen af medicin eller anden behandling, som ikke kan undgås, og som forekommer med større eller mindre hyppighed, for eksempel kvalme ved behandling med antibiotika. Der bør både gives information om forbigående og langvarige bivirkninger. Der bør altid informeres om hyppige bivirkninger, også selv om disse ikke er alvorlige, og om alle alvorlige bivirkninger, også selv om disse kun er sjældne. Det vil afhænge af det konkrete forsøg, hvor hyppig en bivirkning skal være, før der kræves information om denne. Risici Risici er alvorlige begivenheder, som kan indtræffe i forbindelse med forsøg, for eksempel infektion i relation til en operation eller blodforgiftning i forbindelse med behandling med cellegifte mod cancer. 37
39 Forsøgspersonen skal informeres om alle kendte risici ved deltagelse i forsøget. Gravide og ammende kvinder skal tillige informeres om eventuelle risici for barnet. Derudover skal der informeres om, at der kan være ikke kendte bivirkninger eller risici ved deltagelse i forsøg. Dette er for eksempel ofte tilfældet ved afprøvning af ikke godkendt medicin. Ulemper Ulemper er de praktiske besværligheder og gener, som forsøgsdeltagelsen medfører, for eksempel ved fravær fra arbejde på grund af fremmøde til kontrolbesøg, blodprøvetagning eller lignende. Oplysningerne om forsøgets ulemper skal være så nøjagtige som muligt. 4. Nytte ved forsøget. Informationen skal indeholde oplysninger om den mulige nytte ved forsøget. Der skelnes her mellem nytte for forsøgspersonen, for andre og videnskabelige fremskridt. Det skal klart fremgå af informationen, om forsøgspersonen selv kan have nytte af forsøget. Ved nytte for forsøgspersonen forstås alene den bedring af den pågældendes sygdom eller tilstand, som kan opnås gennem projektet. Den umiddelbare nytte, som forsøgspersonen kan opnå gennem deltagelse i forsøget, for eksempel i form af ekstra pleje eller et vederlag for deltagelse, er ikke indeholdt. 38 Der gives i almindelighed ikke vederlag til forsøgspatienter for deltagelse i forsøg. Undertiden kan der dog gives et vederlag til raske forsøgspersoner. Vederlag for deltagelse i forsøg må ikke være af en
40 sådan størrelse, at det påvirker samtykkeafgivelsen på utilbørlig vis, jf. komitélovens 8, stk Udelukkelse fra og afbrydelse af forsøg. Forsøgspersonen skal informeres om omstændigheder der kan medføre, at den pågældende kan blive udelukket fra forsøget mod sit eget ønske, samt under hvilke omstændigheder forsøget som helhed kan afbrydes. En udelukkelse af forsøgspersonen kan for eksempel komme på tale, hvor der opstår uønskede bivirkninger, eller hvor forsøgspersonen af andre grunde ikke følger forsøgsbehandlingen. En generel afbrydelse af forsøget kan for eksempel forekomme, hvis der fremkommer oplysninger som viser, at risikoen ved at gennemføre forsøget er for stor. En afbrydelse vil også kunne blive resultatet, hvis et lignende projekt fremlægger valide resultater vedrørende forsøgsbehandlingen, for eksempel hvor et andet projekt har dokumenteret, at forsøgsbehandlingen er standardbehandlingen overlegen. 6. Kontaktperson. Informationen skal indeholde oplysning om navn, adresse og telefonnummer på mindst én kontaktperson med tilknytning til forsøget. Hvis kontaktpersonen kun træffes indenfor særlige tidsintervaller, bør dette oplyses. 7. Frivillig deltagelse. Informationen skal indeholde oplysning om, at deltagelse i forsøget er frivillig, og at deltagelse kun kan ske, efter at både skriftlig og mundtlig information er givet, og et skriftligt samtykke til deltagelse er indhentet. 39
41 8. Tilbagetrækning af samtykke. Informationen skal indeholde oplysning om, at forsøgspersonen på ethvert tidspunkt og uden begrundelse kan trække samtykket til deltagelse tilbage og udtræde af forsøget, uden at dette påvirker adgangen til nutidig eller fremtidig behandling eller andre rettigheder, som forsøgspersonen måtte have. Hverken den skriftlige eller mundtlige information må indeholde oplysninger, som kan give forsøgspersonen den opfattelse, at vedkommende mister eller fraskriver sig rettigheder, herunder muligheden for at rejse erstatningskrav i tilfælde af skader som følge af forsøget. Dette gælder heller ikke, hvis vedkommende uforsætligt fraviger forskningsplanen. I tilfælde, hvor patienter trækker sig ud af forsøg under afvikling, foreligger en almindelig behandlingssituation. Her gælder informations- og samtykkeforpligtelser efter reglerne i lov om patienters retsstilling. 9. Betænkningstid og bisidder. Informationen skal indeholde oplysning om, at forsøgspersonen ikke behøver at beslutte sig med det samme, men har krav på betænkningstid. Betænkningstidens længde vil afhænge af forsøgets karakter. Er der tale om forsøgspatienter, bør betænkningstiden være så lang, at personen har mulighed for at overveje deltagelsen samt at drøfte dette med pårørende og andre. Som udgangspunkt bør betænkningstiden mindst være af et døgns længde. I mindre indgribende forsøg, for eksempel hvor forsøget kun omfatter afgivelse af en blodprøve, kan betænkningstiden være kortere. 40 I særlige tilfælde, hvor formålet med forsøget ikke tillader betænkningstid, for eksempel hvor en forsøgsperson er ramt af
42 blodprop i hjerte eller hjerne eller af en livstruende infektion, kan der afviges fra reglen om betænkningstid. Informationen skal endvidere indeholde oplysning om, at forsøgspersonen har ret til at medbringe en bisidder ved modtagelsen af den mundtlige information. Denne oplysning bør allerede gives, når der aftales tid for en informationssamtale vedrørende forsøgsdeltagelsen. 10. Tavshedspligt. Det skal fremgå af informationen, at oplysninger om patientens helbredsforhold, øvrige rent private forhold og andre fortrolige oplysninger om forsøgspersonen, som gives eller fremkommer under deltagelse i forsøget, er omfattet af tavshedspligt. Det skal endvidere oplyses, om informationerne opbevares i anonymiseret eller personhenførbar form, samt hvor længe data opbevares. Samtykke til videregivelse af oplysninger vedr. patienter gælder normalt for 1 år, jf. lov om patienters retsstilling, 27, stk. 2. Forsøgspersonen giver kun tilladelse til, at de for projektet relevante oplysninger kan udleveres. Bisiddere er normalt ikke omfattet af tavshedspligten, med mindre der er tale om sundhedspersoner eller andre, hvis hverv eller funktion pålægger dem en sådan. 11. Aktindsigt. Forsøgspersonen skal have oplysning om, at der er mulighed for at få aktindsigt i forsøgsprotokoller efter offentlighedslovgivningens bestemmelser herom. 41
43 Visse oplysninger kan hemmelighedsholdes efter lovgivningen af hensyn til den enkelte forskers intellektuelle ejendomsret eller af hensyn til eventuelle forretningshemmeligheder. Forsøgspersonen bør tillige skriftligt informeres om, at Lægemiddelstyrelsen har adgang til indsigt i patientjournaler og lignende. Ifølge lægemiddellovens 24, stk. 11, har Lægemiddelstyrelsen ret til aktindsigt, såfremt patienten eller forsøgspersonen i forbindelse med deltagelse i forsøget er orienteret om Lægemiddelstyrelsens journaladgang. Den regionale videnskabsetiske komité, som har givet tilladelse til projektet, afgør sager om aktindsigt. Klager over afgørelser om aktindsigt behandles af Den Centrale Videnskabsetiske Komité. 12. Klageadgang, erstatning og kompensation. Informationen skal indeholde oplysning om klageadgang samt mulighed for erstatning efter patientforsikringsloven, lov om erstatning for lægemiddelskader samt anden kompensation ved skader som følge af forsøget. Ved anden mulig kompensation forstås forsikringsaftaler og lignende, som forsøgspersonen er dækket af i forbindelse med deltagelse i forsøget. Oplysninger om økonomiske forhold Informationen til forsøgspersoner skal indeholde oplysninger om den eventuelle økonomiske støtte, som forskeren modtager fra private virksomheder, fonde med videre i forbindelse med forsøget, jf. bekendtgørelsens 8. Navne på støttegivere samt støttebeløb for hver af disse skal være anført. 42 Det skal fremgå, hvorvidt støtten ydes som et fast beløb pr. forsøgsperson (eventuelt inden for et fastlagt antal) eller som en fast sum
Kapitel 1. Anmeldelse af et sundhedsvidenskabeligt forskningsprojekt og indhold i en forsøgsprotokol og en tillægsprotokol
 UDKAST NOVEMBER 2011 Bekendtgørelse om anmeldelse af sundhedsvidenskabelige forskningsprojekter og om information og samtykke til deltagelse i sundhedsvidenskabelige forskningsprojekter I medfør af 7,
UDKAST NOVEMBER 2011 Bekendtgørelse om anmeldelse af sundhedsvidenskabelige forskningsprojekter og om information og samtykke til deltagelse i sundhedsvidenskabelige forskningsprojekter I medfør af 7,
BEK nr 1464 af 02/12/2016 (Gældende) Udskriftsdato: 2. februar Senere ændringer til forskriften Ingen
 BEK nr 1464 af 02/12/2016 (Gældende) Udskriftsdato: 2. februar 2017 Ministerium: Sundheds- og Ældreministeriet Journalnummer: Sundheds- og Ældremin., j.nr. 1609203 Senere ændringer til forskriften Ingen
BEK nr 1464 af 02/12/2016 (Gældende) Udskriftsdato: 2. februar 2017 Ministerium: Sundheds- og Ældreministeriet Journalnummer: Sundheds- og Ældremin., j.nr. 1609203 Senere ændringer til forskriften Ingen
Anordning om ikrafttræden for Færøerne af lov om et videnskabsetisk komitésystem og behandling af biomedicinske forskningsprojekter
 Nr. 862 30. november 1999 Anordning om ikrafttræden for Færøerne af lov om et videnskabsetisk komitésystem og behandling af biomedicinske forskningsprojekter Kapitel 1 Komitésystemet A. nr. 862 frá 30.
Nr. 862 30. november 1999 Anordning om ikrafttræden for Færøerne af lov om et videnskabsetisk komitésystem og behandling af biomedicinske forskningsprojekter Kapitel 1 Komitésystemet A. nr. 862 frá 30.
Godkendelse af biomedicinske forskningsprojekter
 Godkendelse af biomedicinske forskningsprojekter -regler og egne erfaringer Rikke Lund, lektor cand.med. ph.d. Afdeling for Social Medicin Institut for Folkesundhedsvidenskab Københavns Universitet, sept.
Godkendelse af biomedicinske forskningsprojekter -regler og egne erfaringer Rikke Lund, lektor cand.med. ph.d. Afdeling for Social Medicin Institut for Folkesundhedsvidenskab Københavns Universitet, sept.
Kapitel 1. Anmeldelse af et sundhedsvidenskabeligt forskningsprojekt og indhold i en forsøgsprotokol og en tillægsprotokol
 Bekendtgørelse om information og samtykke til deltagelse i sundhedsvidenskabelige forskningsprojekter samt om anmeldelse af og tilsyn med sundhedsvidenskabelige forskningsprojekter I medfør af 7, 15, stk.
Bekendtgørelse om information og samtykke til deltagelse i sundhedsvidenskabelige forskningsprojekter samt om anmeldelse af og tilsyn med sundhedsvidenskabelige forskningsprojekter I medfør af 7, 15, stk.
REGIONERNES FÆLLES TJEKLISTE
 REGIONERNES FÆLLES TJEKLISTE A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne skal være påført
REGIONERNES FÆLLES TJEKLISTE A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne skal være påført
Det videnskabsetiske komitesystem
 Det videnskabsetiske komitesystem DanPedMed 2017 Jesper Johannesen Overlæge, klinisk lektor, dr.med Herlev Hospital Den historiske udvikling: Forsøg på mennesker under 2. verdenskrig Nürenbergproces Nürenbergkodeks
Det videnskabsetiske komitesystem DanPedMed 2017 Jesper Johannesen Overlæge, klinisk lektor, dr.med Herlev Hospital Den historiske udvikling: Forsøg på mennesker under 2. verdenskrig Nürenbergproces Nürenbergkodeks
At skrive en god deltagerinformation (december 2011)
 At skrive en god deltagerinformation (december 2011) Generelt om deltagerinformationen I forbindelse med videnskabelige forsøg, der inddrager forsøgspersoner, er der fastsat regler for, hvordan man informerer
At skrive en god deltagerinformation (december 2011) Generelt om deltagerinformationen I forbindelse med videnskabelige forsøg, der inddrager forsøgspersoner, er der fastsat regler for, hvordan man informerer
Bekendtgørelse af lov om et videnskabsetisk komitésystem og behandling af biomedicinske forskningsprojekter. 8. januar 1999
 Bekendtgørelse af lov om et videnskabsetisk komitésystem og behandling af biomedicinske forskningsprojekter 8. januar 1999 Lovbekendtgørelse nr. 69 af 8. januar 1999 Herved bekendtgøres lov nr. 503 af
Bekendtgørelse af lov om et videnskabsetisk komitésystem og behandling af biomedicinske forskningsprojekter 8. januar 1999 Lovbekendtgørelse nr. 69 af 8. januar 1999 Herved bekendtgøres lov nr. 503 af
REGIONERNES FÆLLES TJEKLISTE
 REGIONERNES FÆLLES TJEKLISTE A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne skal være påført
REGIONERNES FÆLLES TJEKLISTE A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne skal være påført
Det videnskabsetiske komitesystem. Karen Kiilerich
 Det videnskabsetiske komitesystem Komitesystemets opbygning Den Nationale Videnskabsetiske Komite 12 regionale videnskabsetiske Komiteer De Regionale Videnskabsetiske Komiteer Minimum 7, maks 11 medlemmer
Det videnskabsetiske komitesystem Komitesystemets opbygning Den Nationale Videnskabsetiske Komite 12 regionale videnskabsetiske Komiteer De Regionale Videnskabsetiske Komiteer Minimum 7, maks 11 medlemmer
Før du beslutter dig. Om at være forsøgsperson i sundhedsvidenskabelige forsøg
 Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg Revideret september 2018 Hvis du overvejer at deltage i forsøg For at få ny viden om sygdomme og blive bedre til at behandle
Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg Revideret september 2018 Hvis du overvejer at deltage i forsøg For at få ny viden om sygdomme og blive bedre til at behandle
for Komitésystemets behandling af sundhedsvidenskabelige forskningsprojekter med omfattende kortlægning af den menneskelige arvemasse
 Version 3 RETNINGSLINJER for Komitésystemets behandling af sundhedsvidenskabelige forskningsprojekter med omfattende kortlægning af den menneskelige arvemasse Holbergsgade 6 DK-1057 København K Tel +45
Version 3 RETNINGSLINJER for Komitésystemets behandling af sundhedsvidenskabelige forskningsprojekter med omfattende kortlægning af den menneskelige arvemasse Holbergsgade 6 DK-1057 København K Tel +45
Før du beslutter dig. Om at være forsøgsperson i sundhedsvidenskabelige forsøg
 Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg Den Nationale Videnskabsetiske Komité * Finsensvej 15 * 2000 Frederiksberg * Tlf.: +45 72 26 93 70 * E Mail: dnvk@dvvk.dk *
Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg Den Nationale Videnskabsetiske Komité * Finsensvej 15 * 2000 Frederiksberg * Tlf.: +45 72 26 93 70 * E Mail: dnvk@dvvk.dk *
FØR DU BESLUTTER DIG? Om at være forsøgsperson i sundhedsvidenskabelige forsøg
 FØR DU BESLUTTER DIG? Om at være forsøgsperson i sundhedsvidenskabelige forsøg 1 HVIS DU OVERVEJER AT DELTAGE I FORSØG For at få ny viden om sygdomme og blive bedre til at behandle dem, er det vigtigt
FØR DU BESLUTTER DIG? Om at være forsøgsperson i sundhedsvidenskabelige forsøg 1 HVIS DU OVERVEJER AT DELTAGE I FORSØG For at få ny viden om sygdomme og blive bedre til at behandle dem, er det vigtigt
Revideret august Før du beslutter dig. Om at være forsøgsperson i sundhedsvidenskabelige forsøg
 Revideret august 2014 Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg HVIS DU OVERVEJER AT DELTAGE I FORSØG For at få ny viden om sygdomme og blive bedre til at behandle dem,
Revideret august 2014 Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg HVIS DU OVERVEJER AT DELTAGE I FORSØG For at få ny viden om sygdomme og blive bedre til at behandle dem,
9. Dokumentation for den forsøgsansvarliges uddannelse (f.eks. autorisationsid).
 Mødedato: REGIONERNES FÆLLES TJEKLISTE (vs-09_06-13) A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne
Mødedato: REGIONERNES FÆLLES TJEKLISTE (vs-09_06-13) A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne
KOMITÉSYSTEMETS TJEKLISTE INDHOLD KLINISKE LÆGEMIDDELFORSØG
 1 KOMITÉSYSTEMETS TJEKLISTE INDHOLD KLINISKE LÆGEMIDDELFORSØG DOKUMENTER DER SKAL INDSENDES VIA DKMAnet. Se fælles dokumenttjekliste ved ansøgning om lægemiddelforsøg via DKMAnet * markerer komitérelevante
1 KOMITÉSYSTEMETS TJEKLISTE INDHOLD KLINISKE LÆGEMIDDELFORSØG DOKUMENTER DER SKAL INDSENDES VIA DKMAnet. Se fælles dokumenttjekliste ved ansøgning om lægemiddelforsøg via DKMAnet * markerer komitérelevante
VEJLEDNING OM INFORMATION forud for KOSMETISKE INDGREB
 Sundhedsstyrelsens vejledning af 6. januar 2000 VEJLEDNING OM INFORMATION forud for KOSMETISKE INDGREB (Til landets læger) 1. Indledning Sundhedsstyrelsen er, som led i sit tilsyn med den sundhedsfaglige
Sundhedsstyrelsens vejledning af 6. januar 2000 VEJLEDNING OM INFORMATION forud for KOSMETISKE INDGREB (Til landets læger) 1. Indledning Sundhedsstyrelsen er, som led i sit tilsyn med den sundhedsfaglige
Skriftlig deltagerinformation
 Skriftlig deltagerinformation Tak for din interesse for RunSAFE. Tilmelding: Hvis du ikke allerede har udfyldt tilmeldings spørgeskemaet på: http://www.vilober.dk/deltag-klik-her-2/runsafe/sporgeskema-2
Skriftlig deltagerinformation Tak for din interesse for RunSAFE. Tilmelding: Hvis du ikke allerede har udfyldt tilmeldings spørgeskemaet på: http://www.vilober.dk/deltag-klik-her-2/runsafe/sporgeskema-2
Den Centrale Videnskabsetiske. Før du beslutter dig. Forsøgspersoner til sundhedsvidenskabelige forsøg. Videnskabsetiske
 Den Centrale Videnskabsetiske Komité Før du beslutter dig Forsøgspersoner til sundhedsvidenskabelige forsøg De Videnskabsetiske Komitéer i Danmark FØR DU BESLUTTER DIG - Forsøgspersoner til sundhedsvidenskabelige
Den Centrale Videnskabsetiske Komité Før du beslutter dig Forsøgspersoner til sundhedsvidenskabelige forsøg De Videnskabsetiske Komitéer i Danmark FØR DU BESLUTTER DIG - Forsøgspersoner til sundhedsvidenskabelige
Det videnskabsetiske Komitésystem
 En dyster fortid etisk selvransagelse Afvejning af videnskabelig god forskning versus etisk forsvarlig forskning Nürnbergkoden (1947): Det første internationale medicinsk etiske dokument (vægt på frivillighed
En dyster fortid etisk selvransagelse Afvejning af videnskabelig god forskning versus etisk forsvarlig forskning Nürnbergkoden (1947): Det første internationale medicinsk etiske dokument (vægt på frivillighed
December Appendiks 1 Retningslinjer for vederlag eller andre ydelser til frivillige forsøgspersoner
 December 2011 Appendiks 1 Retningslinjer for vederlag eller andre ydelser til frivillige forsøgspersoner Af komitelovens 20, stk. 1, nr. 3 fremgår, at det er en betingelse for at tillade et forskningsprojekt,
December 2011 Appendiks 1 Retningslinjer for vederlag eller andre ydelser til frivillige forsøgspersoner Af komitelovens 20, stk. 1, nr. 3 fremgår, at det er en betingelse for at tillade et forskningsprojekt,
Før du beslutter dig. Om at være forsøgsperson i sundhedsvidenskabelige forsøg
 Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg DEN CENTRALE VIDENSKABSETISKE KOMITÉ * FINSENSVEJ 15 * 2000 FREDERIKSBERG * TLF.: +45 72 26 93 70 * E-MAIL: CVK@SUM.DK * WWW.CVK.SUM.dk
Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg DEN CENTRALE VIDENSKABSETISKE KOMITÉ * FINSENSVEJ 15 * 2000 FREDERIKSBERG * TLF.: +45 72 26 93 70 * E-MAIL: CVK@SUM.DK * WWW.CVK.SUM.dk
Vejledning om forskning på afdøde
 Sagsnr. 1602385 Dok.nr. 248371 Holbergsgade 6 1057 København K Vejledning om forskning på afdøde T: +45 72 26 93 70 M: kontakt@nvk.dk W: www.nvk.dk Indholdsfortegnelse 1. Indledning... 1 2. Forskning i
Sagsnr. 1602385 Dok.nr. 248371 Holbergsgade 6 1057 København K Vejledning om forskning på afdøde T: +45 72 26 93 70 M: kontakt@nvk.dk W: www.nvk.dk Indholdsfortegnelse 1. Indledning... 1 2. Forskning i
Vejledning om akutte forsøg
 Holbergsgade 6 1057 København K T: +45 72 26 93 70 M: kontakt@nvk.dk W: www.nvk.dk Vejledning om akutte forsøg 1. Indledning 2. Generelle krav ved akutte forsøg a. Forskning med indhentning af et efterfølgende
Holbergsgade 6 1057 København K T: +45 72 26 93 70 M: kontakt@nvk.dk W: www.nvk.dk Vejledning om akutte forsøg 1. Indledning 2. Generelle krav ved akutte forsøg a. Forskning med indhentning af et efterfølgende
Forretningsorden for. De Videnskabsetiske Komiteer for Region Hovedstaden
 Forretningsorden for De Videnskabsetiske Komiteer for Region Hovedstaden I medfør af 36, stk. 4 i lov nr. 593 af 14. juni 2011 om videnskabsetisk behandling af sundhedsvidenskabelige forskningsprojekter
Forretningsorden for De Videnskabsetiske Komiteer for Region Hovedstaden I medfør af 36, stk. 4 i lov nr. 593 af 14. juni 2011 om videnskabsetisk behandling af sundhedsvidenskabelige forskningsprojekter
Bekendtgørelse om assisteret reproduktion
 BEK nr 672 af 08/05/2015 (Gældende) Udskriftsdato: 10. januar 2017 Ministerium: Sundheds- og Ældreministeriet Journalnummer: Ministeriet for Sundhed og Forebyggelse, j.nr. 1301525 Senere ændringer til
BEK nr 672 af 08/05/2015 (Gældende) Udskriftsdato: 10. januar 2017 Ministerium: Sundheds- og Ældreministeriet Journalnummer: Ministeriet for Sundhed og Forebyggelse, j.nr. 1301525 Senere ændringer til
Bekendtgørelse af lov om assisteret reproduktion i forbindelse med behandling, diagnostik og forskning m.v.
 LBK nr 93 af 19/01/2015 (Gældende) Udskriftsdato: 19. juni 2016 Ministerium: Ministeriet for Sundhed og Forebyggelse Journalnummer: Ministeriet for Sundhed og Forebyggelse, j.nr. 1406589 Senere ændringer
LBK nr 93 af 19/01/2015 (Gældende) Udskriftsdato: 19. juni 2016 Ministerium: Ministeriet for Sundhed og Forebyggelse Journalnummer: Ministeriet for Sundhed og Forebyggelse, j.nr. 1406589 Senere ændringer
Anmeldelse af Videnskabelig og statistisk undersøgelse/projekt hos UCL med personhenførbare data
 I overensstemmelse med persondatalovens 10 kan UCL behandle (persondatalovens 7, stk 1 og 8), hvis dette alene sker med henblik på at udføre statistiske eller videnskabelige undersøgelser af væsentlig
I overensstemmelse med persondatalovens 10 kan UCL behandle (persondatalovens 7, stk 1 og 8), hvis dette alene sker med henblik på at udføre statistiske eller videnskabelige undersøgelser af væsentlig
Udvalget for Videnskab og Teknologi UVT alm. del - Bilag 252 Offentligt. Patienten i kliniske lægemiddelforsøg
 Udvalget for Videnskab og Teknologi UVT alm. del - Bilag 252 Offentligt Patienten i kliniske lægemiddelforsøg Patienten i kliniske lægemiddelforsøg Side Forord Formålet med denne pjece er at give dig og
Udvalget for Videnskab og Teknologi UVT alm. del - Bilag 252 Offentligt Patienten i kliniske lægemiddelforsøg Patienten i kliniske lægemiddelforsøg Side Forord Formålet med denne pjece er at give dig og
Indenrigs- og Sundhedsministeriet
 Indenrigs- og Sundhedsministeriet Høring over udkast til lovforslag om videnskabsetisk behandling af sundhedsvidenskabelige forskningsprojekter. Lægemiddelstyrelsen har modtaget ovennævnte udkast til lovforslag
Indenrigs- og Sundhedsministeriet Høring over udkast til lovforslag om videnskabsetisk behandling af sundhedsvidenskabelige forskningsprojekter. Lægemiddelstyrelsen har modtaget ovennævnte udkast til lovforslag
Vejledning om akutte forsøg
 Dato: 19. december 2016 Sagsnr. 1608526 Dok.nr. 259875 MLN.DKETIK Holbergsgade 6 1057 København K T: +45 72 26 93 70 M: kontakt@nvk.dk W: www.nvk.dk Vejledning om akutte forsøg 1. Indledning 2. Generelle
Dato: 19. december 2016 Sagsnr. 1608526 Dok.nr. 259875 MLN.DKETIK Holbergsgade 6 1057 København K T: +45 72 26 93 70 M: kontakt@nvk.dk W: www.nvk.dk Vejledning om akutte forsøg 1. Indledning 2. Generelle
Patienters retsstilling
 Patienters retsstilling Baggrund Sundhedsloven Afsnit III Patienters retsstilling Vejledninger Vejledning om information og samtykke og om videregivelse af helbredsoplysninger mv. Vejledning om sundhedspersoners
Patienters retsstilling Baggrund Sundhedsloven Afsnit III Patienters retsstilling Vejledninger Vejledning om information og samtykke og om videregivelse af helbredsoplysninger mv. Vejledning om sundhedspersoners
Deltagerinformation om deltagelse i videnskabeligt forsøg om tape stripping
 Deltagerinformation om deltagelse i videnskabeligt forsøg om tape stripping Forsøgets titel: Hud transkriptomet Vi skriver til dig for at spørge om du vil deltage i et videnskabeligt forsøg, der udføres
Deltagerinformation om deltagelse i videnskabeligt forsøg om tape stripping Forsøgets titel: Hud transkriptomet Vi skriver til dig for at spørge om du vil deltage i et videnskabeligt forsøg, der udføres
Vejledning om ansvarsforholdene mv. ved lægers brug af telemedicin
 Vejledning om ansvarsforholdene mv. ved lægers brug af telemedicin 1 Indledning og baggrund Ved telemedicin forstås i denne vejledning, at en læge ved hjælp af video, billeder, lyd og måleresultater inddrager
Vejledning om ansvarsforholdene mv. ved lægers brug af telemedicin 1 Indledning og baggrund Ved telemedicin forstås i denne vejledning, at en læge ved hjælp af video, billeder, lyd og måleresultater inddrager
københavns universitet det natur- og biovidenskabelige fakultet DELTAGERINFORMATION OM FORSKNINGSPROJEKTET SKOT III MØDRE
 københavns universitet det natur- og biovidenskabelige fakultet DELTAGERINFORMATION OM FORSKNINGSPROJEKTET SKOT III MØDRE Hvem kan deltage 3 Aktiviteter i forsøget 3 Oversigt over aktiviteter i forsøget
københavns universitet det natur- og biovidenskabelige fakultet DELTAGERINFORMATION OM FORSKNINGSPROJEKTET SKOT III MØDRE Hvem kan deltage 3 Aktiviteter i forsøget 3 Oversigt over aktiviteter i forsøget
Retningslinjer for komitésystemets behandling sundhedsvidenskabelige forskningsprojekter, som gennemføres i akutte situationer.
 Holbergsgade 6 DK-1057 København K Tel +45 7226 9370 dketik@dketik.dk www.dnvk.dk 23. august 2013 Sags nr.: 1302923 Dok nr.: 1275779 Sagsbeh.: MVI.DKETIK Retningslinjer for komitésystemets behandling sundhedsvidenskabelige
Holbergsgade 6 DK-1057 København K Tel +45 7226 9370 dketik@dketik.dk www.dnvk.dk 23. august 2013 Sags nr.: 1302923 Dok nr.: 1275779 Sagsbeh.: MVI.DKETIK Retningslinjer for komitésystemets behandling sundhedsvidenskabelige
1. Undersøgelsesmetoder, der hører under begrebet omfattende kortlægning
 Version 5 RETNINGSLINJER for Komitésystemets behandling af sundhedsvidenskabelige forskningsprojekter med omfattende kortlægning af individets arvemasse Holbergsgade 6 DK-1057 København K Tel +45 7226
Version 5 RETNINGSLINJER for Komitésystemets behandling af sundhedsvidenskabelige forskningsprojekter med omfattende kortlægning af individets arvemasse Holbergsgade 6 DK-1057 København K Tel +45 7226
Vejledning om anmeldelse m.v. af et biomedicinsk forskningsprojekt til det videnskabsetiske komitésystem
 Vejledning om anmeldelse m.v. af et biomedicinsk forskningsprojekt til det videnskabsetiske komitésystem 1 2 Vejledning om anmeldelse m.v. af et biomedicinsk forskningsprojekt til det videnskabsetiske
Vejledning om anmeldelse m.v. af et biomedicinsk forskningsprojekt til det videnskabsetiske komitésystem 1 2 Vejledning om anmeldelse m.v. af et biomedicinsk forskningsprojekt til det videnskabsetiske
Testsagen 2016 Kvalitetsudvikling af komitésystemet
 Testsagen 2016 Kvalitetsudvikling af komitésystemet Direktør, dr. pæd., aut. psykolog, Mads Hermansen Medlem af NVK Strukturering af undersøgelse og drøftelse Kort indledende oplæg (ca. 10 min) Præsentation
Testsagen 2016 Kvalitetsudvikling af komitésystemet Direktør, dr. pæd., aut. psykolog, Mads Hermansen Medlem af NVK Strukturering af undersøgelse og drøftelse Kort indledende oplæg (ca. 10 min) Præsentation
Version Vejledning om brug af biologisk materiale i sundhedsvidenskabelige forskningsprojekter
 Version 1 17.01.2017 Vejledning om brug af biologisk materiale i sundhedsvidenskabelige forskningsprojekter Indhold 1 Indledning 4 2 Definitioner og begreber 5 2.1 Biologisk materiale 5 2.2 Vævsafgiver
Version 1 17.01.2017 Vejledning om brug af biologisk materiale i sundhedsvidenskabelige forskningsprojekter Indhold 1 Indledning 4 2 Definitioner og begreber 5 2.1 Biologisk materiale 5 2.2 Vævsafgiver
Uddrag af bekendtgørelse af sundhedsloven
 Myndighed: Ministeriet for Sundhed og Forebyggelse Udskriftsdato: 21. august 2016 (Gældende) Uddrag af bekendtgørelse af sundhedsloven 1-35. (Udelades) Kapitel 8 Aktindsigt 36. Reglerne i dette kapitel
Myndighed: Ministeriet for Sundhed og Forebyggelse Udskriftsdato: 21. august 2016 (Gældende) Uddrag af bekendtgørelse af sundhedsloven 1-35. (Udelades) Kapitel 8 Aktindsigt 36. Reglerne i dette kapitel
Appendix 2. Det menneskelige genom retlig regulering i klinisk og forskningsmæssig sammenhæng
 Appendix 2 Det menneskelige genom retlig regulering i klinisk og forskningsmæssig sammenhæng Indledning I dette bilag beskrives udvalgte dele af den retlige regulering, der omgiver udforskningen af det
Appendix 2 Det menneskelige genom retlig regulering i klinisk og forskningsmæssig sammenhæng Indledning I dette bilag beskrives udvalgte dele af den retlige regulering, der omgiver udforskningen af det
Vejledning om anmeldelse, indberetningspligt mv. (sundhedsvidenskabelige forskningsprojekter)
 Vejledning om anmeldelse, indberetningspligt mv. (sundhedsvidenskabelige forskningsprojekter) Den Nationale Videnskabsetiske Komité Januar 2012 Indholdsfortegnelse 1. Indledning... 5 2. Hvad skal anmeldes...
Vejledning om anmeldelse, indberetningspligt mv. (sundhedsvidenskabelige forskningsprojekter) Den Nationale Videnskabsetiske Komité Januar 2012 Indholdsfortegnelse 1. Indledning... 5 2. Hvad skal anmeldes...
Patientinformation vedrørende omfattende genetisk analyse. 1. udgave
 Patientinformation vedrørende omfattende genetisk analyse 1. udgave Indholdsfortegnelse Indledning... 3 Hvad er gener?... 3 Omfattende genetisk analyse... 3 Hvordan foregår undersøgelsen?... 3 Hvilke resultater
Patientinformation vedrørende omfattende genetisk analyse 1. udgave Indholdsfortegnelse Indledning... 3 Hvad er gener?... 3 Omfattende genetisk analyse... 3 Hvordan foregår undersøgelsen?... 3 Hvilke resultater
Hvidovre Hospital Gynækologisk-Obstetrisk afdeling. Deltagerinformation
 August 2012 Hvidovre Hospital Gynækologisk-Obstetrisk afdeling Deltagerinformation for det videnskabelige forsøg: Formodning af livmoderhalsen med misoprostol ved graviditet efter terminen Modning af de
August 2012 Hvidovre Hospital Gynækologisk-Obstetrisk afdeling Deltagerinformation for det videnskabelige forsøg: Formodning af livmoderhalsen med misoprostol ved graviditet efter terminen Modning af de
Retningslinjer for sygeplejestuderendes indsamling af patientdata til brug i interne opgaver og udviklingsprojekter
 Sygeplejerskeuddannelsen Retningslinjer for sygeplejestuderendes indsamling af patientdata til brug i interne opgaver og udviklingsprojekter Februar 2018 Disse retningslinjer gælder interne opgaver og
Sygeplejerskeuddannelsen Retningslinjer for sygeplejestuderendes indsamling af patientdata til brug i interne opgaver og udviklingsprojekter Februar 2018 Disse retningslinjer gælder interne opgaver og
19. Lægers deltagelse i aktiviteter og modtagelse af ydelser finansieret af virksomheder
 Lægeforeningen Lægeforeningens etiske regler Indhold 1. Formål 2. Omhu og samvittighedsfuldhed 3. Forsvarlig lægevirksomhed 4. Information og samtykke 5. Patientens krav på diskretion/den lægelige tavshedspligt
Lægeforeningen Lægeforeningens etiske regler Indhold 1. Formål 2. Omhu og samvittighedsfuldhed 3. Forsvarlig lægevirksomhed 4. Information og samtykke 5. Patientens krav på diskretion/den lægelige tavshedspligt
Biologiske signaler i graviditeten - Genetisk information
 Biologiske signaler i graviditeten - Genetisk information 2 Vi vil spørge, om du vil deltage i et videnskabeligt studie, der udføres af Afdeling for Epidemiologisk Forskning, Statens Serum Institut. Før
Biologiske signaler i graviditeten - Genetisk information 2 Vi vil spørge, om du vil deltage i et videnskabeligt studie, der udføres af Afdeling for Epidemiologisk Forskning, Statens Serum Institut. Før
Bemærkninger til høringssvar
 Bemærkninger til høringssvar Høringssvar fra Bemærkninger Lægemiddelstyrelsens bemærkninger Den Videnskabsetiske Ingen bemærkninger Ingen bemærkninger Komité for Region Nordjylland GCP-enheden ved Odense
Bemærkninger til høringssvar Høringssvar fra Bemærkninger Lægemiddelstyrelsens bemærkninger Den Videnskabsetiske Ingen bemærkninger Ingen bemærkninger Komité for Region Nordjylland GCP-enheden ved Odense
Juridiske retningslinjer for indsamling af patientdata til brug i opgaver og projekter
 Sygeplejerskeuddannelsen Juridiske retningslinjer for indsamling af patientdata til brug i opgaver og projekter Revideret 30. august 2016 1 Indholdsfortegnelse 1. Indledning 3 2. Informeret samtykke 3
Sygeplejerskeuddannelsen Juridiske retningslinjer for indsamling af patientdata til brug i opgaver og projekter Revideret 30. august 2016 1 Indholdsfortegnelse 1. Indledning 3 2. Informeret samtykke 3
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Patientinformation Fase III randomiseret undersøgelse af lav-dosis helkropsbestråling og
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Patientinformation Fase III randomiseret undersøgelse af lav-dosis helkropsbestråling og
Bekendtgørelse om information og samtykke i forbindelse med behandling og vedog om videregivelse og indhentning af helbredsoplysninger m.v.
 Bekendtgørelse om information og samtykke i forbindelse med behandling og vedog om videregivelse og indhentning af helbredsoplysninger m.v. I medfør af 15, stk. 5, 16, stk. 6, 42, stk. 2, 42 e, stk. 32,
Bekendtgørelse om information og samtykke i forbindelse med behandling og vedog om videregivelse og indhentning af helbredsoplysninger m.v. I medfør af 15, stk. 5, 16, stk. 6, 42, stk. 2, 42 e, stk. 32,
Protokolresume: nyretumorer, dels spredning af tumorceller i forbindelse med udtagning af vævsprøve.
 Protokolresume: Forsøgets titel: Perfusion skanning af nyretumorer Forsøgsansvarlige: Overlæge Nessn H. Azawi, Urologisk afdeling D, Roskilde Sygehus. Formål: At forbedre diagnostikken mhp. at undgå dels
Protokolresume: Forsøgets titel: Perfusion skanning af nyretumorer Forsøgsansvarlige: Overlæge Nessn H. Azawi, Urologisk afdeling D, Roskilde Sygehus. Formål: At forbedre diagnostikken mhp. at undgå dels
Patientinformation. PET ved non-hodgkin lymfom
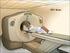 Side 1 af 6 Patientinformation PET ved non-hodgkin lymfom De har for nylig fået konstateret non-hodgkin lymfom (lymfekræft). I den anledning vil vi spørge, om De ønsker at deltage i et videnskabeligt projekt,
Side 1 af 6 Patientinformation PET ved non-hodgkin lymfom De har for nylig fået konstateret non-hodgkin lymfom (lymfekræft). I den anledning vil vi spørge, om De ønsker at deltage i et videnskabeligt projekt,
Deltagerinformation 06-11-2009 INFORMATION TIL DELTAGERE
 INFORMATION TIL DELTAGERE H1N1v vaccination af gravide kvinder. Et kohortestudie til karakterisering af den beskyttende effekt af Influenza A H1N1v vaccine hos gravide kvinder: Delstudium i ABC (Asthma
INFORMATION TIL DELTAGERE H1N1v vaccination af gravide kvinder. Et kohortestudie til karakterisering af den beskyttende effekt af Influenza A H1N1v vaccine hos gravide kvinder: Delstudium i ABC (Asthma
Den Videnskabsetiske Komité for Region Sjælland har behandlet det anmeldte forskningsprojekt på sit møde den 9. oktober 2017.
 Læge, PhD studerende Nina Christine Andersen-Ranberg Sjællands Universitetshospital Anæstesiologisk afdeling Lykkebækvej 1 4600 Køge Dato: 14. oktober 2017 Brevid: 3395076 Komitéens betingede godkendelse
Læge, PhD studerende Nina Christine Andersen-Ranberg Sjællands Universitetshospital Anæstesiologisk afdeling Lykkebækvej 1 4600 Køge Dato: 14. oktober 2017 Brevid: 3395076 Komitéens betingede godkendelse
Aarhus Universitetshospital
 Anmodning om deltagelse i det videnskabelige forsøg: Behandling af patienter med langvarige helbredsproblemer (kroniske funktionelle lidelser) med medicin Originaltitel: Behandling af multi-organ bodily
Anmodning om deltagelse i det videnskabelige forsøg: Behandling af patienter med langvarige helbredsproblemer (kroniske funktionelle lidelser) med medicin Originaltitel: Behandling af multi-organ bodily
Høring over bekendtgørelser og vejledninger om væv og celler samt assisteret
 NOTAT 24. oktober 2014 J.nr.: 1406108 Dok. nr.: 1559218 HKJ.DKETIK Høring over bekendtgørelser og vejledninger om væv og celler samt assisteret reproduktion har modtaget bekendtgørelser og vejledninger
NOTAT 24. oktober 2014 J.nr.: 1406108 Dok. nr.: 1559218 HKJ.DKETIK Høring over bekendtgørelser og vejledninger om væv og celler samt assisteret reproduktion har modtaget bekendtgørelser og vejledninger
SYGEPLEJERSKEUDDAELSE ODESE
 SYGEPLEJERSKEUDDAELSE ODESE Juridiske retningslinjer for prøver Indhold Retningslinjer for deltagelse eller inddragelse af patienter i interne kliniske prøver ved Sygeplejerskeuddannelsen Odense... 3 Retningslinjer
SYGEPLEJERSKEUDDAELSE ODESE Juridiske retningslinjer for prøver Indhold Retningslinjer for deltagelse eller inddragelse af patienter i interne kliniske prøver ved Sygeplejerskeuddannelsen Odense... 3 Retningslinjer
Deltagerinformation om deltagelse i et videnskabeligt projekt
 1 Deltagerinformation om videnskabeligt projekt om mulig sammenhæng mellem fertilitetsbehandling og Deltagerinformation om deltagelse i et videnskabeligt projekt Projektets titel: Undersøgelse af mulig
1 Deltagerinformation om videnskabeligt projekt om mulig sammenhæng mellem fertilitetsbehandling og Deltagerinformation om deltagelse i et videnskabeligt projekt Projektets titel: Undersøgelse af mulig
Deltagerinformation om deltagelse i et videnskabeligt forsøg.
 Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Autoimmunitet ved knoglemarvssvigt Vi vil spørge, om du vil deltage i et videnskabeligt forsøg, der udføres af læge, ph.d.
Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Autoimmunitet ved knoglemarvssvigt Vi vil spørge, om du vil deltage i et videnskabeligt forsøg, der udføres af læge, ph.d.
Vejledning til udfyldelse af anmeldelsesskema til Datatilsynet
 Afdeling: Direktionssekretariatet Udarbejdet af: Dorte Riskjær Larsen Sagsnr.: 13/1121 E-mail: dorte.riskjaer.larsen @ouh.regionsyddanmark.dk Dato: 26. september 2013 Telefon: 2128 4616 Vejledning til
Afdeling: Direktionssekretariatet Udarbejdet af: Dorte Riskjær Larsen Sagsnr.: 13/1121 E-mail: dorte.riskjaer.larsen @ouh.regionsyddanmark.dk Dato: 26. september 2013 Telefon: 2128 4616 Vejledning til
Vejledning om videregivelse. af personoplysninger til brug for forskning og statistik
 Vejledning om videregivelse af personoplysninger til brug for forskning og statistik 1 Indholdsfortegnelse 1. Baggrund 2. Definitioner 2.1. Personoplysning 2.2. Anonymiseret personoplysning (i persondatalovens
Vejledning om videregivelse af personoplysninger til brug for forskning og statistik 1 Indholdsfortegnelse 1. Baggrund 2. Definitioner 2.1. Personoplysning 2.2. Anonymiseret personoplysning (i persondatalovens
Regionen - Tværregionale dokumenter - 1. Ledelse Dokumentation og datastyring
 Regionen - Tværregionale dokumenter - 1. Ledelse - 1.7 Dokumentation og datastyring Dokumentbrugere: Forfatter: Fri, OUH, Psykiatri, SVS, SLB, SHS Læseadgang: Alle Tværregionale dokumenter Emne: Tværregionale
Regionen - Tværregionale dokumenter - 1. Ledelse - 1.7 Dokumentation og datastyring Dokumentbrugere: Forfatter: Fri, OUH, Psykiatri, SVS, SLB, SHS Læseadgang: Alle Tværregionale dokumenter Emne: Tværregionale
Juridiske retningslinjer for indsamling af patientdata
 INFORMATION Juridiske retningslinjer for indsamling af patientdata Til brug i opgaver og projekter Sygeplejerskeuddannelsen i Vejle Marts 2018 TS: 1317137 Indhold 1. Indledning... 3 2. Informeret samtykke...
INFORMATION Juridiske retningslinjer for indsamling af patientdata Til brug i opgaver og projekter Sygeplejerskeuddannelsen i Vejle Marts 2018 TS: 1317137 Indhold 1. Indledning... 3 2. Informeret samtykke...
Revideret den 14. juni 2013 Juridiske retningslinjer for indsamling af patientdata til brug i opgaver og projekter
 Campus Sønderborg Revideret den 14. juni 2013 Juridiske retningslinjer for indsamling af patientdata til brug i opgaver og projekter 1. Indledning Formålet med Sygeplejerskeuddannelsen er at kvalificere
Campus Sønderborg Revideret den 14. juni 2013 Juridiske retningslinjer for indsamling af patientdata til brug i opgaver og projekter 1. Indledning Formålet med Sygeplejerskeuddannelsen er at kvalificere
Sundheds- og Ældreministeriet Holbergsgade København K Danmark med kopi til
 Sundheds- og Ældreministeriet Holbergsgade 6 1057 København K Danmark E-mail: sum@sum.dk med kopi til lepo@sum.dk W I L D E R S P L A D S 8 K 1 4 0 3 K Ø BENHAVN K T E L E F O N 3 2 6 9 8 8 8 8 M O B I
Sundheds- og Ældreministeriet Holbergsgade 6 1057 København K Danmark E-mail: sum@sum.dk med kopi til lepo@sum.dk W I L D E R S P L A D S 8 K 1 4 0 3 K Ø BENHAVN K T E L E F O N 3 2 6 9 8 8 8 8 M O B I
Aarhus Universitetshospital
 Anmodning om deltagelse i det videnskabelige forsøg: Behandling af patienter med langvarige helbredsproblemer (kroniske funktionelle lidelser) med gruppeterapi Originaltitel: Behandling af multi-organ
Anmodning om deltagelse i det videnskabelige forsøg: Behandling af patienter med langvarige helbredsproblemer (kroniske funktionelle lidelser) med gruppeterapi Originaltitel: Behandling af multi-organ
https://www.retsinformation.dk/forms/r0710.aspx?id=21075
 Page 1 of 5 Til forsiden af retsinformation.dk Kapitel 1 Kapitel 2 Kapitel 3 Kapitel 4 Kapitel 5 Oversigt (indholdsfortegnelse) Informeret samtykke Samtykke til videregivelse af helbredsoplysninger mv.
Page 1 of 5 Til forsiden af retsinformation.dk Kapitel 1 Kapitel 2 Kapitel 3 Kapitel 4 Kapitel 5 Oversigt (indholdsfortegnelse) Informeret samtykke Samtykke til videregivelse af helbredsoplysninger mv.
Vejledning om genomforsøg
 Vejledning om genomforsøg Holbergsgade 6 1057 København K T: +45 72 26 93 70 M: kontakt@nvk.dk W: www.nvk.dk Indhold: 1. Undersøgelsesmetoder, der hører under begrebet omfattende kortlægning af individets
Vejledning om genomforsøg Holbergsgade 6 1057 København K T: +45 72 26 93 70 M: kontakt@nvk.dk W: www.nvk.dk Indhold: 1. Undersøgelsesmetoder, der hører under begrebet omfattende kortlægning af individets
Patienters retsstilling
 Patienters retsstilling 20 Uppskot til ríkislógartilmæli um at seta í gildi fyri Føroyar "lov om patienters retsstilling" Viðgerðin av heimildarlógini á fólkatingi Anordning om ikrafttræden på Færøerne
Patienters retsstilling 20 Uppskot til ríkislógartilmæli um at seta í gildi fyri Føroyar "lov om patienters retsstilling" Viðgerðin av heimildarlógini á fólkatingi Anordning om ikrafttræden på Færøerne
Koagulationsprofil hos patienter som opereres for lungekræft - et randomiseret, kontrolleret studie
 Deltagerinformation Forsøgets titel: Koagulationsprofil hos patienter som opereres for lungekræft - et randomiseret, kontrolleret studie Vi vil spørge, om De vil deltage i et videnskabeligt forsøg, der
Deltagerinformation Forsøgets titel: Koagulationsprofil hos patienter som opereres for lungekræft - et randomiseret, kontrolleret studie Vi vil spørge, om De vil deltage i et videnskabeligt forsøg, der
Deltagerinformation. Et videnskabeligt forsøg med to forskellige doseringer af strålebehandling til patienter opereret for brystkræft
 Deltagerinformation Et videnskabeligt forsøg med to forskellige doseringer af strålebehandling til patienter opereret for brystkræft Protokoltitel: Hypofraktioneret versus normofraktioneret helbrystbestråling
Deltagerinformation Et videnskabeligt forsøg med to forskellige doseringer af strålebehandling til patienter opereret for brystkræft Protokoltitel: Hypofraktioneret versus normofraktioneret helbrystbestråling
Forslag til lov om videnskabsetisk behandling af sundhedsvidenskabelige
 Udvalget vedrørende Det Etiske Råd 2010-11 UER alm. del Bilag 12 Offentligt UDKAST Forslag til lov om videnskabsetisk behandling af sundhedsvidenskabelige forskningsprojekter Kapitel 1 Lovens område 1.
Udvalget vedrørende Det Etiske Råd 2010-11 UER alm. del Bilag 12 Offentligt UDKAST Forslag til lov om videnskabsetisk behandling af sundhedsvidenskabelige forskningsprojekter Kapitel 1 Lovens område 1.
11 forskningsprojekter, der ikke angår kliniske forsøg med lægemidler
 Ministeriet for Sundhed og Forebyggelse spok@sum.dk Holbergsgade 6 DK-1057 København K Tel +45 7221 6860 info@dketik.dk www.dnvk.dk Redegørelse til Folketingets Sundhedsudvalg om akutforskning 29. april
Ministeriet for Sundhed og Forebyggelse spok@sum.dk Holbergsgade 6 DK-1057 København K Tel +45 7221 6860 info@dketik.dk www.dnvk.dk Redegørelse til Folketingets Sundhedsudvalg om akutforskning 29. april
Landstingsforordning nr. 6 af 31. maj 2001 om patienters retsstilling
 Landstingsforordning nr. 6 af 31. maj 2001 om patienters retsstilling I medfør af 1 og 3 i lov nr. 369 af 6. juni 1991 om sundhedsvæsenet i Grønland fastsættes: Kapitel 1. Formål, anvendelsesområde, definitioner
Landstingsforordning nr. 6 af 31. maj 2001 om patienters retsstilling I medfør af 1 og 3 i lov nr. 369 af 6. juni 1991 om sundhedsvæsenet i Grønland fastsættes: Kapitel 1. Formål, anvendelsesområde, definitioner
Forespørgsel om at deltage i forskningsprojektet STATICH: Blodfortyndende behandling efter hjerneblødning
 Forespørgsel om at deltage i forskningsprojektet STATICH: Blodfortyndende behandling efter hjerneblødning Vi vil spørge, om du vil deltage i et videnskabeligt forsøg. Det er frivilligt at deltage i forsøget.
Forespørgsel om at deltage i forskningsprojektet STATICH: Blodfortyndende behandling efter hjerneblødning Vi vil spørge, om du vil deltage i et videnskabeligt forsøg. Det er frivilligt at deltage i forsøget.
Udkast Vejledning om sterilisation
 1. juli 2014 Sagsnr. 2014032074 Udkast Vejledning om sterilisation Indhold Indledning 2 Del 1: Sterilisation uden tilladelse 3 1. Fremgangsmåde ved anmodning om sterilisation, der ikke kræver tilladelse
1. juli 2014 Sagsnr. 2014032074 Udkast Vejledning om sterilisation Indhold Indledning 2 Del 1: Sterilisation uden tilladelse 3 1. Fremgangsmåde ved anmodning om sterilisation, der ikke kræver tilladelse
Videnskabsetisk komite og biobanker. Dansk Selskab for Good Clinical Practice 28. januar 2015 Lone Gundelach
 Videnskabsetisk komite og biobanker Dansk Selskab for Good Clinical Practice 28. januar 2015 De videnskabsetiske komiteer Anmeldelsespligtigt: Forsøg hvor man ønsker at opnå viden om menneskets biologi
Videnskabsetisk komite og biobanker Dansk Selskab for Good Clinical Practice 28. januar 2015 De videnskabsetiske komiteer Anmeldelsespligtigt: Forsøg hvor man ønsker at opnå viden om menneskets biologi
Vejledning til udfyldelse af anmeldelsesskemaet for Sundhedsvidenskabelig
 Gældende fra 2. marts 2015 og erstatter tidligere vejledninger Vejledning til udfyldelse af anmeldelsesskemaet for Sundhedsvidenskabelig forskning i Region Syddanmark Generelt om anmeldelse Alle forskningsprojekter
Gældende fra 2. marts 2015 og erstatter tidligere vejledninger Vejledning til udfyldelse af anmeldelsesskemaet for Sundhedsvidenskabelig forskning i Region Syddanmark Generelt om anmeldelse Alle forskningsprojekter
Forretningsorden for bestyrelsen i Danmarks Frie Forskningsfond
 Forretningsorden for bestyrelsen i Danmarks Frie Forskningsfond Forretningsordenen har hjemmel i 20, stk. 1, i lov nr. 384 af 26. april 2017 om Danmarks Forsknings- og Innovationspolitiske Råd og Danmarks
Forretningsorden for bestyrelsen i Danmarks Frie Forskningsfond Forretningsordenen har hjemmel i 20, stk. 1, i lov nr. 384 af 26. april 2017 om Danmarks Forsknings- og Innovationspolitiske Råd og Danmarks
Genoptræning af hukommelse og opmærksomhed hos tidligere depressionsramte gennem opgave-baseret mental træning.
 Information til projektdeltagere (raske forsøgspersoner) om deltagelse i et videnskabeligt forsøg: Genoptræning af hukommelse og opmærksomhed hos tidligere depressionsramte gennem opgave-baseret mental
Information til projektdeltagere (raske forsøgspersoner) om deltagelse i et videnskabeligt forsøg: Genoptræning af hukommelse og opmærksomhed hos tidligere depressionsramte gennem opgave-baseret mental
Forslag. Lov om videnskabsetisk behandling af sundhedsvidenskabelige forskningsprojekter 1)
 2010/1 LSF 169 (Gældende) Udskriftsdato: 1. juli 2016 Ministerium: Indenrigs- og Sundhedsministeriet Journalnummer: Indenrigs- og Sundhedsmin. Fremsat den 17. marts 2011 af indenrigs- og sundhedsministeren
2010/1 LSF 169 (Gældende) Udskriftsdato: 1. juli 2016 Ministerium: Indenrigs- og Sundhedsministeriet Journalnummer: Indenrigs- og Sundhedsmin. Fremsat den 17. marts 2011 af indenrigs- og sundhedsministeren
Deltagerinformation 10-5-2010 INFORMATION TIL DELTAGERE
 INFORMATION TIL DELTAGERE H1N1v vaccination af gravide kvinder. Et kohortestudie til karakterisering af den beskyttende effekt af Influenza A H1N1v vaccine hos gravide kvinder: Vi henvender os til dig
INFORMATION TIL DELTAGERE H1N1v vaccination af gravide kvinder. Et kohortestudie til karakterisering af den beskyttende effekt af Influenza A H1N1v vaccine hos gravide kvinder: Vi henvender os til dig
Anordning om ikrafttræden for Færøerne af lov om videnskabsetisk behandling af sundhedsvidenskabelige forskningsprojekter
 Givið út 26. juli 2013 15. juli 2013. Nr. 961. Anordning om ikrafttræden for Færøerne af lov om videnskabsetisk behandling af sundhedsvidenskabelige forskningsprojekter VI MARGRETHE DEN ANDEN, af Guds
Givið út 26. juli 2013 15. juli 2013. Nr. 961. Anordning om ikrafttræden for Færøerne af lov om videnskabsetisk behandling af sundhedsvidenskabelige forskningsprojekter VI MARGRETHE DEN ANDEN, af Guds
Indhentning af samtykke i CLASSIC forsøget. Version 1.1
 v1.1 20-12-2018 Indhentning af samtykke i CLASSIC forsøget Version 1.1 Generelt Ved akutforsøg med lægemidler følges anvisningerne fra Videnskabsetisk Komité. Akutte lægemiddelforsøg kan kun gennemføres
v1.1 20-12-2018 Indhentning af samtykke i CLASSIC forsøget Version 1.1 Generelt Ved akutforsøg med lægemidler følges anvisningerne fra Videnskabsetisk Komité. Akutte lægemiddelforsøg kan kun gennemføres
Oversigt - adgang til Region Midtjyllands elektroniske patientjournaler, herunder e-journal
 11. november 2013 TL/PC/NS Oversigt - adgang til Region Midtjyllands elektroniske patientjournaler, herunder e-journal Udgangspunktet for denne foreløbige oversigt om mulighederne for adgang til elektroniske
11. november 2013 TL/PC/NS Oversigt - adgang til Region Midtjyllands elektroniske patientjournaler, herunder e-journal Udgangspunktet for denne foreløbige oversigt om mulighederne for adgang til elektroniske
Vejledning om registrering af faderskab og medmoderskab i forbindelse med anmeldelse af barnets fødsel
 Social-, Børne- og Integrationsministeriet Familieret 2013-4392 bgn 18. november 2013 Udkast til Vejledning om registrering af faderskab og medmoderskab i forbindelse med anmeldelse af barnets fødsel (Til
Social-, Børne- og Integrationsministeriet Familieret 2013-4392 bgn 18. november 2013 Udkast til Vejledning om registrering af faderskab og medmoderskab i forbindelse med anmeldelse af barnets fødsel (Til
Blodprøveanalyser og biobank fra navlesnorsblod hos nyfødte
 Deltagerinformation Blodprøveanalyser og biobank fra navlesnorsblod hos nyfødte Tilbud til alle, der fødes på Rigshospitalet og Herlev Hospital Hvis du ønsker at deltage i projektet, kan du finde samtykkearket
Deltagerinformation Blodprøveanalyser og biobank fra navlesnorsblod hos nyfødte Tilbud til alle, der fødes på Rigshospitalet og Herlev Hospital Hvis du ønsker at deltage i projektet, kan du finde samtykkearket
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation i forbindelse med videnskabelig undersøgelse af patienter med lymfeknudekræft.
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation i forbindelse med videnskabelig undersøgelse af patienter med lymfeknudekræft.
Juridiske retningslinjer for indsamling af patientdata til brug i opgaver og projekter
 Sygeplejerskeuddannelsens Ledernetværk Revideret senest den 14. juni 2013 Juridiske retningslinjer for indsamling af patientdata til brug i opgaver og projekter 1. Indledning Formålet med Sygeplejerskeuddannelsen
Sygeplejerskeuddannelsens Ledernetværk Revideret senest den 14. juni 2013 Juridiske retningslinjer for indsamling af patientdata til brug i opgaver og projekter 1. Indledning Formålet med Sygeplejerskeuddannelsen
Høring over udkast til forslag til Lov om kliniske forsøg med lægemidler. Det Etiske Råd takker for tilsendelse af ovennævnte i høring.
 Til Sundheds- og Ældreministeriet Center for psykiatri og lægemiddelpolitik Holbergsgade 6, 1057 København K psykmed@sum.dk med kopi til hbj@sum.dk og jjo@sum.dk Holbergsgade 6 1057 København K Tel + 45
Til Sundheds- og Ældreministeriet Center for psykiatri og lægemiddelpolitik Holbergsgade 6, 1057 København K psykmed@sum.dk med kopi til hbj@sum.dk og jjo@sum.dk Holbergsgade 6 1057 København K Tel + 45
Deltagerinformation og samtykkeerklæring ved deltagelse i en videnskabelig undersøgelse. NeoCol
 Deltagerinformation og samtykkeerklæring ved deltagelse i en videnskabelig undersøgelse NeoCol En undersøgelse, der belyser effekten af kombinationskemoterapi før operation hos patienter med tyktarmskræft
Deltagerinformation og samtykkeerklæring ved deltagelse i en videnskabelig undersøgelse NeoCol En undersøgelse, der belyser effekten af kombinationskemoterapi før operation hos patienter med tyktarmskræft
- Debatspørgsmål fra Det Etiske Råd - April 2000 Donoranonymitet
 Forside - Indhold - Top/ Bund - Forrige/ Næste - Resumé - Udgivelser - Bestil "Kunstig befrugtning - Debatspørgsmål fra Det Etiske Råd - Donoranonymitet" Kunstig befrugtning - Debatspørgsmål fra Det Etiske
Forside - Indhold - Top/ Bund - Forrige/ Næste - Resumé - Udgivelser - Bestil "Kunstig befrugtning - Debatspørgsmål fra Det Etiske Råd - Donoranonymitet" Kunstig befrugtning - Debatspørgsmål fra Det Etiske
Sundhedslovens Kapitel 9
 Sundhedslovens Kapitel 9 Kapitel 9 Tavshedspligt, videregivelse og indhentning af helbredsoplysninger m.v. 40. En patient har krav på, at sundhedspersoner iagttager tavshed om, hvad de under udøvelsen
Sundhedslovens Kapitel 9 Kapitel 9 Tavshedspligt, videregivelse og indhentning af helbredsoplysninger m.v. 40. En patient har krav på, at sundhedspersoner iagttager tavshed om, hvad de under udøvelsen
Deltager information
 READ, Bilag 10 Fortroligt Side 1 af 7 Deltager information Protokol DBCG 07-READ, dateret 15. oktober 2009. Et videnskabeligt forsøg med to forskellige kombinationer af kemoterapi til patienter med brystkræft.
READ, Bilag 10 Fortroligt Side 1 af 7 Deltager information Protokol DBCG 07-READ, dateret 15. oktober 2009. Et videnskabeligt forsøg med to forskellige kombinationer af kemoterapi til patienter med brystkræft.
Loven om kunstig befrugtning. U-kursus i Reproduktionsmedicin 29/1 2014 Thue Bryndorf
 Loven om kunstig befrugtning U-kursus i Reproduktionsmedicin 29/1 2014 Thue Bryndorf Christina & Dennis Christina 26 år, Dennis 29 år, ingen fælles børn, 3 års uhonoreret grav-ønske Henvender sig på privat
Loven om kunstig befrugtning U-kursus i Reproduktionsmedicin 29/1 2014 Thue Bryndorf Christina & Dennis Christina 26 år, Dennis 29 år, ingen fælles børn, 3 års uhonoreret grav-ønske Henvender sig på privat
Metronidazol til behandling af dientamoebiasis hos børn i Danmark - Et randomiseret, placebo-kontrolleret, dobbeltblindet klinisk studie
 Deltagerinformation til forældre I er netop blevet spurgt om jeres barn må deltage i studiet: Metronidazol til behandling af dientamoebiasis hos børn i Danmark - Et randomiseret, placebo-kontrolleret,
Deltagerinformation til forældre I er netop blevet spurgt om jeres barn må deltage i studiet: Metronidazol til behandling af dientamoebiasis hos børn i Danmark - Et randomiseret, placebo-kontrolleret,
