Navn. 500MBq/mL på kalibreringstidspunkte t GLUSCAN MBq/mL på kalibreringstidspunkte t GLUSCAN 500 GLUSCAN PL
|
|
|
- Rasmus Steffensen
- 7 år siden
- Visninger:
Transkript
1 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM(ER), STYRKE(R), INDGIVELSESVEJ(E), ANSØGER(E), INDEHAVER(E) AF MARKEDSFØRINGSTILLADELSE(R) I MEDLEMSSTATERNE 1
2 Medlemssta t EU/EØS Indehaver af markedsføringstilladels e Ansøger Frankrig Advanced Accelerator Applications 20 rue Diesel Saint Genis Pouilly FRANKRIG Tyskland Advanced Accelerator Applications 20 rue Diesel Saint Genis Pouilly FRANKRIG Polen Advanced Accelerator Applications Særnavn Navn GLUSCAN 500 GLUSCAN 500 GLUSCAN PL Styrke 500MBq/mL på kalibreringstidspunkte t 500MBq/mL på kalibreringstidspunkte t 500MBq/mL på kalibreringstidspunkte t Lægemiddelfor m Injektionsvæske, opløsning Injektionsvæske, opløsning Injektionsvæske, opløsning Indgivelsesve j Intravenøs anvendelse Intravenøs anvendelse Intravenøs anvendelse Indhold (Koncentration) For 1mL præparat: Fludeoxyglucose (18F) 500MBq på kalibreringstidspunktet, vand til injektion 1,00g, natriumcitrat 0,62% natriumklorid 0,41% saltsyre 0,39% ethanol 0,31% (v/v) natriumhydroxid 0,24% (v/v) For 1 ml præparat: Fludeoxyglucose (18F) 500MBq på kalibreringstidspunktet, vand til injektion 1,00g, natriumcitrat 0,62% natriumklorid 0,41% saltsyre 0,39% ethanol 0,31% (v/v) natriumhydroxid 0,24% (v/v) For 1 ml præparat: Fludeoxyglucose (18F) 500MBq på 2
3 20 rue Diesel Saint Genis Pouilly FRANKRIG Portugal Advanced Accelerator Applications 20 rue Diesel Saint Genis Pouilly FRANKRIG Spanien Advanced Accelerator Applications 20 rue Diesel Saint Genis Pouilly FRANKRIG GLUSCAN 500 GLUSCAN MBq/mL på kalibreringstidspunkte t 500MBq/mL på kalibreringstidspunkte t Injektionsvæske, opløsning Injektionsvæske, opløsning Intravenøs anvendelse Intravenøs anvendelse kalibreringstidspunktet, vand til injektion 1,00g, natriumcitrat 0,62% natriumklorid 0,41% saltsyre 0,39% ethanol 0,31% (v/v) natriumhydroxid 0,24% (v/v) For 1 ml præparat: Fludeoxyglucose (18F) 500MBq på kalibreringstidspunktet, vand til injektion 1,00g, natriumcitrat 0,62% natriumklorid 0,41% saltsyre 0,39% ethanol 0,31% (v/v) natriumhydroxid 0,24% (v/v) For 1 ml præparat: Fludeoxyglucose (18F) 500MBq på kalibreringstidspunktet, vand til injektion 1,00g, natriumcitrat 0,62% natriumklorid 0,41% 3
4 4 saltsyre 0,39% ethanol 0,31% (v/v) natriumhydroxid 0,24% (v/v)
5 BILAG II FAGLIGE KONKLUSIONER OG BEGRUNDELSER FOR POSITIV UDTALELSE FREMLAGT AF EMEA 5
6 FAGLIGE KONKLUSIONER SAMLET RESUMÉ AF DEN FAGLIGE VURDERING AF GLUSCAN 500 OG TILKNYTTEDE NAVNE (SE BILAG I) Gluscan er et radiofarmaceutisk lægemiddel, der er sammensat af fludeoxyglukose ( 18 F), forkortet som FDG. Fludeoxyglukose ( 18 F) er en glukoseanalog, der akkumuleres i alle celler, der bruger glukose som primær energikilde. Fludeoxyglukose ( 18 F) akkumuleres i tumorer med høj glukoseomsætning. Fludeoxyglukose ( 18 F) passerer blod-hjerne-barrieren, og epileptiske foci udviser en nedsat glukosemetabolisme i de anfaldsfrie faser. Fludeoxyglukose ( 18 F) akkumuleres også af myokardium, især under og efter en reversibel myokardieiskæmi, når der forekommer en øget glukoseoptagelse i myokardiecellen. Gluscan er beregnet til behandling af onkologiske, kardiologiske og neurologiske indikationer og infektiøse eller inflammatoriske sygdomme. De tre indikationer onkologi, kardiologi og neurologi er fastsat i det grundlæggende produktresumé for dette aktive stof. Disse indikationer var hver baseret på en biologisk proces, dvs. glukoseoptagelsen i specifikke organer eller væv: øget optagelse i de maligne celler, vedvarende optagelse i de levedygtige udsatte myokardieceller og nedsat optagelse i neuronerne i den hjernebark (kortex), der er ansvarlig for at fremkalde epilepsi, når patienten ikke er i en krise. Det særlige ved nærværende ansøgning er, at den foreslåede indikation i infektiøse eller inflammatoriske sygdomme for tiden ikke er en del af det grundlæggende produktresumé for FDG. Som med de andre indikationer i det grundlæggende produktresumé er indikationen i infektiøse eller inflammatoriske sygdomme også baseret på en biologisk proces: glukoseoptagelsen i væv eller strukturer med et anormalt indhold af aktiverede hvide blodlegemer. Det er beregnet til behandling af patienter med infektiøse eller inflammatoriske sygdomme i de foreslåede miljøer. En teknik til specifik scanning af væv eller strukturer med et unormalt indhold af aktiverede hvide blodlegemer vil sandsynligvis give vigtige oplysninger i behandlingen af patienter med infektiøse og inflammatoriske sygdomme. Det juridiske grundlag for denne ansøgning henviser til artikel 10, litra a), i direktiv 2001/83/EF, med senere ændringer, vedrørende ansøgninger, der er baseret på veletableret medicinsk anvendelse understøttet af bibliografisk litteratur. En del betænkeligheder blev dog fremsat af den medlemsstat, der gjorde indsigelse, og som ikke betragtede ansøgningen for Gluscan som acceptabel. Sagen blev henvist til den humanmedicinske koordineringsgruppe CMD(h), og en vurdering blev gennemført af referencemedlemsstaten. Da der ikke var opnået enighed på dag 60, blev sagen henvist til Udvalget for Humanmedicinske Lægemidler (CHMP). CHMP vurderede dossieret og de tilgængelige data, herunder de spørgsmål, som den medlemsstat, der havde gjort indsigelse, havde rejst. I alt patienter på verdensplan er til dato blevet indberettet i offentliggjorte serier (bortset fra rapporter om enkelte tilfælde), som havde gavn af FDG PET indiceret til inflammation og infektion (med undtagelse af tilfældige resultater af infektion/inflammation hos patienter, der er blevet henvist for en anden indikation). Den første offentliggørelse af en serie hos 7 patienter med sarkoidose går tilbage til 1994, og i alt 1988 patienter er blevet indberettet i offentliggjorte serier for EU-serier fra 1999 til Desuden er FDG allerede blevet registreret i 3 EU-medlemsstater (EI, UK og CZ) for denne "nye" indikation i infektiøse eller inflammatoriske sygdomme, og de tidlige resultater, der har vist sig at være gunstige i disse lande, er blevet bekræftet med erfaringer fra fortsat brug. CHMP nåede til enighed om, at der har været lang erfaring med fortsat brug af FDG, som støtter dets veletablerede anvendelse. Kvaliteten af de data, der bruges til vurdering af virkningen, er blevet kontrolleret (ensartethed i serierne i et givet miljø ifølge de specifikke inklusionskriterier, billeder, der er taget i overensstemmelse med en accepteret protokol, som er til rådighed for FDG, og ligeledes for 6
7 sammenligningsstoffet i sammenlignende undersøgelser og beskrivelse af den sande standard indhentet fra alle vurderbare patienter, undtagen i tilfælde af en undersøgelse af indvirkningen alene på behandlingen), og kvaliteten har vist sig at være på linje med kravene til de punkter, der skal overvejes (PtC = Points to Consider) ved vurderingen af diagnostiske produkter (CPMP/EWP/1119/98). Kvaliteten af de undersøgelser, der er blevet bevaret til analysen, efter at mange andre er blevet kasseret, er blevet bekræftet i den offentliggjorte meta-analyse eller nylige revurderingsartikler i flere miljøer. Desuden gælder det for alle de infektiøse og inflammatoriske sygdomme, som ansøgningen vedrører, at den diagnostiske ydelse er blevet fastsat og har vist sig at være mindst på niveau med sammenligningsstoffet, efter at undersøgelserne af den samme sygdom er blevet poolet. En høj generel indvirkning på patientbehandling er blevet indberettet for den generelle indikation og for hver specifik sygdom. Denne indvirkning blev undersøgt indirekte for to miljøer. CHMP nåede til enighed om, at den kliniske effekt (diagnostisk ydelse og indvirkning på diagnostisk tankegang) af PET/PET-CT med FDG er blevet tilfredsstillende påvist. Den tekniske virkning - FDG s overlegenhed sammenlignet med alle radiofarmaceutiske sammenligningsstoffer - er blevet dokumenteret i artikler og gælder for alle de foreslåede miljøer i disse indikationer. Det blev konkluderet: at den iboende opløsning i en PET-scanner er dobbelt så god som den, der er i et gammakamera med en lavenergi-kollimator, som bruges til teknetium-99m, og over dobbelt så god med en mellemenergi-kollimator, som bruges til gallium-67 eller indium-111, at ventetiden for patienten (1 time mellem injektion og billedoptagelse) er den korteste af alle registrerede radiofarmaceutiske lægemidler på dette område, at de andre besværligheder/risici for patienten er færre end ved gallium-67 (besværlig patientforberedelse) eller ved mærkede hvide blodlegemer (white blood cells, WBC), som kræver tapning af en stor mængde blod og indebærer risiko for fejl ved reinjektion, at dosimetrien ved FDG PET svarer til dosimetrien ved technetium-99m-mærkede produkter og er mere gunstig end ved gallium-67 eller indium-111 radiofarmaceutiske lægemidler. CHMP fastslog derfor, at den tekniske ydelse og proceduremæssige nemhed ved FDG er af generel fordel i denne indikation. Dette bør omhyggeligt differentieres til diagnostisk ydelse. Vedrørende den diagnostiske effekt af fludeoxyglukose ( 18 F) til patienter med immuninsufficiens har ansøgeren stillet data fra litteraturen til rådighed, der viser, at FDG PET er effektiv til aids-patienter til påvisning af maligniteter og/eller infektionssygdomme. Med hensyn til virkningen af et fald i leukocyttallet hos patienter med leukocytdysfunktion er det blevet påvist hos myelomatosepatienter (Mahfouz (2005)), at "FDG-PET kan være diagnostisk, når det drejer sig om svær neutropeni til forskel fra de fleste andre kernestrålingsteknikker til scanning". Det er tydeligt, at in vitro-mærkning af cirkulerende leukocytter, som er påkrævet ved nogle af sammenligningsstofferne ( 111 I oxin- eller 99m Tc HMPAO-mærkede leukocytter), hæmmes af et dårligt leukocyttal. Dette er dog ikke tilfældet for FDG, som er målrettet mod in vivo-foci af aktiverede leukocytter. Ansøgeren hævder, at der, så vidt vides (på dette tidspunkt), ikke har været nogen rapport om leukocytdysfunktion, der fører til, at de ikke kan aktiveres i nærheden af målceller. For patienter, der er under behandling med specifik samtidig medicinering som f.eks. antibiotika og betændelseshæmmende midler, er det oplagt, at der ikke var nogen effekt i de tilsvarende hævdede sammenhænge ved langvarig eller kronisk sygdom (feber af ukendt oprindelse, kronisk knogleinfektion, mistanke om inficeret hofteprotese, aktiv inflammatorisk tarmsygdom osv.), da patienten blev henvist til FDG PET. Eftersom FDG PET præcist diagnosticerer disse tilstande, ville påvirkningen af disse uundgåelige behandlinger helt sikkert blive betragtet som mindre væsentlige. Dette er blevet bekræftet i 2000 af Meller: "Antibiotika og immunosuppressiv behandling så ikke ud 7
8 til at påvirke resultaterne af FDG-scanning, da 66 % af de patienter, der blev behandlet, udviste en patologisk optagelse, der klarlagde årsagen til feberen." Kortikosteroider har vist sig i høj grad at nedsætte eller undertrykke optagelsen af FDG. Dette blev primært indberettet ved sarkoidose og ligeledes ved vaskulitis (Rehàk 2006). I denne sammenhæng indberettede Walter (2005) en påvisningshyppighed af patologisk stort blodkar på 8/9 = 89 % uden behandling over for 10/21 = 48 % med kortikosteroider. Et afsnit, der fremhæver effekten af kortikosteroider på FDG-optagelsen i infektions- og inflammationsindikationen, og overvejelse af mulig midlertidig tilbageholdelse af denne behandling blev foreslået af en medlemsstat i afsnit 4.5 i produktresuméet ("Interaktion med andre lægemidler og andre former for interaktion"), og dette blev efterfølgende godkendt af CHMP. Det bør huskes, at de farmakodynamiske virkninger af disse lægemidler (f.eks. kortikosteroider) på leukocytter, der optager FDG, er identiske i alle sammenhænge, samt at der ikke er noget behov for en visning fra sammenhæng til sammenhæng af denne påvirkning, selv om konsekvensen på den diagnostiske tankegang kan være anderledes fra en sammenhæng til en anden. Der er ingen grund til at forvente en lavere effekt hos børn sammenlignet med voksne for en diagnostisk undersøgelse, der er nyttig ved et bredt spektrum af årsager, der forekommer hos børn og voksne, uden nogen metabolisk specificitet hos børn. Det bemærkes ligeledes, at FDG længe har været registreret til lymfomer, der opstår i barndommen, selv om der ikke på det tidspunkt var flere offentliggjorte data om børn, end der for øjeblikket er om infektion/inflammation. Det er også tilfældet, at der i produktresuméet anmodes om en omhyggelig vægtning af indikationen til pædiatrisk anvendelse. CHMP nåede derfor til enighed om, at den nuværende ordlyd i produktresuméet vedrørende anvendelse til børn også tilpasses til infektion/inflammation (ved at slette ordet "onkologi"). Ansøgeren henviser også til nogle konkrete undersøgelser, der er blevet gennemført for inflammatorisk tarmsygdom (Lemberg 2005, Löffler 2006) hos i alt 88 patienter, og for kronisk granulomatøs sygdom med en tarmlæsion hos 5 af de 7 Güngör-patienter (2001), og for nogle børn, som også er blevet inkluderet i en serie med andre tilstande (f.eks. 13 børn med feber af ukendt oprindelse). Indvirkningen på behandlingen var lige så tydelig som hos de voksne (feber af ukendt oprindelse, inflammatorisk tarmsygdom) og endnu mere påfaldende i tilfælde af granulomatose (Güngör 2001). Det ville sandsynligvis være skadeligt og imod Euratom-direktiverne (optimering af bestråling) at udelukke børn fra fordelen ved FDG PET til behandling af infektion og betændelse (især feber af ukendt oprindelse eller inflammatorisk tarmsygdom), da andre scintigrafiske muligheder (gallium-67 scintigrafi, indium-111 leukocyt-scintigrafi) faktisk giver mere bestråling og/eller er mere krævende og ville føre til behandling af børn på en mindre fordelagtig måde end voksne. Selv om der argumenteres for, at den effektive bestrålingsdosis fra 99m Tc-mærkede forbindelser svarer til bestrålingsdosen fra FDG, er det 99m Tc-mærkede sammenligningsstof, immunoscintigrafi, der er nemmest at bruge, kontraindiceret til børn af en veldokumenteret grund, nemlig at forekomsten af antistoffer vil hæmme yderligere anvendelse. Besværet og risiciene ved 99m Tc HMPAO in vitromærkede leukocytter er åbenlys: tapning af en stor mængde blod fra et barn til in vitro-mærkning og anafylaksi. Desuden er de 99m Tc HMPAO in vitro-mærkede leukocytter ikke indiceret til hele det spektrum, der er dækket af FDG, eftersom ikke-cirkulerende leukocytter, der er involveret i mange kroniske infektions- og betændelsestilstande, ikke er mærkede, og baggrunden i knoglemarven er høj, hvilket hæmmer påvisningen af foci i det aksiale skelet. Som nævnt ovenfor ville det være imod optimeringsprincippet i Euratom-direktivet (som er gennemført i lovgivningen i alle EU-medlemsstater) at udelukke børn fra fordelen ved FDG PET i tilfælde af infektions-/inflammationssygdomme, da de andre scintigrafiske muligheder faktisk giver mere bestråling for barnet (gallium-67 scintigrafi, indium-111 leukocyt-scintigrafi) eller for personalet (in vitro-mærkning med technetium-99m HMPAO) uden nogen fordel i effekten. Med denne substitution of gallium-67 gennem FDG nedsættes bestrålingseksponeringen med en faktor 3-5, som er af stor betydning for børn med godartede tilstande. CHMP nåede derfor til enighed om, at den 8
9 pædiatriske population under 18 år bør inkluderes i produktresuméet. Underrubrikken "børn under 18 år" under afsnit 4.2 Dosering og indgivelsesmåde er blevet ændret, og ordet "onkologisk" er blevet slettet. Dosimetri-tabellerne i afsnit 11 omfatter allerede de beregnede doser til børn. Anvendelsen af FDG PET-CT er på nuværende tidspunkt blevet indberettet i alle de 10 foreslåede indikationer ved "infektiøse eller inflammatoriske sygdomme", bortset fra påvisningen af infektion i hofteproteser. I denne sammenhæng er CT ikke til ret megen hjælp på grund af artefakter fremkaldt af strålehærdning i nærheden af den metalholdige protese. Omvendt er dette ikke en kontraindikation, da de ikke-dæmpede korrigerede PET-billeder forbliver fri for artefakter. Den dosering (dvs. den injicerede aktivitet), der anbefales i det grundlæggende produktresumé, nemlig MBq med tilpasning til børn, er på linje med den aktivitet, der bruges i de indberettede kliniske undersøgelser for infektion/inflammation, uanset hvilken maskine der bruges, PET, CDET eller PET-CT. Tilpasning er ikke nødvendig efter det kliniske miljø, men en tilpasning er nødvendig (inden for ovenstående område) efter patientens kropsvægt og den type PET(/CT)-maskine, der anvendes til scanningen. Anvendelsen af PET-CT er et spørgsmål om udstyr i PET-centret og om professionelle retningslinjer (herunder ovennævnte Euratom-direktiv, der definerer bestrålingens berettigelse og optimering) og behøver ikke at blive behandlet i produktresuméet, bortset fra de tilfælde, hvor PET-CT har vist sig at øge effekten. Dette er blevet påvist for nogle miljøer inden for onkologi og er medtaget i det grundlæggende produktresumé, men er for tiden ikke tilfældet ved infektion/inflammation. Sikkerhedsdataene for den kombinerede PET/CT-teknologi adskiller sig ikke fra den tilsvarende PETteknologi, idet den eneste forskel er en stigning i bestrålingsdosis på grund af den lave CT-dosis, som ikke har nogen påviselig konsekvens. Den totale effektive dosis af FDG PET/CT med en lav dosis af CT er mindre end den effektive dosis af en komplet kontrastforbedret diagnostisk CT i det samme område. Da bestrålingsbeskyttelse er en del af sikkerheden, noteres det også, at, selv om alle registrerede diagnostiske radiofarmaceutiske lægemidler er globalt sikre, menes FDG at være blandt de sikreste og at give langt lavere bestråling end gallium-67 eller indium-111. PET/CT er nu state-of-the-art for FDG-detektion, og det fremgår klart af litteraturen og ekspertudtalelser, at det ikke kan forringe tekniske og diagnostiske ydelser, når der sammenlignes med PET alene. De fleste data er indhentet med PET alene og er derfor stadig gyldige; men man kunne dog overveje, om de ville repræsentere den minimumsydelse, der kunne forventes med PET/CT. CHMP ser derfor ikke noget behov for yderligere informationer til at understøtte anvendelsen af denne teknik i de 10 infektiøse og inflammatoriske sygdomme, som ansøgningen vedrører, samt den foreslåede dosering i disse indikationer. Det påvirker ikke produktresuméet for øjeblikket, da det ikke er blevet påvist, at nogen af sammenhængene for denne indikation har betydelig fordel af sammenlægningen af PET/CT sammenlignet med PET alene. I langt de fleste FDG-undersøgelser, som er offentliggjort inden for onkologi, er tilfælde af infektion/inflammation blevet indberettet som en kilde til falske positive resultater: Disse FDG-foci svarede ikke til malignt væv. Dette er allerede medtaget i det grundlæggende produktresumé. Det er tydeligt, at FDG er i stand til at påvise infektion/betændelse som et tilfældigt resultat hos patienter, der er blevet henvist på grund af cancer. I det særlige tilfælde med myelomatose (som nu betragtes som en del af lymfomer og angiver FDG som sådan) er FDG blevet brugt bevidst til at søge efter infektion inden starten på kemoterapi i relation til depletion af immunitet og leukocytter. 9
10 Mahfouz (2005) gennemførte FDG-PET-undersøgelser af patienter med multipelt myelom for cancerstadier og/eller for diagnose af mistanke om infektion. Journalerne for de 248 patienter med multipelt myelom, hvor det blev indberettet, at FDG-PET viste øget optagelse af radioaktive sporstoffer på ekstramedullære steder og/eller knogle- og ledlæsioner (der ville være atypiske for multipelt myelom), blev gennemgået for at identificere tilfælde, der var forbundet med infektion. En perfekt positiv forudsigelsesværdi (positive predictive value, PPV) og en betydelig indvirkning på behandlingen blev indberettet. Selv om den perfekte, positive forudsigelsesværdi var gunstig, og virkningen på behandlingen var til rådighed, blev man ifølge de punkter, der bør overvejes (Points to Consider, PtC), og under forudgående drøftelser med referencemedlemsstaten, den berørte medlemsstat og ansøgeren enig om, at disse vigtige oplysninger skulle bevares i afsnit 4.4 i produktresuméet, da disse oplysninger ville være værdifulde for ordineringen og fortolkningen af FDG-PET i denne indikation. CHMP godkendte også denne indfaldsvinkel. Således er benefit/risk-forholdet klart mere gunstigt for FDG end for nogen af de andre registrerede radiofarmaceutiske lægemidler i den anmodede indikation "infektiøse og inflammatoriske sygdomme". 10
11 BEGRUNDELSER FOR POSITIV UDTALELSE CHMP vurderer således, at benefit/risk-forholdet er gunstigt for Gluscan (FDG) i indikationen "infektiøse og inflammatoriske sygdomme", som er behandlet ovenfor. Ud fra følgende betragtninger: - Bevismaterialet vedrørende de infektiøse eller inflammatoriske sygdomme, der er taget med i betragtning i vurderingen af denne veldokumenterede anvendelse, er en omhyggelig udvælgelse af undersøgelser ifølge kriterierne for de punkter, der bør overvejes (PtC) ved vurderingen af diagnostiske produkter (CPMP/EWP/1119/98) og begrænset til de bedst dokumenterede kliniske miljøer. - En høj indvirkning på patientbehandling er blevet indberettet for den generelle indikation og for den enkelte infektiøse eller inflammatoriske sygdom. - Den tekniske ydelse er blevet dokumenteret i artikler og gælder for alle de foreslåede infektiøse eller inflammatoriske sygdomme. - Der er givet tilfredsstillende overvejelser af situationer som patienter med immuninsufficiens, patienter med leukocytdysfunktion og patienter, der får specifik samtidig medicin, som påvirker leukocytternes levedygtighed og/eller funktion (som f.eks. antibiotika, non-steroide antiinflammatoriske lægemidler osv.). - Anvendelsen af Gluscan kan også anbefales til børn for indikationer af infektiøse eller inflammatoriske sygdomme. - PET/CT er nu state-of-the-art for FDG-detektion og viser ikke nogen forringelse af de tekniske og diagnostiske ydelser, når der sammenlignes med PET alene - anbefaler CHMP, at der udstedes markedsføringstilladelser for GLUSCAN 500 og tilknyttede navne (se bilag I). Produktresumé, etikettering og indlægsseddel er de endelige udgaver, der er fremkommet under koordinationsgruppens procedure, og fremgår af bilag III. 11
12 BILAG III PRODUKTRESUME, ETIKETTERING OG INDLÆGSSEDDEL 12
13 Det gyldige produktresumé, etiketteringen og indlægssedlen er de endelige versioner, der er opnået under koordinationsgruppens procedure. 13
Navn Lægemiddelform Styrker Dyrearter Doseringshyppighed og indgivelsesvej. Amoxicillin 40 mg Clavulanic acid 10 mg. Clavulanic acid 10 mg
 BILAG I Liste over veterinærlægemidlets navne, lægemiddelform, styrke, dyrearter, indgivelsesvej, ansøger/indehaver af markedsføringstilladelse i medlemsstaterne 1/10 Medlemsstat EU/EØS Ansøger/indehaver
BILAG I Liste over veterinærlægemidlets navne, lægemiddelform, styrke, dyrearter, indgivelsesvej, ansøger/indehaver af markedsføringstilladelse i medlemsstaterne 1/10 Medlemsstat EU/EØS Ansøger/indehaver
NANOTOP 0,5 mg Kit für ein radioaktives Arzneimittel. ROTOP-NanoHSA 0,5 mg Trousse pour préparation radiopharmaceutique
 Bilag I Fortegnelse over lægemidlernes navne, lægemiddelform, styrker, indgivelsesvej, ansøgere, indehavere af markedsføringstilladelser i medlemsstaterne 1 Medlemsstat EU/EEA Indehaver af markedsføringstilladelse
Bilag I Fortegnelse over lægemidlernes navne, lægemiddelform, styrker, indgivelsesvej, ansøgere, indehavere af markedsføringstilladelser i medlemsstaterne 1 Medlemsstat EU/EEA Indehaver af markedsføringstilladelse
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Bilag I Liste over lægemidlernes navne, lægemiddelformer, styrker, administrationsveje, ansøgere/indehavere af markedsføringstilladelser i medlemsstaterne. 1 Medlemsstat EU/EØS Indehaver af markedsføringstilladelsen
Bilag I Liste over lægemidlernes navne, lægemiddelformer, styrker, administrationsveje, ansøgere/indehavere af markedsføringstilladelser i medlemsstaterne. 1 Medlemsstat EU/EØS Indehaver af markedsføringstilladelsen
Bilag I. Navneliste, lægemiddelform, medicinske produkters styrke, indgivelsesvej og ansøgere i medlemslande
 Bilag I Navneliste, lægemiddelform, medicinske produkters styrke, indgivelsesvej og ansøgere i medlemslande 1 Medlemsland EU/EEA Ansøger Firmanavn, adresse (Særnavn) Navn Styrke Lægemiddelform Indgivelsesvej
Bilag I Navneliste, lægemiddelform, medicinske produkters styrke, indgivelsesvej og ansøgere i medlemslande 1 Medlemsland EU/EEA Ansøger Firmanavn, adresse (Særnavn) Navn Styrke Lægemiddelform Indgivelsesvej
Actocalcio D3 35 mg mg/880 IU. Acrelcombi 35 mg mg/880 IU. Fortipan Combi D 35 mg mg/880 IU
 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM(ER), STYRKE(R), INDGIVELSESVEJ(E), ANSØGER(E), INDEHAVER(E) AF MARKEDSFØRINGSTILLADELSE(R) I MEDLEMSSTATERNE 1 Medlemsstat Indehaver af markedsføringstillad
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM(ER), STYRKE(R), INDGIVELSESVEJ(E), ANSØGER(E), INDEHAVER(E) AF MARKEDSFØRINGSTILLADELSE(R) I MEDLEMSSTATERNE 1 Medlemsstat Indehaver af markedsføringstillad
BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREART, INDGIVELSESVEJE OG INDEHAVER AF MARKEDSFØRINGSTILLADELSE/ANSØGER 1/9
 BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREART, INDGIVELSESVEJE OG INDEHAVER AF MARKEDSFØRINGSTILLADELSE/ANSØGER 1/9 Medlemsstat/Nummer på markedsføringstilladelse Indehaver af markedsføringstilladelse
BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREART, INDGIVELSESVEJE OG INDEHAVER AF MARKEDSFØRINGSTILLADELSE/ANSØGER 1/9 Medlemsstat/Nummer på markedsføringstilladelse Indehaver af markedsføringstilladelse
Actonel Combi D. Norsedcombi 35 mg mg/880 IU. Norsed plus Calcium D. Optinate Plus Ca &D. Opticalcio D3 35 mg mg/880 IU
 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM(ER), STYRKE(R), INDGIVELSESVEJ(E), ANSØGER(E), INDEHAVER(E) AF MARKEDSFØRINGSTILLADELSE(R) I MEDLEMSSTATERNE 1 Medlemsstat Indehaver af markedsføringstil
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM(ER), STYRKE(R), INDGIVELSESVEJ(E), ANSØGER(E), INDEHAVER(E) AF MARKEDSFØRINGSTILLADELSE(R) I MEDLEMSSTATERNE 1 Medlemsstat Indehaver af markedsføringstil
BILAG I NAVN, LÆGEMIDDELFORM, LÆGEMIDDELSTYRKE, DYREARTER, INDGIVELSESVEJE OG INDEHAVER AF MARKEDSFØRINGSTILLADELSE 1/7
 BILAG I NAVN, LÆGEMIDDELFORM, LÆGEMIDDELSTYRKE, DYREARTER, INDGIVELSESVEJE OG INDEHAVER AF MARKEDSFØRINGSTILLADELSE 1/7 Ansøger eller indehaver af markedsføringstilladelse Særnavn Lægemiddelform Styrke
BILAG I NAVN, LÆGEMIDDELFORM, LÆGEMIDDELSTYRKE, DYREARTER, INDGIVELSESVEJE OG INDEHAVER AF MARKEDSFØRINGSTILLADELSE 1/7 Ansøger eller indehaver af markedsføringstilladelse Særnavn Lægemiddelform Styrke
Samlet resumé af den videnskabelige vurdering af suppositorier indeholdende terpenderivater (se bilag I)
 BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR TILBAGEKALDELSEN ELLER ÆNDRINGERNE AF DE RELEVANTE PUNKTER I PRODUKTRESUMÉET, ETIKETTERINGEN OG INDLÆGSSEDLEN FREMLAGT AF EMA, I BETRAGTNING AF
BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR TILBAGEKALDELSEN ELLER ÆNDRINGERNE AF DE RELEVANTE PUNKTER I PRODUKTRESUMÉET, ETIKETTERINGEN OG INDLÆGSSEDLEN FREMLAGT AF EMA, I BETRAGTNING AF
BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJ OG INDEHAVER AF MARKEDSFØRINGSTILLADELSE 1/7
 BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJ OG INDEHAVER AF MARKEDSFØRINGSTILLADELSE 1/7 Medlemsstat Ansøger eller indehaver af markedsføringstilladelse Produktets særnavn
BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJ OG INDEHAVER AF MARKEDSFØRINGSTILLADELSE 1/7 Medlemsstat Ansøger eller indehaver af markedsføringstilladelse Produktets særnavn
BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉ, ETIKETTERING OG INDLÆGSSEDDEL FREMLAGT AF EMA
 BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉ, ETIKETTERING OG INDLÆGSSEDDEL FREMLAGT AF EMA 11 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering
BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉ, ETIKETTERING OG INDLÆGSSEDDEL FREMLAGT AF EMA 11 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering
BILAG I. Fortegnelse over lægemidlernes navne, lægemiddelformer, styrke, indgivelsesvej, ansøgere i medlemsstaterne
 BILAG I Fortegnelse over lægemidlernes navne, lægemiddelformer, styrke, indgivelsesvej, ansøgere i medlemsstaterne 1 Medlemsstat Ansøger Navn Styrke Lægemiddelform Indgivelsesvej EU/EAA Belgien Mometasone
BILAG I Fortegnelse over lægemidlernes navne, lægemiddelformer, styrke, indgivelsesvej, ansøgere i medlemsstaterne 1 Medlemsstat Ansøger Navn Styrke Lægemiddelform Indgivelsesvej EU/EAA Belgien Mometasone
Bilag I. Fortegnelse over lægemidlernes navne, lægemiddelform(er), styrke(r), indgivelsesvej(e), ansøger(e) i medlemsstaterne
 Bilag I Fortegnelse over lægemidlernes navne, lægemiddelform(er), styrke(r), indgivelsesvej(e), ansøger(e) i medlemsstaterne 1 Medlemsstat EU/EAA Ansøger Særnavn Styrke Lægemiddelform Indgivelsesvej Belgien
Bilag I Fortegnelse over lægemidlernes navne, lægemiddelform(er), styrke(r), indgivelsesvej(e), ansøger(e) i medlemsstaterne 1 Medlemsstat EU/EAA Ansøger Særnavn Styrke Lægemiddelform Indgivelsesvej Belgien
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORMER, STYRKER, INDGIVELSESVEJ, ANSØGER I MEDLEMSSTATERNE
 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORMER, STYRKER, INDGIVELSESVEJ, ANSØGER I MEDLEMSSTATERNE 1 Medlemsstat Indehaver af markedsføringstilladelse Ansøger Navn Styrke Lægemiddelform
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORMER, STYRKER, INDGIVELSESVEJ, ANSØGER I MEDLEMSSTATERNE 1 Medlemsstat Indehaver af markedsføringstilladelse Ansøger Navn Styrke Lægemiddelform
BILAG I LISTE OVER SÆRNAVNE, LÆGEMIDDELFORMER, STYRKE, INDGIVELSESVEJ OG INDEHAVERE AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE (EØS)
 BILAG I LISTE OVER SÆRNAVNE, LÆGEMIDDELFORMER, STYRKE, INDGIVELSESVEJ OG INDEHAVERE AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE (EØS) 1 Medlemsstat Cypern Frankrig Frankrig Frankrig Luxembourg Portugal
BILAG I LISTE OVER SÆRNAVNE, LÆGEMIDDELFORMER, STYRKE, INDGIVELSESVEJ OG INDEHAVERE AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE (EØS) 1 Medlemsstat Cypern Frankrig Frankrig Frankrig Luxembourg Portugal
Navn Vertimen 8 mg Tabletten. Vertimen 16 mg Tabletten. Vertisan 16 mg Таблетка. Vertisan 8 mg Tableta 8 mg tablet Oral anvendelse
 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM(ER), STYRKE(R), INDGIVELSESVEJ(E), ANSØGER(E), INDEHAVER(E) AF MARKEDSFØRINGSTILLADELSE(R) I MEDLEMSSTATERNE 1 Medlemsstat EU/EEA Indehaver
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM(ER), STYRKE(R), INDGIVELSESVEJ(E), ANSØGER(E), INDEHAVER(E) AF MARKEDSFØRINGSTILLADELSE(R) I MEDLEMSSTATERNE 1 Medlemsstat EU/EEA Indehaver
Bilag IV. Videnskabelige konklusioner
 Bilag IV Videnskabelige konklusioner 1 Videnskabelige konklusioner Den 7. juni 2017 blev Europa-Kommissionen (herefter "Kommissionen") underrettet om et tilfælde af fulminant leversvigt med dødelig udgang
Bilag IV Videnskabelige konklusioner 1 Videnskabelige konklusioner Den 7. juni 2017 blev Europa-Kommissionen (herefter "Kommissionen") underrettet om et tilfælde af fulminant leversvigt med dødelig udgang
Bilag II. Videnskabelige konklusioner
 Bilag II Videnskabelige konklusioner 14 Videnskabelige konklusioner Haldol, der indeholder det aktive stof haloperidol, er et antipsykotisk lægemiddel, der tilhører butyrophenon-gruppen. Det er en potent,
Bilag II Videnskabelige konklusioner 14 Videnskabelige konklusioner Haldol, der indeholder det aktive stof haloperidol, er et antipsykotisk lægemiddel, der tilhører butyrophenon-gruppen. Det er en potent,
Bruk av PET/CT i diagnostisk pakkeforløp. Overlæge Karin Hjorthaug Nuklearmedicinsk afd & PET center Århus Universitetshospital
 Bruk av PET/CT i diagnostisk pakkeforløp Overlæge Karin Hjorthaug Nuklearmedicinsk afd & PET center Århus Universitetshospital Bruk av PET/CT i utredning av uspecifikke symptomer på alvorlig sygdom Er
Bruk av PET/CT i diagnostisk pakkeforløp Overlæge Karin Hjorthaug Nuklearmedicinsk afd & PET center Århus Universitetshospital Bruk av PET/CT i utredning av uspecifikke symptomer på alvorlig sygdom Er
Bilag II. Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelsen
 Bilag II Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelsen 7 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Cymevene
Bilag II Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelsen 7 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Cymevene
Bilag III Ændringer til produktresuméet og indlægssedlen
 Bilag III Ændringer til produktresuméet og indlægssedlen Bemærk: Disse ændringer skal indføres i det gældende produktresumé, etikettering og indlægsseddel. Det er de endelige versioner, der blev opnået
Bilag III Ændringer til produktresuméet og indlægssedlen Bemærk: Disse ændringer skal indføres i det gældende produktresumé, etikettering og indlægsseddel. Det er de endelige versioner, der blev opnået
BILAG I Liste over veterinærlægemidlets navne, lægemiddelform, styrke, dyrearter og indehavere af markedsføringstilladelse i medlemsstaterne
 BILAG I Liste over veterinærlægemidlets navne, lægemiddelform, styrke, dyrearter og indehavere af markedsføringstilladelse i medlemsstaterne 1/10 Medlemsstat EU/EØS Indehaver af markedsføringstilladelse
BILAG I Liste over veterinærlægemidlets navne, lægemiddelform, styrke, dyrearter og indehavere af markedsføringstilladelse i medlemsstaterne 1/10 Medlemsstat EU/EØS Indehaver af markedsføringstilladelse
Bilag II. Videnskabelige konklusioner
 Bilag II Videnskabelige konklusioner 32 Videnskabelige konklusioner USA's sundhedsmyndigheder (FDA) har mellem den 29. september 2015 og 9. oktober 2015 gennemført en GCP-inspektion af den bioanalytiske
Bilag II Videnskabelige konklusioner 32 Videnskabelige konklusioner USA's sundhedsmyndigheder (FDA) har mellem den 29. september 2015 og 9. oktober 2015 gennemført en GCP-inspektion af den bioanalytiske
Bilag II. Videnskabelige konklusioner
 Bilag II Videnskabelige konklusioner 8 Videnskabelige konklusioner Solu-Medro 40 mg pulver og solvens til injektionsvæske, opløsning, (herefter benævnt "Solu- Medrol") indeholder methylprednisolon og,
Bilag II Videnskabelige konklusioner 8 Videnskabelige konklusioner Solu-Medro 40 mg pulver og solvens til injektionsvæske, opløsning, (herefter benævnt "Solu- Medrol") indeholder methylprednisolon og,
Bilag III. Ændringer i de relevante punkter i produktresumeet
 Bilag III Ændringer i de relevante punkter i produktresumeet Bemærk! Disse præparatoplysninger er resultatet af den referralprocedure, som Kommissionens beslutning relaterer til. Præparatoplysningerne
Bilag III Ændringer i de relevante punkter i produktresumeet Bemærk! Disse præparatoplysninger er resultatet af den referralprocedure, som Kommissionens beslutning relaterer til. Præparatoplysningerne
Bilag III. Ændringer til relevante afsnit i produktresuméer og indlægssedler
 Bilag III Ændringer til relevante afsnit i produktresuméer og indlægssedler Note: De pågældende punkter i produktresuméet og indlægssedlen er resultatet af referral proceduren. Produktinformationen kan
Bilag III Ændringer til relevante afsnit i produktresuméer og indlægssedler Note: De pågældende punkter i produktresuméet og indlægssedlen er resultatet af referral proceduren. Produktinformationen kan
Særnavn Lægemiddelform Styrke(r) Dyreart. Amoxicillin 200 mg Clavulansyre 50 mg Prednisolon 10 mg. suspension
 Bilag I Liste over veterinærlægemidlets navn, lægemiddelform, styrke, dyrearter, indgivelsesvej, tilbageholdelsestid, ansøger og indehaver af markedsføringstilladelse i medlemsstaterne 1/9 Medlemsstat
Bilag I Liste over veterinærlægemidlets navn, lægemiddelform, styrke, dyrearter, indgivelsesvej, tilbageholdelsestid, ansøger og indehaver af markedsføringstilladelse i medlemsstaterne 1/9 Medlemsstat
Bilag IV. Videnskabelige konklusioner
 Bilag IV Videnskabelige konklusioner 59 Videnskabelige konklusioner Den 7. juni 2017 blev Europa-Kommissionen (herefter "Kommissionen") underrettet om et tilfælde af fulminant leversvigt med dødelig udgang
Bilag IV Videnskabelige konklusioner 59 Videnskabelige konklusioner Den 7. juni 2017 blev Europa-Kommissionen (herefter "Kommissionen") underrettet om et tilfælde af fulminant leversvigt med dødelig udgang
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKE, INDGIVELSESVEJ, INDEHAVER AF MARKEDSFØRINGSTILLADELSER I MEDLEMSSTATERNE
 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKE, INDGIVELSESVEJ, INDEHAVER AF MARKEDSFØRINGSTILLADELSER I MEDLEMSSTATERNE 1 Medlemsstat Indehaver af markedsføringstilladelse Særnavn
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKE, INDGIVELSESVEJ, INDEHAVER AF MARKEDSFØRINGSTILLADELSER I MEDLEMSSTATERNE 1 Medlemsstat Indehaver af markedsføringstilladelse Særnavn
Ansøger Navn Styrke Lægemiddelform Indgivelsesvej. GLIMEPIRIDE PFIZER 4 mg, 4 mg Tablet Oral anvendelse. comprimé. comprimé.
 Bilag I Fortegnelse over lægemidlernes navne, lægemiddelform(er), styrke(r), indgivelsesvej(e), ansøger(e), indehaver(e) af markedsføringstilladelse(r) i medlemsstaterne 1 Medlemsstat EU/EAA Ansøger Navn
Bilag I Fortegnelse over lægemidlernes navne, lægemiddelform(er), styrke(r), indgivelsesvej(e), ansøger(e), indehaver(e) af markedsføringstilladelse(r) i medlemsstaterne 1 Medlemsstat EU/EAA Ansøger Navn
Bilag II. Videnskabelige konklusioner og begrundelse for afslaget fremlagt af EMA
 Bilag II Videnskabelige konklusioner og begrundelse for afslaget fremlagt af EMA 29 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Norditropin SimpleXx, Norditropin NordiFlex,
Bilag II Videnskabelige konklusioner og begrundelse for afslaget fremlagt af EMA 29 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Norditropin SimpleXx, Norditropin NordiFlex,
Bilag II. Videnskabelige konklusioner og begrundelser for positiv udtalelse fremlagt af EMA
 Bilag II Videnskabelige konklusioner og begrundelser for positiv udtalelse fremlagt af EMA Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Docetaxel Teva Generics (se bilag
Bilag II Videnskabelige konklusioner og begrundelser for positiv udtalelse fremlagt af EMA Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Docetaxel Teva Generics (se bilag
Bilag II. Videnskabelige konklusioner og begrundelse for den positive udtalelse
 Bilag II Videnskabelige konklusioner og begrundelse for den positive udtalelse 3 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Tobramycin VVB og relaterede navne (jf. bilag
Bilag II Videnskabelige konklusioner og begrundelse for den positive udtalelse 3 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Tobramycin VVB og relaterede navne (jf. bilag
Bilag I. Fortegnelse over lægemidlernes navne, lægemiddelform, styrke, indgivelsesvej, ansøger/indehaver af markedsføringstilladelse i Medlemsstaterne
 Bilag I Fortegnelse over lægemidlernes navne, lægemiddelform, styrke, indgivelsesvej, ansøger/indehaver af markedsføringstilladelse i Medlemsstaterne 1 Medlemss tat EU/EEA Indehaver af markedsføringstilla
Bilag I Fortegnelse over lægemidlernes navne, lægemiddelform, styrke, indgivelsesvej, ansøger/indehaver af markedsføringstilladelse i Medlemsstaterne 1 Medlemss tat EU/EEA Indehaver af markedsføringstilla
NeuroBloc Botulismetoksin type B injektionsvæske, opløsning 5.000 E/ml
 NeuroBloc Botulismetoksin type B injektionsvæske, opløsning 5.000 E/ml Vigtig sikkerhedsinformation til læger Formålet med denne vejledning er at informere læger, der er godkendt til at ordinere og administrere
NeuroBloc Botulismetoksin type B injektionsvæske, opløsning 5.000 E/ml Vigtig sikkerhedsinformation til læger Formålet med denne vejledning er at informere læger, der er godkendt til at ordinere og administrere
Bilag III. Ændringer til relevante afsnit i produktresuméet og indlægssedlen
 Bilag III Ændringer til relevante afsnit i produktresuméet og indlægssedlen Bemærk: Disse ændringer til relevante afsnit i produktresuméet og indlægssedlen er resultatet af referralproceduren. Præparatoplysningerne
Bilag III Ændringer til relevante afsnit i produktresuméet og indlægssedlen Bemærk: Disse ændringer til relevante afsnit i produktresuméet og indlægssedlen er resultatet af referralproceduren. Præparatoplysningerne
BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR AFSLAG PÅ FORNYELSE AF MARKEDSFØRINGSTILLADELSEN
 BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR AFSLAG PÅ FORNYELSE AF MARKEDSFØRINGSTILLADELSEN 5 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Ethirfin og relaterede
BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR AFSLAG PÅ FORNYELSE AF MARKEDSFØRINGSTILLADELSEN 5 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Ethirfin og relaterede
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC s vurderingsrapport om PSUR en for
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC s vurderingsrapport om PSUR en for
BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJ OG INDEHAVER AF MARKEDSFØRINGSTILLADELSEN
 BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJ OG INDEHAVER AF MARKEDSFØRINGSTILLADELSEN EMEA/CVMP/166766/2006-DA Maj 2006 1/7 Medlemssta t Indehaver af markedsføringstillad
BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJ OG INDEHAVER AF MARKEDSFØRINGSTILLADELSEN EMEA/CVMP/166766/2006-DA Maj 2006 1/7 Medlemssta t Indehaver af markedsføringstillad
Europaudvalget EUU alm. del - Bilag 421 Offentligt
 Europaudvalget EUU alm. del - Bilag 421 Offentligt Grundnotat til Folketingets Europaudvalg om forslag til kommissionsbeslutning om udstedelse af markedsføringstilladelse for lægemidlet INCRELEX til sjældne
Europaudvalget EUU alm. del - Bilag 421 Offentligt Grundnotat til Folketingets Europaudvalg om forslag til kommissionsbeslutning om udstedelse af markedsføringstilladelse for lægemidlet INCRELEX til sjældne
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKE, INDGIVELSESVEJE, ANSØGERE, I MEDLEMSSTATERNE
 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKE, INDGIVELSESVEJE, ANSØGERE, I MEDLEMSSTATERNE 1 Medlemsstat Indehaver af markedsførings tilladelse Østrig Pharmachemie B.V. Belgien
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKE, INDGIVELSESVEJE, ANSØGERE, I MEDLEMSSTATERNE 1 Medlemsstat Indehaver af markedsførings tilladelse Østrig Pharmachemie B.V. Belgien
(Meddelelser) EUROPA-KOMMISSIONEN
 2.8.2013 Den Europæiske Unions Tidende C 223/1 (Meddelelser) MEDDELELSER FRA DEN EUROPÆISKE UNIONS INSTITUTIONER, ORGANER, KONTORER OG AGENTURER EUROPA-KOMMISSIONEN Retningslinjer for de forskellige kategorier
2.8.2013 Den Europæiske Unions Tidende C 223/1 (Meddelelser) MEDDELELSER FRA DEN EUROPÆISKE UNIONS INSTITUTIONER, ORGANER, KONTORER OG AGENTURER EUROPA-KOMMISSIONEN Retningslinjer for de forskellige kategorier
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
ved malignt lymfomt Karin Hjorthaug, Nuklearmedicinsk afd & PET center AArhus Universitets Hospital
 18 F-FDG-PET/CT ved malignt lymfomt Karin Hjorthaug, Nuklearmedicinsk afd & PET center AArhus Universitets Hospital DRS årsmøde jan 2012 18F-Fluoro Fluoro-Deoxy-Glukose (18F-FDG) FDG) K Hjorthaug 2 18
18 F-FDG-PET/CT ved malignt lymfomt Karin Hjorthaug, Nuklearmedicinsk afd & PET center AArhus Universitets Hospital DRS årsmøde jan 2012 18F-Fluoro Fluoro-Deoxy-Glukose (18F-FDG) FDG) K Hjorthaug 2 18
Europa-Parlamentets og Rådets direktiv 2004/24/EF
 Europa-Parlamentets og Rådets direktiv 2004/24/EF af 31. marts 2004 om ændring af direktiv 2001/83/EF om oprettelse af en fællesskabskodeks for humanmedicinske lægemidler for så vidt angår traditionelle
Europa-Parlamentets og Rådets direktiv 2004/24/EF af 31. marts 2004 om ændring af direktiv 2001/83/EF om oprettelse af en fællesskabskodeks for humanmedicinske lægemidler for så vidt angår traditionelle
EUROPA-PARLAMENTETS OG RÅDETS DIREKTIV 2004/24/EF. af 31. marts 2004
 30.4.2004 Den Europæiske Unions Tidende L 136/85 EUROPA-PARLAMENTETS OG RÅDETS DIREKTIV 2004/24/EF af 31. marts 2004 om ændring af direktiv 2001/83/EF om oprettelse af en fællesskabskodeks for humanmedicinske
30.4.2004 Den Europæiske Unions Tidende L 136/85 EUROPA-PARLAMENTETS OG RÅDETS DIREKTIV 2004/24/EF af 31. marts 2004 om ændring af direktiv 2001/83/EF om oprettelse af en fællesskabskodeks for humanmedicinske
Bilag Journalnummer Kontor 1 400.C.2-0 EUK 2. marts 2005
 Europaudvalget (2. samling) EUU alm. del - Bilag 36 Offentligt Medlemmerne af Folketingets Europaudvalg og deres stedfortrædere Bilag Journalnummer Kontor 1 400.C.2-0 EUK 2. marts 2005 KOMITÉSAG Til underretning
Europaudvalget (2. samling) EUU alm. del - Bilag 36 Offentligt Medlemmerne af Folketingets Europaudvalg og deres stedfortrædere Bilag Journalnummer Kontor 1 400.C.2-0 EUK 2. marts 2005 KOMITÉSAG Til underretning
EUROPA-PARLAMENTET. Udvalget om Miljø, Folkesundhed og Fødevaresikkerhed ***I UDKAST TIL BETÆNKNING
 EUROPA-PARLAMENTET 2004 2009 Udvalget om Miljø, Folkesundhed og Fødevaresikkerhed 2008/0045(COD) 26.6.2008 ***I UDKAST TIL BETÆNKNING om forslag til Europa-Parlamentets og Rådets direktiv om ændring af
EUROPA-PARLAMENTET 2004 2009 Udvalget om Miljø, Folkesundhed og Fødevaresikkerhed 2008/0045(COD) 26.6.2008 ***I UDKAST TIL BETÆNKNING om forslag til Europa-Parlamentets og Rådets direktiv om ændring af
Methylprednisolonhydrogensuccinat
 Bilag I Liste over veterinærlægemidlernes navne, lægemiddelformer, styrker, måldyrearter, administrationsveje og ansøger/indehaver af markedsføringstilladelse i medlemsstaterne 1/7 Medlemsstat EU/EØS Ansøger/indehaver
Bilag I Liste over veterinærlægemidlernes navne, lægemiddelformer, styrker, måldyrearter, administrationsveje og ansøger/indehaver af markedsføringstilladelse i medlemsstaterne 1/7 Medlemsstat EU/EØS Ansøger/indehaver
Bilag III. Ændringer til relevante afsnit af produktinformationen
 Bilag III Ændringer til relevante afsnit af produktinformationen Bemærk: Disse ændringer til de relevante afsnit i produktresuméet og indlægssedlen er resultatet af referral-proceduren. Produktinformationen
Bilag III Ændringer til relevante afsnit af produktinformationen Bemærk: Disse ændringer til de relevante afsnit i produktresuméet og indlægssedlen er resultatet af referral-proceduren. Produktinformationen
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJE OG INDEHAVER AF MARKEDSFØRINGSTILLADELSEN
 BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJE OG INDEHAVER AF MARKEDSFØRINGSTILLADELSEN Medlemsstat Nederlandene, Østrig, Belgien, Danmark, Finland, Frankrig, Tyskland, Grækenland,
BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJE OG INDEHAVER AF MARKEDSFØRINGSTILLADELSEN Medlemsstat Nederlandene, Østrig, Belgien, Danmark, Finland, Frankrig, Tyskland, Grækenland,
Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste.
 1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
Lægemiddelstyrelsens perspektiv på pædiatriske studier
 Lægemiddelstyrelsens perspektiv på pædiatriske studier DanPedMed 3.3.2017 Marianne Orholm EUROPA-PARLAMENTETS OG RÅDETS FORORDNING (EF) Nr. 1901/2006 af 12. december 2006 om lægemidler til pædiatrisk brug
Lægemiddelstyrelsens perspektiv på pædiatriske studier DanPedMed 3.3.2017 Marianne Orholm EUROPA-PARLAMENTETS OG RÅDETS FORORDNING (EF) Nr. 1901/2006 af 12. december 2006 om lægemidler til pædiatrisk brug
KOMMISSIONENS DIREKTIV 2009/112/EF
 L 223/26 Den Europæiske Unions Tidende 26.8.2009 DIREKTIVER KOMMISSIONENS DIREKTIV 2009/112/EF af 25. august 2009 om ændring af Rådets direktiv 91/439/EØF om kørekort KOMMISSIONEN FOR DE EUROPÆISKE FÆLLESSKABER
L 223/26 Den Europæiske Unions Tidende 26.8.2009 DIREKTIVER KOMMISSIONENS DIREKTIV 2009/112/EF af 25. august 2009 om ændring af Rådets direktiv 91/439/EØF om kørekort KOMMISSIONEN FOR DE EUROPÆISKE FÆLLESSKABER
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKE, INDGIVELSESVEJ, ANSØGER, INDEHAVER AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE
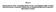 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKE, INDGIVELSESVEJ, ANSØGER, INDEHAVER AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE Medlemsstat Indehaver af markedsføringstilladelse
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKE, INDGIVELSESVEJ, ANSØGER, INDEHAVER AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE Medlemsstat Indehaver af markedsføringstilladelse
BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJ OG INDEHAVERE AF MARKEDSFØRINGSTILLADELSE
 BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJ OG INDEHAVERE AF MARKEDSFØRINGSTILLADELSE EMEA/CVMP/495339/2007-DA November 2007 1/10 Medlemsstat Indehaver af markedsføringstilladelse/ansøger
BILAG I LÆGEMIDLETS NAVN, LÆGEMIDDELFORM, STYRKE, DYREARTER, INDGIVELSESVEJ OG INDEHAVERE AF MARKEDSFØRINGSTILLADELSE EMEA/CVMP/495339/2007-DA November 2007 1/10 Medlemsstat Indehaver af markedsføringstilladelse/ansøger
Bilag II. Videnskabelige konklusioner
 Bilag II Videnskabelige konklusioner 7 Videnskabelige konklusioner Federal Institute of Drugs and Medical Devices (BfArM), Tyskland og Health Care Inspectorate (IGZ), Sundhedsministeriet i Nederlandene,
Bilag II Videnskabelige konklusioner 7 Videnskabelige konklusioner Federal Institute of Drugs and Medical Devices (BfArM), Tyskland og Health Care Inspectorate (IGZ), Sundhedsministeriet i Nederlandene,
11. juli 2005 PRODUKTRESUMÉ. for. Gammanorm, injektionsvæske, opløsning 0. D.SP.NR. 9322. 1. LÆGEMIDLETS NAVN Gammanorm
 11. juli 2005 PRODUKTRESUMÉ for Gammanorm, injektionsvæske, opløsning 0. D.SP.NR. 9322 1. LÆGEMIDLETS NAVN Gammanorm 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Normalt immunglobulin, humant 165 mg/ml Hjælpestoffer
11. juli 2005 PRODUKTRESUMÉ for Gammanorm, injektionsvæske, opløsning 0. D.SP.NR. 9322 1. LÆGEMIDLETS NAVN Gammanorm 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Normalt immunglobulin, humant 165 mg/ml Hjælpestoffer
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKER, INDGIVELSESVEJ, INDEHAVERE AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE
 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKER, INDGIVELSESVEJ, INDEHAVERE AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE 1 CETIRIZINE DIHYDROCHLORIDE DERMAPHARM 10 mg OG TILKNYTTEDE
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, STYRKER, INDGIVELSESVEJ, INDEHAVERE AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE 1 CETIRIZINE DIHYDROCHLORIDE DERMAPHARM 10 mg OG TILKNYTTEDE
Særnavn Lægemiddelform Styrke(r) Dyreart. Amoxicillin 200 mg Clavulansyre 50 mg Prednisolon 10 mg
 Bilag I Liste over veterinærlægemidlets navn, lægemiddelform, styrke, dyrearter, indgivelsesvej, tilbageholdelsestid, ansøger og indehaver af markedsføringstilladelse i medlemsstaterne 1/7 Medlemsstat
Bilag I Liste over veterinærlægemidlets navn, lægemiddelform, styrke, dyrearter, indgivelsesvej, tilbageholdelsestid, ansøger og indehaver af markedsføringstilladelse i medlemsstaterne 1/7 Medlemsstat
Bilag II. Videnskabelige konklusioner og begrundelser for positiv udtalelse fremsat af Det Europæiske Lægemiddelagentur
 Bilag II Videnskabelige konklusioner og begrundelser for positiv udtalelse fremsat af Det Europæiske Lægemiddelagentur 6 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Yvidually
Bilag II Videnskabelige konklusioner og begrundelser for positiv udtalelse fremsat af Det Europæiske Lægemiddelagentur 6 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Yvidually
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Ansat på Nuklearmedicinsk PaT Afdeling OUH siden 2008 Ansvarlig leder for scintigrafi afdelingen på Højgård Hestehospital siden 2006
 Ansvarlig leder for scintigrafi afdelingen på Højgård Hestehospital siden 2006 Ansat på Nuklearmedicinsk PaT Afdeling OUH siden 2008 Ansvarlig leder for scintigrafi afdelingen på Højgård Hestehospital
Ansvarlig leder for scintigrafi afdelingen på Højgård Hestehospital siden 2006 Ansat på Nuklearmedicinsk PaT Afdeling OUH siden 2008 Ansvarlig leder for scintigrafi afdelingen på Højgård Hestehospital
Europaudvalget EUU alm. del - Bilag 296 Offentligt. Resumé
 Europaudvalget EUU alm. del - Bilag 296 Offentligt Ministeriet for Sundhed og Forebyggelse Dato: 27. marts 2009 Sags.nr.: 0903269 Sagsbeh.: SUMTSP / Lægemiddelkontoret Dok nr: 23764 Grundnotat til Folketingets
Europaudvalget EUU alm. del - Bilag 296 Offentligt Ministeriet for Sundhed og Forebyggelse Dato: 27. marts 2009 Sags.nr.: 0903269 Sagsbeh.: SUMTSP / Lægemiddelkontoret Dok nr: 23764 Grundnotat til Folketingets
www.printo.it/pediatric-rheumatology/dk/intro
 www.printo.it/pediatric-rheumatology/dk/intro Majeed Version af 2016 1. HVAD ER MAJEED 1.1 Hvad er det? Majeed er en sjælden genetisk sygdom. Børn med denne sygdom lider af CRMO (kronisk rekurrent multifokal
www.printo.it/pediatric-rheumatology/dk/intro Majeed Version af 2016 1. HVAD ER MAJEED 1.1 Hvad er det? Majeed er en sjælden genetisk sygdom. Børn med denne sygdom lider af CRMO (kronisk rekurrent multifokal
KOMMISSIONENS FORORDNING (EU)
 L 209/4 Den Europæiske Unions Tidende 4.8.2012 KOMMISSIONENS FORORDNING (EU) Nr. 712/2012 af 3. august 2012 om ændring af forordning (EF) nr. 1234/2008 om behandling af ændringer af betingelserne i markedsføringstilladelser
L 209/4 Den Europæiske Unions Tidende 4.8.2012 KOMMISSIONENS FORORDNING (EU) Nr. 712/2012 af 3. august 2012 om ændring af forordning (EF) nr. 1234/2008 om behandling af ændringer af betingelserne i markedsføringstilladelser
Familiær middelhavsfeber
 www.printo.it/pediatric-rheumatology/dk/intro Familiær middelhavsfeber Version af 2016 2. DIAGNOSE OG BEHANDLING 2.1 Hvordan diagnosticeres det? Overordnet set anvendes følgende tilgang: Klinisk mistanke:
www.printo.it/pediatric-rheumatology/dk/intro Familiær middelhavsfeber Version af 2016 2. DIAGNOSE OG BEHANDLING 2.1 Hvordan diagnosticeres det? Overordnet set anvendes følgende tilgang: Klinisk mistanke:
Forslag til RÅDETS AFGØRELSE
 EUROPA- KOMMISSIONEN Bruxelles, den 2.3.2015 COM(2015) 76 final 2015/0040 (NLE) Forslag til RÅDETS AFGØRELSE om den holdning, som Den Europæiske Union skal indtage i det blandede udvalg, der er nedsat
EUROPA- KOMMISSIONEN Bruxelles, den 2.3.2015 COM(2015) 76 final 2015/0040 (NLE) Forslag til RÅDETS AFGØRELSE om den holdning, som Den Europæiske Union skal indtage i det blandede udvalg, der er nedsat
Bilag IV. Videnskabelige konklusioner
 Bilag IV Videnskabelige konklusioner 1 Videnskabelige konklusioner Den 10. marts 2016 blev Europa-Kommissionen underrettet om, at det uafhængige datasikkerhedsovervågningsudvalg i tre kliniske undersøgelser
Bilag IV Videnskabelige konklusioner 1 Videnskabelige konklusioner Den 10. marts 2016 blev Europa-Kommissionen underrettet om, at det uafhængige datasikkerhedsovervågningsudvalg i tre kliniske undersøgelser
Bilag II. Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelserne
 Bilag II Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelserne 14 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Zinacef
Bilag II Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelserne 14 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Zinacef
Europaudvalget EUU alm. del - Bilag 143 Offentligt. Resumé
 Europaudvalget EUU alm. del - Bilag 143 Offentligt Grundnotat til Folketingets Europaudvalg om forslag til kommissionsbeslutning om udstedelse af markedsføringstilladelse med betingelser for lægemidlet
Europaudvalget EUU alm. del - Bilag 143 Offentligt Grundnotat til Folketingets Europaudvalg om forslag til kommissionsbeslutning om udstedelse af markedsføringstilladelse med betingelser for lægemidlet
Ændringer til produktresuméet og indlægssedlen fremlagt af Det Europæiske Lægemiddelagentur
 Bilag II Ændringer til produktresuméet og indlægssedlen fremlagt af Det Europæiske Lægemiddelagentur Dette produktresumé og denne indlægssedel er resultatet af referralproceduren. Produktinformationen
Bilag II Ændringer til produktresuméet og indlægssedlen fremlagt af Det Europæiske Lægemiddelagentur Dette produktresumé og denne indlægssedel er resultatet af referralproceduren. Produktinformationen
Lægemidler indeholdende dextropropoxyfen med markedsføringstilladelse i Den Europæiske Union. Styrke/ dextropropoxyfen/ paracetamol/ koffein
 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM(ER), STYRKE(R), INDGIVELSESVEJ(E), ANSØGER(E), INDEHAVER(E) AF MARKEDSFØRINGSTILLADELSE(R) I MEDLEMSSTATERNE 1 Lægemidler indeholdende dextropropoxyfen
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM(ER), STYRKE(R), INDGIVELSESVEJ(E), ANSØGER(E), INDEHAVER(E) AF MARKEDSFØRINGSTILLADELSE(R) I MEDLEMSSTATERNE 1 Lægemidler indeholdende dextropropoxyfen
Anvendelsen af radioaktive lægemidler ved nuklearmedicinske undersøgelser og behandlinger i Danmark i 2009
 Anvendelsen af radioaktive lægemidler ved nuklearmedicinske undersøgelser og behandlinger i Danmark i 29 De årlige nuklearmedicinske opgørelser indsendes af alle de sygehusafdelinger, hvor der har været
Anvendelsen af radioaktive lægemidler ved nuklearmedicinske undersøgelser og behandlinger i Danmark i 29 De årlige nuklearmedicinske opgørelser indsendes af alle de sygehusafdelinger, hvor der har været
Den Europæiske Unions Tidende C 323/9
 31.12.2009 Den Europæiske Unions Tidende C 323/9 Meddelelse fra Kommissionen Retningslinjer for anvendelsen af procedurerne i kapitel II, III og IV i Kommissionens forordning (EF) nr. 1234/2008 om behandling
31.12.2009 Den Europæiske Unions Tidende C 323/9 Meddelelse fra Kommissionen Retningslinjer for anvendelsen af procedurerne i kapitel II, III og IV i Kommissionens forordning (EF) nr. 1234/2008 om behandling
Lægemidlerne anvendes til behandling af moderat til svær depression ( major depression ) hos voksne.
 Europaudvalget EUU alm. del - Bilag 207 Offentligt Grundnotat til Folketingets Europaudvalg om forslag til kommissionsbeslutning om udstedelse af markedsføringstilladelser med betingelser for lægemidlerne
Europaudvalget EUU alm. del - Bilag 207 Offentligt Grundnotat til Folketingets Europaudvalg om forslag til kommissionsbeslutning om udstedelse af markedsføringstilladelser med betingelser for lægemidlerne
Ansøger Navn INN Lægemiddelform Styrke Dyrearter Administrationsvej. opløsning. opløsning. opløsning. opløsning. opløsning.
 Bilag I Liste over veterinærlægemidlernes navne, lægemiddelformer, styrker, måldyrearter, administrationsvej og ansøger om markedsføringstilladelse i medlemsstaterne 1/12 Medlemsstat EU/EØS Ansøger Navn
Bilag I Liste over veterinærlægemidlernes navne, lægemiddelformer, styrker, måldyrearter, administrationsvej og ansøger om markedsføringstilladelse i medlemsstaterne 1/12 Medlemsstat EU/EØS Ansøger Navn
Liste over veterinærlægemidlernes navne, lægemiddelformer, styrker, måldyrearter og ansøgere/indehavere af markedsføringstilladelse i medlemsstaterne
 Bilag I Liste over veterinærlægemidlernes navne, lægemiddelformer, styrker, måldyrearter og ansøgere/indehavere af markedsføringstilladelse i medlemsstaterne Medlemsstat EU/EØS Ansøger Særnavn INN Styrke
Bilag I Liste over veterinærlægemidlernes navne, lægemiddelformer, styrker, måldyrearter og ansøgere/indehavere af markedsføringstilladelse i medlemsstaterne Medlemsstat EU/EØS Ansøger Særnavn INN Styrke
BILAG II FAGLIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉER OG INDLÆGSSEDLER FREMLAGT AF DET EUROPÆISKE LÆGEMIDDELAGENTUR
 BILAG II FAGLIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉER OG INDLÆGSSEDLER FREMLAGT AF DET EUROPÆISKE LÆGEMIDDELAGENTUR 108 FAGLIGE KONKLUSIONER SAMLET RESUMÉ AF DEN VIDENSKABELIGE VURDERING
BILAG II FAGLIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉER OG INDLÆGSSEDLER FREMLAGT AF DET EUROPÆISKE LÆGEMIDDELAGENTUR 108 FAGLIGE KONKLUSIONER SAMLET RESUMÉ AF DEN VIDENSKABELIGE VURDERING
Sundhedsudvalget SUU alm. del - Bilag 702 Offentligt
 Sundhedsudvalget SUU alm. del - Bilag 702 Offentligt Grundnotat til Folketingets Europaudvalg om forslag til kommissionsbeslutning om udstedelse af markedsføringstilladelse på særlige vilkår for lægemidlet
Sundhedsudvalget SUU alm. del - Bilag 702 Offentligt Grundnotat til Folketingets Europaudvalg om forslag til kommissionsbeslutning om udstedelse af markedsføringstilladelse på særlige vilkår for lægemidlet
Europaudvalget EUU alm. del - Bilag 293 Offentligt
 Europaudvalget EUU alm. del - Bilag 293 Offentligt Grundnotat til Folketingets Europaudvalg om forslag til kommissionsbeslutning om udstedelse af markedsføringstilladelse for lægemidlet Sebivo Resumé En
Europaudvalget EUU alm. del - Bilag 293 Offentligt Grundnotat til Folketingets Europaudvalg om forslag til kommissionsbeslutning om udstedelse af markedsføringstilladelse for lægemidlet Sebivo Resumé En
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
BILAG I BEGRUNDELSER FOR AFSLAG PÅ MARKEDSFØRINGSTILLADELSE
 BILAG I BEGRUNDELSER FOR AFSLAG PÅ MARKEDSFØRINGSTILLADELSE 1 BAGGRUND: Kommissionens beslutning K(2002) 5453 af 18. december 2002 udpegede "cholsyre" som lægemiddel til sjældne sygdomme på baggrund af
BILAG I BEGRUNDELSER FOR AFSLAG PÅ MARKEDSFØRINGSTILLADELSE 1 BAGGRUND: Kommissionens beslutning K(2002) 5453 af 18. december 2002 udpegede "cholsyre" som lægemiddel til sjældne sygdomme på baggrund af
Bilag II. Videnskabelige konklusioner og begrundelser for ændring af produktresumé, etikettering og indlægsseddel fremlagt af EMA
 Bilag II Videnskabelige konklusioner og begrundelser for ændring af produktresumé, etikettering og indlægsseddel fremlagt af EMA 7 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering
Bilag II Videnskabelige konklusioner og begrundelser for ændring af produktresumé, etikettering og indlægsseddel fremlagt af EMA 7 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering
Bilag II. Videnskabelige konklusioner og begrundelse for tilbagetrækning af markedsføringstilladelserne
 Bilag II Videnskabelige konklusioner og begrundelse for tilbagetrækning af markedsføringstilladelserne 4 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Caustinerf arsenical,
Bilag II Videnskabelige konklusioner og begrundelse for tilbagetrækning af markedsføringstilladelserne 4 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Caustinerf arsenical,
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, DYREARTER, INDGIVELSESVEJ OG INDEHAVERE AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE
 BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, DYREARTER, INDGIVELSESVEJ OG INDEHAVERE AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE EMEA/CVMP/269630/2006-DA Juli 2006 1/7 Medlemsstat Belgien
BILAG I FORTEGNELSE OVER LÆGEMIDLERNES NAVNE, LÆGEMIDDELFORM, DYREARTER, INDGIVELSESVEJ OG INDEHAVERE AF MARKEDSFØRINGSTILLADELSE I MEDLEMSSTATERNE EMEA/CVMP/269630/2006-DA Juli 2006 1/7 Medlemsstat Belgien
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Ingelvac CircoFLEX injektionvæske, suspension til grise 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En dosis à 1 ml inaktiveret vaccine indeholder: Aktivt
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Ingelvac CircoFLEX injektionvæske, suspension til grise 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En dosis à 1 ml inaktiveret vaccine indeholder: Aktivt
Hele virion influenzavaccine af pandemisk stamme, inaktiveret, med antigen * svarende til:
 1. LÆGEMIDLETS NAVN Daronrix, injektionsvæske, suspension, i fyldt injektionssprøjte Pandemisk influenzavaccine (hele virion, inaktiveret, adjuveret) 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hele virion
1. LÆGEMIDLETS NAVN Daronrix, injektionsvæske, suspension, i fyldt injektionssprøjte Pandemisk influenzavaccine (hele virion, inaktiveret, adjuveret) 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hele virion
BILAG I PRODUKTRESUMÉ
 BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN YTRACIS radiofarmaceutisk mærkningsopløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml steril opløsning indeholder 1,850 GBq yttriumchlorid ( 90 Y) på
BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN YTRACIS radiofarmaceutisk mærkningsopløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml steril opløsning indeholder 1,850 GBq yttriumchlorid ( 90 Y) på
BILAG II FAGLIGE KONKLUSIONER OG BEGRUNDELSER FOR AFSLAG
 BILAG II FAGLIGE KONKLUSIONER OG BEGRUNDELSER FOR AFSLAG 3 FAGLIGE KONKLUSIONER SAMLET RESUMÉ AF DEN FAGLIGE VURDERING AF MYDERISON Tolperison er et centralt virkende muskelafslappende middel, som er indiceret
BILAG II FAGLIGE KONKLUSIONER OG BEGRUNDELSER FOR AFSLAG 3 FAGLIGE KONKLUSIONER SAMLET RESUMÉ AF DEN FAGLIGE VURDERING AF MYDERISON Tolperison er et centralt virkende muskelafslappende middel, som er indiceret
Bilag II. Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelsen
 Bilag II Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelsen 35 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Seroquel/Seroquel
Bilag II Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelsen 35 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Seroquel/Seroquel
PRODUKTRESUMÉ. for. Hyobac App 2 Vet., injektionsvæske, emulsion. Actinobacillus pleuropneumoniae, serotype 2, RP > 1*
 10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Gripovac 3 injektionsvæske, suspension, til svin. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 2 ml indeholder: Aktive stoffer: Stammer af
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Gripovac 3 injektionsvæske, suspension, til svin. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 2 ml indeholder: Aktive stoffer: Stammer af
PRODUKTRESUMÉ. for. Romefen Vet., tabletter
 29. oktober 2012 PRODUKTRESUMÉ for Romefen Vet., tabletter 0. D.SP.NR 8710 1. VETERINÆRLÆGEMIDLETS NAVN Romefen Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Ketoprofen 10 mg og 20 mg. 3. LÆGEMIDDELFORM
29. oktober 2012 PRODUKTRESUMÉ for Romefen Vet., tabletter 0. D.SP.NR 8710 1. VETERINÆRLÆGEMIDLETS NAVN Romefen Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Ketoprofen 10 mg og 20 mg. 3. LÆGEMIDDELFORM
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1/19 1. VETERINÆRLÆGEMIDLETS NAVN Eurican Herpes 205 pulver og solvens til injektionsvæske, emulsion. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof 1 dosis á 1 ml indeholder:
BILAG I PRODUKTRESUME 1/19 1. VETERINÆRLÆGEMIDLETS NAVN Eurican Herpes 205 pulver og solvens til injektionsvæske, emulsion. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof 1 dosis á 1 ml indeholder:
