Den mulige rolle for kaliumkanalen TASK-2 i aktiveringen af humane T-celler
|
|
|
- Magdalene Jeppesen
- 6 år siden
- Visninger:
Transkript
1 K Ø B E N H A V N S U N I V E R S I T ET Kandidatspeciale Pernille Dyhl Strøm Den mulige rolle for kaliumkanalen TASK-2 i aktiveringen af humane T-celler Vejleder: Professor Else Kay Hoffmann, ph.d. Afleveret den: 01/09/12
2 Forord Dette speciale repræsenterer afslutningen på min uddannelse som kandidatstuderende på Københavns Universitet, ved Det Naturvidenskabelige Fakultet. Specialet er baseret på forsøg udført fra november 2010 til juni 2012, under vejledning af Professor Else Kay Hoffmann ph.d. og Signe Skyum Kirkegaard ph.d.-studerende på Biologisk institut, sektionen for Celle og Udviklings Biologi. Dele af resultaterne blev præsenteret på Cell Volume Regulation meeting (CVR) september 2011, i Tübingen, Tyskland. Konference Resumé: TASK-2 and Activation of Human T-cells; Author(s): Strom Pernille D.; Kirkegaard Signe S.; Hoffmann Else K. Source: Cellular Physiology and Biochemistry Volume: 28, Issue: 6, Pages: , Published: Kontaktinformationer: Pernille Dyhl Strøm Amagerfælledvej 50B, vær København S Tlf.: pernille_08@hotmail.com 1
3 2
4 Anerkendelser Først og fremmest vil jeg gerne takke min vejleder Professor Else Kay Hoffmann for faglig og kyndig vejledning, samt ph.d.-studerende Signe Skyum Kirkegaard for faglig og praktisk vejledning, samt for de forsøg hun har udført. Derudover vil jeg også takke laborant Dorthe Nielsen og laborant Birthe (Bibi) Juul Hansen for hjælp i laboratoriet, samt postdoc Carlo G. Ossum for altid at være flink til at hjælpe, hvis man har et problem eller spørgsmål. Jeg vil også gerne takke laborant Pia Birn fra Novo Nordisk for vejledning i oprensning af humane T-celler. Der skal også lyde en stor tak til de andre speciale studerende på 5 sal, samt de øvrige personer på 5 sal for gode og hyggelige stunder. Som det sidste vil jeg gerne takke min familie og kæreste for støtte igennem hele min uddannelse. Pernille Dyhl Strøm, september
5 4
6 Resumé T-celler er en heterogen population bestående af flere subpopulationer herunder CD4 +, CD8 +, regulatoriske og memory T-celler. Kontakt imellem T-celler og antigen præsenterende celler resulterer i en konformationsændring af T-celle receptoren og aktivering via en signaleringskaskade, der fører til øget cellevolumen og proliferation, samt udskillelse af cytokiner. Det er velkendt at K + -kanaler spiller en vigtig rolle i aktiveringen af T-celler, hvoraf det især er den spændingsafhængige Kv1.3 og den Ca 2+ aktiveret KCa3.1, der er velbeskrevet. Dog er det nu klart at ekspressions-mønstret af K + - kanaler i humane T-celler er mere kompliceret end tidligere beskrevet. En nylig publikation af Bittner et al. (2010) tilskriver den svumningsaktiveret, to-pore domæne K + -kanal TASK-2 en potentiel rolle i aktiveringen af T-celler. TASK-2 kanalen er blevet vist at være involveret i regulatory volume decrease (RVD), en regulatorisk mekanisme der findes i de fleste mammale celler i respons på cellesvulmning. Når celler svulmer grundet øget intracellulær- eller nedsat ekstracellulær osmolaritet, kompenserer de ved at udskille KCl, organiske osmolytter og vand. Da TASK-2 s rolle i aktiverede T-celler endnu ikke er fulgt afklaret, har formålet med dette speciale været at undersøge den mulige rolle for TASK-2 i aktiveringen af humane T-celler. Dette er blevet undersøgt ved at undersøge ekspressionen af TASK-2 på mrna- og protein niveau, samt ved at undersøge ændringer af volumen og volumenreguleringen som følge af T-celle aktivering. Ved aktivering med CD3/CD28 beads sås der en opregulering af TASK-2 i de aktiverede T-celler på både mrna- (efter 24 timer) og protein niveau (efter 3 dage) sammenlignet med de ikkeaktiverede Kontrolceller. Derudover blev de aktiverede T-celler signifikant større end de ikkeaktiverede Kontrolceller (efter 24 timer), samt signifikant dårligere til at udføre RVD (efter 24 timer). Der skal dog laves flere forsøg, for at kunne konkludere om TASK-2 har en rolle i aktiveringen af T-celler. 5
7 Abstract T-cells are a heterogeneous population consisting of several subpopulations including CD4 +, CD8 +, regulatory and memory T-cells. Contact between T-cells and antigen expressing cells results in rearrangement of the T-cell receptor and activation through a signaling cascade leading to several downstream events such as increased cell volume, proliferation, and release of cytokines. K + channels are known to play an important role in T-cell activation, and especially the voltage dependent Kv1.3, and the Ca 2+ -activated KCa3.1 is well described. However, it is now clear that the expression pattern of K + channels in human T-cells is more complicated than previously described. A recent publication by Bittner et al. (2010) ascribe the swelling activated, two-pore domain K + channel TASK-2, a potential role in T-cell activation. The TASK-2 channel has been shown to be involved in regulatory volume decrease (RVD), a regulatory mechanism found in most mammalian cells in response to cell swelling. When cells swell due to increased intracellular or decreased extracellular osmolarity, they compensate by releasing KCl, organic osmolytes, and water. The role of TASK-2 in T-cells is still not fully elucidated, thus the aim of this study is to investigate the potential role of TASK-2 in human T-cell activation. This has been studied by examining the expression of TASK-2 at mrna and protein levels as well as by examining the changes of the volume, and the volume regulation as a result of T cell activation. Upon activation with CD3/CD28 beads an upregulation of the TASK-2 on both mrna- (after 24 hours) and protein levels (after 3 days) was observed in the activated T cells compared to the nonactivated Control cells. In addition, the activated T cells are significantly greater than the nonactivated Control cells (after 24 hours), and significant poorer to perform the RVD (after 24 hours). However more experiments are needed in order to be able to conclude whether TASK-2 has role in the activation of T cells. 6
8 Indholdsfortegnelse Forkortelser Kapitel Introduktion T-celle subtyper Tidsperspektivet i et immunrespons T-celle aktivering T-celle receptoren (TCR) Signaleringskaskaden DAG medieret signalering IP 3 medieret signalering Costimulation K + - kanaler involveret i T-celle aktivering (Kv1.3, KCa3.1) TASK-2: En nylig rolle i T-celler To-pore domæne familien TASK-2 og TASK- familien TASK-2 i volumenreguleringen af EATC Mekanismer i aktiveringen af TASK Nylig rolle for TASK-2 i T-celler Cellevolumenregulering Regulatory Volume Decrease og Regulatory Volume Increase Betydningen af cellesvulmning for proliferation Volumenregulering i T-celler Autoimmune sygdomme: Multipel Sklerose Multipel Sklerose (MS) Epidemiologi Nervesignaler Patogenesen i Multipel Sklerose Kapitel Formål Kapitel
9 Materialer og Metoder Celler T-celler Oprensning af T-celle subtyper Aktivering af T-celler Jurkat- cellelinjen Cellevolumen måling Coulter Counteren RNA kvantificering RNA oprensning og måling Reverse transkriptase (RT) PCR (cdna syntese) Real time PCR (qpcr) Kvantificering af cdna Protein kvantificering Cellelysater Proteinmåling SDS-PAGE (Sodium-dodecyl-sulfat-polyacrylamide-gel electrophoresis) Western Blotting Knockdown med sirna Proliferation Kapitel Resultater Effekten af aktivering på volumen og RVD T-cellers volumen øges ved aktivering Ændring i RVD responset mrna ekspression af TASK-2, Kv1.3 og KCa Ekspression af TASK-2 og Kv1.3 på protein niveau Ekspression af TASK-2 og Kv1.3 i T-celle subtyper Knockdown af TASK-2 med sirna Proliferation Kapitel Diskussion
10 Generelt om forsøgsopsættet Effekten af aktivering på volumen og volumenregulering i humane T-celler Initial nedgang i antallet af celler Opregulering af TASK-2 på mrna- og protein niveau i aktiverede T-celler Ekspressionen af KCa3.1 og Kv1.3 i aktiverede T-celler TASK-2 ekspression i forskellige T-celle subtyper Kv1.3 ekspression i Central Memory og Effector Memory T-celler Knockdown med sirna Proliferation i T-celle subtyper efter aktivering med CD3/CD28 beads Kapitel Fremtidige eksperimenter Kapitel Konklusion Referenceliste Appendiks A: Opløsninger, buffere og medier Appendiks B: Produkter Appendiks C: Protokoller Appendiks D: Forsøgsoversigt Appendiks E: Øvrige resultater Appendiks F: Abstract CVR Meeting
11 10
12 Forkortelser ADAP: Adhesion- and degranulation-promoting adaptor protein Ag: Antigen AP-1: Aktiverings protein-1 APC: Antigen præcenterende celle AQP: Aquaporin BCL10: B-cell lymphoma-10 CARMA1: Caspase recruitment domain (CAR), membrane-associated guanylate kinase, protein 1 (MA1) cdna: Complement DNA CM: Central Memory CNS: Centralnervesystemet CRAC: Calcium Release-Activated Ca 2+ CSF: Cerebrospinalvæsken DAG: Diacyl glycerol ddh2o: Dobbelt Destillerede vand DMSO: Dimethyl Sulfoxide DNA: Deoxyribonucleic acid DTT: Dithiothreitol EATC: Ehrlich ascites tumor cells EBV: Epstein Barr EM: Effector Memory ER: Endoplasmatiske Reticulum ERK: Extracellular signal-regulated Kinase FBS: Fetal Bovine Serum Foxp3: Forkhead box P3 GADS: GRB2-related adaptor protein GAPs: GTPase-Aktiverende Proteiner GEFs: Guanine nucleotide Exchange Factors GRB2: Growth-factor-receptor-bound protein 2 HHV: Human Herpesvirus HLA: Humane Leukocyt antigener HPK1: Haematopoietic progenitor kinase 1 IFN-ɣ: Interferon-gamma Ig: Immunoglobulin IKK: Inhibitor of NF-κB Kinase IL: Interleukin IP-10: IFN-inducerede Protein på 10 kda ITAMs: Immunoreceptor tyrosine-based activation motifs Itk: IL-2 induceret tyrosine kinase K: Kalium LAT: Linker for activation of T cells LFA-1: Leucocyte Functional Antigen-1 MAPKs: Mitogen-Aktiveret Protein Kinaser MBP: Myelin Basic Protein MHC: Major histocompatibility complex mpv(pic): monoperoxo(picolinato)-oxo-vanadate(v) MR: Magnetisk Resonans MS: Multiple Sclerosis MALT-1: Mucosa-Associated Lymphoid Tissue lymphoma translocation protein 1 Nck: Non-catalytic region of tyrosine kinase NFAT: Nuclear Factor of Activated T cells NF-κB: Nuclear Factor κb NO: Nitrigenmonooxid 11
13 PBMC: Peripheral Blood Mononuclear Cell PBS: Phosphate Buffered Saline PDK1: 3-Phosphoinositide-Dependent protein Kinase 1 PH: Pleckstrin Homology PI3K: Phosphoinositide 3-kinase PIP 2 : Phosphatidylinositol 4,5-bisphosphate PIP 3 : Phosphatidylinositol 3,4,5 triphosphate PKCθ: Protein kinase C theta PLC: Phospholipase C IP 3 : Inositol 1,4,5-tris-phosphate PP-MS: Primær-progressiv PR-MS: Progressiv-relapserende PTK: Protein tyrosine kinase qpcr: Quantitative polymerase chain reaction (Real time PCR) RBC: Røde blodceller RANTES: Regulated upon Activation, Normal T-cell Expressed, and Secreted RasGRP: Ras Guanyl nukleotide-releasing Protein RISC: RNAi Induced Silencing Complex RNA: Ribonucleic acid RNAi: RNA interferens RR-MS: Relapserende-remitterende RT: Reverse transcriptase RVD: Regulatory Volume Decrease RVI: Regulatory Volume Increase SDS-PAGE: Sodium-dodecyl-sulfat-polyacrylamide-gel electrophoresis SH2: Src homologi 2 sirna: small interfering RNA SLP-76: Src homology 2 (SH2) domain-containing leukocyte protein of 76 kda SOS: Son of sevenless SP-MS: Sekundært-progressiv ssdna: single-stranded DNA STIM1: Stromal Interacting Molecule 1 TALK: TWIK-Related Alkaline ph-activated K + channel TASK-2: TWIK-related Acid-Sensitive K + channel-2 TCR: T-celle recepter Th: T hjælper THIK: Tandem Pore Domain Halothane-Inhibited K + channel TM: Trans-Membrane TNF-β: Transforming growth factor-beta TRAAK: TWIK-Related Arachidonic Acid-stimulated K + channel Treg: regulatoriske T-celler TREK: TWIK-Related K + channel TRESK: TWIK-Related Spinal Cord K + channel TSLP: Thymic stromal lymphopoietin TWIK: Two pore domain Weak Inward rectifying K + channel VLA-4: alpha 4 subunit of Very Late activation Antigen- 4, VRAC: volume-regulated anion current WB: Western Blot ZAP-70: Zeta-associated protein SEM: Standard Error of Mean 12
14 Kapitel 1 Introduktion Det har været kendt længe, at aktiveringen af T-celler er afhængig af kalium(k + )- kanaler, herunder den spændingsafhængige Kv1.3 [1] og den calcium (Ca 2+ ) afhængige KCa3.1 [2]. Udover Kv1.3 og KCa3.1 er det fornyligt foreslået, at K + - kanalen TASK-2 måske har en rolle i aktiveringen af T-celler [3]. Udover at kunne spille en rolle i aktiveringen af T-celler er det også for nyligt vist, at TASK-2 spiller en rolle i volumenreguleringen af murine T-celler [4]. TASK-2 blev først identificeret som en svulmningsaktiveret K + - kanal i Ehrlich ascites tumor celler (EATC) af Else K. Hofmanns og Francisco V. Sepulvedas (Chile) forskningsgrupper [5]. Derudover er TASK-2 også blevet vist at være involveret i volumenregulering af nyreceller [6] og murine spermatozoer [7]. Da T-celler er involveret i flere autoimmune sygdomme, herunder Multipel Sklerose, har der længe været fokus på, som en mulig behandling, at udvikle antistoffer mod K + -kanaler i T-celler [8,9]. På baggrund af dette, har jeg i mit speciale undersøgt den mulige rolle for TASK-2 i aktiveringen af humane T- celler. I introduktionen indgår der først en beskrivelse af de forskellige T-celle subtyper og tidsperspektivet i et immunrespons, samt signaleringskaskaden der resulterer i aktiveringen af T- celler. Dernæst vil Kv1.3 og KCa3.1 kanalernes rolle i aktiveringen af T-celler blive beskrevet, hvilket efterfølges af en beskrivelse af TASK-2 og cellevolumenregulering. Introduktionen afsluttes med en beskrivelse af den autoimmune sygdom Multipel Sklerose. 13
15 1.1 T-celle subtyper T-celler er en del af det adaptive immunsystem og er en heterogen population bestående af forskellige subpopulationer herunder CD4 +, CD8 +, regulatoriske og memory T-celler. Udviklingen af T-celler begynder i thymus, hvor Thymocytter 1 (forstadier til T-celler) rearrangerer deres TCR gener og differentierer til modne T-celler. T-celle receptoren genkender korte peptider fra fremmed- og selv-antigener bundet til Major histocompatibility complex (MHC). Ved positiv selektion redes de Thymocytter der kan reagere med MHC molekyler fra apoptose. Thymocytterne tjekkes også ved en negativ selektion for, om de reagerer med selv-peptid. Selv-peptid reagerende Thymocytter vil få signal om at gå i apoptose. De Thymocytter der overlever begge dele forlader thymus som modne T-celler. T-cellerne kan være Naive CD4 + (CCR7 + CD45RA + ), Naive CD8 + (CCR7 + CD45RA + ) eller regulatoriske T-celler (CD4 + CD25 + ) [10 12]. Ved registrering af et antigen differentierer naive CD4 + og CD8 + T-celler til forskellige klasser af effekter T-celler. Naive CD4 + T-celler registrerer antigen via MHC klasse II, der findes på antigen præsenterende celler (APC), hvoraf de vigtigste er Dendritiske celler [13]. Naive CD4 + T-celler kan differentiere til Th1, Th2, Th17 og regulatoriske T-celler (Treg) (se Figur 1) [14]. CD4 + hjælper T- celler kan ikke selv dræbe værts inficerede celler, men hjælper andre immunceller ved at aktivere og dirigere dem. De forskellige typer af hjælper T-celler adskilles ved deres udskillelse af cytokiner. Th1 T-celler udskiller Interleukin 2 (IL-2), Interferon-gamma (IFN-ɣ) og Transforming growth factor-beta (TNF-β) og er involveret i immunresponset imod intracellulære mikoorganismer. IL-12 der udskilles af makrofager og dendriter er vigtig i udviklingen af Naive CD4 + T-celler til Th1 T- celler. IL-4 er vigtig i udviklingen af Th2 T-celler, som udskiller IL-4, IL-5, IL-6 og IL 13. Th2 T-celler indgår i bekæmpelsen af parasitiske orme og inducerer Immunoglobulin E (IgE) afhængig Mastcelle degranulering og aktivering af Eosinofile leukocytter, som også er skyld i allergi hos nogle personer [15]. Th17 T-celler initieres af TGF-β ved tilstedeværelsen af IL-6 eller IL-21 og forstærkes af IL-23. Th17 T-celler er med i bekæmpelsen af svampe og ekstracellulære bakterier og udskiller cytokinerne IL-17, IL-17F og IL-22. Derudover er Th17 T-celler også involveret i vævsinflammationen i flere autoimmune sygdomme [11,14]. 1 Udviklet fra den pluripotent hematopoietic stamcelle dannet i knoglemarven. 14
16 Treg cellerne indgår i hæmningen af et immunrespons, hvilket de gør ved at hindre aktiveringen og udviklingen af Naive T-celler. Treg celler kendetegnes ved at udtrykke CD4 og CD25 på overfladen, samt transkriptionsfaktoren Forkhead box P3 (Foxp3) i cellekernen. Der findes to typer af Treg celler: naturligt forekommende Natural regulatory T-celler som udvikles i thymus og Adaptive regulatory T-celler der udvikles i periferien [10,16,17]. Udviklingen af de naturligt forekommende Treg celler drives af Thymic stromal lymphopoietin (TSLP) udskilt af aktiverede dendritiske celler i thymus [16], mens de adaptive Treg celler udvikles ved, at TGF-β inducerer transkription af Foxp3 i perifere CD4 + CD25 - T-celler [17]. Figur 1: Differentieringen af CD4 + T- celler. Naive CD4 + differentierer til forskellige effekter T-celler (Th1, Th2, Th17 og Treg) efter aktivering med antigen og påvirkelse af forskellige cytokiner (IL-12, IL-4, TGF-β/IL- 6/IL-23 og TGF-β) (Fra: [14]). Naive CD8 + T-celler genkender antigen via MHC klasse I, der udtrykkes på de fleste celler i kroppen. Naive CD8 + T-celler udvikles til cytotoksiske (dræber) T-celler ved aktivering med antigen. Cytotoksiske T-celler dræber virus inficerede celler og inducerer deres effekter funktion ved cellecelle afhængig udskillelse af cytotoksiner (Perforin, Granzymes og Granulysin), der perforerer cellemembranen og inducerer apoptose. Cytotoksiske T-celler kan også inducere apoptose ved at binde deres Fas ligander på overfladen, til Fas receptorer på overfladen af målcellerne [18,19]. Ved et immunrespons dannes der to typer af langtidslevende memory T-celler: Central Memory T-celler (T CM ) og Effector Memory T-celler (T EM ). Disse adskilles ved at T CM (CD4 + eller CD8 + CD45RA - ) udtrykker chemokin-receptoren CCR7, der kontrollerer homing til sekundære 15
17 lymfoide organer, hvor T CM stimulerer dendritiske celler og B-celler, mens T EM (CD4 + eller CD8 + CD45RA - ) mangler CCR7, hvilket gør, at T EM kan udføre øjeblikkelige inflammatoriske og cytotoksiske effekter-funktioner i det inflammeret væv. T CM mangler øjeblikkelige inflammatoriske og cytotoksiske effekter-funktioner, men differentierer til T EM ved aktivering [20]. 1.2 Tidsperspektivet i et immunrespons Et effektivt og specifikt immunrespons kan forekomme 4-7 dage efter infektion med et ukendt patogen. Inden Naive CD4 + og Naive CD8 + T-celler, i respons på aktivering med antigen, kan differentiere til effekter T-celler og memory T-celler, må de Naive T-celler først dele sig. Efter 4-5 dage med kraftig vækst kan de aktiverede T-celler differentiere til effekter T-celler med maksimal cytokin produktion og memory T-celler. Initiering af cytokin-genekspression tager timer i hvilende celler og evnen til at udskille cytokiner starter 1-2 dage efter aktivering [21]. Antigen specifikke T-celler genererer et gennemsnit på mere end 20 datterceller indenfor en 48 timers periode og gennemgår dermed en cellecyklus indenfor ca. 10,6 timer [22,23]. Aktiverede T-celler kan dermed karakteriseres ved proliferation og cytokin produktion. Aktiveringen af T-celler involverer en kompleks signaleringskaskade, der resulterer i aktiveringen af specifikke transkriptionsfaktorer, som inducerer transkription af gener, der indgår i proliferation og differentiering af T-celler [24]. 1.3 T-celle aktivering T-celle receptoren (TCR) I begyndelsen af 1980 erne udførte flere grupper eksperimenter, der identificeret og karakteriseret antigen receptoren på T-celler [25,26]. T-celle receptoren (TCR) består af en 16
18 heterodimer af en α- og en β- glykoprotein kæde 2. TCR er nonkovalent bundet til to heterodimere af CD3 proteiner (ɣɛ og δɛ), samt en homodimer af to ζ kæder (se Figur 2) [27]. α- og β-kæderne består henholdsvis af en konstant del (C), som går igennem membranen, samt en variabel del (V), der genkender og binder antigen. Den variable del udgøres af et genrearrangement af forskellige V (Variable), D (Diversitet, kun β) og J (Joining) gen-segmenter. Det store antal af forskellige V, D og J segmenter og dermed et utal af kombinationsmuligheder gør, at T-celler kan registrere mange forskellige antigener [28]. Ekspressionen af α,β sammen med CD3 er obligatorisk, da T-celle aktivering ikke kan forekomme uden CD3 [29]. T-celler kan aktiveres med anti-cd3, hvilket også bekræfter relevansen af disse proteiner [30,31]. Som ovenfor nævnt genkender T-celler peptider af antigener via MHC, der er udtrykt på overfladen af antigen præsenterende celler (APC) [32]. Ved ligand binding af en APC, med det specifikke antigen-peptid bundet til MHC, sker der en konformationsændring i TCR, som samler de forskellige komponenter i TCR-komplekset og coreceptoren (CD4 eller CD8), hvilket medfører aktiveringen af en downstream signaleringskaskade, der fører til genekspressionen af gener involveret i aktiveringen af T-celler. De præcise konformationsændringer er dog kontroversielle og flere modeller er forslået [24]. Figur 2: T-celle receptor (TCR)- komplekset. TCR αβ-heterodimeren er nonkovalent bundet til CD3 heterodimerne ɛδ og ɛɣ, samt til ζζ-homodimeren. α- og β kæderne består af henholdvis en variabel del, der genkender og binder antigen, samt en konstant del, som går igennem membranen (Fra: Murphy K, Travers P, Walport M (2008). Janeway s Immuno biology, seventh edition, side 229, Garland Science). 2 T-celler med TCR opbygget af α,β kæder udgør mere end 95 % af de perifere T-celler, mens den sidste del udgøres af T-celler, der udtrykker TCR bestående af en ɣ- og en δ kæde [23]. 17
19 Signaleringskaskaden Første trin i den intracellulære signalering, efter TCR binding og samling, er aktiveringen af nonreceptor protein tyrosin kinaser (PTKs), da TCR ikke selv har nogen enzymatisk aktivitet. TCR rekrutterer cytosoliske PTKs af Src familen (Fyn og Lck) [33,34]. Fyn associerer med TCR via CD3 [35] og Lck associerer med membranproteinerne CD4 eller CD8 [36]. I hvilende celler er Fyn og Lck enzymatiske inactive ved at være fosforyleret på tyrosin residues Tyr 528/505 på C-terminalen. Fosforyleret Tyr 528/505 binder Src homologi 2 (SH2) domæner på N-terminalen, hvilket gør, at molekylerne er foldet i et inaktivt stadie, hvor kinase-domænet er dækket og dermed blokeret for aktivitet. Ved aktivering af T-celler defosforyleres Tyr 528/505 af fosfatasen CD45, som er bundet til membranen, hvilket frigiver kinase-domænet og medfører autofosforylering af Tyr 417/394 og aktivering af kinaserne [37]. Efter aktivering fosforylerer Fyn og Lck Immunoreceptor tyrosine-based activation motifs (ITAMs) på CD3 og ζζ. ITAM er et aminosyrer langt molekyle, indeholdende to tyrosin residues. TCR-komplekset indeholder 10 ITAMs, en på hver CD3 kæde og 3 på hver ζ kæde [38,39]. De fosforylerede ITAMs fungerer som bindingssted for PTK Zeta-associated protein (ZAP-70), der er et 70- kda fosfoprotein fra Syk kinase familien. ITAMs binder ZAP-70 via SH2 domæner [40,41]. Bundet ZAP-70 fosforyleres og aktiveres af Fyn og Lck. Aktiveret ZAP-70 rekrutterer og fosforylerer adapterproteinerne Linker for the activation of T-cells (LAT) og SH2 domain-containing leukocyte phospho-protein of 76 kda (SLP-76) (se figur 3) [42,43]. LAT er membranbundet og ved fosforylering rekrutterer og binder LAT Phospholipase C-gamma 1 (PLCɣ1), Phosphoinositide 3-kinase (PI3K), samt adapterproteinerne Growth-factor-receptorbound protein 2 (GRB2) og GRB2-related adaptor protein (GADS), via SH2 domænet på C- terminalen [44]. Cytosolisk SLP-76 rekrutteres til fosforyleret LAT via GADS. SLP-76 indeholder tre fosforyleringssteder på N-terminalen, der integrerer med SH2 domæner på Guanine-nukleotideexchange faktoren (GEF) Vav1, adapter Non-catalytic region of tyrosine kinase (Nck), IL-2 induceret tyrosine kinase (Itk), Adhesion- and degranulation-promoting adaptor protein (ADAP) og Haematopoietic progenitor kinase 1 (HPK1). Dette udgør tilsammen det proksimale signaleringskompleks (se Figur 3) [45]. 18
20 PLCɣ1 er direkte bundet til SLP-70, LAT og Itk i signaleringskomplekset. Itk fosforylerer og aktiverer PLCɣ1. Aktiveringen af PLCɣ1 via Itk er afhængig af SLP-76 og Vav1, da de sørger for, at Itk er i den aktive form [46,47]. PLCɣ1 aktivering resulterer i aktiveringen af de PLCɣ1 afhængige signaleringsveje, som inkluderer Ca 2+ og diacyl glycerol (DAG) inducerede responser. PLCɣ1 hydrolyserer membranlipidet Phosphatidylinositol 4,5-bisphosphate (PIP 2 ) til Inositol 1,4,5-tris-phosphate (IP 3 ) og DAG (se Figur 3). Disse sekundære signaleringsstoffer er essentielle i aktiveringen af T- celler, da de aktiverer signaleringskaskader, der fører til aktiveringen af transkriptionsfaktorerne Aktiverings protein-1 (AP-1), Nuclear factor κb (NF-κB) og Nuclear factor of activated T cells (NFAT), som inducerer ekspression af gener involveret i proliferation, cytokin produktion og differentiering [24]. Figur 3: Signaleringskaskaden downsteam for T-celle receptoren. TCR-komplekset rekrutterer protein tyrosin kinasen Lck, som fosforylerer ITAMs på CD3 og ζ, hvorefter protein tyrosin kinasen ZAP-70 kan bindes og fosforyleres af Lck. ZAP-70 rekrutterer og fosforylerer adapterproteinerne LAT og SLP-76. Fosforyleret LAT binder PLCɣ, samt adapterproteinerne GRB2 og GADS. SLP-76 rekrutteres til fosforylerede LAT via GADS og binder guanine-nukleotide-exchange faktoren Vav1, adapterproteinerne Nck og ADAP, samt kinaserne Itk og HPK1. Disse udgør tilsammen det proksimale signaleringskompleks. Itk fosforylerer og aktiverer PLCɣ, som herefter hydrolyserer PIP-2 til IP 3 og DAG. IP 3 aktiverer Ca 2+ afhængig aktivering af transkriptionsfaktoren NFAT, mens DAG fører til aktivering af RAS og PKCθ, der er involveret i aktiveringen af transkriptionsfaktorene NF-κβ og AP1 (For forkortelser se teksten) (Fra: [45]). 19
21 DAG medieret signalering DAG aktiverer to signaleringsveje hvor henholdsvis Ras og Protein kinase C theta (PKCθ) er involveret [24]. Ras er et guanin nukleotid-bindende protein (GTPase), der er aktiv i det GTPbundet stadie. Aktiveringen af Ras faciliteres af guanine nucleotide exchange factors (GEFs) og undertrykkes af GTPase-aktiverende proteiner (GAPs) [48]. Der findes to typer af GEFs i T-celler; Son of sevenless (SOS) og Ras guanyl nukleotide-releasing protein (RasGRP) [49]. SOS er konstitutivt bundet til GRB2, der ved T-celle aktivering binder LAT, hvilket bringer SOS i kontakt med det proksimale signaleringskompleks og plasmamembranen, hvormed det kan aktivere Ras. RasGRP rekrutteres til plasmamembranen via DAG-bindings domæner, hvor det fosforyleres af PKCθ og herefter kan aktivere Ras. Aktiverede Ras kan binde en række effekter-proteiner og dermed aktivere flere downstream signaleringskaskader. Aktiveringen af serin-threonin kinasen Raf-1 er afhængig af GTP bundet Ras. Raf-1 initierer en fosforylerings- og aktiveringskaskade ved at fosforylere og stimulere kinasen Mek, der herefter aktiverer de mitogen-aktiverede protein kinaser (MAPKs) Extracellular signal-regulated kinase 1 (ERK-1) og ERK-2. ERK kinase aktivitet resulterer i aktiveringen af transkriptionsfaktoren Elk1, der bidrager til aktiveringen af transkriptionsfaktoren AP-1 [24,48]. PKCθ signaleringen fører til aktiveringen af transkriptionsfaktoren NF-κB. Aktivering af NF-κB involverer aktivering af flere adapterproteiner inkl. CARMA1 3, B-cell lymphoma-10 (BCL10), Mucosa-associated lymphoid tissue lymphoma translocation protein 1 (MALT-1), samt Inhibitor of NF-κB kinase (IKK) komplekset bestående af enzymatiske komponenter IKKα og IKKβ, samt en regulatorisk subunit IKKɣ. PKCθ indeholder et cystein-rigt C1 domæne, der binder plasmamembran lokaliseret DAG. Plasmamembran associeret PKCθ rekruterer og fosforylerer CARMA1, som dernæst rekrutterer BCL10-MALT-1 komplekset. Det aktiveret BCL10-MALT kompleks aktiverer IKK ved at inducere ubiquitinering af IKKɣ. Nedbrydning af IKKɣ fører til frigivelse af IKKβ og IKKα, der fosforylerer det inhibitoriske IκB protein, hvilket fører til destruktion af IκB og translokation af NFκB ind i cellekernen [50 52]. 3 CARMA1: Caspase recruitment domain (CAR), membrane-associated guanylate kinase, protein 1 (MA1). 20
22 IP3 medieret signalering IP 3 initierer Ca 2+ -medieret signalering ved at binde til IP 3 - receptorer på membranen af det Endoplasmatiske reticulum (ER), hvilket medfører frigivelsen af Ca 2+ fra intracellulære Ca 2+ lagre. Ved tømning af lagret aktiveres Calcium release-activated Ca 2+ (CRAC) kanaler i cellemembranen, som resulterer i at ekstracellulært Ca 2+ kommer ind i cellen. CRAC- kanaler aktiveres ved, at Ca 2+ sensoren Stromal interacting molecule 1 (STIM1) i ER interagerer med den poreformende subunit Orai1 i CRAC-kanaler. Øgningen af intracellulært Ca 2+ resulterer i bindingen af Ca 2+ til calmodulin (CaM). Ca 2+ bundet calmodulin aktiverer serin-threonin fosfatasen calcineurin. Aktiveret calcineurin defosforylerer NFAT, hvilket frigiver nukleus lokaliserende sekvenser, som medfører, at NFAT translokerer ind i kernen og interagerer med andre transkriptionsfaktorer, heriblandt AP-1 [53]. Costimulation T-celle aktivering via signalering fra TCR-komplekset kan ikke stå alene, men kræver costimulering af en coreceptor. Ved manglen på stimulering via en coreceptor vil T-cellen gå i anergy, som er et stadie hvor T-cellen ikke reagerer på binding af antistof [54]. CD28 er den mest fremtrædende af de kendte coreceptorer og dens rolle er at fremme celledeling, cytokin produktion, celleoverlevelse og cellulær metabolisme. CD28s ligander B7.1 (CD80) og B7.2 (CD86) er udtrykt i høje niveauer på overfladen af aktiverede APC [24]. Når B7.1 eller B7.2 ligand bindes til CD28, vil PI3K associere med et phospho-ymnm (pymnm) motif lokaliseret på den cytoplasmiske hale af CD28. Den katalytiske del af PI3K kan herefter omdanne PIP 2 til Phosphatidylinositol 3,4,5 triphosphate (PIP 3 ). PIP 3 fungerer som et bindingssted for Pleckstrin homology (PH) domænerne af 3-phosphoinositide-dependent protein kinase 1 (PDK1) og Akt. PDK1 fosforylerer og aktiverer Akt, der herefter øger translokationen af NF-κB til kernen ved at binde CARMA1 og dermed facilitere samlingen af signaleringskomplekset. Itk kan binde PIP 3 via dens PH domæne eller binde direkte til CD28, hvilket medfører aktivering af Itk via Lck medieret fosforylering. Derudover er CD28 også med til at aktivere Vav1. Dermed er CD28 med til at mediere en forøgelse af den TCR induceret aktivering af PLCɣ1, via det proksimale signaleringskompleks. [24,55,56]. 21
23 1.4 K + - kanaler involveret i T-celle aktivering (Kv1.3, KCa3.1) Det er vist at K + -kanalerne Kv1.3 og KCa3.1 er involveret i aktiveringen af humane T-celler [1,2]. Kv1.3 og KCa3.1 har 6 transmembrane (TM) segmenter og 4 pore domæner. Kv1.3 er en spændingsaktiveret K + - kanal, der aktiveres når membranpotentialet depolariseres, hvilket resulterer i en udstrømning af K + ioner. KCa3.1 er en Ca 2+ aktiveret K + - kanal, som aktiveres ved stigning i cytosolisk Ca 2+, hvilket medfører en udstrømning af K + ioner. Udstrømningen af K + ioner hyperpolariserer cellen og driver indstrømningen af Ca 2+, hvilket er med til at opretholde Ca 2+ - signaleringen i cellen. K + - udstrømningen gennem begge kanaler er involveret i aktiveringen af humane T-celler ved at opretholde indstrømningen af Ca 2+ [57]. Involveringen af Kv1.3 og KCa3.1 i aktiveringen af humane T-celler blev bevist ved forsøg, hvor hæmmere af Kv1.3 og KCa3.1 blev tilsat, hvilket resulterede i hæmning af proliferation og dermed af aktivering [1,2,58]. Ikke aktiverede Naive CD4 + og CD8 + T-celler fra humant perifert blod udtrykker ca. 300 funktionelle Kv1.3 kanaler og ca. 10 funktionelle KCa3.1 kanaler pr. celle. Ved aktivering forbliver antallet af Kv1.3 kanaler det samme, mens antallet af KCa3.1 stiger til ca. 500 kanaler pr. celle (se figur 4) [1,2,57]. Ved et immunrespons dannes der som ovenfor nævnt to typer af memory T-celler: langtids-levende Central Memory (CM) og Effector Memory (EM). Disse adskiller sig ikke kun ved at være henholdsvis CCR7 + CD45RA - og CCR7 - CD45RA -, men også ved at have et forskelligt ekspressions-mønster af K + - kanaler. Ikke aktiverede CM- og EM T-celler udtrykker ca. 300 funktionelle Kv1.3 kanaler og ca funktionelle KCa3.1 kanaler pr. celle. Ved aktivering opregulerer CM ligesom naive T-celler antallet af KCa3.1 til ca. 500 kanaler pr. celle, mens antallet af Kv1.3 kanaler forbliver det samme. EM derimod opregulerer Kv1.3 til ca kanaler pr. celle, mens antallet af KCa3.1 forbliver uændret (se figur 4) [8,57]. 22
24 Figur 4: Oversigt over ekspressionen af antal Kv1.3 og KCa3.1 K + - kanaler pr. celle (angivet som tal efter kanalnavnet) i aktiverede og ikke aktiverede Naive-, Effekter- og Memory T-celler (Revideret fra: [57]). Udover K + -kanalerne Kv1.3 og KCa3.1 er det for nyligt opdaget at K + - kanalen TASK-2, som hører til familien af to-pore domæne K + - kanaler, muligvis spiller en rolle i aktiveringen af T-celler [3]. Dette vil jeg beskrive nærmere i det følgende afsnit. 1.5 TASK-2: En nylig rolle i T-celler I dette afsnit vil jeg starte med at beskrive opdagelsen af familien af to-pore domæne K + - kanaler, TASK- familien, samt TASK-2. Dernæst vil jeg beskrive TASK-2 s rolle som svulmningsaktiveret K + - kanal i EATC, herunder nogle af aktiveringsmekanismerne. Til sidst vil jeg beskrive den ny opdaget mulige betydning af TASK-2 for aktiveringen af T-celler. To-pore domæne familien TASK-2 også kaldet KCNK5 og K 2p 5.1 hører til familien af to-pore (2P) domæne K + - kanaler (K 2P ) med 4 transmembrane (TM) segmenter M1-M4, hvoraf M1 og M2 flankerer det første P domæne, 23
25 mens M3-M4 flankerer det andet P domæne (se Figur 5). Denne familie af K + -kanaler med 2P/4TM subunits blev først identificeret i Det første eksempel på en K + - kanal med 2P domæner blev fundet i en sekvensdatabase for gæren Saccharomyces cerevisiae. Året efter blev KCNK0 klonet fra frugtfluen Drosophila melanogaster og det første mammale gen klonet for 2P/4TM (KCNK1). Siden er over 50 gener for 2P/4TM opdaget i sekvensdatabaser. Baseret på strukturelle og funktionelle egenskaber er familien af 2P/4TM K + - kanaler inddelt i 6 under familier: Two pore domain weak inward rectifying K + channel (TWIK), TWIK-related K + channel (TREK)/ TWIK-related arachidonic acid-stimulated K + channel (TRAAK), TWIK-related acid-sensitive K + channel (TASK), TWIKrelated alkaline ph-activated K + channel (TALK), Tandem pore domain halothane-inhibited K + channel (THIK) og TWIK-related spinal cord K + channel (TRESK). Familien af 2P/4TM K + - kanaler skiller sig ud fra andre familier af K + - kanaler ved at være konstitutiv aktive ved hvilemembranpotentialet [59,60], samt at være aktive som dimere (se Figur 5) [61]. hej Figur 5: Strukturen af K + - kanalen TASK-2. Den aktive form af TASK-2 består af to subunits, hver bestående af to-pore domæner og 4 TM segmenter (Fra: [62]). TASK-2 og TASK- familien TASK- kanaler blev klonet og identificerede som TWIK lignende K + - kanaler af Duprat et al. i 1997, heraf navnet TASK [63]. TASK-2 blev identificeret og klonet fra humane nyreceller i 1998 af Reyes et al [64]. TASK- familien består af baggrundskanaler også kaldet leak-kanaler, da de er 24
26 karakteriseret ved at være konstant aktive, med en udadgående strøm af K +, samt at mangle spændingsafhængig aktivering. Derudover er TASK- kanaler meget sensitive overfor ekstracellulært ph, da 90 % af den maksimale strøm kan måles ved ph 7,7, mens kun 10 % kan måles ved ph 6,7 [63]. TASK- kanaler er udtrykt i mange forskellige væv herunder i f.eks. hjernen, hjertet, lungerne, bugspytkirtlen og nyrerne, hvor de menes at bidrage til opretholdensen af hvilemembranpotentialet og/eller K + - transport associeret til genbrug eller sekretion. TASK-2 skiller sig ud fra de andre TASK- kanaler ved ikke at være udtrykt i nervesystemet, hjertet og skelet-muskulaturen [61]. TASK-2 udtrykkes mest i epitelvæv herunder i bugspytkirtlen, liveren, placenta, maven, tynd- og tyktarmen, samt i nyrerne. TASK-2 er især udtrykt i nyrerne, hvor den er udtrykt i Cortical distal tubules og Collecting ducts. TASK-2 kan blokeres med quinine og quinidine, men ikke med andre kendte K + - kanal blokere som tetraethylammonium, 4- aminopyridine og Cs + [64]. Derudover er TASK-2 blevet identificeret til at indgå i volumenreguleringen af nogle celletyper (se nedenfor). TASK-2 i volumenreguleringen af EATC TASK-2 blev som nævnt i indledningen først identificeret som en svulmningsaktiveret K + - kanal i EATC af Else K. Hofmanns og Francisco V. Sepulvedas (Chile) forskningsgrupper [5] og senere også identificeret til at være involveret i volumenreguleringen af nyreceller [6] og murine spermatozoer [7] (For nærmere beskrivelse af volumenregulering se 1.7 nedenfor). Det er vist, at TASK-2 som svulmningsaktiveret K + - kanal i EATC er spændings- og Ca 2+ uafhængig, samt at TASK-2 er sensitiv overfor Clofilium. Da TASK-2 er in sensitiv overfor de fleste kendte K + - hæmmere og at flere typer af K + - kanaler er sensitiv overfor Clofilium herunder Kv1.5, er der mangel på specifikke hæmmere af TASK-2 [5,65]. TASK-2 i EATC er også afhængig af ekstracellulært ph og konduktansen hæmmes af acidificering og øges af alkanisering [66]. Det var på baggrund af disse egenskaber at gruppen af TASK- kanaler kom i betragtning, som mulige kandidater til den ukendte svulmningsaktiveret K + - kanal i EATC. Forsøg viste at TASK-2 var udtrykt i EATC og kunne aktiveres ved cellesvulmning [67]. 25
27 Mekanismer i aktiveringen af TASK-2 Aktiveringen af TASK-2 er ikke direkte aktiveret af et cellemembranstræk som følge af cellesvulmningen [68]. Aktiveringen ser nærmere ud til at være en autokrin proces der involverer leukotrien D 4 [69], GTP binding [70] og tyrosin fosforylering [71]. Forsøg lavet af Signe S. Kirkegaard [71] viser, at tyrosin kinase-hæmmeren Genistein hæmmer RVD med 90 % og at tyrosin fosfatasehæmmeren Monoperoxo (picolinato)-oxo-vanadate(v) (mpv(pic) skifter volumen udgangspunktet for inaktivering af TASK-2 til et mindre volumen, hvilket indikerer, at tyrosin kinaser er involveret i aktiveringen af TASK-2 efter cellesvulmning og at fosfataser er involveret i inaktiveringen af TASK-2. Janus kinase-hæmmeren Curcurbitacin hæmmer RVD med 50 %, hvilket kunne indikere, at en cytokin receptor koblet JAK/STAT signaleringsvej kunne være opstrøms for den svulmningsaktiveret fosforylering og aktivering af TASK-2 [71]. Nylig rolle for TASK-2 i T-celler Det er som nævnt i indledningen fornylig fundet, at TASK-2 måske har en rolle i aktiveringen af T- celler. Dette er vist ved forsøg lavet af Bittner et al. [3]. Tilstedeværelsen af TASK-2 i humane T- celler blev fundet ved elektrofysiologiske undersøgelser, som viste karakter af en K 2p strøm, samt ved undersøgelser af ekspressionen af TASK-2 på RNA- og protein niveau. Ved aktivering af humane T-celler sås en signifikant og tidsafhængig opregulering af TASK-2 på både RNA- og protein niveau, hvoraf CD8 + T-celler havde den højeste ekspression. Knockdown med sirna eller farmakologisk hæmning af TASK-2 resulteret i reduceret T-celle funktion, hvorimod overekspression havde den modsatte effekt. Derudover blev den patofysiologiske relevans af TASK-2 vist ved undersøgelser af ekspressionen i T-celler fra patienter med Multipel Sklerose (MS). Da disse viste en øget ekspression af TASK-2 blev det konkluderet, at TASK-2 kan være et muligt mål i behandlingen af MS og andre autoimmune sygdomme foresagede af T-celler [3]. Udover at kunne spille en rolle i aktiveringen af T-celler er det også for nyligt vist, at TASK-2 spiller en rolle i volumenreguleringen af murine T-celler [4] (se nedenfor). 26
28 1.7 Cellevolumenregulering Overlevelsen af humane og animalske celler afhænger af, om cellerne kan undgå for store ændringer i cellevolumen, da de ikke kan modstå hydrostatisk pres pga. manglende cellevægge og dermed vil briste ved større stigninger i cellevolumen. Mammale cellemembraner er, med få undtagelser, meget permeable for vand, da de indeholder aquaporiner (AQPs), hvilket gør, at cellevolumen er determinerede af osmotisk aktive komponenter [72]. Grundet akkumulationen af organiske substanser inde i cellen, må den intracellulære koncentration af uorganiske ioner være lavere end den ekstracellulære koncentration. Cellen opretholder denne forskel ved at udskille 3 Na + i bytte for 2 K + via Na + /K + -ATPasen. Optaget af K + via Na + /K + -ATPasen skaber en udadgående gradient for K +. Cellers negative hvilemembranpotentiale skabes ved, at K + forlader cellen via K + - kanaler i cellemembranen, hvilket gør, at membranen er mere negativ på indersiden i forhold til ydersiden, hvilket skaber en udadgående gradient for Cl - [73]. Selv under fysiologiske forhold sker der ændringer i ekstracellulær og cellulær osmolaritet. Ved hypotoniske (lavere osmolaritet) ekstracellulære påvirkninger eller ved en øgning i den intracellulære mængde af osmolytter vil cellen svulme, da vand vil passere ind i cellen pga. den indadgående osmotiske gradient, mens cellen vil skrumpe ved hypertoniske (højere osmolaritet) ekstracellulære påvirkninger og ved tab af osmolytter, da vand vil forlade cellen pga. en udadgående osmotisk gradient. Cellen kompenserer for ændringer i cellevolumen ved to mekanismer Regulatory Volume Decrease (RVD) og Regulatory Volume Increase (RVI) [72 74]. Regulatory Volume Decrease og Regulatory Volume Increase Som nævnt ovenfor vil en celle der udsættes for en væske der har en lavere osmolaritet end inde i cellen (hypoton) svulme, da vand følger den osmotiske gradient ind i cellen, mens en celle der udsættes for en væske der har højere osmolaritet i forhold til inde i cellen (hyperton) vil skrumpe, da vand følger den osmotiske gradient ud af cellen [72]. 27
29 Osmotisk svulmede celler udskiller KCl og nonessentielle organiske osmolytter, hvilket reducerer cellevolumen til det normale igen, da cellevand følger den udadgående osmotiske gradient. Denne mekanisme kaldes for Regulatory Volume Decrease (RVD) og er afhængig af aktiveringen af K + - og Cl - - kanaler. Svulmningen kan i sig selv aktivere K + - kanaler og Cl - - kanaler, eller den kan i nogle celler føre til aktiveringen af uspecifikke cation- kanaler, som medfører et optag af Ca 2+, hvis elektrokemiske gradient er indadgående. Optag af Ca 2+ fører til aktiveringen af Ca 2+ sensitive K + - og/eller Cl - - kanaler. I nogle celler kan KCl udskillelsen også ske via en K + -Cl - (KCC) cotransporter (se Figur 6) eller via en K + /H + exchancer og en Cl - - /HCO 3 (AE) exchancer [72,73]. Osmotisk skrumpede celler optager KCl og organiske osmolytter, i følge med vand, hvilket øger cellevolumen til det normale igen. Denne mekanisme benævnes Regulatory Volume Increase (RVI). KCl optages via aktiveringen af cotransporteren Na + -K + -2Cl - (NKCC) eller Na + /H + (NHE) exchangeren i parallel med Cl - - /HCO 3 (AE) exchangeren (se Figur 6), samt nonselektive cationkanaler. Netto effekten er optag af NaCl. Det optagede Na + udskilles via Na + /K + -ATPasen i bytte for K +. Hvilket samlet resulterer i optaget af KCl. Af organiske osmolytter er de vigtigste polyoler, methylaminer, aminosyrer og aminosyrer derivatet taurin [72,73]. Figur 6: RVD og RVI. En osmotisk svulmet celle vil tilbageregulere sin volumen ved at udskille KCl og vand (RVD), mens en osmotisk skrumpet celle vil optage KCl og vand (Revideret fra: Boron W og Boulpaep EL (2012). Medical Physiology, second edition, side 136, Elsevier Saunders). 28
30 Betydningen af cellesvulmning for proliferation Ved proliferation deles en modercelle til to datterceller af samme størrelse. For at dette kan lade sig gøre, må der forekomme en forøgelse af cellestørrelsen i løbet af cellecyklussen. Cellevolumen er involveret i reguleringen af proliferation ved, at en osmotisk svulmning stimulerer proliferation, mens en osmotisk skrumpning inhiberer proliferation. En del K + - kanaler og Cl - - kanaler er involveret i reguleringen af proliferation, samt i progressionen af cellecyklus [72,75]. Volumenregulering i T-celler RVD i T-celler er afhængig af K + og Cl - efflux, ligesom i mange andre celler. Når T-celler udsættes for hypotont chok (159 mosm) vil de svulme til ca. 120 % af deres oprindelige størrelse i løbet af 0,5-2 min. Den initiale svulmning efterfølges af et RVD respons, der tilbageregulerer T-cellernes volumen til oprindelig størrelse indenfor 5-15 min [76,77]. Flere ionkanaler er forslået at indgå i RVD-responset, men det er den spændingsafhængige K + - kanal Kv1.3, sammen med endnu ukendte svulmingsaktiverede Cl - - kanaler (Cl swell ) også kaldet volume-regulated anion current (VRAC), der har vist sig at have størst betydning for cellevolumenreguleringen. Som reaktion på cellesvulmning vil aktiveringen af den udadgående Cl - strøm udløse RVD. Den udadgående Cl - strøm medfører, at membranpotentialet depolariseres imod Cl - ligevægtspotentiale (-35 mv). Depolariseringen resulterer i aktivering af Kv1.3 kanaler og dermed en udstrømning af K +. I modne T-celler er RVD uafhængig af Ca 2+, mens RVD i Thymocytter er afhængig af strækaktiveret Ca 2+ indstrømning, der aktiverer KCa3.1 kanaler og dermed K + udstrømning [57]. Forsøg udført af Bobak et al. hvor forskellige K + - kanaler er testet, herunder K 2p kanaler (TASK-1, TASK-2, TASK-3 og TRESK), Kv1.3 og KCa3.1, har fornylig vist, at det især er TASK-2 og Kv1.3 der spiller en rolle i RVD responset i murine T-celler udsat for hypotonisk chok [4]. Til forskel fra de fleste andre celler er T-celler ikke i stand til at udføre RVI i hypertonisk medie og forbliver derfor skrumpet [4,78]. 29
31 1.8 Autoimmune sygdomme: Multipel Sklerose Autoimmune sygdomme opstår når immunsystemet ved en fejl genkender og angriber kroppens egne molekyler. Der findes mange typer af autoimmune sygdomme og symptomerne afspejler hvilke celler/væv der er angrebet. F.eks. i Diabetes 1 er det bugspytkirtlens insulinproducerende β- celler i de Langerhanske øer der angribes, hvilket resulterer i forhøjet blodsukker [79]. Mens det ved Multipel Sklerose (MS) er myelinskeder omkring hjernens og rygsøjlens axoner der nedbrydes og fører til demyelinering, hvilket hæmmer eller blokerer for signaleringen via axonerne. De mest almindelige symptomer herpå er nedsat førlighed, dårligt syn, lammelser og koordinationsvanskeligheder [80]. Da Bittner et al. [3] har undersøgt TASK-2 i T-celler fra MS patienter med henblik på at finde et muligt mål i behandlingen af MS, der på nuværende tidspunkt ikke har nogen helbredende behandlingsform, har jeg valgt at beskrive MS nærmere. Multipel Sklerose (MS) Multipel Sklerose (MS) er en kronisk inflammatorisk sygdom der rammer centralnervesystemet (CNS) og dermed hjernen og rygmarven. MS blev første gang beskrevet som en selvstændig sygdom af Jean-Martin Charcot i Navnet Multiple Sclerosis hentyder til de læsioner/ar (sclerose = plak eller læsioner) der opstår i den hvide substans i hjernen og rygmarven ved ødelæggelse af myelin, hvilket kan ses på MR (Magnetisk Resonans)- scanninger som hvide pletter og er en del af diagnosticeringen af MS (se Figur 7). Udover læsionerne i den hvide substans tjekkes cerebrospinalvæsken (CSF) for karakteristiske forandringer, der ses som oligoklonale bånd af Immunoglobulin G (IgG) ved Immunofixation. Da båndene ikke findes i serum er det en indikation på inflammation i hjernen eller rygmarven (se Figur 7). Sygdommen rammer typisk i års alderen og rammer kvinder hyppigere end mænd (1,6-2,0:1). Dette menes at skyldes hormonelle forskelle. MS fører til ustabilitet og fejl i syns-, bevægelses-, autonomiske- og neurokognitive funktioner. Symptomer på MS kan være meget forskellige alt efter hvor i hjernen eller rygmarven inflammationen (attakket) opstår og vise tegn på mange forskellige neurologiske sygdomme, hvilket gør MS svær at diagnosticere. Start symptomer på MS er typisk synsnerve- 30
32 betændelse (optic neuritis), balance problemer, føleforstyrrelser eller nedsat kraft i arme og ben [80,81]. Figur 7: Yderst til venstre ses en MR- scanning af hjernen og i midten ses en MR- scanning af rygmarven. På begge figurer ses læsionerne som hvide pletter (læsionerne er angivet med pile). Yderst til højre ses resultatet fra en Immunofixation. Der ses oligoklonale bånd af IgG på kørslen med CSF og ingen bånd på kørslen med serum (Reviderede figurer fra: [80]). MS består af 3 hovedformer: Relapserende-remitterende (RR)-MS (85-90 %), som senere kan udvikle sig til Sekundært-progressiv (SP)-MS (10-15 %), Primærprogressiv (PP)-MS (10-15 %), samt Progressivrelapserende (PR)-MS (se Figur 8). RR-MS er karakteriseret ved uforudsigelige attakker (relapser), efterfulgt af måneder eller år hvor sygdommen er i bero (remission) og hvor symptomer fra angrebet forsvinder, men med tiden vil der komme følgesygdomme. SP-MS beskrives ved progressive neurologiske problemer imellem attakkerne og uden egentlige perioder med remmission. PP-MS er en betegnelse for personer der aldrig eller meget sjældent oplever remission efter deres første symptomer på MS og uden egentlige forbedringer. PR-MS karakteriseres ved at være progressiv med neurologisk tilbagegang fra starten, med nye attakker oveni [82]. Figur 8: Sygdomsforløbene for de fire typer af MS. Se tekst for beskrivelse (Fra: ipedia/commons/1/1f/msprogre ssiontypesda.svg) 31
33 Epidemiologi Årsagerne til udviklingen af MS er kontroversielle og endnu ikke klarlagte, men der er igennem en massiv forskning fundet evidens for nogle genetiske og miljømæssige risikofaktorer, der spiller en rolle i udviklingen af MS. Af genetiske risikofaktorer er fundet bestemte alleler af Humane leukocyt antigener (HLA-gener), som indgår i opbygningen af MHC. Alleler af typen DR15/DR2 og DQ6 er associeret med en øget risiko for at udvikle MS [83]. Miljømæssige faktorer er inddelt i to grupper; de infektiøse- og ikke-infektiøse risikofaktorer. Der er en stærk evidens for, at herpes virussen Epstein Barr (EBV) også kaldet human herpesvirus 4 (HHV-4) har en hovedrolle i udviklingen af MS. Personer der er positive for EPV har en øget risiko for at udvikle MS fremfor personer der ikke er smittet. Derudover har personer der er smittet i en sen alder højere risiko for at udvikle MS end dem der er smittet i en tidlig alder. Denne tendens er relateret til hygiejne hypotesen, som bygger på de vestlige landes sterile miljø, hvor mennesker lever rent og beskyttet imod mikroorganismer, hvilket resulterer i få infektioner med uskadelige mikroorganismer i de første leveår. Manglen på infektioner og dermed manglende immunrespons i de første leveår menes at medføre et overaktivt immunsystem, der reagerer kraftigt på små infektioner, samt kan medføre udviklingen af autoimmune sygdomme. EPV menes at øge risikoen for MS ved at krydsreagere med myelin-antigener i genetiske modtagelige personer og dermed aktivere potentielle autoreaktive immunceller. Denne mimicry teori støttes op af, at der er fundet EPV reaktive T-celler i CSF fra MS patienter. Andre virusser er også under mistanke for at øge risikoen for MS, herunder HHV-6, da den også er fundet i MS læsioner. Risikoen for MS er også afhængig af andre faktorer end EPV, da hypotesen ikke kan forklare den øgede risiko i nordiske lande, samt at personer der immigrerer inden de er 15 år fra lande med en høj risiko for at udvikle MS til lande med lav risiko nedsætter deres risiko for at udvikle MS [84]. Den grafiske variation kan beskrives ved ikke-infektiøse faktorer som sollys og D-vitamin. Der er evidens for, at sollys og høje mængder af D-vitamin nedsætter risikoen for MS. Sollys beskytter både ved at være med i dannelsen af D-vitamin, men også ved at have immun-nedsættende effekter. Af andre risikofaktorer for MS er der f.eks. rygning, hormoner og visse dele af diæten, 32
34 herunder fedtsyrer og antioxidanter. Udover at være en risikofaktor for udviklingen af MS har rygning også vist sig at forværre MS symptomer. Fedtsyrer og antioxidanter som risikofaktorer er dog kontroversielt og kræver flere undersøgelser, før der kan siges noget konkret [85]. Nervesignaler Nerveceller kommunikerer ved at sende elektriske signaler kaldet aktionspotentialer langs axoner (nervefibre), som er omgivet af myelinskeder. Myelinskeder som består af vand, lipider og proteiner danner et elektrisk isolerende lag rundt om axonet, hvilket forhindrer depolarisering i de områder af membranen, som er omgivet af myelinskeder. Depolarisering kan så kun ske i mellemrummene imellem myelinskederne, de såkaldte Ranvierske- indsnøringer. Dette medfører en langt hurtigere impulsledning, da aktionspotentialet hopper fra den ene Ranvierske- indsnøring til den næste. Ved ødelæggelsen af myelin og dermed det isolerende lag kan depolariseringen finde sted langs med axonet og signalet vil derfor blive meget langsommere eller helt udeblive, da aktionspotentialet ikke længere kan hoppe fra den ene Ranvierske- indsnøring til den næste. Dette er årsagen til de neurologiske symptomer i MS [86]. Patogenesen i Multipel Sklerose Ødelæggelsen af myelinskeder/oligodendrocytter i CNS sker tidligt i inflammationen. Processen er drevet af autoreaktive T-celler der genkender proteiner i myelin, herunder Myelin Basic Protein (MBP) [87]. Man troede først at Th1 CD4 + T-celler var skyld i inflammationen [88], men senere forsøg har vist, at Th17 CD4 + T-celler er mere effektive end Th1 T-celler til at inducere inflammation i CNS [89]. Mens det er CD4 + T-celler der driver immunresponset, er det andre immunceller der er skyld i selve ødelæggelsen af myelin. Et autoimmunt respons i MS starter med, at potentielle autoreaktive CD4 + T-celler aktiveres i periferien ved genkendelse af f.eks. et viraltpeptid, der har sekvens lighed med myelin. Aktiverede autoreaktive T-celler fæstner til blodhjerne-barrierens endothel via adhæsions molekylerne Leucocyte Functional Antigen-1 (LFA-1) 33
35 og Very Late activation Antigen-4 (VLA-4), hvorefter T-cellerne trans-migrerer igennem endothelet og ind i hjernen, hvor de udløser et immunrespons (se Figur 9) [90]. Efterfølgende frigivet pro-inflammatoriske cytokiner (f.eks. IFN-ɣ, IL-23, TNF-α og lymfotoksin (LT)) [91] og chemokiner (f.eks. "Regulated upon activation, normal T-cell expressed, and secreted (RANTES) og "IFN-inducerede protein på 10 kda (IP-10)) [92] aktiverer residerende celler som microglia og astrocytter, samt rekrutterer andre immunceller herunder monocytter, CD8 + T-celler, B-celler og mast-celler fra perifert blod, hvilket resulterer i den inflammatoriske læsion. Flere processer fører til myelin/oligodendrocyt og axonal ødelæggelse herunder frie radikaler, TNF-α, LT, direkte komplement disponering, antistof-medieret komplement aktivering, antistof-afhængig cellulær cytotoksicitet via Fc-receptoren (se Figur 9), myelin fagocytose, direkte lysering af axoner forsaget af cytotoksiske CD8 + T-celler, sekretion af proteaser og apoptose af oligodendrocytter. Det inflammatoriske respons kan vare i få dage til 2 uger. Efter responset vil forstadier til oligodendrocytter og overlevende oligodendrocytter begynde at remyelinere demyelinerede axoner. Den originale tykhed kan dog ikke opbygges og nervesignaler vil fremover være langsommere end før angrebet [81]. Figur 9: Illustration over nogle af processerne i MS patogenesen. En CD4 + T-celle genkender antigen (Ag) via MHC klasse II og aktiveres. Den aktiveret T-celle udsender cytokiner (vist ved IFN-ɣ), som aktiverer en microglia celle. Microglia cellen beskadiger myelin ved at udsende Nitrigenmonooxid (NO), samt at udtrykke Fc-receptorer på overfladen. Fc-receptoren binder til et Anti-myelin antistof, udskilt af B-celler, der er bundet på overfladen af myelin, hvilket resulterer i cytotoksisk nedbrydning af myelin (Revideret figur fra: [93]). 34
36 Kapitel 2 Formål Formålet med dette speciale er, at undersøge en eventuel rolle for TASK-2 i aktiveringen af humane T-celler. For at undersøge om TASK-2 har en rolle i aktiveringen af T-celler, er der udført en række forsøg på humane T-celler. Den tidlige volumenforøgelse, cellernes evne til at udføre RVD, samt ekspressionen af TASK-2 på mrna- og protein niveau efter aktivering er undersøgt. Herudover blev ekspressionen af de to velkendte K + -kanaler involveret i aktiveringen af T-celler Kv1.3 og KCa3.1 undersøgt. Kv1.3 ekspressionen blev undersøgt på mrna- og protein niveau, mens KCa3.1 ekspressionen kun blev undersøgt på mrna niveau pga. manglen på et effektivt antistof. Da T-celler er en heterogen population af forskellige subtyper, med forskellige funktioner i et immunrespons, samt har forskelligt udtryk af ionkanaler, er TASK-2 ekspressionen også undersøgt på protein niveau i forskellige subtyper. Kv1.3 ekspressionen blev undersøgt på protein niveau i subtyperne Central Memory (CM) og Effector Memory (EM). Studierne er foretaget 2, 4, 8, 12, 24 og 48 timer, samt 3 og 6 dage efter aktivering. Tiderne 2-12 timer er valgt for at undersøge hvad der sker med ekspressionen af TASK-2 i den tidlige aktivering og tiderne 24 og 48 timer, samt 3 og 6 dage er valgt på baggrund af tidsperspektivet i et immunrespons. 35
37 Kapitel 3 Materialer og Metoder I dette kapitel har jeg beskrevet hvilke celletyper, samt hvilke metoder jeg har brugt i mit speciale til, at undersøge om TASK-2 har en rolle i aktiveringen af humane T-celler. Jeg har beskrevet metoderne, der er brugt, teoretisk og praktisk. Udførlige protokoller kan ses i Appendiks C og en oversigt over alle produkter kan ses i Appendiks B. 3.1 Celler I dette speciale er der primært brugt humane T-celler oprenset fra Buffy Coats. T-cellerne blev oprenset på Monocyt afdelingen, Novo Nordisk Måløv. De fleste forsøg er lavet på T-cellerne som en samlet population, men der er også udført protein kvantificering på forskellige subtyper (se nedenfor). Derudover er der lavet knockdown forsøg med sirna for TASK-2 i Jurkat celler (en human T-cellelinje), for at finde de tider og koncentrationer hvor transfektion med sirna virker bedst, til brug for senere forsøg af knockdown af TASK-2 i humane T-celler. T-celler T-cellerne der er brugt i dette speciale er som nævnt ovenfor primært oprenset fra Buffy Coats. Buffy Coat er det lag, der ligger i midten efter en centrifugering af fuldblod og indeholder hovedparten af hvide blodlegemer (leukocytter) og blodplader (trombocytter). Øverst ligger plasma og nederst ligger de røde blodlegemer (erytrocytter). Nogle af oprensningerne er udført af ph.d.-studerende Signe S. Kirkegaard (se Appendix D). 36
38 Metode: Blodet fra Buffy Coaten blev fordelt i Nuncrør (ca. 15 ml) og dernæst tilsat 750 µl RosetteSep (Human T Cell Enrichment Cocktail; RosetteSep Procedure; Cat: 15021/15061). Blandingen inkuberede i 20 min ved stuetemperatur. RosetteSep indeholder en blanding af antistoffer, der binder uønskede celler til røde blodceller (RBC), så der dannes immunorosetter (se Figur 10). Dette medfører en berigelse af de ønskede celler (her T-celler), da de ikke bindes til RBC (se nedenfor). Efter inkubationen blev blodet fortyndet med 15 ml PBS + 2 % FBS (se Appendix A) og pipetteret forsigtigt oven på 15 ml Ficoll densitetsmedie (Ficoll-Paque PLUS; StemCell Technologies; Cat: 07957) tilsat nye Nuncrør. Ficoll gør, at prøverne ved centrifugering bliver opdelt i fire lag, hvor det øverste lag består af plasma fortyndet i PBS, det næst øverste af de ønskede celler, det anden nederste af Ficollen og det nederste af de røde blodceller, hvortil de uønskede celler er bundet (se Figur 10). Prøverne blev herefter centrifugeret ved stuetemperatur i 20 min ved 1200 x g uden bremse, da en hård opbremsning ville have opblandet lagene og dermed cellerne. Dernæst blev laget med de oprensede T-celler pipetteret op og overført til nye Nuncrør, vasket to gange med 25 ml PBS + 2 % FBS og centrifugeret ved 500 x g i 5 min. Herefter blev der tilsat 1xRBC Lysisbuffer (BioSite; Cat: /100ml) og prøverne blev inkuberet på is i 5 min. Dette blev gjort for, at fjerne de sidste røde blodceller og dermed uønskede celler fra prøverne. Reaktionen blev standset ved at tilsætte 25 ml PBS. Dernæst blev T-cellerne centrifugeret i 5 min ved 500 x g og supernatanten blev suget fra. Som det sidste blev pellet (de oprensede celler) resuspenderet i 40 ml T-celle medie (se Appendiks A), talt og sat op til 1x10 6 celler/ml. Cellerne blev efter oprensning opbevaret ved 37 C i en inkubator med 95 % luftfugtighed og 5 % CO 2. 37
39 Figur 10: På billedet til venstre ses en roset bestående af en uønsket celle omgivet af røde blodceller, dannet af de tetrameriske antistoffer i RosetteSepen. Til højre ses først et Nuncrør, hvor blodet er placeret ovenpå ficollen, dernæst ses opdelingen efter centrifugeringen med plasma fortyndet i PBS øverst, dernæst de ønskede celler, anden nederst Ficollen og nederst de røde blodceller, hvortil de uønskede celler er bundet. Til sidst ses de ønskede celler udtaget i et nyt Nuncrør (Reviderede figurer fra: Oprensning af T-celle subtyper Alle oprensninger af T-celle subtyper blev fortaget at ph.d.-studerende Signe S. Kirkegaard. Subtyperne blev oprenset fra Peripheral Blood Mononuclear Cells (PBMCs), oprenset fra Buffy Coats (se Appendiks C for protokol) og isoleret ved brug af diverse isolationskits. Tabel 1 giver en oversigt over de undersøgte subtyper, samt hvilke kits der er brugt til isoleringen af dem. Beskrivelse Produkt CD4 All Alle subtyper der udtrykker CD4 Human CD4+ T cell Enrichment Kit (StemCell, Easy Sep; Cat: 19052) CD8 All Alle subtyper der udtrykker CD8 Human CD8+ T cell Enrichment Kit (StemCell, Easy Sep; Cat: 19053) Naive CD4 Naive CD8 CD4 Central Memory CD4 Effector Memory Subtyper der udtrykker CD4, men hvor memory cellerne er depleterede Subtyper der udtrykker CD8, men hvor memory cellerne er depleterede Subtype der udtrykker CD4, CD45RO og CCR7 Subtype der udtrykker CD4, CD45RO, men ikke CCR7 Human Naïve CD4+ T cell Enrichment Kit (StemCell, Easy Sep; Cat: 19155) Human Naive CD8+ T cell Enrichment Kit (StemCell, Easy Sep; Cat: 19158) CD4+ Central Memory T-cell Isolation Kit, human (MACS; Cat: ) CD4+ Effector Memory T-cell Isolation Kit, human (MACS; Cat: ) Tabel 1: T-celle subtyper og kits brugt til isolering. 38
40 Metode: Subtyperne blev oprenset efter producenternes forskrift. Aktivering af T-celler Til aktivering af humane T-celler in vitro kan bruges CD3/CD28 Dynabeads, der er magnetiske kugler, der når de tilsættes T-cellerne efterligner in vivo aktivering af T-celler med antigenpræsenterende celler (APC). Kuglerne er samme størrelse som de antigenpræsenterende celler og er coatet på overfladen med monoklonale antistoffer imod CD3 (epsilon kæden) og CD28. Når antistofferne binder til CD3 og CD28 på overfladen af en T-celle, medfører det en aktivering af T- cellen (se Figur 11). Figur 11: På figuren ses øverst en in vivo aktiveringen af en T-celle ved binding af en Dendritisk celle (APC) til CD3 og CD28. Nederst ses hvordan, en CD3/CD28 bead kunstigt efterligner den in vivo aktivering af en T-celle med en APC (Fra: Dynabeads-HumanTActivator CD3CD28man. pdf). Metode: Der blev brugt CD3/CD28 Dynabeads (Human T-Activator CD3/CD28; Invitrogen; Cat: 111:32D) til aktivering af T-cellerne. T-cellerne blev tilsat Dynabeads i forholdet 1:1 og høstet efter 2, 4, 8, 12, 24, 48, samt efter 3 og 6 dage. Før brug blev Dynabeadsene vasket i sterilt PBS. Dette blev gjort ved først at udtage den ønskede mængde af de magnetiske beads, der er opblandet i PBS, og 39
41 tilsætte dem i et rør, som herefter blev placeret i en magnet. Magneten gjorde, at beadsene blev hængende på siden af røret, da væsken blev suget fra. Røret blev herefter taget op af magneten og beadsene resuspenderet i nyt sterilt PBS. Efter at have suget væsken fra igen, blev beadsene resuspenderet i T-celle medie og tilsat de oprensede T-celler. Efter 3 dages aktivering blev T- cellerne tilsat nyt medie, svarende til det dobbelte af startvolumenet, for at give de prolifererende celler de bedste vækstbetingelser. Jurkat- cellelinjen Jurkat- cellelinjen består af leukæmiske T-celler, der blev etableret fra perifert blod fra en 14 årig dreng med leukæmi af Schneider et. al. (1977) og oprindeligt betegnet JM [94]. Cellelinjen der er brugt i dette speciale, er leveret af Novo Nordisk Måløv og er en klon af cellelinjen Jurkat-FHCRC, som er afledt af Jurkat cellelinjen. Metode: Jurkat cellerne, der er nedfrosset i flydende nitrogen (-196 C), blev optøet hurtigt ved 37 C for at undgå, at cellerne blev skadet, da de er nedfrosset i medie tilsat 5 % DMSO (Dimethyl Sulfoxide). Jurkat cellerne blev herefter overført til en suspensionsflaske tilsat ca. 10 ml +/+ medie (se Appendix A). Cellerne blev centrifugeret og 10 ml nyt medie blev tilsat. Dette blev gjort for at fjerne den sidste rest DMSO. Cellerne blev opbevaret ved 37 C i en inkubator med 95 % luftfugtighed og 5 % CO 2. Cellerne blev splittet 2 gange om ugen. 3.2 Cellevolumen måling Der findes forskellige metoder til måling af cellevolumen. Har man celler i suspension som T- cellerne, der er brugt i dette speciale, er Coulter Counteren en effektiv metode til måling af cellevolumen, da den er nem og hurtig at bruge, samt giver absolutte værdier. 40
42 Coulter Counteren Teknikken bag Coulter Counteren bygger på Coulter princippet, der blev formelt annonceret i 1956 af Wallace H. Coulter, som en hurtig metode til tælling af blodceller [95]. Coulter Counter instrumentet består af et rør med en lille åbning, som nedsænkes i et bægerglas indeholdende en elektrolytopløsning, hvori cellerne der ønskes målt tilsættes. To elektroder er placeret ved åbningen i røret, hvoraf den ene befinder sig inde i røret og den anden udenfor røret (se Figur 12). Når der tilsættes strøm, vil der løbe en elektrisk strøm imellem elektroderne, ledet af elektrolytterne i opløsningen. Denne strøm kan måles og når en celle suges igennem åbningen, vil modstanden øges proportionalt med cellens volumen, da celler leder strøm dårligere end elektrolytter. Coulter Counteren er indstillet til at opretholde en konstant strømstyrke og ifølge Ohms lov (V = R * I), hvor (V) er spændingen, (R) modstanden og (I) strømstyrken, vil en øget modstand i et kredsløb med konstant strømstyrke medføre en spændingsforøgelse (I Konstant = R / V ). Coulter Counter maskinen må øge spændingen for at kompensere for den øgede modstand. Denne spændingsforøgelse er direkte proportional med cellevolumen og er denne som maskinen registrerer. Figur 12: På figuren ses opsætningen af Coulter Counteren med de to elektroder, der er placeret henholdsvis i røret med elektrolytten og i bægeret med Ringeren indeholdende cellesuspension (Fra: Book&func=displayarticle&artid=105&theme=printer). 41
43 Metode: Der blev brugt et rør med en åbning på 70 µm og Coulter Counteren (Coulter Multisizer 3) blev kalibreret med Latex kugler med diameteren 9,615 µm, da T-cellerne er ret små med en diameter på ca. 6 µm inden aktivering. Ved aktivering i 3 dage med CD3/CD28 beads voksede T-cellerne til ca. 8 µm. Grunden til at der ikke blev brugt et rør med mindre åbning skyldes, at der ville have været større tendens til tilstopning. I dette speciale blev der målt på ikke aktiverede T-celler og T-celler aktiveret med CD3/CD28 beads i henholdsvis 2, 4, 8, 12 og 24 timer, samt i 3 og 6 dage. T-cellerne blev målt i en Isoton Ringer (300 mosm) (se Appendiks A) for at måle cellevolumen og i en Hypoton Ringer (160 mosm) (se Appendiks A) for at måle T-cellernes evne til at udføre Regulatory volume decrease (RVD). Begge Ringere blev filtret igennem et Millipore filter med porer på 0,45 µm for at undgå tilstopning med skidtpartikler. Der blev målt på 2,5 million celler, tilsat i 40 ml Ringer. Cellevolumenmålingerne blev målt hvert 20 sek. i 3 min i Isoton Ringer og 8 min i Hypoton Ringer. Beregning: Resultatet for målingen fås ved at aflæse medianværdien på fordelingskurven, hvor antallet af celler med et givent volumen er plottet som funktion af cellevolumen. Medianværdien hvor 50 % af målingerne findes på hver side blev brugt frem for middelværdien, da celleaggregater 4 og enkelte celler tæller forskelligt i gennemsnittet, hvilket fejlagtigt kunne have givet et lidt højere tal, hvis der var suget mange dobbelte celler ind. Medianværdien er lig med cellernes diameter og sættes ind i formlen for en kugles rumfang (ligning 1) for at udregne cellernes volumen. Ligning 1: Beregning af en kugles rumfang: 4 To eller flere celler der suges ind gennem hullet på samme tid og fejlagtigt registreres som én celle. 42
44 Ud fra de opnåede kurver blev cellevolumen (V Iso ) estimeret fra Isotone værdier og den maksimale volumen (V max ) aflæst fra Hypotone værdier. Tilbagereguleringshastigheden blev fundet ved, at lave lineær-regression på den lineære del af kurven efter maksimal svulmning. T-cellernes evne til at udføre RVD i Hypoton Ringer blev ligeledes beregnet efter 3 og 5 min ved hjælp af ligning (2). V t er den målte volumen til tiden t i Hypoton Ringer. Ligning 2: Beregning af RVD: (V max V t )/(V max V Iso ) 3.3 RNA kvantificering Ved kvantificering af mrna for specifikke gener i en prøve kan benyttes real time PCR (qpcr), som er en metode hvor der bruges fluorescens. Inden der kan laves qpcr, skal RNAet først oprenses fra prøverne og syntetiseres til cdna. I dette speciale er de aktiverede T-celler og de ikke-aktiverede Kontrolceller undersøgt for transskriptionen af generne TASK-2, Kv1.3 og KCa3.1. Pga. manglende stabile House keeping gener blev cdna kvantificering brugt til normalisering. RNA oprensning og måling Det første trin i kvantificeringen af mrna er isolationen af RNA fra cellerne. RNA er meget følsomt overfor kontaminering og nedbrydes nemt. Derfor er det vigtigt at udføre alt arbejde med RNA sterilt, samt at al opsætning foregår på is for at undgå nedbrydning af RNA. Metode: Til oprensningen af RNA blev der brugt NucleoSpin RNA II kit (Cat: ). Ca. 7,5 million T- celler blev udtaget til tiderne 2, 4, 8, 12, 24 og 48 timer, samt 3 og 6 dage efter aktivering. Disse blev spundet ved 700 x g i 5 min og herefter høstet i 350 µl RA1 lysisbuffer tilsat 3,5 µl β- 43
45 mercapto-ethanol. β-mercapto-ethanol tilsættes for at forhindre nedbrydningen af RNA, da det inaktiverer RNaser ved at nedbryde deres disulfidbroer og dermed ødelægge deres strukturer. Lysaterne blev opbevaret ved -80 C indtil de skulle oprenses for at undgå nedbrydning af mrna, da dette er meget let nedbrydeligt. Ved oprensningen af RNA blev lysaterne først overført til NucleoSpin Filter (violet ring) og centrifugeret i 1 min ved x g for at mindske viskositeten. Dernæst blev lysaterne tilsat 350 µl ethanol (70 %) for at forbedre bindingen af RNA og overført til NucleoSpin RNA II Column (lyseblå ring), der binder RNA. Lysaterne blev centrifugeret i 30 sek. ved x g. Herefter blev der tilsat 350 µl Membrane Desaltning Buffer til membranen, som blev centrifugeret i 1 min ved x g for at fjerne salt fra membranen, så den efterfølgende tilføjelse af rdnaase kunne nedbryde DNA bundet til membranen bedre. 95 µl DNase reaktionsmix blev tilsat hver prøve (10 µl rdnase + 90 µl Reaktions Buffer pr. prøve), som herefter blev inkuberet i 15 min. Inkuberingen blev efterfulgt af 3 vasketrin og tørring af membranen. Ved første vask blev der tilført 200 µl RA2 Buffer, som blev spundet ned ved x g i 30 sek. Ved 2. vask blev der tilført 600 µl RA3 Buffer og centrifugeret ved x g i 30 sek. Ved sidste vask blev der tilsat 250 µl RA3 Buffer og centrifugeret i 2 min ved x g for at tørre membranen. Kolonnen blev herefter placeret i et nyt opsamlingsrør inden eluering af RNA. RNA blev elueret ved tilsættelse af 20 µl RNase-frit H 2 O midt på membranen, samt centrifugering i 1 min ved x g. Efter centrifugeringen blev eluatet overført til sterile eppendorfrør. Målingen af mængden af RNA, samt renheden blev kvantificeret ved anvendelse af UV absorption i et spektrofotometer. Koncentrationen af nukleinsyrer blev målt ved 260 nm og 280 nm og kan bestemmes ved hjælp af Beer-Lamberts lov (A= -In(I/I 0 ), som forudser en lineær ændring i absorbans med koncentration. Da 260 nm er absorptions-maksimum for RNA og 280 er absorptions-maksimum for proteiner, angiver absorption ved 260 nm RNA koncentrationer og forholdet mellem absorption ved 260 nm og 280 nm RNA renheden. Ren RNA har en værdi på 2,1, men ses sjældent under normale laboratorieforhold, hvor værdier omkring 1,8 antages for meget rene [96]. 44
46 Reverse transkriptase (RT) PCR (cdna syntese) Da RNA er meget let nedbrydeligt, er det ikke egnet til PCR analyser, hvor prøverne opvarmes til høje temperaturer. Derfor laves der komplementært DNA (cdna) ud fra RNA ved brug af enzymet Reverse transkriptase. For at der kan syntetiseres cdna skal de fire dntps (datp, dttp, dctp, dgtp) som indgår i DNA tilsættes, samt en DNA primer, hvilket ofte er en oligo(dt) der binder til poly (A) halen i 3 enden på RNA. Binding af DNA primeren og dntps til mrna strengen resulterer i dannelsen af en DNA-RNA hybrid. For at få enkeltstrenget cdna nedbrydes RNA strengen ved alkalin hydrolyse (se Figur 13). Figur 13: cdna syntese (Fra: Gilbert S (2011) Developmental Biology ( RT-PCR består af fire trin. Det første trin er denaturering af RNA, hvilket forgår ved ca. 65 C. I det næste trin sættes prøverne på is, så oligo(dt) primere kan binde til mrna s poly (A) hale. Ved det 3. trin opvarmes prøverne til 42 C grader, hvilket er en optimal temperatur for Revers transkriptases syntese af cdna. Til sidst hæves temperaturen til 70 C for at afslutte cdna syntesen. 45
47 Metode: Til en reaktion blev der udtaget X antal µl af den oprensede RNA svarende til 1 µg mrna. Som det første blev 10-X µl nuclease frit ddh 2 O tilsat 1 µl dntp mix (10 mm dntp Mix, PCR Grade; Invitrogen; Cat: /-088), som indeholder de fire deoxyribonucleotid trifosfotaser (datp, dgtp, dttp og dctp) DNA er opbygget af, samt 1 µl Oligo(dT) primer (Invitrogen; Cat: ), som hybridserer til poly-(a) halen på mrna. Dette blev blandet på is i PCR- bænk. Dernæst blev prøve svarende til 1 µg mrna tilsat udenfor PCR-bænken og blandingen blev inkuberet ved 65 C i 5 min. Efter at være sat på is og centrifugeret kort, blev prøverne tilsat 7 µl af en blanding bestående af 4 µl 5xfirst strand buffer, 2 µl 0,1 M DTT, samt 1 µl nuclease frit ddh 2 O og inkuberet ved 42 C i 2 min. 5xfirst strand og DTT tilsættes for at sikre optimal syntese. Herefter blev prøverne tilsat 1 µl SuperScript (SuperScript TM II Reverse Transcriptase; Invitrogen; Cat: /-014) og inkuberet i først 50 min ved 42 C, dernæst i 15 min ved 70 C og til sidst kølet ned til 4 C. Prøverne blev herefter overført til eppendorfrør og opbevaret ved -20 C. Real time PCR (qpcr) Real time PCR er en sensitiv og hurtig metode til amplifikation og analysering af gen-ekspression ud fra små mængder prøve. Syntetiseret cdna fra RT-PCR bruges som template i PCR reaktionen. Ved brug af fluorescens kan kvantificering af PCR produkt ske efter hver cyklus, heraf navnet real time. Reaktionen foregår i en thermocycler, der kan måle fluorescens. Et eksempel på en teknik der benytter fluorescens er SYBR Green, som binder til dobbeltstrenget DNA med en høj affinitet og ved exitation udsender lys. Ubundet SYBR Green har en ca gange lavere fluorescensintensitet end bundet. Ulempen ved at bruge SYBR Green er, at det binder til alt dobbeltstrenget DNA også primer-dimere og andre uspecifikke reaktionsprodukter, hvilket kan give en overestimering af resultatet [97]. Denne overestimering kan minimeres ved godt designede primere. Kvantificeringen af reaktionen baseres på C t værdier (Tærskelcyklus), som er det antal cyklusser, hvor stigningen i fluorescens signifikant overgår baggrunden, hvilket altid er i den eksponentielle fase (se Figur 14). Des flere cyklusser det kræver at overgå baggrunden, jo mindre gen-ekspression 46
48 er der af det givne gen i ens prøve. Mængden af template beregnes ud fra en standardkurve, der er lavet ud fra en række fortyndingers C t værdier. Kvantificeringen af mrna transskription kan være absolutte værdier eller relative værdier. Absolutte værdier udregnes fra en RNA standard kurve, der er lavet ud fra kendte mængder RNA. Relative værdier udregnes fra en standard kurve, der er lavet på baggrund af en fortyndingsrække af en af prøverne. I de fleste tilfælde er relative værdier gode nok, da der ses efter en ændring i forhold til en kontrol eller om et bestemt gen er udtrykt. Effektiviteten (A) udregnes ud fra hældningen af standardkurven ved formlen: A= 10 (- 1/hældningen). I et ideelt eksponentielt forløb med 100 % effektivitet vil mængden af template DNA fordobles ved hver cyklus og hældningen på standardkurven være -3,32 [98]. Forholdet imellem forskellige prøvers C t værdier udregnes ved hjælp af ligning (3): Ligning 3: ΔRatio reference = A (Ct Kontrol Ct X) Figur 14: På figuren ses et typisk qpcr amplifikationsplot indeholdende de tre faser. Først er der en eksponentiel fase, hvor fluorescensen stiger til et niveau signifikant over bagrunden (C t ). I denne fase er reaktionseffektiviteten tæt på 100 %. Akkumulationen af produkt fortsætter i den linærer fase, men reaktionseffektiviteten falder i takt med, at reagensenerne bliver brugt op og reaktionen når til sidst et plateau, hvor der ikke længere akkumuleres produkt (Figur fra: [97]). 47
49 Metode: Til qpcr blev der brugt SYBR Green (Brilliant II SYBR Green QPCR Master Mix; Agilent Technologies (STRATAGENE); Cat: ), forward og reverse primere (se tabel 2) designet af ph.d.-studerende Signe S. Kirkegaard, samt en reference farve (1mM ROX; Agilent Technologies (STRATAGENE); Cat: ) fortyndet 1:500 med nucleasefrit ddh 2 O. Der blev som det første blandet en master-miks bestående af 10 µl SYBR Green, 0,4 µl forward primer (10mM), 0,4 µl reverse primer (10mM), 0,4 µl ROX reference farve, samt 7,8 µl nucleasefrit ddh 2 O (* X antal prøver). Dette blev foretaget i en PCR bænk. Herefter blev 19 µl master-miks tilsat i hvert PCR rør (Strip tube 8x 0,2 ml format; Agilent Technologies (STRATAGENE); Cat: ). Der blev brugt 1 µl cdna pr. måling. Standardkurven blev lavet ud fra en 6x fortyndingsrække af en af prøverne. Der blev lavet trippelbestemmelser på alle prøver inklusiv standard kurven. Prøverne blev kørt på PCR maskinen MX4000 (MX4000 TM Multiplex kvantitative PCR system fra Stratagene) ved temperaturprofil: 1 cyklus af 95 C i 10 min, 40 cyklusser af 95 C i 30 sek., 58 C i 1 min og 72 C i 30 sek. 1 cyklus af 95 C i 1 min 41 cyklusser af 55 C i 30 sek. Temperatur-profilen består først af en cyklus på 10 min ved 95 C, som gør at polymerasen aktiveres. Dernæst 40 cyklusser hvor prøverne ved hver cyklus først varmes op til 95 C i 30 sek. for at denaturere (adskille) DNA strengene til enkeltstrenget DNA. Herefter nedkøles de til 58 C i 1 min, så primerne kan binde til deres komplementære sekvens (anneling). Cyklussen afsluttes ved at hæve temperaturen til 72 C i 30 sek., hvormed DNA-polymerasen kan sætte nukleotider (dntp er) på enkeltstrengene i forlængelse af primerne (elongation). Dette består af den egentlige PCR cyklus, men for at vurdere om evt. primere-dimere eller uspecifikke produkter har bidraget til 48
50 signalet, opvarmes prøverne til sidst op i en cyklus af 95 C, efterfulgt af 41 cyklusser af 30 sek., hvor prøverne gradvis varmes op fra 55 C til 95 C. Primere-dimere og uspecifikke reaktionsprodukter vil som regel være kortere og have lavere smelte-temperaturer ind det specifikke produkt. Primere (5 3 ) For. Rev. htask-2 ACCACCCACTCATCTTCCAG AGTGCTGGTGAAGGTGGACT hkv1.3 CACTTCAGGTTTCAGCAGCA TGTCTCCCGGTGGTAGAAGT hkca3.1 ACTGGGCACCTTTCAGACAC ACGTGCTTCTCTGCCTTGTT Tabel 2: Primere fra Eurofins brugt til qpcr. Beregning: De aktiverede prøver blev udregnet relativt til kontrol prøverne ved brug af ligning 3. En effektivitet på mellem 80 og 150 % blev accepteret. Kvantificering af cdna Da der på trods af brugen af 1 µg mrna i Reverse transkriptase PCR kan forekomme forskelle i mængden af cdna i ens prøver, er det vigtigt at bruge en normaliserings metode til Real time PCR resultaterne. En ofte brugt metode er brugen af house keeping gener, som for at kunne bruges skal forblive uændret under eksperimentelle påvirkninger. Som en alternativ normaliserings metode til house keeping gener, hvis ekspression i nogle tilfælde kan ændres under de eksperimentelle påvirkninger og derfor ikke længere kan bruges som interne kontroller, kan mængden af cdna bestemmes ved brug af OliGreen reagent [99]. Oligreen er en fluorescensteknik, der kan bestemme mængden af cdna i ens prøver efter RT-PCR. OliGreen reagent detekterer single-stranded DNA (ssdna). For at kunne udregne de målte fluorescenser til mængden af cdna i prøverne, laves en standard kurve med kendt mængder oligonukleotid. Da en 49
51 række mulige house keeping gener har vist sig at ændres under de eksperimentelle forhold i dette speciale, er kvantificeringen af cdna brugt som normaliseringsmetode i stedet for. Metode: Til kvantificeringen af cdna blev der brugt 96 brønds bakker (Greiner bio-one, Cellstar; Cat: ) og Quant-iT OliGreen ssdna Assay Kit (Invitrogen; Cat: O11492), bestående af QuantiT TM OliGreen ssdna Reagens opløst i DMSO, 20xTE buffer, samt Oligonucleotid standard. Der blev lavet trippelbestemmelser på cdna prøverne og dobbeltbestemmelser på standarderne. Al opsætning blev foretaget på is. Til start blev der lavet en 1xTE buffer ved at fortynde 20xTE bufferen med nucleasefrit ddh 2 O. Dernæst blev der lavet en RNAse-miks bestående af 1,5 µl 1xTE buffer tilsat 1 µl RNAse (Ribonuclease A (bovine pancreas); SIGMA; Cat: R6513) gange X antal prøver. RNAse blev tilsat for at sikre, at hybridseret DNA-RNA blev skilt og RNA nedbrudt, så det ikke indgik i målingen og dermed overestimerede indholdet af cdna. Eftersom der blev lavet trippelbestemmelser blev der udtaget 3 µl prøve, som blev tilsat 2,7 µl RNAse-miks. Prøverne blev inkuberet ved 65 C i 30 min med omrystning. Imens blev der lavet en standardkurve ved at tilsætte 0, 1, 2½, 5, 10, 15 og 20 µl Oligostandard (1ng/µl), samt en kontrol på 7 µl i brøndene og derefter tilsætte 1xTE buffer til et samlet volumen på 100 µl. Efter inkuberingen blev prøverne sat på is og centrifugeret kort, samt tilsat 315 µl 1xTE buffer og 100 µl prøve blev tilsat pr. brønd. Oligreen reagens blev herefter tøet og fortyndet 200 gange i 1xTE buffer. Der blev tilsat 100 µl fortyndet Oligreen reagens til alle prøver og standarder, hvorefter pladen blev sat på rystebord i 3 min. Fluorescensen blev målt på et spektrofotometer ved bølgelængderne 485 nm (excitation) og 520 nm (emission) ved Gain Gain 1000 blev valgt efter test af forskellige Gains, da denne gav den bedste sensitivitet overfor fluorescensmålingerne. Beregning: De målte mængder af cdna i prøverne blev sat relativt til kontrolprøven, for den korteste tid og det samme blev gjort for C t værdierne. Herefter blev C t værdierne korrigeret for evt. forskelle i 50
52 mængden af cdna ved hjælp af ligning (4) og prøverne for de aktiverede T-celler blev udregnet relativt til deres egen kontrol. Ligning 4: Korrektion = ΔRatio reference / [cdna] 3.4 Protein kvantificering Ved kvantificering af specifikke proteiner i en prøve bruges ofte Western blot (WB). Forud for selve Western Blottet følger ekstrahering af proteiner fra cellerne, protein måling og SDS-Page. I mit speciale har jeg brugt Western blot til at kvantificere mængden af TASK-2 og Kv1.3 i aktiverede T-celler, samt i ikke-aktiverede T-celler (Kontrol), for at undersøge om aktiveringen med CD3/CD28 beads har haft en indvirkning på ekspressionen af kanalerne. Cellelysater For at kunne kvantificere mængden eller tilstedeværelsen af specifikke proteiner skal cellerne lyseres, så proteinerne kan ekstraheres. Dette gøres ved at tilsætte en lysisbuffer indeholdende en detergent f.eks. SDS, som nedbryder cellemembranen, samt protease- og fosfatasehæmmere der sikrer at proteinerne og deres fosforyleringer bevares. Prøverne er som ofte viskose og kræver derfor videre fragmentering. Dette kan gøres ved sonikering (ultralyd) eller kanylering. Prøverne spindes herefter for at adskille proteinerne fra celleresterne, som bundfældes. Supernatanten indeholdende proteinerne suges fra og bruges til kvantificering af proteinmængden. Metode: Ca. 7,5 mio. T-celler blev høstet til tiderne 2, 4, 8, 12, 24 og 48 timer, samt 3 og 6 dage efter aktivering. Cellerne blev centrifugeret ved 700 x g i 5 min, hvorefter supernatanten blev suget fra og T-cellerne (pellet) vasket med iskold PBS (se appendiks A). Herefter blev T-cellerne igen 51
53 centrifugeret ved 700 x g i 5 min og supernantanten suget fra. T-cellerne blev dernæst tilsat µl 1x lysisbuffer (se appendiks A) alt efter mængden af pellet. Efter tilsætning af lysisbuffer blev prøverne sat på varmeblok (95 C) i 5 min for at optimere lyseringen og frosset ved -18 C. Inden proteinmålingen blev prøverne tøet og sonikeret med ultralyd i 2x10 sek. for at nedbryde cellevæggene og mindske viskositeten. Herefter blev prøverne centrifugeret ved x g i 5 min. ved 4 C og supernantanten overført til nye eppendorfrør. Proteinmåling Når ekspressionen af et bestemt protein kvantificeres ved Western Blot, er det vigtigt først at måle mængden af protein i lysaterne, så der kan blive loadet lige meget protein i hver brønd ved SDS- Page. Til måling af den totale mængde af protein i hver prøve blev der brugt BioRad DC Protein Assay. Assayet er kolorimetrisk og er baseret på det veldokumenteret Lowry assay. Teorien bag begge assays er baseret på to principper: Et at kobber reagerer med tyrosine og tryptofan i en alkalisk opløsning, samt at protein-kobber komplekset reducerer syrer i en folin-reagent, som resulterer i en blåfarvning [100,101]. Absorbansen af blåfarvningen måles på et spektrofotometer ved 600 nm. For at OD værdierne kan omregnes til mængden af protein i prøverne, skal man bruge hældningen fra en standardkurve lavet ud fra kendte mængder protein. Metode: Til at lave standardkurven blev der brugt forskellige koncentrationer (0, 5, 10, 15, 20, 25 og 30 µg) af Albumin Standard (Thermo Scientific; Cat: 23209). Koncentrationerne blev lavet ved at fortynde stock-opløsningen med lysisbuffer. Standarderne blev lavet ved at udtage 25 µl af hver koncentration. Af prøverne blev der målt på 1-5 µl, der blev blandet med lysisbuffer svarende til volumenet af standarderne (25 µl). Standarderne og prøverne blev tilsat 125 µl A+S reagent (1:50) (Bio-Rad DC Protein Assay, Reagent A: Bio RAD; Cat: og Reagent S; Bio RAD; Cat: ), hvilket danner en alkalisk kobber-tartrat opløsning. Derefter blev 1 ml reagent B (Bio-Rad DC TM Protein Assay, Reagent B; Bio RAD; Cat: ) indeholdende folin tilsat og blandet ved at vortexse lige efter. Blandingen blev inkuberet i 15 min og da blandingen er lysfølsomt, blev 52
54 prøverne pakket ind i sølvpapir. Herefter blev prøverne målt på et spektrofotometer. Standardkurvens hældning blev brugt til at udregne mængden af protein i prøverne. SDS-PAGE (Sodium-dodecyl-sulfat-polyacrylamide-gel electrophoresis) SDS-page er en elektroforetisk teknik, der adskiller proteiner efter deres molekylære størrelse. Princippet bag teknikken er at lysaterne tilsættes SDS (Sodium Dodecyl Sulfate) og DTT (Dithiothreitol). SDS denaturerer proteiner ved at binde sig til deres hydrofobe regioner (se Figur 15). Det negativt ladet SDS der er bundet langs de udfoldede polypeptidkæder medfører, at disse bliver negativt ladede, samt at mængden af negative ladninger per masse enhed er ens. Den negative ladning medfører, at proteinerne vil vandre mod den positive pol, når der tilsættes strøm. Reduktionsmidlet DTT nedbryder proteinernes disulfidbroer. Proteinerne adskilles gennem gelen således, at de mindste proteiner løber længst og de største kortest. Figur 15: Denatureringen af protein ved binding af SDS til de hydrofobe regioner (Fra: Christensen ST et al. (2010). Exercise guide in Primary cilia and PDGFRa signaling, Department of Biology). Gelen består af en stabiliseringsgel ( stacking gel ) og en separationsgel. Stabiliseringsgelen samler proteinerne som smalle bånd ved starten af separationsgelen. Proteinerne kan samles i smalle bånd, da stabiliseringsgelen har et lavere acrylamid indhold, samt en lavere ph end separationsgelen. Proteinerne samles derudover også pga., at den ledende ion Cl - og den 53
55 efterløbende MOPS (3-(N-morpholino) propane sulfonic acid) komprimerer proteinerne ved starten af separationsgelen (se Figur 16). Teknikken bag separationsgelen er, at den består af acrylamid, der når det tilsættes ammonium persulfat danner krydsbundne strukturer med bisacrylamid. Disse strukturer udgør porerne i gelen. Jo mere acrylamid der findes i gelen, des mindre er porerne og jo langsommere vil proteinerne løbe. Så hvis man kvantificerer små proteiner der løber hurtigt, er det bedst at vælge en gel med et højt indhold af acrylamid. Figur 16: Skematisk præsentation af protein stabilisering og separation i NuPAGE Bis-Tris systemet fra katoden (-) til anoden (+) (Fra: Christensen ST et al. (2010). Exercise guide in Primary cilia and PDGFRa signaling, Department of Biology). Metode: Systemet InVitrogen (Xcell Sure Lock Module) blev brugt til SDS-PAGE. Prøverne blev gjort klar til loading ved at udtage en mængde af lysatet svarende til µg protein/25 µl, som blev tilsat ddh 2 O og samplebuffer (NuPAGE LDS Sample Buffer (4X); Invitrogen; Cat: NP0007) + DTT (1:2,5). Prøverne blev lige inden loading kogt ved 95 C i 5 min. For at få fordampet væske ned fra låget, blev prøverne efterfølgende spundet kort ved x g. Før loading af prøverne blev gelelektroforese-apparatet afsprittet og 600 ml running-buffer blev lavet ved at blande 30 ml 20 x stock NuPage MOPS SDS (Invitrogen; Cat: NP ) med 570 ml ddh 2 O. Heraf 400 ml i det ydre 54
56 kammer og 200 ml, tilsat 500 µl antioxidant (NuPAGE Antioxidant; Invitrogen; Cat: NP0005), i det indre kammer. Ved klargøring af gelerne (NuPAGE 10 % Bis-Tris Gel ((NuPAGE Novex Tris-Acetate Mini Gels) 1.0 mm *12 well: Invitrogen; Cat:NP0302Box) blev gelkassetterne klippet fri og skyllet med ddh 2 O og 96 % ethanol. Herefter blev tapen og kammene fjernet og brøndene skyllet to gange med running-buffer tilsat antioxidant. Efter indsættelse af gelkassetterne i gelelektroforeseapparatet og tilsætning af running-buffer i det indre og ydre kammer, blev de opblandede prøver (25 µl), samt 8 µl af markøren (BenchMark TM Protein Ladder; Invitrogen; Cat: ) loadet på gelen. Markøren der blev brugt indeholder 15 proteiner med kendte molekylevægte mellem 10 og 220 kda. Gelen blev kørt på programmet NuPage Gel ved 140 V i ca. 1 time og 15 min. Western Blotting Efter SDS-pagen overføres de separerede proteiner fra gelen til en nitrocellulosemembran. For at detektere interessante proteiner tilsættes specifikke antistoffer. Inden tilsætning af primære antistoffer skal membranen blokkes, så der ikke sker uspecifikke bindinger. Dette kan f.eks. gøres med skummetmælkspulver, der har et højt indhold af protein. Efter membranen har været tilsat primært antistof, vaskes den med TBST (se appendiks A) for at fjerne overskydende antistof. Dernæst tilsættes det sekundære antistof, som binder til det primære antistof. Det sekundære antistof er påsat et enzym, der kløver et substrat i fremkalderen, hvilket resulterer i en farvereaktion. Farven markerer det søgte protein. Metode: Inden SDS-pagen var kørt færdig, blev der lavet 600 ml transfer-buffer bestående af 30 ml 20 x stock NuPAGE Transfer Buffer (Invitrogen; Cat: NP0006-1), 60 ml 96 % ethanol, samt 510 ml ddh 2 O. Derudover blev svampe (blotting pads), filterpapir (Whatman; Cat: ) og nitrocellulosemembraner (Whatman; Cat: ) lagt i blød i transfer-bufferen. Da SDS-pagen var kørt færdig, blev gelkassetterne åbnet og bundene af gelerne, samt brøndene fjernet. Der blev herefter lavet sandwich bestående af gennemvædede svampe, filterpapir, en membran, samt en gel. Luftbobler blev fjernet ved at rulle et plasticrør forsigtigt henover sandwicherne. Evt. 55
57 luftbobler ville have ødelægt overførelsen af proteinerne på det pågældende sted. Herefter blev Sandwicherne placeret i blottingkammeret og transfer-bufferen hældt i. Blottet blev kørt på programmet NuPAGE Blot ved 25 V i 1 time pr. gel. Efter blotting blev de overførte proteiner visualiseret med Ponceau-opløsning (Ponceau S solution; SIGMA; Cat: P7170-1L), der farver proteiner røde. Dette blev gjort for at tjekke overførelsen af protein. Markørerne blev tegnet op med blyant og membranerne klippet til. Herefter blev membranerne lagt i blocking-buffer (se appendiks A) og inkuberet 1 time ved 37 C på rystebord eller evt. natten over ved 4 C. Dernæst blev membranerne placeret i et fugtkammer lavet af en petriskål, parafilm og vandvædet filterpapir. Membranerne blev herefter tilsat primært antistof (se tabel 3 for antistoffer og koncentrationer) fortyndet i blocking-buffer og inkuberet natten over ved 4 C. Membranerne blev efter inkubering skyllet 2 gange med TBST og vasket 1x15 min og derefter 3x5 min med TBST. Efter vask blev membranerne tilsat sekundært antistof, som ved alle de brugte primære antistoffer var GAR (Goat Anti Rabbit IgG; SIGMA; Cat: A3937) og inkuberet 1 time ved stuetemperatur. Som det sidste blev membranerne vasket som ovenfor beskrevet og fremkaldt. Til fremkaldelsen blev der brugt fosfatase substratet BCIP/NBT (5-Bromo-4-chloro-3-indolyl fosfat og Nitro blue tetrazolium, VWR: KPL, Cat: ). Visualiseringen af båndene skete ved, at den alkaliske fosfatase på det sekundære antistof spaltede fosfatasesubstratet og sammen med NBT dannede farvningen. Reaktionen blev standset med ddh 2 O. Antistof Produkt Fortynding GAR TASK-2 Anti-K 2p5.1 (TASK-2); Alomone Labs; Cat: APC-037 1: 100 1: 5000 Kv1.3 Anti-K v 1.3 (extracellular); Alomone Labs; Cat: APC-101 Anti-Potassium Channel K v 1.3 (extracellular); SIGMA-ALDRICH; Cat: P4497 1:100; 1:200 1: 2000 β-actin β-actin (13E5) Rabbit mab; Cell Signaling Technology; Cat: : : 5000 Histon Histone H3 (FL-136); SANTA CRUZ Biotechnology; Cat: sc : 100 1: 5000 Tabel 3: Antistoffer brugt til protein kvantificering. 56
58 Beregning Membranerne blev scannet, da de var tørre og båndene kvantificeret ved hjælp af programmet UN-SCAN-IT version 6.1. Programmet udregner mængden af pixel i båndene, hvilket bruges som et udtryk for mængden af protein. 3.5 Knockdown med sirna Small interfering RNA (sirna) er små dobbeltstrengede RNA molekyler, som er involveret i RNA interferens processen (RNAi). Ved at binde komplementære sekvenser kan sirna hæmme genekspressionen på mrna niveau. RNA interferens er en mekanisme, hvor dobbeltstrenget RNA nedbrydes af enzymet Dicer til sirna. sirnaen inkorporeres i komplekset RISC (RNAi induced silencing complex), hvori sirna separeres og antisense-strengen binder og leder nedbrydning af den komplementære mrna sekvens. Dette er en forsvarsmekanisme imod bl.a. virus. Ved at fremstille syntetisk sirna kan man hæmme specifikke gener. Der er dog visse udfordringer forbundet med brugen af syntetisk sirna, da RNA er vandopløseligt og negativt ladet, mens cellemembranen er fedtholdig og har en negativ ladede overflade, hvilket gør det vanskeligt at få sirnaet ind i cellen. Der er forskellige metoder, både fysiske og kemiske, til at overkomme dette problem. Af fysiske metoder bruges tryk, strøm (elektrochok) eller ultralyd til at få molekylerne ind i cellen. Kemiske metoder benytter positivt ladede molekyler som lipider og polymerer, der kompleksbinder sirnaet i partikler, som kan optages via endocytose. Et andet problem ved brugen af sirna til knockdown af gener er, at effekten er kortvarig [102,103]. I dette speciale blev der brugt kemiske transfektions-agenter til transfektion af Jurkat T-celler. Der blev afprøvet 3 slags (se tabel 4), samt brugt sirna mod TASK-2 i forskellige koncentrationer (30 nm, 40 nm og 50 nm) til forskellige tider (60, 72, 84 og 96 timer) for at finde ud af hvilken opsætning, der gav den bedste knockdown. Derudover blev der også brugt en Negativ Kontrol (Transfection II Kit; Ambion; Cat: AM1631) bestående af sirna sekvenser uden homologi til humant genom. 57
59 Produkt Katalog nr. Molekyle type Lipofectamine Invitrogen, Cat: Lipid siport TM Amine Ambion, Cat: AM4502 Polyaminer siport TM NeoFx TM Ambion, Cat: AM4510 Lipid Tabel 4: Transfektion-agenter brugt til knockdown med sirna. Metode: Jurkat T-cellerne blev sat op i 6 brønds bakker (Greiner bio-one, Cellstar; Cat: ) med celler pr brønd. Inden transfektionen med sirna blev +/+ mediet fjernet ved at spinde cellerne ned og resuspendere dem i medie uden P/S (+/-). Dette blev gjort for, at undgå at P/S passerede cellemembranen og medførte celledød. Ved forsøgsstart blev transfektions-agenten blandet med -/- medie (uden FBS og P/S) og inkuberet i 5 min ved stuetemperatur. Der blev brugt 7 µl transfektions-agent og 100 µl -/- medie pr brønd. Imens blev sirnaen (se tabel 5), samt den negative kontrol blandet med -/- medie og overført til transfektions-agenten. Efter blandingen havde inkuberet i 20 min ved stuetemperatur blev 200 µl af den fordelt drypvis i hver brønd. Pladen blev herefter vippet forsigtigt og inkuberet til de forskellige tider. Gen sirna ID Sense (5 3 ) Antisense TASK GGAAGCAAGUCAUCAGAGCTT GCUCUGAUGACUUGCUUCCTG Tabel 5: Prædesignet sirna mod TASK-2 fra Ambion. 3.6 Proliferation Til måling af proliferation findes metoder der benytter inkorporering af radioaktivt mærket isotoper. Disse metoder kan dog værre problematiske med celler i suspension, da celler kan mistes når mediet suges fra. Derfor er der til måling af T-cellers proliferation, efter aktivering med CD3/CD28 beads, i dette speciale benyttet tælling af T-cellerne ved hjælp af et tællekammer på Universitetet og ved hjælp af en celletæller på Novo Nordisk, Måløv. 58
60 Kapitel 4 Resultater I dette kapitel vil jeg vise og beskrive de resultater jeg har opnået igennem min eksperimentelle del af mit specialeforløb. Nogle af forsøgene er udført i samarbejde med/af ph.d.-studerende Signe S. Kirkegaard (se Appendiks D). På de fleste af resultaterne er der som statistisk test brugt ANOVA, som tester på middelværdiernes varians. På de øvrige resultater hvor der har været for få forsøg til at udføre en ANOVA test på hele forsøgssættet, er der brugt tosidet (Two-tailed) parret (Wilcoxon s) og uparret (Student s) t-test til sammenligning af to forsøgsbetingelser. Parret t-test er lavet på forsøg, hvor de aktiverede T-celle subtyper sammenlignes med Kontrolcellerne (ikke aktiverede T-celler) der er kørt parallelt og uparret t-test er lavet på forsøgene, hvor de aktiverede subtyper Central Memory og Effector Memory sammenlignes. Spredningen på resultaterne er vist med ± Standard Error Mean (±SEM) for uafhængige forsøg. Statistisk signifikans er vist med stjerner. En stjerne (*) viser et signifikansniveau på 95 % (P < 0,05), mens to stjerner (**) viser et signifikans niveau på 99 % (P < 0,01). 4.1 Effekten af aktivering på volumen og RVD Ændringer af volumen og volumenregulering som følge af T-celle aktivering blev undersøgt ved måling på en Coulter Counter (se Materialer og Metode). T-cellerne blev testet i Isoton Ringer (300 mosm) for at undersøge cellevolumen og i Hypoton Ringer (160 mosm) for at undersøge cellesvulmningen og evnen til at tilbageregulere (RVD). 59
61 T-cellers volumen øges ved aktivering På Figur 17A ses volumenet af de aktiverede T-celler udregnet relativt til Kontrolcellerne. Cellevolumen blev beregnet ud fra målingerne i Isoton Ringer. Der ses en signifikant volumenforøgelsen i de aktiverede T-celler efter 24 timer, samt efter 3 og 6 dages aktivering med CD3/CD28 beads, sammenlignet med Kontrollen. Volumenforøgelsen er størst efter 3 dages aktivering, med en ca. 2 folds forøgelse af volumen i forhold til Kontrollen. Det ser ud som om, der er en tendens til, at de aktiverede T-celler allerede begynder at vokse efter 8 timers aktivering. Kontrolcellernes volumen ændres ikke med tiden, hvilket kan ses ud fra de absolutte værdier (se Appendiks E). Den lille spredning på resultaterne indikerer, at T-cellerne ved aktivering, meget stabilt har øget deres volumen til ca. dobbelt størrelse efter 3 dage. Udover at være blevet signifikant større end Kontrolcellerne efter 24 timer, samt efter 3 og 6 dage, er de aktiverede T- celler også blevet signifikant større end de aktiverede T-celler til tiderne 2, 4, 8 og 12 timer. Derudover er de aktiverede T-celler efter 3 og 6 dage signifikant større end de aktiverede T-celler til tiden 24 timer (Figur 17B). Figur 17: T-cellers volumen øges ved aktivering. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og målt efter 2, 4, 8, 12 og 24 timer, samt efter 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Cellevolumen blev målt i en Coulter Counter. Kontrol og aktiverede T-celler blev målt i 3 min i Isoton Ringer (300 mosm). A) Gennemsnitsvolumen af de aktiverede T-celler målt i Isoton Ringer. Resultaterne er vist relativ til Kontrollen ±SEM. Aktiverede T-celler er blevet signifikant større end Kontrolcellerne efter 24 timers aktivering. B) Tabel over antal forsøg (n) og signifikanser. P 0,01 er vist med **. Nogle af forsøgene er udført af ph.d.-studerende Signe S. Kirkegaard (se Appendiks D). 60
62 Ændring i RVD responset På Figur 18 er vist to repræsentative RVD-forløb over tid i Hypoton Ringer (160 mosm), efter henholdsvis 4 timer og 3 dages CD3/CD28 aktivering. RVD-forløbene er vist med de hypotone værdier udregnet relativt til cellevolumen i Isoton Ringer. Efter 4 timers aktivering (Figur 18A) svulmer de aktiverede T-celler ikke mere (relativt) end Kontrolcellerne (ikke-aktiverede T-celler), og der ses en ca. 1,5 gange svulmning af de hypotont stimulerede celler, i forhold til celler holdt i Isoton Ringer. Efter 3 dages aktivering (Figur 18B) svulmer T-celler i Hypoton Ringer til et maksimum, der er ca. 2,3 gange så stort som deres startvolumen, mens Kontrolcellerne derimod svulmer til ca. halvanden gange deres startvolumen. Figur 18: RVD-forløb i Hypoton Ringer. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og målt efter 2, 4, 8, 12 og 24 timer, samt efter 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Cellevolumen blev målt i en Coulter Counter. Kontrol og aktiverede T celler blev målt i 3 min i Isoton Ringer (300 mosm) og 8 min i Hypoton Ringer (160 mosm). Resultaterne viser RVD udregnet relativt til cellevolumen i Isoton Ringer A) Efter 4 timers aktivering, hvor de aktiverede T-celler endnu ikke svulmer mere end Kontrolcellerne i Hypoton Ringer og B) Efter 3 dages aktivering, hvor de aktiverede T-celler svulmer ca. 2,5 gange, mens de ikke aktiverede T-celler svulmer ca. 1,5 gange i Hypoton Ringer. 61
63 Figur 19A viser den absolutte maksimale volumen målt i Hypoton Ringer (relativ til Kontrollens maksimale volumen i Hypoton Ringer). Den absolutte maksimale volumen i aktiverede T-celler bliver signifikant større i forhold til Kontrolcellerne efter 24 timer (ca. 1,7 gange større). Den højeste maksimale svulmning ses efter 3 dages aktivering med en ca. 3 folds forøgelse af maksimal volumen i forhold til Kontrollen og er faldende, men stadig signifikant højere, end de tilsvarende Kontrolceller efter 6 dages aktivering (ca. 2,5 gange større). Den absolutte maksimale volumen efter 24 timer, samt efter 3 og 6 dages aktivering er også signifikant større i forhold til de aktiverede T-celler efter 2, 4, 8 og 12 timer. T-celler aktiveret i 3 dage og 6 dage svulmer signifikant mere end T-celler aktiveret i 24 timer. Derudover svulmer T-celler aktiveret i 3 dage også signifikant mere end T-celler aktiveret i 6 dage (Figur 19B). Da der ved den absolutte maksimale volumen ikke er taget højde for øgningen af cellevolumen i de aktiverede T-celler, er der i Figur 19C vist den relative maksimale volumen, som er den maksimale volumen i Hypoton Ringer først udregnet relativt til volumen i Isoton Ringer og derpå sat relativt til den tilsvarende værdi for de ubehandlede celler. Der ses ligesom med den absolutte volumen en signifikant stigning i maksimal svulmning efter 24 timers aktivering (ca. 1,2 gange større), samt efter 3 og 6 dages aktivering (henholdsvis ca. 1,4 og 1,2 gange større). På figur 19D ses de tider hvor de aktiverede T-celler efter 24 timer, samt efter 3 og 6 dages aktivering er svulmet signifikant mere end kortere tids aktiverede T-celler. Dette afviger kun fra den absolutte maksimale volumen ved, at 24 timer ikke er signifikant større i forhold til 12 timer, samt at 6 dage ikke er signifikant større i forhold til 24 timer. De absolutte og relative værdier for Kontrolcellernes maksimale volumen forbliver ligesom med cellevolumen de samme til alle tider (se Appendiks E). 62
64 Figur 19: Det maksimale volumen der opnås i Hypoton Ringer øges i aktiverede T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og målt efter 2, 4, 8, 12 og 24 timer, samt efter 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Cellevolumen blev målt i en Coulter Counter. Kontrol og aktiverede T celler blev målt i 3 min i Isoton Ringer (300 mosm) og 8 min i Hypoton Ringer (160 mosm). A) Absolut maksimal volumen i Hypoton Ringer. Resultaterne er vist relativ til Kontrollen ± SEM. Aktiverede T-celler svulmer signifikant mere end Kontrolcellerne efter 24 timers aktivering. B) Tabel over antal forsøg (n) og signifikanser for den absolutte maksimale svulmning. C) Relativ maksimal volumen i Hypoton Ringer. Resultaterne er vist relativ til Kontrollen ± SEM. Aktiverede T-celler svulmer, ligesom i A), signifikant mere end Kontrolcellerne efter 24 timers aktivering. D) Tabel over antal forsøg (n) og signifikanser for den relative maksimale svulmning. P < 0,05 er vist med * og P 0,01 er vist med **. Nogle af forsøgene er udført af ph.d.-studerende Signe S. Kirkegaard (se Appendiks D). Tilbagereguleringen i % efter 3 min, i Hypoton Ringer, udregnet ved brug af ligning (2) ses på Figur 20A. Resultaterne er udregnet relativt til Kontrolcellerne. Tilbagereguleringen indikerer T-cellernes evne til at udføre RVD efter udsættelse for hypotone forhold. De aktiverede T-celler bliver signifikant dårligere til at tilbageregulere deres volumen i forhold til Kontrolcellerne efter 24 timer, samt efter 3 og 6 dages aktivering. De aktiverede T-celler er dårligst til at udføre RVD efter 3 dages aktivering med et ca. 2,5 folds fald i % tilbageregulering. Det ser ud som om, der er en tendens til, at de aktiverede T-celler allerede er dårligere til at tilbageregulere efter 12 timers aktivering. De aktiverede T-celler til tiderne 24 timer, samt 3 og 6 dage er signifikant dårligere til at udføre RVD 63
65 end aktiverede T-celler til tiderne 2, 4 og 8 timer, mens T-celler aktiveret i 3 dage også er signifikant dårligere, sammenlignet med T-celler aktiveret i 12 timer. Derudover er T-celler aktiveret i 12 timer signifikant dårligere til at udføre RVD end T-celler aktiveret i 4 timer (Figur 20B). Resultaterne for tilbagereguleringen i % efter 5 min (se Appendiks E) er meget ens med resultaterne for tilbagereguleringen i % efter 3 min. Figur 20: Evnen til at udføre RVD falder i aktiverede T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og målt efter 2, 4, 8, 12 og 24 timer, samt efter 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Cellevolumen blev målt i en Coulter Counter. Kontrol og aktiverede T celler blev målt i 3 min i Isoton Ringer (300 mosm) og 8 min i Hypoton Ringer (160 mosm). A) Tilbagereguleringen (RVD) i % efter 3 min, udregnet ved hjælp af ligning (2). Resultaterne er vist relativ til Kontrollen ± SEM. Efter 24 timeres aktivering er de aktiverede T-celler blevet signifikant dårligere end Kontrolcellerne til at udføre RVD. B) Tabel over antal forsøg (n) og signifikanser. P 0,05 er vist med * og P 0,01 er vist med **. Nogle af forsøgene er udført af p.hd.-studerende Signe S. Kirkegaard (se Appendix D). Den absolutte tilbagereguleringshastighed i Hypoton Ringer (relativ til Kontrollens tilbagereguleringshastighed i Hypoton Ringer) udregnet ved lineær-regression ses på Figur 21A. Efter 3 og 6 dages aktivering bliver T-cellerne signifikant hurtigere end Kontrolcellerne til at tilbageregulere deres volumen (ca. 1,5 gange så hurtige). Der ses en tendens til, at tilbagereguleringshastigheden i ikke-aktiverede Kontrolceller og CD3/CD28 aktiverede T-celler er rimelig ens efter 2, 4 og 8 timer, hvorefter der er en tendens til, at de aktiverede T-celler bliver en anelse langsommere (efter 12 og 24 timers aktivering). Det evt. lille fald i hastigheden skyldes nok, at Kontrolcellerne har en tendens til at blive en anelse hurtigere efter 12 og 24 timer, hvilket kan ses ud fra de absolutte værdier (se appendiks E). Udover at være signifikant hurtigere til at tilbageregulere i forhold til Kontrollen, er de aktiverede T-celler efter 3 og 6 dages aktivering også signifikant hurtigere end de aktiverede T-celler til de øvrige tider (Figur 21B). 64
66 Da den absolutte tilbagereguleringshastighed ikke tager højde for den øgede volumen i de aktiverede T-celler, er den relative tilbagereguleringshastighed udregnet ved lineær-regression på RVD-forløb, hvor de hypotone værdier er udregnet relativt til den isotone cellevolumen (se figur 18). Ved den relative tilbagereguleringshastighed (Figur 21C) ses det, at de aktiverede T-celler bliver signifikant langsommere til at tilbageregulere efter 12 og 24 timer (ca. 0,7 gange). Efter 3 dages aktivering kunne det se ud som om, at der er en tendens til en stigning i hastigheden igen. Der er ingen signifikant forskel i hastigheden imellem de aktiverede T-celler til forskellige tider (Figur 21D). Figur 21: Tilbagereguleringshastighed i aktiverede T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og målt efter 2, 4, 8, 12 og 24 timer, samt efter 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Cellevolumen blev målt i en Coulter Counter. Kontrol og aktiverede T celler blev målt i 3 min i Isoton Ringer (300 mosm) og 8 min i Hypoton Ringer (160 mosm). A) Absolut tilbagereguleringshastighed udregnet ved lineær-regression. Resultaterne er vist relativ til Kontrollen ± SEM. Efter 3 dages aktivering er de aktiverede T-celler blevet signifikant hurtigere til at tilbageregulere end Kontrolcellerne B) Tabel over antal forsøg (n) og signifikanser for den absolutte tilbagereguleringshastighed. C) Relativ tilbagereguleingshastighed udregnet ved linærregression. Resultaterne er vist relativ til Kontrollen ± SEM. Efter 24 timer er de aktiverede T-celler blevet signifikant langsommere til at tilbageregulere end Kontrolcellerne. D) Tabel over antal forsøg (n) og signifikanser for den relative tilbagereguleringshastighed. P 0,01 er vist med **. Nogle af forsøgene er udført af ph.d.-studerende Signe S. Kirkegaard (se Appendiks D). 65
67 4.2 mrna ekspression af TASK-2, Kv1.3 og KCa3.1 Niveauet af TASK-2, Kv1.3 og KCa3.1 mrna ekspression i de aktiverede T-celler blev undersøgt ved Real Time PCR. Resultaterne er udregnet relativt til hver tids Kontrol. Figur 22A viser ekspressionen af TASK-2 på mrna niveau efter aktivering af T-celler med CD3/CD28 beads. Ekspressionen af TASK-2 er signifikant opreguleret i aktiverede T-celler efter 24 timers aktivering, med en ca. 114 folds stigning, sammenlignet med Kontrolcellerne. Det ser ud som om, der er en tendens til, at stigningen i ekspressionen af TASK-2 i de aktiverede T-celler starter efter 2 timers aktivering. Derudover kan det se ud som om, der er en tendens til, at ekspressionen falder igen efter 24 timers aktivering og at ekspressionen næsten er tilbage på niveau med Kontrolcellerne efter 6 dages aktivering. Der var for få forsøg (n= 2) til at medtage 48 timer i ANOVA testen og det store fald der ses i ekspressionen efter 48 timers aktivering, er derfor umuligt at sige noget om. Ekspressionen af TASK-2 i aktiverede T-celler efter 24 timers aktivering er også signifikant opreguleret i forhold til ekspressionen i aktiverede T-celler efter 2 timer og 6 dages aktivering (Figur 22B). 24 timer er også det tidspunkt, hvor de aktiverede T-celler er blevet signifikant større end Kontrolcellerne. Figur 22: Ekspression af TASK-2 på mrna niveau i Humane T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og høstet til tiderne 2, 4, 8, 12, 24 og 48 timer, samt 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Efter høst blev mrna oprenset fra prøverne og syntetiseret til cdna ved Reverse transkriptase PCR. Ekspressionen af TASK-2 på mrna niveau blev kvantificeret ved Real time PCR. A) Gennemsnitslig mrna ekspression af TASK-2. Resultaterne er vist relativ til Kontrollen ±SEM. TASK-2 er signifikant opreguleret i de aktiverede T-celler efter 24 timers aktivering, sammenlignet med Kontrolcellerne. Der var for få forsøg til at medtage 48 timer i ANOVA testen. B) Tabel over antal forsøg (n) og signifikanser. P 0,05 er vist med * og P 0,01 er vist med **. 66
68 Kv1.3 ekspressionen på mrna niveau efter T-celle aktivering med CD3/CD28 beads (relativ til Kontrollen) ses på Figur 23A. Der er ingen signifikant stigning i ekspressionen af Kv1.3 i de aktiverede T-celler, sammenlignet med Kontrolcellerne. Det kunne se ud som om, at der er en tendens til et lille fald i ekspressionen af Kv1.3 efter 2, 4 og 8 timers aktivering, samt en stigning efter 12 timer, som når op på Kontrolcellernes niveau igen efter 24 timers aktivering. Ved 48 timer ses der et fald i ekspressionen af Kv1.3, ligesom i ekspressionen af TASK-2, men pga. at der kun er lavet to forsøg (Figur 23B), er der ikke baggrund for at sige, om der er en egentlig tendens. Ekspressionen af Kv1.3 efter 3 og 6 dages aktivering ser ud til at være nogenlunde på niveau med Kontrollen, men det er svært at sige om dette er tilfældet, da der er en stor spredning på resultaterne. Figur 23: Ekspression af Kv1.3 på mrna niveau i Humane T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og høstet til tiderne 2, 4, 8, 12, 24 og 48 timer, samt 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Efter høst blev mrna oprenset fra prøverne og syntetiseret til cdna ved Reverse transkriptase PCR. Ekspressionen af Kv1.3 på mrna niveau blev kvantificeret ved Real time PCR. A) Gennemsnitslig mrna ekspression af Kv1.3. Resultaterne er vist relativ til Kontrollen ±SEM. Kv1.3 er ikke signifikant opreguleret til nogle af tiderne. Der var for få forsøg til at medtage 48 timer i ANOVA testen. B) Tabel over antal forsøg (n). På Figur 24A ses KCa3.1 mrna ekspressionen i T-celler efter aktivering med CD3/CD28 beads (relativ til Kontrollen). Ekspressionen af KCa3.1 i aktiverede T-celler er signifikant forøget efter 3 og 6 dages aktivering, med en ca. 13 folds stigning, sammenlignet med Kontrolcellerne. Der ses en tendens til et bifasisk ekspressions-mønster, med et lille fald i ekspressionen efter 2 og 4 timer, samt en stødt stigning af KCa3.1 efter 8 timer. Der var for få forsøg (n= 2) til at medtage 48 timer i 67
69 ANOVA testen. Ekspressionen af KCa3.1 i aktiverede T-celler efter 3 og 6 dages aktivering er udover at være signifikant opreguleret i forhold til Kontrolcellerne også signifikant opreguleret i forhold ekspressionen i aktiverede T-celler efter 4 timers aktivering (Figur 24B). Figur 24: Ekspression af KCa3.1 på mrna niveau i Humane T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og høstet til tiderne 2, 4, 8, 12, 24 og 48 timer, samt 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Efter høst blev mrna oprenset fra prøverne og syntetiseret til cdna ved Reverse transkriptase PCR. Ekspressionen af KCa3.1 på mrna niveau blev kvantificeret ved Real time PCR. A) Gennemsnitslig mrna ekspression af KCa3.1. Resultaterne er vist relativ til Kontrollen ±SEM. KCa3.1 er signifikant opreguleret i de aktiverede T-celler i forhold til Kontrolcellerne efter 3 og 6 dages aktivering. Der var for få forsøg til at medtage 48 timer i ANOVA testen. B) Tabel over antal forsøg (n) og signifikanser. P 0,05 er vist med *. 4.3 Ekspression af TASK-2 og Kv1.3 på protein niveau Ekspressionen af generne TASK-2 og Kv1.3 på protein niveau blev undersøgt ved Western Blot. Ekspressionen af KCa3.1 på protein niveau kunne ikke undersøges, pga. manglen på et effektivt antistof. Resultaterne for TASK-2 ekspressionen på protein niveau efter aktivering med CD3/CD28 beads ses på Figur 25A-B. Gennemsnitsværdierne for TASK-2 ekspressionen er vist relativ til Kontrollen (Figur 25B). Resultaterne viser en tendens til et bifasisk ekspressions-mønster af TASK-2 i de aktiverede T-celler, med en lavere ekspression efter 2 og 4 timers aktivering, efterfulgt af en vedvarende stigning efter 8 timers aktivering. Der ses en signifikant højere ekspression af TASK-2 efter 3 og 6 dages aktivering. TASK-2 ekspressionen topper efter 3 dages aktivering med en ca. 3 folds stigning. Det er også efter 3 dage, at den absolutte tilbagereguleringshastighed er signifikant forøget (Figur 21A). Tendensen til et fald i ekspression af TASK-2 i aktiverede T-celler efter 2 og 4 68
70 timers aktivering støttes op af, at der er lavet forholdsvis mange forsøg med en lille spredning på data (Figur 25B). Der var ikke forsøg nok til at medtage 48 timer i ANOVA testen. Udover at have en signifikant øget ekspression af TASK-2 i forhold til Kontrollen, er ekspressionen i de aktiverede T-celler efter 3 dages aktivering signifikant større end i de aktiverede T-celler efter 2, 4, 8, 12 og 24 timers aktivering. Ekspressionen af TASK-2 i de aktiverede T-celler efter 24 timer og 6 dages aktivering er signifikant større end i T-celler aktiverede i 2 og 4 timer (Figur 25C). Figur 25: TASK-2 ekspression på protein niveau i humane T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og høstet til tiderne 2, 4, 8, 12, 24 og 48 timer, samt 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Ekspressionen af TASK-2 blev verificeret ved SDS-page og Western Blot, med et antistof imod TASK-2 og kvantificeret ved pixel beregning i UN-SCAN-IT. A) Repræsentativt Western Blot for ekspressionen af TASK-2. Forsøgene 3 og 6 dage er kørt uden loading kontrol, da disse forsøg blev udført før det blev besluttet at have en loading kontrol med. Derudover er nogle af de første forsøg til tiderne 2, 4, 8, 12 og 24 timer kørt med Histon som loading kontrol, i stedet for β-actin. Histon blev skiftet ud med β-actin, da båndene havde en tendens til at løbe ud pga. en lille molekylærvægt (15 kda). B) Gennemsnitslig protein ekspression af TASK-2. Resultaterne er vist relativt til kontrollen ±SEM. TASK-2 er signifikant opreguleret i forhold til kontrollen efter 3 og 6 dages aktivering. Der var for få forsøg til at medtage 48 timer i ANOVA testen. C) Tabel over antal forsøg (n) og signifikanser. P 0,05 er vist med * og P 0,01 er vist med **. Nogle af forsøgene er udført af ph.d.-studerende Signe S. Kirkegaard (se Appendiks D). 69
71 Ekspression af Kv1.3 på protein niveau kan ses på Figur 26A-B. Gennemsnitsværdierne for Kv1.3 ekspressionen er vist relativ til Kontrollen (Figur 26B). Kv1.3 ekspressionen er ikke signifikant opreguleret til nogle af tiderne i forhold til Kontrollen, men der er en signifikant forskel i ekspressionen imellem T-celler aktiverede i henholdsvis 4 timer og 3 dage. Det kan se ud som om, at der er en tendens til et lille fald i ekspressionen af Kv1.3 efter 4 timers aktivering (ca. 0,5 gange lavere), samt en lille stigning efter 3 dages aktivering (ca. 1,8 gange højere). Denne evt. lille stigning kan se ud til at starte ved 24 timer og falde igen efter 6 dage. Det formodede fald og den formodede stigningen styrkes af, at der er en signifikant forskel på ekspressionen af Kv1.3 imellem aktiverede T-celler efter 4 timers og 3 dages aktivering. Der var for få forsøg til at medtage 8 timer (n= 3) og 48 timer (n= 3) i ANOVA testen (Figur 26C). Figur 26: Kv1.3 ekspression på protein niveau i humane T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og høstet til tiderne 2, 4, 8, 12, 24 og 48 timer, samt 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Ekspressionen af Kv1.3 blev verificeret ved SDS-page og Western Blot, med et antistof imod Kv1.3 og kvantificeret ved pixel beregning i UN-SCAN-IT. A) Repræsentativt Western Blot for ekspressionen af Kv1.3. B) Gennemsnitslig protein ekspression af Kv1.3. Resultaterne er vist relativt til Kontrollen ±SEM. Der er ingen signifikant forskel i forhold til Kontrollen til nogle af tiderne, men der er en signifikant forskel imellem 4 timers og 3 dages aktivering. Der var for få forsøg til at medtage 8 timer og 48 timer i ANOVA testen. C) Tabel over antal forsøg (n). 70
72 4.4 Ekspression af TASK-2 og Kv1.3 i T-celle subtyper Da T-celler, som nævnt ovenfor, er en heterogen population af forskellige subtyper, med forskellige funktioner i et immunrespons, samt har forskelligt udtryk af ionkanaler, er TASK-2 blevet undersøgt på protein niveau i forskellige subtyper, for at se om der en evt. forskel i ekspressionen af TASK-2. TASK-2 ekspressionen blev undersøgt i subtyperne CD4 All, Naive CD4, CD8 All, Naive CD8, samt i Central Memory (CM) og Effector Memory (EM). På Figur 27A-B ses ekspressionen i CD4 All, Naive CD4, CD8 All og Naive CD8. Figur 27B viser gennemsnitsværdierne for TASK-2 ekspressionen. Der er lavet en tovejs parret t-test på resultaterne, da der ikke var forsøg nok af CD8 All (n= 4) og Naive CD8 (n= 4) til, at der kunne laves en ANOVA test på hele forsøgssættet. Resultaterne viser, at CD4 All, Naive CD4 og Naive CD8 er signifikant opreguleret i forhold til Kontrollen, mens ekspressionen af TASK-2 i CD8 All ikke er signifikant opreguleret i forhold til Kontrollen. Det ser dog ud som om, at der er en stærk tendens til, at ekspressionen også stiger ved aktivering i CD8 All. En ANOVA test på CD4 All og Naive CD4 viste ingen signifikant forskel i ekspressionen af TASK-2. Ser man på niveauet af TASK-2 ekspression efter aktivering imellem subtyperne, kan det se ud som om, der er en tendens til, at de aktiverede CD4 All og især Naive CD4 T-celler har en lavere ekspressionen af TASK-2 i forhold til CD8 All og Naive CD8 T-celler. Det kræver dog flere forsøg at fastlægge dette. 71
73 Figur 27: TASK-2 ekspression på protein niveau i forskellige humane T-celle subtyper efter 3 dages aktivering. T-celler oprenset fra PBMCs blev aktiveret med CD3/CD28 beads og høstet efter 3 dages aktivering. Ikke aktiverede T-celler blev brugt som kontrol. Ekspressionen af TASK-2 blev verificeret ved SDS-page og Western Blot, med et antistof imod TASK-2 og kvantificeret ved pixel beregning i UN-SCAN-IT. A) Repræsentativt Western Blot for ekspressionen af TASK-2. B) Gennemsnitslig protein ekspression af TASK-2. Resultaterne er vist relativt til Kontrollen ±SEM. Der er ikke udført forsøg nok til, at kunne lave en ANOVA test på CD8 All (n= 4) og Naive CD8 (n= 4). En tosidet parret t-test viste en signifikant øget ekspression af TASK-2 efter aktivering i Naive CD8. ANOVA test på CD4 All (n= 6) og Naive CD4 (n= 5) viste ingen signifikant øgning af TASK-2 ekspressionen efter aktivering. En tosidet parret t-test viste en signifikant øget ekspressionen af TASK-2 i CD4 All og Naive CD4. P < 0,05 er vist med *. Ekspressionen af TASK-2 i subtyperne Central Memory (CM) og Effector Memory (EM) ses på Figur 28. Der ses en tendens til en øgning i ekspressionen af TASK-2 efter aktivering i begge T-celle subtyper, sammenlignet med Kontrollen (Figur 28B), hvoraf det ser ud som om, at TASK-2 er mest opreguleret i CM. Da der kun er udført ét forsøg, kan der dog ikke drages nogen konklusion herpå. Sammenligningen af ekspressionen af TASK-2 i de aktiverede EM i forhold til de aktiverede CM (Figur 28C), viste ingen signifikant forskel ved en tovejs uparret t-test. Der ses en tendens til en næsten ens ekspression af TASK-2, men spredningen er meget stor, hvilket skyldes, at et af de tre resultater for EM var meget lavere end CM (0,26:1), mens de to andre resultater var lidt højere (1,38:1 og 1,23:1). På baggrund af dette er det svært at sige noget om forskellen i ekspressionen af TASK-2 i de to subtyper, men ud fra disse resultater peger det mod, at ekspressionen i EM måske opreguleres mest. 72
74 Figur 28: TASK-2 ekspression på protein niveau i Central Memory (CM) og Effector Memory (EM) T- celler. T-celler oprenset fra PBMCs blev aktiveret med CD3/CD28 beads og høstet efter 3 dages aktivering. Ikke aktiverede T-celler blev brugt som kontrol. Ekspressionen af TASK-2 blev verificeret ved SDS-page og Western Blot, med et antistof imod TASK-2 og kvantificeret ved pixel beregning i UN-SCAN-IT. A) Repræsentativt Western Blot for ekspressionen af TASK-2. B) TASK-2 ekspressionen (n= 1) i CM og EM T- celler. Resultaterne er vist relativt til Kontrollen. Der er en tendens til, at ekspressionen af TASK-2 opreguleres i både CM og EM efter aktivering. C) Gennemsnitslig ekspression (n= 3) af TASK-2 i aktiverede CM og EM T-celler. Resultaterne for EM er vist relativ til CM ±SEM. Der ses ingen signifikant forskel på ekspressionen. Figur 29 viser ekspressionen af Kv1.3 i subtyperne CM og EM. Der ses ligesom med ekspressionen af TASK-2 en tendens til en øgning i ekspressionen af Kv1.3 i begge T-celle subtyper, sammenlignet med Kontrollen (Figur 29B), men igen kan der ikke drages nogen konklusion herpå, da der kun er udført ét forsøg. Sammenligningen imellem aktiverede CM og aktiverede EM T-celler (Figur 29C), hvor EM er udregnet relativ til CM, viste ingen signifikant forskel ved en tovejs uparret t-test. Det ser dog måske ud som om, at der en tendens til en lavere ekspression af Kv1.3 i EM T-celler i forhold til CM T-celler. 73
75 Figur 29: Kv1.3 ekspression på protein niveau i Central Memory (CM) og Effector Memory (EM) T- celler. T-celler oprenset fra PBMCs blev aktiveret med CD3/CD28 beads og høstet efter 3 dages aktivering. Ikke aktiverede T-celler blev brugt som kontrol. Ekspressionen af Kv1.3 blev verificeret ved SDS-page og Western Blot, med et antistof imod Kv1.3 og kvantificeret ved pixel beregning i UN-SCAN-IT. A) Repræsentativt Western Blot for ekspressionen af Kv1.3. B) Kv1.3 ekspression (n= 1) i CM og EM T-celler. Resultaterne er vist relativt til Kontrollen. Der er en tendens til, at ekspressionen af Kv1.3 opreguleres i både CM og EM efter aktivering, sammenlignet med Kontrollen. C) Gennemsnitslig ekspression (n= 3) af Kv1.3 i aktiverede CM og EM T-celler. Resultaterne for EM er vist relativ til CM ±SEM. Der er en tendens til, at ekspressionen af Kv1.3 er lidt lavere i EM sammenlignet med CM. 4.5 Knockdown af TASK-2 med sirna For på længere sigt at undersøge betydningen af TASK-2 for en række parameter i T-celle aktivering, får vi brug for at lave knockdown af TASK-2, hvorfor nogle indledende forsøg blev foretaget. Figur 30 viser resultaterne på protein niveau for knockdown af TASK-2 med sirna i Jurkat celler. Forsøget var et testforsøg, der skulle undersøge hvilke transfektions-agenter (Lipofectamine, NeoFx eller Amine), der virker bedst, samt hvilke inkubationstider (60, 72, 84 og 96 timer), der giver den bedste knockdown. Som det ses på Figur 30, er der kun en nedregulering af TASK-2 efter 72 timer ved brug af Lipofectamine. Udover testen af transfektions-agenter og inkubationstider, blev der også lavet en test med forskellige koncentrationer af TASK-2 sirna (30 nm, 40 nm og 50 nm) for at se hvilke koncentrationer, der giver den bedste knockdown (se Figur 31). Dette blev gjort ved brug af Lipofectamine til tiden 72 timer. Der blev udover Kontrollen også lavet en negativ Kontrol (30 nm) for at sikre, at det ikke er transfektions-agenten der er skyld i nedreguleringen af TASK-2. Alle tre koncentrationer gav en nedregulering af ekspressionen af 74
76 TASK-2, men transfektionen med 50 nm gav den bedste knockdown, med en reduktion i ekspressionen på ca. 50 %. Figur 30: Ekspression af TASK-2 på protein niveau efter knockdown med sirna i Jurkat celler. Jurkat celler blev transfekteret med sirna for TASK-2 ved brug af forskellige transfektions-agenter (Lipofectamine (L), NeoFx (Fx) og Amine (A)) og inkuberet i 60-, 72-, 84- og 96 timer. Ekspressionen af TASK-2 blev verificeret ved SDS-page og Western Blot, med et antistof imod TASK-2 og kvantificeret ved pixel beregning i UN-SCAN-IT. Øverst er vist Western Blottet for ekspressionen af TASK-2 og nederst er vist resultaterne for pixelberegningen. Der ses kun en nedreguleringen af TASK-2 efter 72 timers inkubering med Lipofectamine. Figur 31: Knockdown af TASK-2 i Jurkat celler med forskellige koncentrationer af sirna. Jurkat celler blev transfekteret med forskellige koncentrationer af TASK-2 sirna ved brug af transfektions-agenten Lipofectamine og inkuberet i 72 timer. Ekspressionen af TASK-2 blev verificeret ved SDS-page og Western Blot, med et antistof imod TASK-2 og kvantificeret ved pixel beregning i UN-SCAN-IT. Øverst er vist Western Blottet for ekspressionen af TASK-2 og nederst er vist resultaterne for pixelberegningen. Den største nedregulering af TASK-2 ses ved en koncentration på 50nM. 75
77 4.6 Proliferation Proliferationen blev undersøgt ved at tælle de oprensede T-celle subtyper på dag 0 og igen efter 3 dages aktivering med CD3/CD28 beads. Ikke aktiverede T-celler blev brugt som Kontrol. Den gennemsnitslige % proliferation i forhold til dag 0 i de aktiverede T-celler og i Kontrolcellerne kan ses på figur 32A. Da der ikke var forsøg nok til at udføre en ANOVA test på hele forsøgssættet, blev der lavet en tovejs parret t-test på resultaterne med 3 n (Naive CD4, CD8 All og Naive CD8) i forhold til Kontrollen. Der ses en signifikant større % proliferation i Naive CD8 T-celler i forhold til Kontrolcellerne, med en ca. 300 % proliferation i forhold til dag 0. Naive CD4 og CD8 All er ikke signifikante, men er tæt på at være det (P < 0,07 og P < 0,08). Der ses ingen umiddelbar forøgelse i proliferationen i de forskellige Kontrolceller. Af de aktiverede T-celler ser det ud som om, at det er EM der har delt sig mest, men da resultatet kun er baseret på ét forsøg (Figur 32B), kan der ikke på baggrund af dette forsøg siges at være nogen tendens. Af de øvrige aktiverede T-celle subtyper er der en tendens til, at det er Naive CD8, som har delt sig mest. Af de andre aktiverede T-celle subtyper er det svært at sige, hvilke der har tendens til at have delt sig mest. Figur 32: T-celle proliferation efter aktivering med CD3/CD28 beads. T-celler oprenset fra PBMCs blev talt på dag 0 og igen efter 3 dages aktivering med CD3/CD28 beads. Ikke aktiverede T-celler blev brugt som kontrol. A) Den gennemsnitslige procent proliferation i forhold til dag 0. Da der ikke var forsøg nok til at udføre en ANOVA test, blev der lavet en tosidet parret t-test på resultater med 3 n. Der ses en signifikant proliferation i aktiverede Naive CD8 T-celler i forhold til Kontrolcellerne. B) Tabel over antal forsøg (n). P < 0,05 er vist med *. 76
78 Kapitel 5 Diskussion Formålet med dette speciale var at undersøge om K + - kanalen TASK-2 har en rolle i aktiveringen af T-celler. Bittner et al. [3] har vist at TASK-2 kan have en mulig rolle i aktiveringen af T-celler, mens Bobak et al. [4] har sat TASK-2 i forbindelse med volumenreguleringen af murine T-celler. TASK-2 er tidligere bevist at være involveret i volumenreguleringen af EATC [5], nyreceller [6] og spermatozoer [7]. Dermed kan TASK-2 s rolle i aktiverede T-celler også være i forbindelse med volumenreguleringen af de svulmede celler. I dette speciale er TASK-2 s mulige rolle i aktiveringen af T-celler blevet undersøgt ved at udføre målinger på humane T-celler oprenset fra Buffy Coats. Cellevolumen og volumenreguleringen, samt ekspressionen af TASK-2 på mrna og protein niveau er undersøgt efter aktivering med CD3/CD28 beads. Ekspressionen af TASK-2 blev ydermere undersøgt i forskellige T-celle subtyper for at se, om der var eventuelle forskelle i ekspressionen af TASK-2. Derudover blev ekspressionen af K + - kanalerne Kv1.3 og KCa3.1, der begge har en velkendt rolle i aktiveringen af T-celler [1,2], undersøgt for at se påvirkningen af aktivering med CD3/CD28 beads på ekspressionen. I de efterfølgende afsnit vil jeg fortolke og diskutere de opnåede resultater, samt sammenholde dem med hvad der tidligere er fundet. Generelt om forsøgsopsættet Et aspekt der er værd at bemærke inden de forskellige resultater diskuteres er, at T-cellerne blev oprenset fra forskellige donorer og dermed ikke stammede fra én cellelinje, hvilket kan have haft indflydelse på resultaterne i form af genetiske forskelle. Derudover kunne de enkelte donorer have haft en infektion, som også kan have haft indflydelse på homogeniteten, da nogle af T- cellerne fra disse personer allerede kunne være aktiveret. Af denne grund var der mulighed for, at K + - kanalerne kunne være forskelligt udtrykt og resultaterne dermed ville variere en del fra 77
79 hinanden. Dette er dog ikke vurderet til at være et væsentligt problem, idet der ikke sås de store forskelle imellem Kontrollerne. Effekten af aktivering på volumen og volumenregulering i humane T-celler Volumen- og volumenreguleringsforsøg viste efter 24 timer en signifikant større volumen hos de aktiverede T-celler i forhold til de ikke-aktiverede Kontrolceller, hvilket kan skyldes, at aktiverede T-celler prolifererer [23] og dermed må øge deres volumen inden de deler sig [72]. Derudover svulmede de aktiverede T-celler også mere end Kontrolcellerne i Hypoton Ringer, både når der sås på den absolutte og relative maksimale volumen. De aktiverede T-celler svulmede signifikant mere end Kontrolcellerne efter 24 timer, samt efter 3 og 6 dages aktivering (Figur 19), hvilket stemmer overens med øgningen i cellevolumen (Figur 17). Den øget maksimale svulmning kunne dermed se ud til at være sammenhængende med det øgede cellevolumen. T-celler aktiveret i 6 dage svulmede dog signifikant mindre end T-celler aktiveret i 3 dage, uden at cellevolumen så ud til at være gået ned igen. Dette kunne tyde på, at der er sket en opregulering af nogle af de ionkanaler der indgår i RVD responset, herunder K + - og Cl - - kanaler [72]. Da der sås en signifikant opregulering af TASK-2 på protein niveau i de aktiverede T-celler efter 3 og 6 dages aktivering, kunne TASK-2 måske være årsag til den lavere svulmning i de aktiverede T-celler efter 6 dages aktivering ved at indgå i RVD responset. At TASK-2 kanalerne ikke allerede var effektive efter 3 dages aktivering kunne skyldtes, at kanalerne endnu ikke var kommet ud i membranen. Udover at svulme mere blev de aktiverede T-celler samtidigt dårligere til at volumenregulere i forhold til Kontrolcellerne, både når der sås på % tilbageregulering efter 3 min (Figur 20A) og når der sås på den relative tilbagereguleringshastighed (Figur 21C). De aktiverede T-celler blev signifikant dårligere til at udføre RVD efter 24 timer, samt efter 3 og 6 dages aktivering, når det blev bedømt som % tilbageregulering efter 3 min, hvilket igen passer med den signifikante øgning i cellevolumen. Den relative tilbagereguleringshastighed i aktiverede T-celler blev derimod signifikant langsommere efter 12 og 24 timers aktivering i forhold til Kontrollen. Tilbagereguleringshastigheden i de aktiverede T-celler så ud til at blive hurtigere igen efter 3 og 6 dages 78
80 aktivering, hvilket kunne skyldtes opreguleringen af TASK-2, der som nævnt ovenfor blev signifikant opreguleret på protein niveau efter 3 dage og 6 dages aktivering. Da TASK-2 er vist at være involveret i volumenreguleringen af EATC [5], nyreceller [6] og spermatozoer [7], samt fornylig at være involveret i volumenreguleringen af murine T-celler [4], er det usandsynligt at opreguleringen af TASK-2 kunne være årsag til, at de aktiverede T-celler blev dårligere til at udføre RVD ved et øgede cellevolumen. Det er derfor muligt at opreguleringen af TASK-2 snarere var en konsekvens af det øgede cellevolumen. På baggrund heraf kan opreguleringen af TASK-2 i aktiverede T-celler måske først og fremmest være vigtig, fordi den muligvis indgår i volumenreguleringen af de svulmede celler. Initial nedgang i antallet af celler Jeg fandt en initial nedgang i antallet af aktiverede T-celler efter 2 og 4 timers aktivering, selvom det samme volumen af cellesuspension var udtaget. Derudover sås der også et lavere protein indhold i lysaterne for tiderne 2 og 4 timer, hvilket også kunne tyde på et mindre antal celler. Den initiale nedgang i antallet af aktiverede T-celler kunne måske skyldes apoptose, da T-celler der ikke aktiveres korrekt går i apoptose [104]. Om dette er tilfældet skal undersøges ved et apoptose assay. En anden mulig årsag kunne være, at nogle af T-cellerne blev siddende tilbage på de magnetiske beads, når cellesuspensionen blev suget fra, hvilket ville resultere i et lavere antal celler. Dette vurderes dog ikke at være grunden i dette studie, da et lavere antal celler kun sås for tiderne 2 og 4 timer efter aktivering. Efter ca. 8 timer kom antallet af aktiverede T-celler på niveau med Kontrolcellerne, hvilket skyldtes de aktiverede T-cellers proliferation [23]. Opregulering af TASK-2 på mrna- og protein niveau i aktiverede T-celler TASK-2 ekspressionen i de aktiverede T-celler sammenlignet med Kontrolcellerne viste en opregulering af TASK-2 på både mrna- og protein niveau (Figur 22 og 25), hvilket er i overensstemmelse med hvad Bittner et al. har vist [3]. Ekspressionen af TASK-2 var signifikant 79
81 opreguleret på mrna niveau efter 24 timers aktivering med en ca. 114 folds forøgelse, samt på protein niveau efter 3 dages aktivering med en ca. 3 folds forøgelse og efter 6 dages aktivering med en ca. 2 folds forøgelse. Denne tidsmæssige forskydning mellem mrna- og proteinmålingerne passer fint i forhold til, at protein skal translateres fra mrna, før det kan blive udtrykt i cellen [105]. Som nævnt ovenfor stemte opregulering af TASK-2 ekspressionen overens med perioden, hvor de aktiverede T-celler blev større. Det kunne tænkes, at opreguleringen af TASK-2 ekspressionen er en kompensation for det øgede cellevolumen. Bittner et al. viste at antallet af TASK-2 kanaler pr. overflade-areal blev forøget i aktiverede T-celler [3]. På baggrund heraf og den store forøgelse i ekspressionen af TASK-2 på både mrna- og protein niveau er det sandsynligt, at antallet af TASK-2 kanaler pr. overfladeareal forøges. Ekspressionen af KCa3.1 og Kv1.3 i aktiverede T-celler Ved undersøgelsen af ekspressionen af de to velkendte K + -kanaler, involveret i aktiveringen af T- celler, sås en opregulering af KCa3.1 på mrna niveau efter 3 og 6 dages aktivering (Figur 24), mens ekspressionen af Kv1.3 forblev uændret både på mrna- og protein niveau (Figur 23 og 26). Dette stemmer overens med tidligere forsøg, hvor det er ekspressionen af KCa3.1 der opreguleres, når naive T-celler differentierer til effekter T-celler [57]. Tendensen til en stigning i ekspressionen af Kv1.3 på protein niveau efter 3 dages aktivering kunne skyldtes, at forsøgene blev lavet på T-celler som en samlet population, hvoraf nogle var Effector Memory T-celler, der ved aktivering opregulerer ekspressionen af Kv1.3 [57]. TASK-2 ekspression i forskellige T-celle subtyper Der sås en signifikant opregulering af TASK-2 ekspressionen på protein niveau i aktiverede CD4 All, Naive CD4 og Naive CD8 i forhold til Kontrolcellerne (Figur 27). Derudover sås der en stærk tendens til, at de aktiverede CD8 All også opregulerede TASK-2 i forhold til Kontrollen. Pga. tidspres nåede jeg desværre ikke at udføre forsøg nok til, at der kunne laves en ANOVA test på hele forsøgssættet, så der kunne testes for hvilke af de aktiverede T-celle subtyper, der havde 80
82 opreguleret ekspressionen af TASK-2 mest. Det så dog ud som om, der var en tendens til, at CD8 All og Naive CD8 havde opreguleret ekspressionen af TASK-2 mest. Dette passer med forsøg lavet af Bittner et al., som også viste en tendens til, at det var CD8 + T-celler der havde opreguleret ekspressionen af TASK-2 mest efter aktivering [3]. De aktiverede T-celle subtyper Central Memory (CM) og Effector Memory (EM) så også ud til at have opreguleret ekspressionen af TASK-2 på protein niveau i forhold til Kontrolcellerne (Figur 28B), men da der kun er udført ét forsøg, skal der laves flere forsøg for, at der kan konkluderes noget om ekspressionen af TASK-2. Sammenligningen mellem aktiverede CM og EM viste ingen forskel i ekspressionen af TASK-2 på protein niveau (Figur 28C), men der sås en stor spredning på resultatet. Sås der på de enkelte resultater var ekspressionen af TASK-2 i EM opreguleret på to ud af de tre resultater i forhold til ekspressionen af TASK-2 i CM, hvilket kunne tyde på, at ekspressionen af TASK-2 var mest opreguleret i EM. Det er dog svært at konkludere noget på baggrund af disse resultater. Forsøg lavet af Bittner et al. viste en tendens til, at det var CM der havde opreguleret TASK-2 mest [3], men dette resultat er på mrna niveau efter 2 dages aktivering. Det er dermed ikke til at sige, hvad der er tilfældet, før der er udført flere forsøg. EM T-celler adskiller sig fra CM T-celler ved ikke at home til lymfoidt væv og dermed kan de udføre deres effekter funktioner direkte i det inflammerede væv [20]. EM T-celler opregulerer Kv1.3 i stedet for KCa3.1 ved aktivering [57]. Hvis det viser sig, at det er EM T-celler der har den højeste ekspressionen af TASK-2, samt er afhængige af denne opregulering for at kunne udføre deres effekter funktioner, er det interessant, da EM T-celler er vist at være involveret i inflammationen af flere autoimmune sygdomme, inkl. Multipel Sklerose [8]. TASK-2 kunne dermed være et muligt mål i behandlingen af autoimmune sygdomme, hvor EM T-celler er involveret i patogenesen. Kv1.3 ekspression i Central Memory og Effector Memory T-celler Resultatet fra det ene forsøg, hvor Kv1.3 ekspressionen på protein niveau i aktiverede CM og EM T-celler blev undersøgt i forhold til Kontrolcellerne, viste en tendens til, at begge subtyper havde opreguleret ekspressionen af Kv1.3 (Figur 29B). Tidligere forsøg har dog vist, at det kun er EM T- 81
83 celler der opregulerer Kv1.3 ved aktivering [57]. Sammenligningen mellem aktiverede CM og EM T- celler viste ingen forskel i ekspressionen af Kv1.3 på protein niveau (Figur 29C), men der sås en tendens til, at det var CM T-cellerne der havde den højeste ekspression af Kv1.3. Dette er i modstrid med tidligere forsøg, der viste at EM T-celler opregulerer deres antal af Kv1.3 kanaler ved aktivering, mens antallet af Kv1.3 kanaler i CM T-celler forbliver uændret ved aktivering [57]. Dog er resultatet i denne rapport kun baseret på 3 forsøg, hvoraf der er en stor spredning på resultatet. Knockdown med sirna Den inkubationstid (72 timer), transfektions-agent (Lipofectamine), samt koncentration (50nM) af sirna for TASK-2 der blev fundet ved testforsøg på Jurkat celler (Figur 30 og 31), blev afprøvet af ph.d.-studerende Signe S. Kirkegaard på humane T-celler, indtil videre uden held. Dermed mangler der et vigtigt aspekt i at afgøre om TASK-2 har en rolle i aktiveringen af T-celler, eller har en anden rolle i forbindelse med aktiveringen, herunder volumenregulering. Det er lykkedes Bittner et al. at lave knockdown af TASK-2 i humane T-celler, hvilket resulteret i nedsat proliferation af T-cellerne [3]. Dog kunne knockdown af TASK-2 kun vises på RNA niveau og ikke på protein niveau, hvilket gør deres resultat lidt tvivlsomt. Proliferation i T-celle subtyper efter aktivering med CD3/CD28 beads Ved aktivering med CD3/CD28 beads sås en signifikant forøget proliferation af Naive CD8 T-celler, sammenlignet med Kontrolcellerne der ikke prolifererede. De andre aktiverede T-celle subtyper viste ingen signifikant forøget proliferation sammenlignet med Kontrolcellerne, men forøgelsen i proliferation var dog tæt på at være signifikant, hvilket også er sandsynligt, da et af kendetegnene for aktiverede T-celler er at de prolifererer [23]. Proliferationen i de aktiverede T-celler var dermed et bevis på, at T-cellerne var blevet aktiveret med CD3/CD28 beads. Det er muligt at opreguleringen af TASK-2 er vigtig for proliferationen af de aktiverede T-celler, fordi flere K + - kanaler vil føre til en hyperpolarisering af cellen. Dette vides ikke, men kunne undersøges nærmere. 82
84 Kapitel 6 Fremtidige eksperimenter Som videre eksperimenter skal der udføres flere forsøg på T-celle subtyperne, så der kan laves en ANOVA test på forsøgssættet og det dermed kan afgøres, hvilke af subtyperne der opregulerer ekspressionen af TASK-2 mest ved aktivering med CD3/CD28 beads. Der skal laves et apoptose assay for at kunne afgøre, om det initiale lavere antal celler skyldes apoptose. Dette kan være ved et caspase-3 assay, hvor caspase 3 aktiviteteten undersøges. På baggrund af resultaterne i dette speciale er det vist, at ekspressionen af TASK-2 opreguleres i aktiverede T-celler. Dog er den præcise rolle for TASK-2 i aktiverede T-celler ikke klarlagt og der må derfor laves flere forsøg, for at kunne afgøre om TASK-2 har en rolle i aktiveringen af humane T- celler. Dette kunne være en knockdown eller opregulering af TASK-2 ekspressionen, for at se indvirkningen på volumenforøgelsen, proliferationen og evt. cytokinproduktionen, da disse er parametre for aktiverede T-celler. Derudover ville det være oplagt at lave et biotinylerings assay for at se, om den opregulerede ekspression af TASK-2 er udtrykt som funktionelle TASK-2 kanaler i plasmamembranen. En forøgelse af TASK-2 kanaler i membranen vil føre til en hyperpolarisering af T-cellerne, og det kunne dermed også være interessant at undersøge om en sådan hyperpolarisering finder sted og om den er vigtig for induktionen af proliferation i de aktiverede T celler Hvis det viser sig at TASK-2 har en rolle i aktiveringen af humane T-celler, kunne det være interessant at finde nogle specifikke inhibitorer eller antistoffer imod TASK-2 kanalen, som en mulig behandling af autoimmune sygdomme, som Multipel Sklerose, hvor T-celler er årsag til inflammationen af det involveret væv. 83
85 Kapitel 7 Konklusion Ud fra resultaterne præsenteret i dette speciale er det vist, at TASK-2 ekspressionen opreguleres signifikant i aktiverede T-celler i løbet af 24 timer på mrna niveau og 3 dage på protein niveau, hvilket tyder på, at TASK-2 har en betydning for aktiverede T-celler. Det blev også vist, at de aktiverede T-celler bliver dårligere til at udføre RVD efter de har øget deres cellevolumen i løbet af 24 timer, hvilket opreguleringen af TASK-2 ikke kan være årsag til, da TASK-2 tidligere er vist at være involveret i volumenreguleringen af EATC, nyreceller, spermatozoer og murine T-celler. Det er derfor muligt, at opreguleringen af TASK-2 snarere er en konsekvens af det øgede cellevolumen. T-celler aktiveret i 6 dage svulmer signifikant mindre i Hypoton Ringer, sammenlignet med T-celler aktiveret i 3 dage, uden at cellevolumen ser ud til at være blevet mindre igen. Dette tyder på, at der er sket en opregulering af ionkanaler involveret i RVD, hvilket evt. kunne være TASK-2, da den er signikant opreguleret efter 3 og 6 dage, samt tidligere er vist at være involveret i cellevolumenregulering. TASK-2 s mulige rolle i aktiverede T-celler kan dermed også være i volumenreguleringen af de svulmede T-celler. Der skal dog laves flere forsøg, herunder gerne knockdown eller opregulering af TASK-2 ekspressionen, før at det kan afgøres om TASK-2 har en rolle i aktiveringen af humane T-celler, eller/og er involveret i volumenreguleringen. 84
86 Referenceliste Reference List 1. DeCoursey TE, Chandy KG, Gupta S, Cahalan MD (1984) Voltage-gated K+ channels in human T lymphocytes: a role in mitogenesis? Nature 307: Ghanshani S, Wulff H, Miller MJ, Rohm H, Neben A, Gutman GA, Cahalan MD, Chandy KG (2000) Up-regulation of the IKCa1 potassium channel during T-cell activation. Molecular mechanism and functional consequences. J Biol Chem 275: /jbc.M [doi];m [pii]. 3. Bittner S, Bobak N, Herrmann AM, Gobel K, Meuth P, Hohn KG, Stenner MP, Budde T, Wiendl H, Meuth SG (2010) Upregulation of K2P5.1 potassium channels in multiple sclerosis. Ann Neurol 68: /ana [doi]. 4. Bobak N, Bittner S, Andronic J, Hartmann S, Muhlpfordt F, Schneider-Hohendorf T, Wolf K, Schmelter C, Gobel K, Meuth P, Zimmermann H, Doring F, Wischmeyer E, Budde T, Wiendl H, Meuth SG, Sukhorukov VL (2011) Volume regulation of murine T lymphocytes relies on voltage-dependent and two-pore domain potassium channels. Biochim Biophys Acta 1808: S (11) [pii]; /j.bbamem [doi]. 5. Riquelme G, Sepulveda FV, Jorgensen F, Pedersen S, Hoffmann EK (1998) Swelling-activated potassium currents of Ehrlich ascites tumour cells. Biochim Biophys Acta 1371: S (98) [pii]. 6. Barriere H, Belfodil R, Rubera I, Tauc M, Lesage F, Poujeol C, Guy N, Barhanin J, Poujeol P (2003) Role of TASK2 potassium channels regarding volume regulation in primary cultures of mouse proximal tubules. J Gen Physiol 122: /jgp [doi];jgp [pii]. 7. Barfield JP, Yeung CH, Cooper TG (2005) The effects of putative K+ channel blockers on volume regulation of murine spermatozoa. Biol Reprod 72: biolreprod [pii]; /biolreprod [doi]. 8. Wulff H, Calabresi PA, Allie R, Yun S, Pennington M, Beeton C, Chandy KG (2003) The voltagegated Kv1.3 K(+) channel in effector memory T cells as new target for MS. J Clin Invest 111: /JCI16921 [doi]. 9. Cahalan MD, Chandy KG (1997) Ion channels in the immune system as targets for immunosuppression. Curr Opin Biotechnol 8: S (97) [pii]. 10. Picca CC, Larkin J, III, Boesteanu A, Lerman MA, Rankin AL, Caton AJ (2006) Role of TCR specificity in CD4+ CD25+ regulatory T-cell selection. Immunol Rev 212: IMR416 [pii]; /j x [doi]. 11. Littman DR, Rudensky AY (2010) Th17 and regulatory T cells in mediating and restraining inflammation. Cell 140: S (10) [pii]; /j.cell [doi]. 85
87 12. Starr TK, Jameson SC, Hogquist KA (2003) Positive and negative selection of T cells. Annu Rev Immunol 21: /annurev.immunol [doi]; [pii]. 13. Itano AA, Jenkins MK (2003) Antigen presentation to naive CD4 T cells in the lymph node. Nat Immunol 4: /ni957 [doi];ni957 [pii]. 14. Huang G, Wang Y, Chi H (2012) Regulation of T(H)17 cell differentiation by innate immune signals. Cell Mol Immunol 9: cmi [pii]; /cmi [doi]. 15. Abbas AK, Murphy KM, Sher A (1996) Functional diversity of helper T lymphocytes. Nature 383: /383787a0 [doi]. 16. Watanabe N, Wang YH, Lee HK, Ito T, Wang YH, Cao W, Liu YJ (2005) Hassall's corpuscles instruct dendritic cells to induce CD4+CD25+ regulatory T cells in human thymus. Nature 436: nature03886 [pii]; /nature03886 [doi]. 17. Fantini MC, Becker C, Monteleone G, Pallone F, Galle PR, Neurath MF (2004) Cutting edge: TGFbeta induces a regulatory phenotype in CD4+. J Immunol 172: Doherty PC, Allan W, Eichelberger M, Carding SR (1992) Roles of alpha beta and gamma delta T cell subsets in viral immunity. Annu Rev Immunol 10: /annurev.iy [doi]. 19. Andersen MH, Schrama D, Thor SP, Becker JC (2006) Cytotoxic T cells. J Invest Dermatol 126: [pii]; /sj.jid [doi]. 20. Sallusto F, Lenig D, Forster R, Lipp M, Lanzavecchia A (1999) Two subsets of memory T lymphocytes with distinct homing potentials and effector functions. Nature 401: /44385 [doi]. 21. Swain SL, Croft M, Dubey C, Haynes L, Rogers P, Zhang X, Bradley LM (1996) From naive to memory T cells. Immunol Rev 150: Badovinac VP, Messingham KA, Jabbari A, Haring JS, Harty JT (2005) Accelerated CD8+ T-cell memory and prime-boost response after dendritic-cell vaccination. Nat Med 11: nm1257 [pii]; /nm1257 [doi]. 23. Gudmundsdottir H, Wells AD, Turka LA (1999) Dynamics and requirements of T cell clonal expansion in vivo at the single-cell level: effector function is linked to proliferative capacity. J Immunol 162: Smith-Garvin JE, Koretzky GA, Jordan MS (2009) T cell activation. Annu Rev Immunol 27: /annurev.immunol [doi]; /annurev.immunol [pii]. 25. Yanagi Y, Yoshikai Y, Leggett K, Clark SP, Aleksander I, Mak TW (1984) A human T cell-specific cdna clone encodes a protein having extensive homology to immunoglobulin chains. Nature 308:
88 26. Hedrick SM, Cohen DI, Nielsen EA, Davis MM (1984) Isolation of cdna clones encoding T cellspecific membrane-associated proteins. Nature 308: Call ME, Wucherpfennig KW (2007) Common themes in the assembly and architecture of activating immune receptors. Nat Rev Immunol 7: nri2186 [pii]; /nri2186 [doi]. 28. Davis MM (1990) T cell receptor gene diversity and selection. Annu Rev Biochem 59: /annurev.bi [doi]. 29. Weiss A, Stobo JD (1984) Requirement for the coexpression of T3 and the T cell antigen receptor on a malignant human T cell line. J Exp Med 160: Weiss A, Wiskocil RL, Stobo JD (1984) The role of T3 surface molecules in the activation of human T cells: a two-stimulus requirement for IL 2 production reflects events occurring at a pretranslational level. J Immunol 133: Meuer SC, Hodgdon JC, Hussey RE, Protentis JP, Schlossman SF, Reinherz EL (1983) Antigen-like effects of monoclonal antibodies directed at receptors on human T cell clones. J Exp Med 158: Schwartz RH (1985) T-lymphocyte recognition of antigen in association with gene products of the major histocompatibility complex. Annu Rev Immunol 3: /annurev.iy [doi]. 33. Samelson LE, Phillips AF, Luong ET, Klausner RD (1990) Association of the fyn protein-tyrosine kinase with the T-cell antigen receptor. Proc Natl Acad Sci U S A 87: Marchildon GA, Casnellie JE, Walsh KA, Krebs EG (1984) Covalently bound myristate in a lymphoma tyrosine protein kinase. Proc Natl Acad Sci U S A 81: Timson Gauen LK, Kong AN, Samelson LE, Shaw AS (1992) p59fyn tyrosine kinase associates with multiple T-cell receptor subunits through its unique amino-terminal domain. Mol Cell Biol 12: Barber EK, Dasgupta JD, Schlossman SF, Trevillyan JM, Rudd CE (1989) The CD4 and CD8 antigens are coupled to a protein-tyrosine kinase (p56lck) that phosphorylates the CD3 complex. Proc Natl Acad Sci U S A 86: Isakov N, Wange RL, Samelson LE (1994) The role of tyrosine kinases and phosphotyrosinecontaining recognition motifs in regulation of the T cell-antigen receptor-mediated signal transduction pathway. J Leukoc Biol 55: Billadeau DD, Leibson PJ (2002) ITAMs versus ITIMs: striking a balance during cell regulation. J Clin Invest 109: /JCI14843 [doi]. 39. Samelson LE, Klausner RD (1992) Tyrosine kinases and tyrosine-based activation motifs. Current research on activation via the T cell antigen receptor. J Biol Chem 267:
89 40. Isakov N, Wange RL, Burgess WH, Watts JD, Aebersold R, Samelson LE (1995) ZAP-70 binding specificity to T cell receptor tyrosine-based activation motifs: the tandem SH2 domains of ZAP-70 bind distinct tyrosine-based activation motifs with varying affinity. J Exp Med 181: Wange RL, Kong AN, Samelson LE (1992) A tyrosine-phosphorylated 70-kDa protein binds a photoaffinity analogue of ATP and associates with both the zeta chain and CD3 components of the activated T cell antigen receptor. J Biol Chem 267: Zhang W, Sloan-Lancaster J, Kitchen J, Trible RP, Samelson LE (1998) LAT: the ZAP-70 tyrosine kinase substrate that links T cell receptor to cellular activation. Cell 92: S (00) [pii]. 43. Bubeck WJ, Fu C, Jackman JK, Flotow H, Wilkinson SE, Williams DH, Johnson R, Kong G, Chan AC, Findell PR (1996) Phosphorylation of SLP-76 by the ZAP-70 protein-tyrosine kinase is required for T-cell receptor function. J Biol Chem 271: Sommers CL, Samelson LE, Love PE (2004) LAT: a T lymphocyte adapter protein that couples the antigen receptor to downstream signaling pathways. Bioessays 26: /bies [doi]. 45. Koretzky GA, Abtahian F, Silverman MA (2006) SLP76 and SLP65: complex regulation of signalling in lymphocytes and beyond. Nat Rev Immunol 6: nri1750 [pii]; /nri1750 [doi]. 46. Beach D, Gonen R, Bogin Y, Reischl IG, Yablonski D (2007) Dual role of SLP-76 in mediating T cell receptor-induced activation of phospholipase C-gamma1. J Biol Chem 282: M [pii]; /jbc.m [doi]. 47. Qi Q, August A (2007) Keeping the (kinase) party going: SLP-76 and ITK dance to the beat. Sci STKE 2007: e39. stke pe39 [pii]; /stke pe39 [doi]. 48. Genot E, Cantrell DA (2000) Ras regulation and function in lymphocytes. Curr Opin Immunol 12: S (00) [pii]. 49. Roose JP, Mollenauer M, Ho M, Kurosaki T, Weiss A (2007) Unusual interplay of two types of Ras activators, RasGRP and SOS, establishes sensitive and robust Ras activation in lymphocytes. Mol Cell Biol 27: MCB [pii]; /mcb [doi]. 50. Hayashi K, Altman A (2007) Protein kinase C theta (PKCtheta): a key player in T cell life and death. Pharmacol Res 55: S (07) [pii]; /j.phrs [doi]. 51. Schulze-Luehrmann J, Ghosh S (2006) Antigen-receptor signaling to nuclear factor kappa B. Immunity 25: S (06) [pii]; /j.immuni [doi]. 52. Thome M (2004) CARMA1, BCL-10 and MALT1 in lymphocyte development and activation. Nat Rev Immunol 4: /nri1352 [doi];nri1352 [pii]. 88
90 53. Savignac M, Mellstrom B, Naranjo JR (2007) Calcium-dependent transcription of cytokine genes in T lymphocytes. Pflugers Arch 454: /s y [doi]. 54. Schwartz RH, Mueller DL, Jenkins MK, Quill H (1989) T-cell clonal anergy. Cold Spring Harb Symp Quant Biol 54 Pt 2: Acuto O, Michel F (2003) CD28-mediated co-stimulation: a quantitative support for TCR signalling. Nat Rev Immunol 3: /nri1248 [doi];nri1248 [pii]. 56. Ward SG (1996) CD28: a signalling perspective. Biochem J 318 ( Pt 2): Cahalan MD, Chandy KG (2009) The functional network of ion channels in T lymphocytes. Immunol Rev 231: IMR816 [pii]; /j x x [doi]. 58. Price M, Lee SC, Deutsch C (1989) Charybdotoxin inhibits proliferation and interleukin 2 production in human peripheral blood lymphocytes. Proc Natl Acad Sci U S A 86: Goldstein SA, Bockenhauer D, O'Kelly I, Zilberberg N (2001) Potassium leak channels and the KCNK family of two-p-domain subunits. Nat Rev Neurosci 2: / [doi]. 60. Enyedi P, Czirjak G (2010) Molecular background of leak K+ currents: two-pore domain potassium channels. Physiol Rev 90: /2/559 [pii]; /physrev [doi]. 61. Lesage F, Lazdunski M (2000) Molecular and functional properties of two-pore-domain potassium channels. Am J Physiol Renal Physiol 279: F793-F Pathan AR, Rusch NJ (2011) Two-pore domain K(+) channels: evidence for TWIK-2 in blood pressure regulation. Hypertension 58: HYPERTENSIONAHA [pii]; /hypertensionaha [doi]. 63. Duprat F, Lesage F, Fink M, Reyes R, Heurteaux C, Lazdunski M (1997) TASK, a human background K+ channel to sense external ph variations near physiological ph. EMBO J 16: /emboj/ [doi]. 64. Reyes R, Duprat F, Lesage F, Fink M, Salinas M, Farman N, Lazdunski M (1998) Cloning and expression of a novel ph-sensitive two pore domain K+ channel from human kidney. J Biol Chem 273: Niemeyer MI, Hougaard C, Hoffmann EK, Jorgensen F, Stutzin A, Sepulveda FV (2000) Characterisation of a cell swelling-activated K+-selective conductance of ehrlich mouse ascites tumour cells. J Physiol 524 Pt 3: PHY_0526 [pii]. 66. Hougaard C, Jorgensen F, Hoffmann EK (2001) Modulation of the volume-sensitive K+ current in Ehrlich ascites tumour cells by ph. Pflugers Arch 442: Niemeyer MI, Cid LP, Barros LF, Sepulveda FV (2001) Modulation of the two-pore domain acidsensitive K+ channel TASK-2 (KCNK5) by changes in cell volume. J Biol Chem 276: /jbc.M [doi];m [pii]. 89
91 68. Christensen O, Hoffmann EK (1992) Cell swelling activates K+ and Cl- channels as well as nonselective, stretch-activated cation channels in Ehrlich ascites tumor cells. J Membr Biol 129: Jorgensen NK, Lambert IH, Hoffmann EK (1996) Role of LTD4 in the regulatory volume decrease response in Ehrlich ascites tumor cells. J Membr Biol 151: Niemeyer MI, Stutzin A, Sepulveda FV (2002) A voltage-independent K+ conductance activated by cell swelling in Ehrlich cells is modulated by a G-protein-mediated process. Biochim Biophys Acta 1562: 1-5. S [pii]. 71. Kirkegaard SS, Lambert IH, Gammeltoft S, Hoffmann EK (2010) Activation of the TASK-2 channel after cell swelling is dependent on tyrosine phosphorylation. Am J Physiol Cell Physiol 299: C844-C853. ajpcell [pii]; /ajpcell [doi]. 72. Hoffmann EK, Lambert IH, Pedersen SF (2009) Physiology of cell volume regulation in vertebrates. Physiol Rev 89: /1/193 [pii]; /physrev [doi]. 73. Lang F (2007) Mechanisms and significance of cell volume regulation. J Am Coll Nutr 26: 613S- 623S. 26/suppl_5/613S [pii]. 74. Hoffmann EK, Pedersen SF (2011) Cell volume homeostatic mechanisms: effectors and signalling pathways. Acta Physiol (Oxf) 202: /j x [doi]. 75. DuBois JM, Rouzaire-Dubois B (2004) The influence of cell volume changes on tumour cell proliferation. Eur Biophys J 33: /s [doi]. 76. Grinstein S, Foskett JK (1990) Ionic mechanisms of cell volume regulation in leukocytes. Annu Rev Physiol 52: /annurev.ph [doi]. 77. Khanna R, Chang MC, Joiner WJ, Kaczmarek LK, Schlichter LC (1999) hsk4/hik1, a calmodulinbinding KCa channel in human T lymphocytes. Roles in proliferation and volume regulation. J Biol Chem 274: Grinstein S, Rothstein A, Sarkadi B, Gelfand EW (1984) Responses of lymphocytes to anisotonic media: volume-regulating behavior. Am J Physiol 246: C204-C Kuzuya T, Nakagawa S, Satoh J, Kanazawa Y, Iwamoto Y, Kobayashi M, Nanjo K, Sasaki A, Seino Y, Ito C, Shima K, Nonaka K, Kadowaki T (2002) Report of the Committee on the classification and diagnostic criteria of diabetes mellitus. Diabetes Res Clin Pract 55: S [pii]. 80. Compston A, Coles A (2008) Multiple sclerosis. Lancet 372: S (08) [pii]; /s (08) [doi]. 81. Sospedra M, Martin R (2005) Immunology of multiple sclerosis. Annu Rev Immunol 23: /annurev.immunol [doi]. 82. Lublin FD, Reingold SC (1996) Defining the clinical course of multiple sclerosis: results of an international survey. National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis. Neurology 46:
92 83. Dyment DA, Ebers GC, Sadovnick AD (2004) Genetics of multiple sclerosis. Lancet Neurol 3: S X [pii]. 84. Ascherio A, Munger KL (2007) Environmental risk factors for multiple sclerosis. Part I: the role of infection. Ann Neurol 61: /ana [doi]. 85. Ascherio A, Munger KL (2007) Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors. Ann Neurol 61: /ana [doi]. 86. Salzer JL, Brophy PJ, Peles E (2008) Molecular domains of myelinated axons in the peripheral nervous system. Glia 56: /glia [doi]. 87. Allegretta M, Nicklas JA, Sriram S, Albertini RJ (1990) T cells responsive to myelin basic protein in patients with multiple sclerosis. Science 247: Zhang J, Markovic-Plese S, Lacet B, Raus J, Weiner HL, Hafler DA (1994) Increased frequency of interleukin 2-responsive T cells specific for myelin basic protein and proteolipid protein in peripheral blood and cerebrospinal fluid of patients with multiple sclerosis. J Exp Med 179: Langrish CL, Chen Y, Blumenschein WM, Mattson J, Basham B, Sedgwick JD, McClanahan T, Kastelein RA, Cua DJ (2005) IL-23 drives a pathogenic T cell population that induces autoimmune inflammation. J Exp Med 201: jem [pii]; /jem [doi]. 90. Martino G, Furlan R, Brambilla E, Bergami A, Ruffini F, Gironi M, Poliani PL, Grimaldi LM, Comi G (2000) Cytokines and immunity in multiple sclerosis: the dual signal hypothesis. J Neuroimmunol 109: 3-9. S (00) [pii]. 91. Imitola J, Chitnis T, Khoury SJ (2005) Cytokines in multiple sclerosis: from bench to bedside. Pharmacol Ther 106: S (04) [pii]; /j.pharmthera [doi]. 92. Szczucinski A, Losy J (2007) Chemokines and chemokine receptors in multiple sclerosis. Potential targets for new therapies. Acta Neurol Scand 115: ANE749 [pii]; /j x [doi]. 93. Compston A, Coles A (2002) Multiple sclerosis. Lancet 359: S (02)08220-X [pii]; /s (02)08220-x [doi]. 94. Schneider U, Schwenk HU, Bornkamm G (1977) Characterization of EBV-genome negative "null" and "T" cell lines derived from children with acute lymphoblastic leukemia and leukemic transformed non-hodgkin lymphoma. Int J Cancer 19: Graham MD (2003) The Coulter Counter Principle: Foundation of an Industry. JALA 8: [Anonymous] (2012) Vanguilder HD, Vrana KE, Freeman WM (2008) Twenty-five years of quantitative PCR for gene expression analysis. Biotechniques 44: [pii]; / [doi]. 91
93 98. [Anonymous] (2007) Øvelsesvejledning Genteknologi 2, Institut for Molekylær Biologi. 99. Lundby C, Nordsborg N, Kusuhara K, Kristensen KM, Neufer PD, Pilegaard H (2005) Gene expression in human skeletal muscle: alternative normalization method and effect of repeated biopsies. Eur J Appl Physiol 95: /s [doi] Lowry OH, ROSEBROUGH NJ, FARR AL, RANDALL RJ (1951) Protein measurement with the Folin phenol reagent. J Biol Chem 193: Peterson GL (1979) Review of the Folin phenol protein quantitation method of Lowry, Rosebrough, Farr and Randall. Anal Biochem 100: Foed C, Frøkjær S, Nielsen HM (2006) sirna- fremtidens lægemidler? Dansk Kemi 87: Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC (1998) Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391: /35888 [doi] Wang R, Xie H, Huang Z, Shang W, Sun Z (2012) Developing and activated T cell survival depends on differential signaling pathways to regulate anti-apoptotic Bcl-x(L). Clin Dev Immunol 2012: /2012/ [doi] Sonenberg N, Hinnebusch AG (2009) Regulation of translation initiation in eukaryotes: mechanisms and biological targets. Cell 136: S (09) [pii]; /j.cell [doi]. 92
94 Appendiks A: Opløsninger, buffere og medier PBS: - 16g NaCl - 0,4g KCl - 2,3g Na 2 HPO 4 TBST: - 10 ml 1M Tris/CHI ph 7,5 (10mM final) ml 1,5M NaCl (120mM NaCl final) - 1 ml Tween 20, 0,1 % final - 0,4g KH 2 PO 4 - ddh 2 O 2000 ml - ph 7,4 Blocking buffer - 50 ml TBST - 2,5g tørmælk Lysis buffer - ddh 2 O 100 ml - 150mM NaCl - 20mM Hepes - 1mM EDTA - 10 % Glycerol - 0,5 % Triton X-100-0,5 % SDS - ddh2o 50 ml - 1 tablet protease inhibitor pr. 10 ml - På dagen for eksperimentet tilsættes: 1mM NaVO3 DTT: - 770mg Dithiothreitol - ddh2o 10 ml T-celle medie - RPMI GlutaMaxTM-I (Invitrogen, Gibco; Cat: ) 500 ml - 10 % FBS - 1 % P/l - 30 units IL-2 Jurkat celle medie - RPMI GlutaMax TM -I (Invitrogen, Gibco; Cat: ) 500 ml - 10 % FBS - 10 mm Hepes - 1 mm Na-pyruvat - 1 % P/S - 1 g glucose 93
95 +/- medie - RPMI GlutaMax TM -I (Invitrogen, Gibco; Cat: ) 500 ml - 10 mm Hepes - 1 mm Na-pyruvat -/- medie - RPMI GlutaMaxTM-I (Invitrogen, Gibco; Cat: ) 500 ml - 1 g glucose - 10 % FBS Hypoton Ringer (160 mosm) 600 ml ddh 2 O 50 ml Stamopløsning I 5 ml Stamopløsning II Isoton Ringer (300 mosm) Laves ved at udtage 500 ml af den Hypotone Ringer og tilsætte sucrose, til man opnår en osmolaritet på 300 mosm. ph 7,4 5 ml Stamopløsning III 10 ml MTH ddh 2 O op til 1000 ml ph 7,4 Stamopløsning I Stamopløsning II Stamopløsning III MTH 83,56 g NaCl 3,72 g KCl 2,46 g MgSO 4, 7H 2 O 1,78 g Na 2 HPO 4, 2H 2 O 1,47 g CaCl 2 x 2 H 2 O 6,9 g MOPS 7,56 g TES 11,92 g HEPES Til 1000 ml med ddh 2 O Til 100 ml med ddh 2 O Til 100 ml ddh 2 O Til 100 ml med ddh2o 94
96 Appendiks B: Produkter T-celle oprensning og stimulering, samt T-celle+Jurkat medie Ficoll densitets medie, Ficoll-Paque PLUS; StemCell Technologies; Cat: Human T Cell Enrichment Cocktail; RosetteSep Procedure; Cat: 15021/15061 RBC Lysis Buffer (10x); BioSite; Cat: /100ml GIBO RPMI 1640+GlutaMAX TM -I (T-cell medium); Invitrogen; Cat: Dynabeads Human T-Activator CD3/CD28; Invitrogen; Cat: 111:32D Protein måling Foetal Bovine serum; SIGMA; Cat: F9665 Penicillin-Streptomycin; SIGMA; Cat: P0781 Suspensions-kulturflasker sterile; Greiner bio-one, Cell Star; Cat: (T25, 50 ml), (T75, 250 ml) og (T175, 650 ml). Bio-Rad DC TM Protein Assay, Reagent B; Bio RAD; Cat: Bio-Rad D C Protein Assay, Reagent S; Bio RAD; Cat: Bio-Rad D C Protein Assay, Reagent A: Bio RAD; Cat: Albumin Standard; Thermo Scientific; Cat: SDS-Page: NuPAGE LDS Sample Buffer (4X); Invitrogen; Cat: NP0007 NuPAGE Mops SDS Running Buffer (20x); Invitrogen; Cat: NP NuPAGE Antioxidant; Invitrogen; Cat: NP0005 BenchMark TM Protein Ladder; Invitrogen; Cat: Western Blot: NuPAGE 10 % Bis-Tris Gel (NuPAGE Novex Tris-Acetate Mini Gels) 1.0 mm *12 well: Invitrogen; Cat:NP0302Box NuPAGE Transfer Buffer (20x); Invitrogen ; Cat: NP Nitrocellulose Transfer membrane; Whatman; Cat: CHROMATOGRAPHY Paper; Whatman; Cat: Ponceau S solution; SIGMA; Cat: P7170-1L BCIP/NBT phosphatase substrate; KPL; Cat: Antistoffer: Anti-K 2p5.1 (TASK-2); Alomone Labs; Cat: APC-037 Anti-K v 1.3 (extracellular); Alomone Labs; Cat: APC-101 Anti-Potassium Channel K v 1.3 (extracellular); SIGMA-ALDRICH; Cat: P4497 β-actin (13E5) Rabbit mab; Cell Signaling Technology; Cat: 4970 Histone H3 (FL-136); SANTA CRUZ Biotechnology; Cat: sc
97 Goat Anti Rabbit IgG; SIGMA; Cat: A3937 cdna RT Oligo(dT) Primer; Invitrogen; Cat: mm dntp Mix, PCR Grade ( /-088) Nuclease-Free Water (50 ml); QlAgen; Cat: Real-Time PCR SuperScript TM II Reverse Transcriptase; Invitrogen; Cat: /-014. (5x first strand og DTT medfølger). Brilliant II SYBR Green OPCR Master Mix; Agilent Technologies (STRATAGENE); Cat: Referance Dye (1 mm) (ROX); Agilent Technologies (STRATAGENE); Cat: Primere fra eurofins Nuclease-Free Water (50 ml); QlAgen; Cat: Strip tube 8x 0,2 ml format; Agilent Technologies (STRATAGENE); Cat: Coulter counter Coulter CC Size Standard L 10; Beckman Coulter; Cat: A R 3-01 Kvantificering af cdna 96 well cell culture plate, sterile; Greiner bio-one, Cellstar; Cat: sirna Quant-iT OliGreen ssdna Assay Kit; Invitrogen; Cat: O11492 (bestående af Quant-iT TM OliGreen ssdna Reagens opløst i DMSO, 20xTE buffer, samt Oligonucleotid standard. Ribonuclease A (bovine pancreas); SIGMA; Cat: R well cell culture plate; Greiner bio-one,cellstar; Cat: Lipofectamine; Invitrogen; Cat: Subtyper siport TM Amine; Ambion; Cat: AM4502 siport TM NeoFx TM ; Ambion; Cat: AM4510 Prædesignet srna fra Ambion Transfection II Kit; Ambion; Cat: AM1631 CD4+ Effector Memory T-cell Isolation Kit, human (MACS; Cat: ) CD4+ Central Memory T-cell Isolation Kit, human (MACS; Cat: ) Negative selection Human CD4+ T cell Enrichment Kit (StemCell, Easy Sep; Cat: 19052) Negative selection Human CD8+ T cell Enrichment Kit (StemCell, Easy Sep; Cat: 19053) Negative selection Human Naïve CD4+ T cell Enrichment Kit (StemCell, Easy Sep; Cat: 19155) Negative selection Human Naive CD8+ T cell Enrichment Kit (StemCell, Easy Sep; Cat:
98 Appendiks C: Protokoller Oprensning af T- Celler: Noter Donor information. En af de korte slanger klippes over med en saks, og blodet overføres til 4 rør, 15 ml. i hver hvis der er nok, ellers opvejes dette ved tilsætning af PBS. 750µl Rosettesep (50µl til 1 ml, hvis 10 ml = 500 µl). Mikses med 25 ml pipette (Binder uønskede celler til røde blodceller, som skal fjernes). Inkuberes i 20 min ved stuetemperatur. Prøverne fortyndes med 15 ml PBS + 2 % FBS (Her opvejes for blodmængden, hvis 10 ml blod = 25 ml PBS + 2 % FBS). Mikses forsigtigt med 25 ml pipette. 15 ml Ficoll (densitets medie; separerer forskellige celletyper) overføres til 4 nye rør. Blodet overføres langsomt oven på Ficollen. Centrifugeres i 20 min ved 1200 g i 20 min, program 4 (ingen bremse, eller bremse på laveste). Efter centrifugering suges T-cellerne op og overføres til 2 nye rør. T-cellerne vaskes med 25 ml PBS + 2 % FBS. Centrifugeres i 5 min ved 700 g på program 2 (med bremse). Ved uklar væske tjekkes mængden af celler i væsken, hvis mange centrifugeres igen. Væsken suges fra og vaskeproceduren gentages (Husk pellet skal løsnes). Lysis buffer 1 laves (1 ml 10 Lysis buffer + 9 ml ddh 2 O). De røde blodlegemer lyseres ved tilsætning af 5 ml af den 1 Lysis buffer. Sættes på is i 4½ min og omrystes ca. hvert min (Vigtigt det ikke er længere end 5 min). Reaktion standes ved tilsætning af 25 ml PBS. Cellerne centrifugeres i 5 min ved 700 g på program 2 (med bremse). Væsken suges fra begge rør og der tilsættes 20 ml T-celle medie til hvert rør og pellet opløses og cellesuspensionen føres sammen i et rør. Cellerne skal sættes op til celler pr. ml. 97
99 Eks. Skal bruge celler, har en cellesuspension på 5, celler pr. ml = 220/5,875 = 37,5 ml celler. Medie der skal tilsættes for at få 1 mio. celler pr. ml ,5 = 182,5 ml medie. Måling af oprensede T-celler: 100 µl af cellesuspensionen overføres til et eppendorfrør og 200 µl lysisbuffer tilsættes og der blandes. Derefter tilsættes 200 µl stabiliseringsbuffer (Et tryk fra hver er de to beholdere med rød tut). Der suges væske op i kassetten ved at trykke den hvide knap i bund. Kassetten sættes i måleren og der trykkes start. Tallet der kommer frem skal ganges med fortyndingsfaktoren. Eks. 100 µl cellesuspension µl lysisbuffer µl stabiliseringsbuffer er fortyndet 5 (500 (samlet volumen)/100 (cellesuspensionen) = 5). Eks. 200 µl cellesuspension µl lysisbuffer µl stabiliseringsbuffer er fortyndet 3 (600 (samlet volumen)/200 (cellesuspensionen) = 3) Tællekammer: 98
100 Tjek om kammer er rent under mikroskop. Ånd på det store glas og sæt dækglasset på, så det sidder fast. Påfør lidt cellesuspension med et glasrør (suges op under glasset). 4 af de 9 kamre tælles. På to sider tælles alle celler der rører og er inden for de to inderste streger, mens der på de to andre sider tælles de celler, der rører og er inden for den inderste streg. Gennemsnittet af de fire kamre udregnes = X. X 10 4 celler pr. ml. Stimulering af T-celler og vask af beads: Udregning af antallet af beads der skal bruges. Eks celler skal stimuleres. Beads findes i en væske på beads pr. ml. 7, / = 1,9 ml. Mængden af beads tilsættes et rør i magnet. Stå ca. 1 min. Væsken suges fra og røret tages op af magneten og der tilsættes sterilt PBS (2-3 ml). Sættes i magnet i ca. 1 min og væsken suges fra. Røret tages op og en passende mængde T-celle medie tilsættes. Pipetteres op og ned. Beads tilsættes T-cellerne for stimulering. Westernblot: Høst: Celler høstes ved at spinde ca. 7,5 ml cellesuspension (ca. 7,5 mio.) ned ved 700 x g i 5 min og suge væsken fra. (evt. anden volumen). Pellet resuspenderes i 7,5 ml PBS (evt. anden volumen) og spindes ned ved 700 RCF i 5 min. 99
101 Væsken suges fra og 50 µl Lysis/Pille + NaVO 3 (tilsat på dagen) tilsættes (1:200). Pellet løsnes og lysatet (væsken, slimet) overføres til eppendorfrør. Proteinmåling: Prøver sonikeres i 2x10 sek. (Indstilling 4, medium). Der skylles med ddh 2 O mellem hver prøve (Sonikering ødelægger cellemembranen). Prøver spindes ned ved x g i 5 min ved 4 C. Supernatant overføres til nye eppendorfrør. Buffer A + buffer S blandes lige før brug (2 ml A til 40 µl S). 125 µl A+S tilsættes alle prøverør inkl. standard. Standardkurve (0,5,10,15,20,25,30) 25 µl af hver tilsættes prøverør. Prøver overføres til prøverør efter formodet proteinmængde (1 µl prøve hvis mange celler) og der tilsættes lysisbuffer (Lysis+Pille tilsat NaVO 3 ) til et samlet volumen på 25 µl. Er prøverne uklare, kan det skyldes udfældning af SDS. Hvis dette er tilfældet sættes prøverne kort på varmeblok inden der udtages prøve. 1 ml B buffer tilsættes og der vortexes (hastighed 2) efter hver prøve med det samme. Prøverne pakkes ind i sølvpapir (da reaktionen er lysfølsomt) og inkuberes i 15 min. Prøverne måles i engangskuvetter på frøen (spektrofotometer) ved 600 nm. Tryk abs, indsæt reference (standard 0) set reference, tryk enter. Standardkurveprøver måles. Print lidt papir ud (husk printer skal være online). Prøverne måles. Data noteres på udprint. Resultater for 600 nm indskrives i regneark under OD proteinmængde fås. SDS-PAGE: Prøverne til WB gøres klar ved at udtage mængden af protein der skal bruges (udregnet i Exel ark) og tilsætte ddh 2 O og loading buffer + DTT (100 µl DTT µl 4 load). Ydre kammer: 600 ml running-buffer laves. (30ml 20 stock NuPAGE MOPS SDS Running-buffer afmåles og der fyldes op med ddh 2 O til 600 ml (570 ml ddh 2 O). 100
102 Indre kammer: 500 µl antioxidantopløsning pipetteres over i et bægerglas og 200 ml runnigbuffer tilsættes (op til 200 ml). Gel-kassetter, samt apparat afsprittes. Gelen klippes fri af emballagen, skylles med ddh 2 O, afsprittes, kammen fjernes, brønde skylles to gange med running-buffer til indre kammer og tapen fjernes. Gelen sættes i karet og der hældes lidt buffer i det indre kammer for at tjekke for utætheder. Prøverne sættes på varmeblokken i 5 min og spindes derefter kort for at få evt. fordampet væske i låget ned. Imens loades markøren (7 µl). Prøverne loades (25 µl). Låget sættes på og gel-apparatet tændes på NuPage Gel, 140 V i 1 time og 35 min. Køres til båndene er ved åbningen hvor tapen sad. Blotting: 600 ml transfer buffer laves (60 ml EtOH + 30 ml NuPAGE Transfer-buffer (20 stock) ml ddh 2 O). Membraner og filterpapir klippes ud efter skabelon. Svampe (blotting pads), filterpapir og nitrocellulose membraner lægges i blød i transferbuffer. Western blot kammer afsprites, saks, stor bakke, rør og palet. Kassetten tages op af kammeret og løsnes hele vejen rundt med paletten (over vasken). NuPAGE skal vende nedad. Øverste løftes af og bunden, samt brøndende fjernes. Der laves et hak i øverste venstre hjørne af gelen. Et filterpapir lægges på gelen og gelen fjernes fra kasette ved at vende kassetten rundt og løsne gelen, så den falder ned i hånden. Gelen + filterpapir lægges på bakken med filterpapiret nederst. Membranen (klippet i hjørnet) og det andet filterpapir lægges på oven på. Der rulles forsigtigt oven på med et rør for at fjerne luftbobler. En gang fra hver side. Sandwichen samles og blotting kammeret samles. Transfer-buffer hældes i det indre kammer for at se om det er tæt. Der fyldes derefter op til de hvide skruer og resten hældes i det yderste kammer. 101
103 Låget sættes på og blottet køres på NuPAGE Blot 1 time ved 25 V ved 1 gel (2 geler, 2 timer ved 25 V). Efter blotting tages membranen ud og Ponceau farves. Båndene fremkommer og markøren tegnes op med blyant. Membranen vaskes flere gange med ddh 2 O og klippes til. Evt. scannes membranen. Blocking: Membranerne lægges i blocking-buffer (2,5g skummetmælkspulver til 50 ml TBST) på rystebord i 1 time ved 37 C eller natten over ved 4 C (hvis natten over skal membranen skylles en gang med nyt blocking-buffer). Vådkammer bestående af vandvædet filtrepapir og parafilm laves (skal være plant) og membranen placeres på parafilmen. Membranen dækkes med primært antistof fortyndet i blocking-buffer). Skal stå natten over ved 4 C. Eks. 1:100 i 3 ml = 3000/100 = 30 µl. Primært antistof suges fra med en pipette (genbruges 4-5 gange). Membranen skylles 2 gange med TBST og vaskes herefter 1 15 min og derefter 3 5 min på rystebord ved stuetemperatur. Membranen tilsættes sekundært antistof 1 time ved stuetemperatur. 1:5000 (GAR). Sekundært antistof fjernes og membranen vaskes som ovenfor i TBST. Membranen fremkaldes med BCIP/TNBT. Reaktionen standes ved at lægge membranen i ddh 2 O. RNA oprensning: Høst: Celler høstes ved at spinde 7,5 ml cellesuspension ned (evt. anden volumen) og suge væsken fra. Pellet opløses med 350 µl RA1 lysisbuffer tilsat 3,5 µl β-mercaptoethanol (bliver slimet). 102
104 Lysatet overføres til sterile eppendorfrør. Opbevares ved -80 C, hvis de ikke skal bruges med det samme. Oprensning: Prøverne overføres til pink søjler (mindsker viskositet). Centrifugeres ved g i 1 min. 70 % ethanol laves (eks sprit 95 % ddh 2 O sterilt). Filter søjlen smides væk og 350 µl ethanol tilsættes og der pipetteres op og ned ca. 5 gange. Væsken (prøverne) overføres til blå RNA II søjler i collecting tubes for at binde RNA. Centrifugeres ved g i 30 sek. Væsken fra collecting tubes fjernes og de-saltning af membranerne (blå søjle) ved at tilsætte 350 µl MDB (membrane desalting buffer). Centrifugeres ved g i 1 min. Væsken fjernes og 95 µl DNase reaktionsmix tilsættes midt på membranerne (10 µl rdnase (køleskab) + 90 µl rdnase reaction buffer blandes i eppendorfrør ( antal prøver)) for at fordøje DNAet. Inkuberes i 15 min. Membranerne vaskes med 200 µl RA2 buffer. Centrifugeres ved g i 30 sek. Væske fjernes og 600 µl RA3 buffer tilsættes. Centrifugeres ved g i 30sek. Væske fjernes og 250 µl RA3 buffer tilsættes. Centrifugeres ved g i 2 min. Membranerne overføres til nye collecting tubes og der tilsættes 20 µl RNase frit vand (løsner RNAet fra membranerne). Centrifugeres ved g i 1 min. Flow-through (væsken) overføres til sterile eppendorfrør. Måling af RNA koncentration: 2 µl RNA tilsættes 108 µl DEP-H 2 O (eller RNase frit vand). Måles på frøen under indstillinger: program RNA vælges, pathlength: 10mm, units: µg/µl, dilution factor: 55 og use 320nm: no. DEP-H 2 O (eller RNase frit vand) bruges som reference ( set ref. ). RNA koncentrationen måles ved at tilsætte 100 µl prøve i kuvetten og trykke enter. Kuvetten vaskes med ddh 2 O mellem hver prøve. 103
105 Revers transkriptase (mrna til cdna): PCR-bænk: UV-lampen tændes i PCR-bænken ca. 15 min før brug. ddh 2 O (10-X µl), 1 µl dntp mix og 1 µl Oligo dt blandes på is i eppendorfrør (2 pr. prøve, hvis der er nok). Master mix bestående af 4 µl 5 first strand buffer, 2 µl 0,1M DTT og 1 µl ddh 2 O ( antal prøver + 1). Ved PCR maskinen: PCR maskinen tændes, program: Stine (password 2803) rtkap. RNA (X µl) tilsættes (1µg pr. reaktion) og spindes ned ca. 10 sek. Inkuberes ved 65 C i 5 min. Luk låget, tryk close lid og start. Tryk stop efter de 5 min og open lid. Prøverne spindes kort og sættes på is. 7 µl master mix tilsættes og blandes ved at slå på siden. Inkuberes ved 42 C i 2 min. Luk låget, tryk close lid og resume. Tryk stop efter 2 min og open lid. 1 µl SuperScript II RT tilsættes og blandingen inkuberes ved 42 C i 50 min 70 C i 15 min slut 4 C (programmet kører selv). Prøver sættes på frys når programmet er slut. Coulter counter: Start: Tænd computeren og Multisizer 3 (Coulter counter). Åben Multisizer 3 programmet. Tryk ok på de 8 fejlmeddelelser. 104
106 De to beholdere på siden. Den ene til Isoton saltopløsning (fra skab) skal være fyldt og den anden til affald skal være tom. Glasset i maskinen skal fyldes med Isoton saltopløsning (fra skab). CC-rør og omrører monteres. Pas på den ydre elektrode. Tjek at indsugningshullet er rent. Omrører skal have en hastighed på 6 (stirrer). Fyld systemet ved at trykke SYSTEM i værktøjslinjen og vælg FILL. (Rengøring af CC-røret på indersiden, vælg SYSTEM og FLUSH APERTURE). Indstillingerne skal stå på Save data (- Export data, - Include ). Vælg Directory, Browse og vælg C:drev, MS og Navn (PDS). Vælg Aperture for at ændre CC-rørets diameter. Indtast måletid (5 sek.). Kalibrering: Et lille bægerglas fyldes med Isoton ringer, så hullet i CC-røret dækkes. CALIBRATE vælges i værktøjslinjen. Ca. 15 dråber Latex kugler 10 µm tilsættes (antal dråber så kalibreringsværdi kan opnås). Tjek om kalibreringsværdi er okay og accepter. Måling af cellevolumen: 40 ml Ringer (37 C) fyldes i bægerglas og sættes i maskinen (Isoton og Hypoton). Celler tilsættes (optimalt at måle på 2,5 mio. celler) og der trykkes start og sekunduret sættes i gang. Der startes en ny måling hvert 20 sek. (gennemført måling lukkes ned). Isoton måles i 3 min (10 runder) og Hypoton 8 min (26 runder). Hullet børstes engang i min for at undgå, at hullet stopper til. Data: Tryk Overlay, vælg Samples og mappen hvor data er gemt. ( gå tilbage). Add samples (se på kurven i mens). Skal have ens navn (m3). Vælg OK. Tryk Display og vælg Curve (kun Uni.). Marker kurven inden for det interessante interval med musen og højre klik ( 2). 105
107 Skriv LC og UC ned. Tryk Analyze og vælg Statistics. Median værdien skrives ned og bruges til videre udregning i regneark, hvor den bruges til at udregne volumen af en kugle. Medianværdien bruges frem for middelværdien, fordi store (dobbelte celler) og små celler tæller forskelligt i gennemsnittet, hvilket giver et lidt højre tal. Hvorimod medianværdien er der, hvor der er 50 % af målingerne på hver side. Sluk: Tryk SYSTEM i værktøjslinjen og vælg FLUSH APERTURE. Tryk SYSTEM og vælg Drain. Skru røret af den forreste beholder. Tryk SYSTEM og vælg Emty waste tank. Tøm og skyl affaldsbeholderen (bagerste). Sluk computer, skærm og Multisizer 3. SiRNA Tælle celler. Sættes op til pr.ml ( pr. brønd i 6 brønds bakker). Cellesuspension spindes ned for at fjerne P/S. Medie minus P/S tilsættes. X µl Lipofectamine pr brønd blandes med -/- medie (i to eppendorfrør). Står herefter i 5 min. (f.eks. 4 brønde: 400 µl -/- medie, 28 µl Lipofectamine). X µl sirna blandes med -/- medie (f.eks. 50 nm i 4 brønde: 400 µl -/- medie, 5 µl SiRNA). Negativ Kontrol blandes med -/- medie (f.eks. 4 brønde: 400 µl -/- medie, 25 µl Neg. Kon.) sirnaet overføres over i det ene eppendorfrør med Lipofectamine. Inkuberes i 20 min ved RT. Den Neg. Kontrol overføres i det andet eppendorfrør med Lipofectamine. Inkuberes i 20 ved RT min. Cellerne overføres herefter til brøndene. 200 µl sirna+lipofectamine eller Neg. Kontrol+Lipofectamine dryppes i en spiral ned i brøndene. Pladen vippes forsigtigt og inkuberes herefter i den ønskede tid. 106
108 Oprensning af PBMC fra buffy coat (Signe S. Kirkegaards protokol) PBMC medie: RPMI-1640 (Glutamax) + 10 % FBS + 1% P/S Histopaque-1077 (Sigma-Aldrich # 10771) Leucosep 50 ml rør (Greiner Bio-One #227290) 1 x RBC Lysis buffer (ebioscience # ) Accuspin rør (Sigma-Aldrich) Histopaque bringes til stuetemp ml Histopaque tilsættes til 6 x 50 ml Accuspin rør og der centrifugeres kort (1000 x g i 30 sek.) - PBS tilsættes til buffy coat til et samlet volumen på 180 ml (ca. 60 ml buffy coat og 120 ml PBS) - 30 ml fortyndes buffy coat sættes ovenpå Histopaquen - der centrifugeres ved 1680 rpm i 25 min ved stuetemp (brake: off, acc: 9) - cellerne (laget mellem histopaque og plasma) overføres til 2 x 50 ml rør - PBS tilsættes til samlet volumen på 50 ml pr. Rør - Der centrifugeres ved 1500 rpm i 5 min ved stuetemp. (break: 9) - Pellet resuspenderes i 10 ml 1 x RBC lysis byffer og inkuberer i 10 min (i mørke) - 10 ml FBS tilsættes for at stoppe reaktionen, der fyldes op til 50 ml med PBS og centrifugeres (se ovenfor) - Pellet resuspenderes i PBMC medie og der centrifugeres - Pellet resuspenderes i PBMC medie og cellerne er nu klar til videre oprensninger 107
109 Appendiks D: Forsøgsoversigt Dato Alle Tider Oprenset RVD WB (TASK-2) WB (Kv1.3) QPCR og 6 d SSK SSK PDS/SSK SSK SSK og 6 d SSK SSK PDS/SSK SSK og 6 d SSK SSK SSK PDS/SSK , 2, 4, 8 t og 3 d PDS/SSK PDS/SSK og 6 d PDS/SSK , 8, og 12 t PDS/SSK PDS/SSK og 6 d , 8 og 12 t PDS/SSK , 24 t og 3, 6 d PDS/SSK , 4, 8, 12, 24 t og 3, 6 d , 4, 8, 12 og 24 t SSK SSK SSK , 4, 8, 12 og 24 t d SSK SSK , 4, 8, 12 og 24 t SSK SSK SSK , 4 og 24 t SSK SSK SSK og 4 t SSK SSK , 4, 8, 12 og 24 t SSK og 6 d SSK , 4, 12, 24 og 48 t SSK , 4, 24 og 48 t SSK , 4, 12, 24 og 48 t SSK Dato Subtyper Oprenset RVD WB (TASK-2) WB (Kv1.3) QPCR CD4 All SSK CD4 All SSK CD4 og CD8 All+Naive SSK CD4 og CD8 All+Naive og CM+EM SSK CD4 All + Naive SSK CD4 og CD8 All+Naive og CM+EM SSK CD4 Naive og CD8 All+Naive SSK CM og EM SSK SSK = Signe S. Kirkegaard PDS = Pernille D. Strøm *Grå felter angiver ikke lavet forsøg. * Har kun angivet de felter hvor Signe har udført forsøget/ eller været med. De tomme felter har jeg udført alene eller med hjælp fra laborant Dorthe Nielsen. Nb! Ikke alle tider indgår i alle forsøg, da nogle er udtaget pga. mislykkede forsøg. 108
110 Appendiks E: Øvrige resultater T-cellers volumen øges ved aktivering. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og målt efter 2, 4, 8, 12 og 24 timer, samt efter 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Cellevolumen blev målt i en Coulter Counter. Kontrol og aktiverede T celler blev målt i 3 min i Isoton Ringer (300 mosm). Figuren viser de absolutte værdier for den gennemsnitslige cellevolumen i Isoton Ringer ±SEM. Aktiverede T-celler er blevet signifikant større end Kontrolcellerne efter 24 timers aktivering. P 0,01 er vist med **. Nogle af forsøgene er udført af ph.d.-studerende Signe S. Kirkegaard (se Appendiks D). Evnen til at udføre RVD falder i aktiverede T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og målt efter 2, 4, 8, 12 og 24 timer, samt efter 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Cellevolumen blev målt i en Coulter Counter. Kontrol og aktiverede T celler blev målt i 3 min i Isoton Ringer (300 mosm) og 8 min i Hypoton Ringer (160 mosm). Figuren viser tilbagereguleringen (RVD) efter 5 min udregnet ved hjælp af ligning (2). Resultaterne er vist relativ til Kontrollen ± SEM. Efter 24 timeres aktivering er de aktiverede T-celler blevet signifikant dårligere end Kontrol cellerne til at udføre RVD. P 0,01 er vist med ** og P 0,05 er vist med *. Nogle af forsøgene er udført af ph.d.-studerende Signe S. Kirkegaard (se Appendiks D). 109
111 Maksimal svulmning i Hypoton Ringer øges i aktiverede T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og målt efter 2, 4, 8, 12 og 24 timer, samt efter 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Cellevolumen blev målt i en Coulter Counter. Kontrol og aktiverede T celler blev målt i 3 min i Isoton Ringer (300 mosm) og 8 min i Hypoton Ringer (160 mosm). A) Absolut maksimal volumen i Hypoton Ringer (absolutte værdier) ± SEM. Aktiverede T-celler svulmer signifikant mere end Kontrolcellerne efter 24 timers aktivering. B) Relativ maksimal volumen i Hypoton Ringer (absolutte værdier). Aktiverede T-celler svulmer signifikant mere end Kontrolcellerne efter 3 dages aktivering. P < 0,05 er vist med * og P 0,01 er vist med **. Nogle af forsøgene er udført af ph.d.-studerende Signe S. Kirkegaard (se Appendiks D). 110
112 Tilbagereguleringshastighed i aktiverede T-celler. T-celler oprenset fra Buffy Coats blev aktiveret med CD3/CD28 beads og målt efter 2, 4, 8, 12 og 24 timer, samt efter 3 og 6 dage. Ikke aktiverede T-celler blev brugt som kontrol. Cellevolumen blev målt i en Coulter Counter. Kontrol og aktiverede T celler blev målt i 3 min i Isoton Ringer (300 mosm) og 8 min i Hypoton Ringer (160 mosm). A) Absolut tilbagereguleringshastigheden udregnet ved lineærregression (absolutte værdier) ± SEM. Efter 3 dages aktivering er de aktiverede T-celler blevet signifikant hurtigere til at tilbageregulere end Kontrolcellerne B) Relativ tilbagereguleingshastighed udregnet ved linærregression (absolutte værdier). De aktiverede T-celler er ikke blevet signifikant langsommere/hurtigere til at tilbageregulere end Kontrolcellerne. P 0,05 er vist med *. Nogle af forsøgene er udført af ph.d.-studerende Signe S. Kirkegaard (se Appendiks D). 111
Syv transmembrane receptorer
 Syv transmembrane receptorer Receptoren som kommunikationscentral Cellemembranen definerer grænsen mellem en celles indre og ydre miljø, der er meget forskelligt. Det er essentielt for cellens funktion
Syv transmembrane receptorer Receptoren som kommunikationscentral Cellemembranen definerer grænsen mellem en celles indre og ydre miljø, der er meget forskelligt. Det er essentielt for cellens funktion
Forårseksamen Titel på kursus: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
 Studienummer: 1/10 Forårseksamen 2014 Titel på kursus: Det hæmatologiske system og immunsystemet Uddannelse: Bacheloruddannelsen i Medicin/Medicin med industriel specialisering Semester: 2. semester Eksamensdato:
Studienummer: 1/10 Forårseksamen 2014 Titel på kursus: Det hæmatologiske system og immunsystemet Uddannelse: Bacheloruddannelsen i Medicin/Medicin med industriel specialisering Semester: 2. semester Eksamensdato:
Forårseksamen Med korte, vejledende svar
 Studienummer: 1/10 Forårseksamen 2014 Med korte, vejledende svar (Heri angives de facts, der skal nævnes i besvarelserne, men ikke de uddybende forklaringer, tegninger etc., der i nogle af opgaverne også
Studienummer: 1/10 Forårseksamen 2014 Med korte, vejledende svar (Heri angives de facts, der skal nævnes i besvarelserne, men ikke de uddybende forklaringer, tegninger etc., der i nogle af opgaverne også
Hvilket af efterfølgende udsagn er forkert? a) Golgi-proteiner syntetiseres i ER b) mitochondriale proteiner syntetiseres i cytosol c)
 Test 3 Hvilket af efterfølgende udsagn er forkert? a) Golgi-proteiner syntetiseres i ER b) mitochondriale proteiner syntetiseres i cytosol c) plasmamembran-proteiner syntetiseres i cytosol d) lysosomale
Test 3 Hvilket af efterfølgende udsagn er forkert? a) Golgi-proteiner syntetiseres i ER b) mitochondriale proteiner syntetiseres i cytosol c) plasmamembran-proteiner syntetiseres i cytosol d) lysosomale
Eksamen i. Cellebiologi (kandidatdelen): Cellebiologi - Cellers struktur og funktion - Membranbiokemi - Cellulær signaltransduktion
 Eksamen i Cellebiologi (kandidatdelen): Cellebiologi - Cellers struktur og funktion - Membranbiokemi - Cellulær signaltransduktion Opgavesættet består af 5 sider inklusive denne forside. Sættet består
Eksamen i Cellebiologi (kandidatdelen): Cellebiologi - Cellers struktur og funktion - Membranbiokemi - Cellulær signaltransduktion Opgavesættet består af 5 sider inklusive denne forside. Sættet består
Almen cellebiologi Membrantransport
 Almen cellebiologi 2007 Membrantransport Kap. 12, s. 389-420 Forelæsning 1 Stine Falsig Pedersen sfpedersen@aki.ku.dk 35321546/room 527 1 De næste tre forelæsninger: 1. - Membranen og membran-transport
Almen cellebiologi 2007 Membrantransport Kap. 12, s. 389-420 Forelæsning 1 Stine Falsig Pedersen sfpedersen@aki.ku.dk 35321546/room 527 1 De næste tre forelæsninger: 1. - Membranen og membran-transport
Det innate virusforsvar. TLR7, TLR8, TLR9, MDA5, RIG I og type I interferoner
 Det innate virusforsvar. TLR7, TLR8, TLR9, MDA5, RIG I og type I interferoner A kursus i teoretisk og immunologi TLR3 og LGP 2 Odense, 13. april 2015 Søren T. Lillevang Klinisk Immunologisk Afdeling Odense
Det innate virusforsvar. TLR7, TLR8, TLR9, MDA5, RIG I og type I interferoner A kursus i teoretisk og immunologi TLR3 og LGP 2 Odense, 13. april 2015 Søren T. Lillevang Klinisk Immunologisk Afdeling Odense
Eksamen i Modul 2.2, Det hæmatologiske system og immunforsvaret MEDIS, AAU, 2. semester, juni 2010
 MedIS, AAU. Det hæmatologiske system og immunforsvaret, 7. Juni 2010 1 Navn: Studienummer: Eksamen i Modul 2.2, Det hæmatologiske system og immunforsvaret MEDIS, AAU, 2. semester, juni 2010 Dette eksamenssæt
MedIS, AAU. Det hæmatologiske system og immunforsvaret, 7. Juni 2010 1 Navn: Studienummer: Eksamen i Modul 2.2, Det hæmatologiske system og immunforsvaret MEDIS, AAU, 2. semester, juni 2010 Dette eksamenssæt
Re- eksamen 2014. Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering. kl. 09.00-11.
 1/10 Re- eksamen 2014 Titel på kursus: Uddannelse: Semester: Eksamensdato: Tid: Bedømmelsesform Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
1/10 Re- eksamen 2014 Titel på kursus: Uddannelse: Semester: Eksamensdato: Tid: Bedømmelsesform Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
Sommereksamen 2012 Med korte, vejledende svar
 1 Sommereksamen 2012 Med korte, vejledende svar Titel på kursus: Uddannelse: Semester: ksamensdato: Tid: Bedømmelsesform Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin
1 Sommereksamen 2012 Med korte, vejledende svar Titel på kursus: Uddannelse: Semester: ksamensdato: Tid: Bedømmelsesform Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin
Im-F2 T-celler og deres antigener Modul b10 E08
 Beskrivelse af peptidrepertoirets størrelse, HLA klasse-i- og II-molekylernes struktur, deres måde at binde peptider på og de cellulære mekanismer bag deres opladning med peptid. Professionelle antigen-præsenterende
Beskrivelse af peptidrepertoirets størrelse, HLA klasse-i- og II-molekylernes struktur, deres måde at binde peptider på og de cellulære mekanismer bag deres opladning med peptid. Professionelle antigen-præsenterende
Skriftlig eksamen april 2017
 Studienummer: 1/10 Skriftlig eksamen april 2017 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Medicin og medicin med industriel specialisering 2. semester Eksamensdato:
Studienummer: 1/10 Skriftlig eksamen april 2017 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Medicin og medicin med industriel specialisering 2. semester Eksamensdato:
Reeksamen 2013. Det hæmatologiske system og immunsystemet. Bacheloruddannelsen i Medicin/Medicin med industriel specialisering. kl. 09.00-11.
 1/10 Reeksamen 2013 Titel på kursus: Uddannelse: Semester: Eksamensdato: Tid: Bedømmelsesform Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
1/10 Reeksamen 2013 Titel på kursus: Uddannelse: Semester: Eksamensdato: Tid: Bedømmelsesform Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
Glat muskulatur F16 : B: , ,
 Læringsmål Beskrive glat muskulaturs opbygning (ikke tværstribet, organisering varierer fra multi unit (ukoblede celler) til single unit" (kraftig kobling)) Beskrive det kontraktile apparats opbygning
Læringsmål Beskrive glat muskulaturs opbygning (ikke tværstribet, organisering varierer fra multi unit (ukoblede celler) til single unit" (kraftig kobling)) Beskrive det kontraktile apparats opbygning
Liste A 1 Na + -glucosetransportør 2 Glucosetransportør 3 Na + /H + exchanger 4 Na +,K + ATPase 5 Acetylcholinreceptoren i den neuromuskulære junction
 Liste A 1 Na + -glucosetransportør 2 Glucosetransportør 3 Na + /H + exchanger 4 Na +,K + ATPase 5 Acetylcholinreceptoren i den neuromuskulære junction Liste B A B C D E F Antiport Symport Passiv transport
Liste A 1 Na + -glucosetransportør 2 Glucosetransportør 3 Na + /H + exchanger 4 Na +,K + ATPase 5 Acetylcholinreceptoren i den neuromuskulære junction Liste B A B C D E F Antiport Symport Passiv transport
Enzyme-linked receptors p557- p566
 Enzyme-linked receptors p557- p566 2007 Hvor sidder receptoren er agonisten lipid permeabel? 16_09_molecules_bind.jpg Peptid-ligander binder til membran associerede receptorer Receptorer A A A A B A B
Enzyme-linked receptors p557- p566 2007 Hvor sidder receptoren er agonisten lipid permeabel? 16_09_molecules_bind.jpg Peptid-ligander binder til membran associerede receptorer Receptorer A A A A B A B
Humanbiologi - Lymfesystemet og Immunologi
 Humanbiologi - Lymfesystemet og Immunologi Lymfekarrets vægge er tyndere end venernes og har ligesom dem også klapper. Der er fælles indløb til vena cava superior, hvor den øvre indløbsgren drænerer koppens
Humanbiologi - Lymfesystemet og Immunologi Lymfekarrets vægge er tyndere end venernes og har ligesom dem også klapper. Der er fælles indløb til vena cava superior, hvor den øvre indløbsgren drænerer koppens
Skriftlig reeksamen august 2017
 Studienummer: 1/10 Skriftlig reeksamen august 2017 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Medicin og medicin med industriel specialisering 2. semester Eksamensdato:
Studienummer: 1/10 Skriftlig reeksamen august 2017 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Medicin og medicin med industriel specialisering 2. semester Eksamensdato:
Autoimmunitet. Umahro Cadogan Sundhedsrevolutionær-uddannelsen
 Autoimmunitet Umahro Cadogan Sundhedsrevolutionær-uddannelsen 1 Hvad er autoimmunitet? Når immunforsvaret (fejlagtigt) angriber kroppen, fordi det tror væv i kroppen er blevet fjenden Auto = selv Immunitet
Autoimmunitet Umahro Cadogan Sundhedsrevolutionær-uddannelsen 1 Hvad er autoimmunitet? Når immunforsvaret (fejlagtigt) angriber kroppen, fordi det tror væv i kroppen er blevet fjenden Auto = selv Immunitet
Biologien bag epidemien
 Biologien bag epidemien Af Niels Kristiansen, biologilærer, Grindsted Gymnasium Sygdomme kan smitte på mange måder. Enten via virus, bakterier eller parasitter. I det følgende vil vi koncentrere os om
Biologien bag epidemien Af Niels Kristiansen, biologilærer, Grindsted Gymnasium Sygdomme kan smitte på mange måder. Enten via virus, bakterier eller parasitter. I det følgende vil vi koncentrere os om
Re- eksamen 2014. Med korte, vejledende svar
 1/10 Re- eksamen 2014 Med korte, vejledende svar (Heri angives de facts, der skal nævnes i besvarelserne, men ikke de uddybende forklaringer, tegninger etc., der i nogle af opgaverne også forventes, for
1/10 Re- eksamen 2014 Med korte, vejledende svar (Heri angives de facts, der skal nævnes i besvarelserne, men ikke de uddybende forklaringer, tegninger etc., der i nogle af opgaverne også forventes, for
Forstå dine laboratorieundersøgelser. myelomatose
 Forstå dine laboratorieundersøgelser ved myelomatose Denne vejledning giver indblik i de målinger og undersøgelser, der udføres hos patienter med myelomatose. Resultaterne af disse målinger og undersøgelser
Forstå dine laboratorieundersøgelser ved myelomatose Denne vejledning giver indblik i de målinger og undersøgelser, der udføres hos patienter med myelomatose. Resultaterne af disse målinger og undersøgelser
Re- eksamen 2012 Med korte, vejledende svar
 Studienummer: 1 Re- eksamen 2012 Med korte, vejledende svar Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
Studienummer: 1 Re- eksamen 2012 Med korte, vejledende svar Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
Forsvar mod meldug i byg 8/1-07
 Forsvar mod meldug i byg 8/1-07 Meldugsvampens angreb på bygplanten aktiverer en række interessante gener der fungerer i reguleringen af plantens forsvar. Modtagelig David B. Collinge, Michael K. Jensen
Forsvar mod meldug i byg 8/1-07 Meldugsvampens angreb på bygplanten aktiverer en række interessante gener der fungerer i reguleringen af plantens forsvar. Modtagelig David B. Collinge, Michael K. Jensen
Biologi opgave Opsamling: Cellebiologi (Bioanalytiker modul3)
 1 Delphine Bonneau Biologi opgave Opsamling: Cellebiologi 1-6 Pelle har spist en kæmpe stor kage, og efterfølgende stiger hans blodsukker. Derfor sender kroppen besked til de endokrine kirtler i bugspytkirtlen
1 Delphine Bonneau Biologi opgave Opsamling: Cellebiologi 1-6 Pelle har spist en kæmpe stor kage, og efterfølgende stiger hans blodsukker. Derfor sender kroppen besked til de endokrine kirtler i bugspytkirtlen
< Elabscience ELSIA Kit 20% 할인품목 >
 < Elabscience ELSIA Kit 20% 할인품목 > Cat No. Product Name 20% DC Price Signaling Pathways E-EL-H0004 Human ADP/Acrp30 (Adiponectin) ELISA Kit 470,000 E-EL-H0012 Human BMP-4 (Bone Morphogenetic Protein 4)
< Elabscience ELSIA Kit 20% 할인품목 > Cat No. Product Name 20% DC Price Signaling Pathways E-EL-H0004 Human ADP/Acrp30 (Adiponectin) ELISA Kit 470,000 E-EL-H0012 Human BMP-4 (Bone Morphogenetic Protein 4)
Undervisningsplan FORÅR februar Introduktion til faget Hana Malá februar Hjernens opbygning og funktion Hana Malá
 Undervisningsplan FORÅR 2008 1. 5. februar Introduktion til faget Hana Malá 2. 12. februar Hjernens opbygning og funktion Hana Malá 3. 19. februar Nyt fra forskningen Hana Malá 4. 26. februar Plasticitet
Undervisningsplan FORÅR 2008 1. 5. februar Introduktion til faget Hana Malá 2. 12. februar Hjernens opbygning og funktion Hana Malá 3. 19. februar Nyt fra forskningen Hana Malá 4. 26. februar Plasticitet
MERE OM MS (MULTIPEL SKLEROSE)
 MERE OM MS (MULTIPEL SKLEROSE) Udarbejdet i samarbejde med læge Anna Tsakiri Neurologisk afdeling, Glostrup Hospital. Indhold Hvordan kommer jeg videre? 4 Hvad er MS? 5 Almindelige typer af MS 6 Hvordan
MERE OM MS (MULTIPEL SKLEROSE) Udarbejdet i samarbejde med læge Anna Tsakiri Neurologisk afdeling, Glostrup Hospital. Indhold Hvordan kommer jeg videre? 4 Hvad er MS? 5 Almindelige typer af MS 6 Hvordan
Coordinator: Dr. Hsien-Ming Lee Coach Professor: Dr. Joseph J.-T. Huang Sit-in Professor: Dr. Su-Chang Lin. Presenter: Bagher Golzarroshan
 Coordinator: Dr. Hsien-Ming Lee Coach Professor: Dr. Joseph J.-T. Huang Sit-in Professor: Dr. Su-Chang Lin Presenter: Bagher Golzarroshan 1 Outline Introduction Cancer Apoptosis Apoptosis and disease Scope
Coordinator: Dr. Hsien-Ming Lee Coach Professor: Dr. Joseph J.-T. Huang Sit-in Professor: Dr. Su-Chang Lin Presenter: Bagher Golzarroshan 1 Outline Introduction Cancer Apoptosis Apoptosis and disease Scope
Almen cellebiologi Membrantransport
 Almen cellebiologi 2007 Membrantransport Kap. 12, s. 389-420 Forelæsning 2 Stine Falsig Pedersen sfpedersen@aki.ku.dk 35321546/room 527 1 De næste tre forelæsninger: 1. - Membranen og membran-transport
Almen cellebiologi 2007 Membrantransport Kap. 12, s. 389-420 Forelæsning 2 Stine Falsig Pedersen sfpedersen@aki.ku.dk 35321546/room 527 1 De næste tre forelæsninger: 1. - Membranen og membran-transport
21. Mandag Kroppens forsvar (at last...)
 21. Mandag Kroppens forsvar (at last...) Kroppens forsvar overordnet Det er formålet med immunforsvaret at: 1) beskytte mod indtrængende mikrober (mikroorganismer), f.eks. virus, bakterie, svampe og parasitter,
21. Mandag Kroppens forsvar (at last...) Kroppens forsvar overordnet Det er formålet med immunforsvaret at: 1) beskytte mod indtrængende mikrober (mikroorganismer), f.eks. virus, bakterie, svampe og parasitter,
IM-H11 Parasitter og immunsystemet Modul b10 E08 Abstrakt Grith Lykke Sørensen Senest opdateret: 13-11-2008
 IM-H11 Parasitter og immunsystemet Forskellige parasitters metoder til at omgå det adaptive immunsystem gennemgås, bla malaria og trypanosomiasis. TH2 celler defineres og deres dannelse udfra TH0 omtales.
IM-H11 Parasitter og immunsystemet Forskellige parasitters metoder til at omgå det adaptive immunsystem gennemgås, bla malaria og trypanosomiasis. TH2 celler defineres og deres dannelse udfra TH0 omtales.
Reeksamen 2015. Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering. kl. 09.00-11.
 1 Reeksamen 2015 Titel på kursus: Uddannelse: Semester: Eksamensdato: Tid: Bedømmelsesform Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
1 Reeksamen 2015 Titel på kursus: Uddannelse: Semester: Eksamensdato: Tid: Bedømmelsesform Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
Im-F3 T-celle-immunitet Modul b10 E08
 Forelæsningen tager udgangspunkt i recirkulationen af naive T-celler mellem blod og lymfe og mødet med antigen præsenteret af dendritiske celler i lymfeknuderne. Herunder kommer jeg ind på betydningen
Forelæsningen tager udgangspunkt i recirkulationen af naive T-celler mellem blod og lymfe og mødet med antigen præsenteret af dendritiske celler i lymfeknuderne. Herunder kommer jeg ind på betydningen
Skriftlig reeksamen august 2017
 Studienummer: 1/10 Skriftlig reeksamen august 2017 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Medicin og medicin med industriel specialisering 2. semester Eksamensdato:
Studienummer: 1/10 Skriftlig reeksamen august 2017 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Medicin og medicin med industriel specialisering 2. semester Eksamensdato:
Immunologi- det store overblik. Dyrlæge Rikke Søgaard Teknisk rådgiver, Merial Norden A/S
 Immunologi- det store overblik Dyrlæge Rikke Søgaard Teknisk rådgiver, Merial Norden A/S Hvem er jeg Rikke Søgaard Uddannet dyrlæge i 1998 Ansat 5 år i praksis både blandet og svinepraksis Ansat 5 år på
Immunologi- det store overblik Dyrlæge Rikke Søgaard Teknisk rådgiver, Merial Norden A/S Hvem er jeg Rikke Søgaard Uddannet dyrlæge i 1998 Ansat 5 år i praksis både blandet og svinepraksis Ansat 5 år på
Besvarelse af opgaverne til den Spm.A: efter TGA TCA Spm. B:
 Besvarelse af opgaverne til den 20-9-06 Spm.A: Her vil vi gerne sætte et relativt lille stykke DNA (FLAG) sammen med et relativt stort stykke (PRB1). Det lille stykke er for lille til at vi kan PCR amplificere
Besvarelse af opgaverne til den 20-9-06 Spm.A: Her vil vi gerne sætte et relativt lille stykke DNA (FLAG) sammen med et relativt stort stykke (PRB1). Det lille stykke er for lille til at vi kan PCR amplificere
Reeksamen Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
 1 Reeksamen 2015 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato: 10. august
1 Reeksamen 2015 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato: 10. august
Proteiner. Proteiner er molekyler der er opbygget af "aminosyrer",nogle er sammensat af få aminosyrer medens andre er opbygget af mange tusinde
 Proteiner Proteiner er molekyler der er opbygget af "aminosyrer",nogle er sammensat af få aminosyrer medens andre er opbygget af mange tusinde Der findes ca. 20 aminosyrer i menneskets organisme. Nogle
Proteiner Proteiner er molekyler der er opbygget af "aminosyrer",nogle er sammensat af få aminosyrer medens andre er opbygget af mange tusinde Der findes ca. 20 aminosyrer i menneskets organisme. Nogle
Sygdom og metaboliske forstyrrelser hos farende søer
 Sygdom og metaboliske forstyrrelser hos farende søer Dyrlæge, ph.d. studerende Marianne Kaiser Det Sundhedsvidenskabelige Fakultet Institut for Klinisk Veterinærmedicin Vejle d. 27. september 2017 27-09-2017
Sygdom og metaboliske forstyrrelser hos farende søer Dyrlæge, ph.d. studerende Marianne Kaiser Det Sundhedsvidenskabelige Fakultet Institut for Klinisk Veterinærmedicin Vejle d. 27. september 2017 27-09-2017
Trimning af immunsystemet. ved gentagne infektioner ved autoimmune sygdomme ved kronisk infektion
 Trimning af immunsystemet ved gentagne infektioner ved autoimmune sygdomme ved kronisk infektion ved gentagne infektioner for eksempel i hals, lunger eller underliv ved autoimmune sygdomme som Type 1 diabetes,
Trimning af immunsystemet ved gentagne infektioner ved autoimmune sygdomme ved kronisk infektion ved gentagne infektioner for eksempel i hals, lunger eller underliv ved autoimmune sygdomme som Type 1 diabetes,
Immunsystemet - Ib Søndergaard. Biolearning. vores fantastiske forsvar mod sygdom. Immunsystemet tager fejl
 Kursus for Folkeuniversitetet i Aarhus april-maj 2015. Immunsystemet - vores fantastiske forsvar mod sygdom. Alt materiale i denne fil (undtaget enkelte figurer fra citerede kilder) er Ib Søndergaard,.
Kursus for Folkeuniversitetet i Aarhus april-maj 2015. Immunsystemet - vores fantastiske forsvar mod sygdom. Alt materiale i denne fil (undtaget enkelte figurer fra citerede kilder) er Ib Søndergaard,.
Menneskets væskefaser
 Menneskets væskefaser Mennesket består af ca. 60% væske (vand) Overordnet opdelt i to: Ekstracellulærvæske og intracellulærvæske Ekstracellulærvæske udgør ca. 1/3 Interstitielvæske: Væske der ligger mellem
Menneskets væskefaser Mennesket består af ca. 60% væske (vand) Overordnet opdelt i to: Ekstracellulærvæske og intracellulærvæske Ekstracellulærvæske udgør ca. 1/3 Interstitielvæske: Væske der ligger mellem
Opgave 1. EPO og bloddoping
 Side 1 af 8 sider Opgave 1. EPO og bloddoping Nogle sportsfolk snyder ved at få tilført hormonet erythropoietin, EPO, eller røde blodceller (bloddoping) før en konkurrence, fordi det øger præstationsevnen.
Side 1 af 8 sider Opgave 1. EPO og bloddoping Nogle sportsfolk snyder ved at få tilført hormonet erythropoietin, EPO, eller røde blodceller (bloddoping) før en konkurrence, fordi det øger præstationsevnen.
Mere om MS (multipel sklerose)
 Mere om MS (multipel sklerose) EXT-11/2008-15 EX.1498 www.novartis.dk Mere om MS (multipel sklerose) Indhold Hvordan kommer jeg videre? 4 Hvad er MS? 5 Almindelige typer af MS 6 Attakvis MS (RRMS) 6 Sekundær-progressiv
Mere om MS (multipel sklerose) EXT-11/2008-15 EX.1498 www.novartis.dk Mere om MS (multipel sklerose) Indhold Hvordan kommer jeg videre? 4 Hvad er MS? 5 Almindelige typer af MS 6 Attakvis MS (RRMS) 6 Sekundær-progressiv
Reeksamen Det hæmatologiske system og immunsystemet. Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
 Studienummer: 1/10 Reeksamen 2013 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato:
Studienummer: 1/10 Reeksamen 2013 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato:
Im-F1 Det medfødte immunsystem Modul b10 E08
 Det medfødte immunsystem defineres og sammenlignes med det erhvervede immunsystem mht. receptorspecificitet ( pathogen-associated molecular patterns ) herunder hvordan det medfødte immunsystem diskriminerer
Det medfødte immunsystem defineres og sammenlignes med det erhvervede immunsystem mht. receptorspecificitet ( pathogen-associated molecular patterns ) herunder hvordan det medfødte immunsystem diskriminerer
Biomarkører ved neurologiske sygdomme. Thomas Christensen
 Biomarkører ved neurologiske sygdomme Thomas Christensen Biomarkører ved neurologiske sygdomme Identificere diagnostiske og prognostiske biomarkører for neurologiske sygdomme Biobank oprettet Samarbejde
Biomarkører ved neurologiske sygdomme Thomas Christensen Biomarkører ved neurologiske sygdomme Identificere diagnostiske og prognostiske biomarkører for neurologiske sygdomme Biobank oprettet Samarbejde
ME naturvidenskabeligt set
 Myalgisk Encephalomyelitis (G93.3) ME naturvidenskabeligt set ME FORENINGEN Figur ref. 1 Tusindvis af naturvidenskabelige artikler viser, at ME er en kompleks fysisk sygdom, der påvirker adskillige områder
Myalgisk Encephalomyelitis (G93.3) ME naturvidenskabeligt set ME FORENINGEN Figur ref. 1 Tusindvis af naturvidenskabelige artikler viser, at ME er en kompleks fysisk sygdom, der påvirker adskillige områder
Re- eksamen Det hæmatologiske system og immunsystemet. Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
 Studienummer: 1 Re- eksamen 2012 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato:
Studienummer: 1 Re- eksamen 2012 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato:
Skriftlig eksamen juni 2018
 Studienummer: 1/11 Skriftlig eksamen juni 2018 Titel på kursus: Immunsystemet (ny studieordning, 2017) Uddannelse: Semester: Medicin og medicin med industriel specialisering 2. semester Eksamensdato: 18.
Studienummer: 1/11 Skriftlig eksamen juni 2018 Titel på kursus: Immunsystemet (ny studieordning, 2017) Uddannelse: Semester: Medicin og medicin med industriel specialisering 2. semester Eksamensdato: 18.
Forårseksamen 2016. Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
 1 Forårseksamen 2016 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato: 11. april
1 Forårseksamen 2016 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato: 11. april
Nervesystemets celler, fysiologi & kemi
 Nervesystemets celler, fysiologi & kemi Carsten Reidies Bjarkam. Professor, specialeansvarlig overlæge, Ph.D. Neurokirurgisk Afdeling Aalborg Universitetshospital Nervesystemet er opbygget af nerveceller
Nervesystemets celler, fysiologi & kemi Carsten Reidies Bjarkam. Professor, specialeansvarlig overlæge, Ph.D. Neurokirurgisk Afdeling Aalborg Universitetshospital Nervesystemet er opbygget af nerveceller
MÅLRETTET BEHANDLING AF LUNGEKRÆFT PATIENTINFORMATION OM NYESTE BEHANDLINGSMULIGHEDER
 MÅLRETTET BEHANDLING AF LUNGEKRÆFT PATIENTINFORMATION OM NYESTE BEHANDLINGSMULIGHEDER I løbet af det seneste årti har vi fået langt mere viden om, hvordan kræft udvikler sig. På baggrund af denne viden
MÅLRETTET BEHANDLING AF LUNGEKRÆFT PATIENTINFORMATION OM NYESTE BEHANDLINGSMULIGHEDER I løbet af det seneste årti har vi fået langt mere viden om, hvordan kræft udvikler sig. På baggrund af denne viden
10. Mandag Nervesystemet del 1
 10. Mandag Nervesystemet del 1 Det er ikke pensums letteste stof at kunne redegøre for mekanismerne bag udbredelsen af nerveimpulser. Måske pensums sværeste stof forståelsesmæssigt, så fortvivl ikke hvis
10. Mandag Nervesystemet del 1 Det er ikke pensums letteste stof at kunne redegøre for mekanismerne bag udbredelsen af nerveimpulser. Måske pensums sværeste stof forståelsesmæssigt, så fortvivl ikke hvis
Immunforsvar. Kampen i kroppen. Immunforsvar. Praxis Nyt Teknisk Forlag. Immunforsvar kampen i kroppen. Ib Søndergaard Mads Duus Hjortsø
 Immunforsvar kampen i kroppen Vores krop bliver dagligt angrebet af bakterier, virus, parasitter og mikrosvampe. Men vi har heldigvis et immunforsvar, der er i stand til at kæmpe mod disse angreb. Forklaringen
Immunforsvar kampen i kroppen Vores krop bliver dagligt angrebet af bakterier, virus, parasitter og mikrosvampe. Men vi har heldigvis et immunforsvar, der er i stand til at kæmpe mod disse angreb. Forklaringen
MULTIPLE CHOICE OPGAVER.
 Hvert svar vægtes 1 point Opgave MULTIPLE CHOICE OPGAVER. Svar 1.1 A 1.2 B 1.3 G 2 A 3 C 4 B 5 A 6 C 7 D 8.1 E 8.2 A 8.3 F 9 A 10 D 11.1 A 11.2 M 11.3 I 12 E 13 A 14 C 15 E 16 B 17 A 18 A 19 B Side 1 af
Hvert svar vægtes 1 point Opgave MULTIPLE CHOICE OPGAVER. Svar 1.1 A 1.2 B 1.3 G 2 A 3 C 4 B 5 A 6 C 7 D 8.1 E 8.2 A 8.3 F 9 A 10 D 11.1 A 11.2 M 11.3 I 12 E 13 A 14 C 15 E 16 B 17 A 18 A 19 B Side 1 af
Almen cellebiologi Membrantransport
 Almen cellebiologi 2007 Membrantransport Kap. 12, s. 389-420 Forelæsning 3 Stine Falsig Pedersen sfpedersen@aki.ku.dk 35321546/room 1527 De næste tre forelæsninger: 1. - Membranen og membran-transport
Almen cellebiologi 2007 Membrantransport Kap. 12, s. 389-420 Forelæsning 3 Stine Falsig Pedersen sfpedersen@aki.ku.dk 35321546/room 1527 De næste tre forelæsninger: 1. - Membranen og membran-transport
HVAD BESTÅR BLODET AF?
 i Danmark HVAD BESTÅR BLODET AF? HVAD BESTÅR BLODET AF? Blodet er et spændende univers med forskellige bittesmå levende bestanddele med hver deres specifikke funktion. Nogle gør rent, andre er skraldemænd
i Danmark HVAD BESTÅR BLODET AF? HVAD BESTÅR BLODET AF? Blodet er et spændende univers med forskellige bittesmå levende bestanddele med hver deres specifikke funktion. Nogle gør rent, andre er skraldemænd
Immunologi. AMU kursus
 Immunologi AMU kursus Udarbejdet af Morten Kobæk Larsen 2012 Indledning Mennesker og dyr er konstant truet af sygdomsfremkaldende mikroorganismer, f.eks. virus og bakterier, og ville hurtigt blive bukke
Immunologi AMU kursus Udarbejdet af Morten Kobæk Larsen 2012 Indledning Mennesker og dyr er konstant truet af sygdomsfremkaldende mikroorganismer, f.eks. virus og bakterier, og ville hurtigt blive bukke
Sommereksamen 2011. Uddannelse: Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
 1/14 Sommereksamen 2011 Titel på kursus: Det hæmatologiske system og immunsystemet Uddannelse: Bacheloruddannelsen i Medicin/Medicin med industriel specialisering Semester: 2. semester Eksamensdato: 06.
1/14 Sommereksamen 2011 Titel på kursus: Det hæmatologiske system og immunsystemet Uddannelse: Bacheloruddannelsen i Medicin/Medicin med industriel specialisering Semester: 2. semester Eksamensdato: 06.
Tema-F3 Virusinfektioner Modul b10 E08
 Forelæsningen tager udgangspunkt i læge Peter Ludvig Panum s observationer fra mæslingeepidemien på Færøerne i 1846. Panums arbejde blev en hjørnesten i vor forståelse af epidemiske sygdomme, hvor han
Forelæsningen tager udgangspunkt i læge Peter Ludvig Panum s observationer fra mæslingeepidemien på Færøerne i 1846. Panums arbejde blev en hjørnesten i vor forståelse af epidemiske sygdomme, hvor han
Syge- og reeksamen august 2011 Med svar. Uddannelse: Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
 1/10 Syge- og reeksamen august 2011 Med svar Titel på kursus: Det hæmatologiske system og immunsystemet Uddannelse: Bacheloruddannelsen i Medicin/Medicin med industriel specialisering Semester: 2. semester
1/10 Syge- og reeksamen august 2011 Med svar Titel på kursus: Det hæmatologiske system og immunsystemet Uddannelse: Bacheloruddannelsen i Medicin/Medicin med industriel specialisering Semester: 2. semester
Nyrefysiologi: Renal ionbehandling, kap. 8 Anne Agersted, 5. sem. efterår 2013 CALCIUM HOMEOSTASEN
 CALCIUM HOMEOSTASEN 35 % af Ca +2 indholdet i en normal voksen persons kost absorberes gennem mavetarmkanalen. Den ekstracellulære Ca +2 pool indeholder ca. 25 mmol, hvorfra Ca +2 udskilles i urinen. PTH:
CALCIUM HOMEOSTASEN 35 % af Ca +2 indholdet i en normal voksen persons kost absorberes gennem mavetarmkanalen. Den ekstracellulære Ca +2 pool indeholder ca. 25 mmol, hvorfra Ca +2 udskilles i urinen. PTH:
Thomas Feld Biologi 05-12-2007
 1 Indledning: Kredsløbet består af to dele - Det lille kredsløb (lungekredsløbet) og det store kredsløb (det systemiske kredsløb). Det systemiske kredsløb går fra hjertets venstre hjertekammer gennem aorta
1 Indledning: Kredsløbet består af to dele - Det lille kredsløb (lungekredsløbet) og det store kredsløb (det systemiske kredsløb). Det systemiske kredsløb går fra hjertets venstre hjertekammer gennem aorta
På grund af reglerne for copyright er det ikke muligt at lægge figurer fra lærebøger på nettet. Derfor har jeg fjernet figurerne fra slides ne, men
 På grund af reglerne for copyright er det ikke muligt at lægge figurer fra lærebøger på nettet. Derfor har jeg fjernet figurerne fra slides ne, men skrevet hvorfra de er taget. De tre bøger, hvorfra illustrationerne
På grund af reglerne for copyright er det ikke muligt at lægge figurer fra lærebøger på nettet. Derfor har jeg fjernet figurerne fra slides ne, men skrevet hvorfra de er taget. De tre bøger, hvorfra illustrationerne
Repetition. Carsten Reidies Bjarkam. Professor, Overlæge, Ph.D. Neurokirurgisk Afdeling Aalborg Universitetshospital
 Repetition Carsten Reidies Bjarkam. Professor, Overlæge, Ph.D. Neurokirurgisk Afdeling Aalborg Universitetshospital Præ- & Postnatale udviklingsforandringer Hardware vs Software Migration (cerebellum)
Repetition Carsten Reidies Bjarkam. Professor, Overlæge, Ph.D. Neurokirurgisk Afdeling Aalborg Universitetshospital Præ- & Postnatale udviklingsforandringer Hardware vs Software Migration (cerebellum)
Sommereksamen 2013 Med korte, vejledende svar
 1/10 Sommereksamen 2013 Med korte, vejledende svar Titel på kursus: Uddannelse: Semester: Eksamensdato: Tid: Bedømmelsesform Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin
1/10 Sommereksamen 2013 Med korte, vejledende svar Titel på kursus: Uddannelse: Semester: Eksamensdato: Tid: Bedømmelsesform Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin
Atomic force mikroskopi på blodceller
 1 Atomic force mikroskopi på blodceller Problemstilling: Problemstillingen eleven bliver sat overfor er: Hvad er atomic force mikroskopi, og hvordan kan det bruges til at studere blodceller på nanometerskala?
1 Atomic force mikroskopi på blodceller Problemstilling: Problemstillingen eleven bliver sat overfor er: Hvad er atomic force mikroskopi, og hvordan kan det bruges til at studere blodceller på nanometerskala?
CYP7A1 (0,1 nm) CYP7A1 (0nM) UBIC (0,1 nm)
 Opgave 1 Leveren spiller en central rolle i lipid metabolismen og i opretholdelse af lipid homeostasen i hele kroppen. Lipidmetabolismen er fejlreguleret hos blandt andet svært overvægtige personer samt
Opgave 1 Leveren spiller en central rolle i lipid metabolismen og i opretholdelse af lipid homeostasen i hele kroppen. Lipidmetabolismen er fejlreguleret hos blandt andet svært overvægtige personer samt
Studiespørgsmål til blod og lymfe
 Studiespørgsmål til blod og lymfe 1. Hvor meget blod har du i kroppen (ca.)? 2. Hvad forstås ved plasma og hvad består plasma af? 3. Giv eksempler på vigtige plasmaproteiner og redegør for deres funktioner
Studiespørgsmål til blod og lymfe 1. Hvor meget blod har du i kroppen (ca.)? 2. Hvad forstås ved plasma og hvad består plasma af? 3. Giv eksempler på vigtige plasmaproteiner og redegør for deres funktioner
Studienummer: MeDIS Exam 2015. Husk at opgive studienummer ikke navn og cpr.nr. på alle ark, der skal medtages i bedømmelsen
 MeDIS Exam 2015 Titel på kursus: Uddannelse: Semester: Videregående biokemi og medicinudvikling Bachelor i Medis 5. semester Eksamensdato: 26-01-2015 Tid: kl. 09.00-11.00 Bedømmelsesform 7-trin Vigtige
MeDIS Exam 2015 Titel på kursus: Uddannelse: Semester: Videregående biokemi og medicinudvikling Bachelor i Medis 5. semester Eksamensdato: 26-01-2015 Tid: kl. 09.00-11.00 Bedømmelsesform 7-trin Vigtige
Spm. A: Hvad viser data i Figur 1?
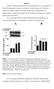 Opgave 1 Leptin er et plasma proteinhormon der primært produceres af og secerneres fra fedtceller (adipocytter). Leptin, der er kodet af ob (obecity) genet, er 16 kda stort. Leptins fysiologiske funktion
Opgave 1 Leptin er et plasma proteinhormon der primært produceres af og secerneres fra fedtceller (adipocytter). Leptin, der er kodet af ob (obecity) genet, er 16 kda stort. Leptins fysiologiske funktion
Translationel kræftforskning og individbaseret behandling med udgangspunkt i brystkræft og et konkret forskningsprojekt
 Translationel kræftforskning og individbaseret behandling med udgangspunkt i brystkræft og et konkret forskningsprojekt Anne-Sofie Schrohl Rasmussen, cand.scient. (humanbiologi) Faggruppen Patobiologi,
Translationel kræftforskning og individbaseret behandling med udgangspunkt i brystkræft og et konkret forskningsprojekt Anne-Sofie Schrohl Rasmussen, cand.scient. (humanbiologi) Faggruppen Patobiologi,
Komplementsystemets fysiologi og patofysiologi. Søren Hansen, Cancer og Inflammationsforskning, WP21-1, SHansen@health.sdu.dk
 Komplementsystemets fysiologi og patofysiologi C3 Søren Hansen, Cancer og Inflammationsforskning, WP21-1, SHansen@health.sdu.dk Detaljeret - aktiveringsmekanismer - opbygning - effektorfunktioner (incl.
Komplementsystemets fysiologi og patofysiologi C3 Søren Hansen, Cancer og Inflammationsforskning, WP21-1, SHansen@health.sdu.dk Detaljeret - aktiveringsmekanismer - opbygning - effektorfunktioner (incl.
Skriftlig eksamen juni 2018
 Studienummer: 1/11 Skriftlig eksamen juni 2018 Titel på kursus: Immunsystemet (ny studieordning, 2017) Uddannelse: Semester: Medicin og medicin med industriel specialisering 2. semester Eksamensdato: 18.
Studienummer: 1/11 Skriftlig eksamen juni 2018 Titel på kursus: Immunsystemet (ny studieordning, 2017) Uddannelse: Semester: Medicin og medicin med industriel specialisering 2. semester Eksamensdato: 18.
[ ] =10 7,4 = 40nM )
![[ ] =10 7,4 = 40nM ) [ ] =10 7,4 = 40nM )](/thumbs/22/1453135.jpg) Syre og base homeostasen (BN kap. 9) Nyrefysiologi: Syre/base homeostase, kap. 9 Normal ph i arterielt plasma: 7,4 ( plasma H + [ ] =10 7,4 = 40nM ) o ECV indhold af H+: 40 nm (ph 7,4) x 15 l =600 nmol
Syre og base homeostasen (BN kap. 9) Nyrefysiologi: Syre/base homeostase, kap. 9 Normal ph i arterielt plasma: 7,4 ( plasma H + [ ] =10 7,4 = 40nM ) o ECV indhold af H+: 40 nm (ph 7,4) x 15 l =600 nmol
Signalmekanismer i immunforsvaret. Umahro Cadogan Sundhedsrevolutionær-uddannelsen
 Signalmekanismer i immunforsvaret Umahro Cadogan Sundhedsrevolutionær-uddannelsen 1 Nano Faktor kappa Beta Forkortet NFkB Er et intracellulært signal der får celler til at aflæse gener der koder for inflammation
Signalmekanismer i immunforsvaret Umahro Cadogan Sundhedsrevolutionær-uddannelsen 1 Nano Faktor kappa Beta Forkortet NFkB Er et intracellulært signal der får celler til at aflæse gener der koder for inflammation
Regulation af immunresponset
 Regulation af immunresponset A-kursus i teoretisk immunologi Odense, 15. april 2015 Søren T. Lillevang Klinisk Immunologisk Afdeling Odense Universitetshospital Krav til det adaptive immunsystem I steady
Regulation af immunresponset A-kursus i teoretisk immunologi Odense, 15. april 2015 Søren T. Lillevang Klinisk Immunologisk Afdeling Odense Universitetshospital Krav til det adaptive immunsystem I steady
Skriftlig eksamen april 2017
 Skriftlig eksamen april 2017 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Medicin og medicin med industriel specialisering 2. semester Eksamensdato: 6. april 2017 Tid:
Skriftlig eksamen april 2017 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Medicin og medicin med industriel specialisering 2. semester Eksamensdato: 6. april 2017 Tid:
Nervesystemets sygdomme meningitis og hovedpine
 Nervesystemets sygdomme meningitis og hovedpine Meningitis En alvorlig infektion i centralnervesystemet En betændelsestilstand i hjernehinderne og i det subaraknoidale rum Fig. 10.16 1 Årsag til meningitis
Nervesystemets sygdomme meningitis og hovedpine Meningitis En alvorlig infektion i centralnervesystemet En betændelsestilstand i hjernehinderne og i det subaraknoidale rum Fig. 10.16 1 Årsag til meningitis
Studiespørgsmål til celler og væv
 Studiespørgsmål til celler og væv 1. Hvad er en celle og hvad vil det sige, at den har et stofskifte? 2. Tegn en figur af en celle og navngiv, på figuren, de vigtigste organeller. Hvad er navnet på den
Studiespørgsmål til celler og væv 1. Hvad er en celle og hvad vil det sige, at den har et stofskifte? 2. Tegn en figur af en celle og navngiv, på figuren, de vigtigste organeller. Hvad er navnet på den
Studieplan Biomedicin og humanbiologi Semester 5
 OMRÅDET FOR SUNDHEDSUDDANNELSER Studieplan Biomedicin og humanbiologi Semester 5 Bioanalytikeruddannelsen i Odense Efterår 2017 Semester 5 Indhold 1. Fagets fokus og emner... 3 2. Lektionsplan... 4 3.
OMRÅDET FOR SUNDHEDSUDDANNELSER Studieplan Biomedicin og humanbiologi Semester 5 Bioanalytikeruddannelsen i Odense Efterår 2017 Semester 5 Indhold 1. Fagets fokus og emner... 3 2. Lektionsplan... 4 3.
Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab Træning øger cellulært genbrug
 Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab Træning øger cellulært genbrug Træning øger genbrug i museceller. Er det derfor, at motion er
Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab Træning øger cellulært genbrug Træning øger genbrug i museceller. Er det derfor, at motion er
TrP Akupunktur kursus
 TrP Akupunktur kursus Hvad er jeres forventninger og erfaringer med emnet? Vores forventninger er at i bliver fortrolige med TrP aku, og at i føler jer rustet til at behandle med nåle overfor visse smertetilstande.
TrP Akupunktur kursus Hvad er jeres forventninger og erfaringer med emnet? Vores forventninger er at i bliver fortrolige med TrP aku, og at i føler jer rustet til at behandle med nåle overfor visse smertetilstande.
Biomarkører. Lars P. Nielsen Professor, overlæge Speciallæge i klinisk mikrobiologi, Statens Serum Ins>tut, Biomarkørlaboratoriet. LPN@ssi.
 Biomarkører Lars P. Nielsen Professor, overlæge Speciallæge i klinisk mikrobiologi, Statens Serum Ins>tut, Biomarkørlaboratoriet. LPN@ssi.dk Biomarkører Molekyler, som afspejler forekomst og udvikling
Biomarkører Lars P. Nielsen Professor, overlæge Speciallæge i klinisk mikrobiologi, Statens Serum Ins>tut, Biomarkørlaboratoriet. LPN@ssi.dk Biomarkører Molekyler, som afspejler forekomst og udvikling
Proximal reabsorption
 SAU2 Nyrefunktion 2 Undervisning med Charlotte Mehlin Sørensen REABSORPTION I NEFRONET: Al reabsorption i nyrene er drevet af Na/KPumpen! Proksimale tubulus, S1 (figur A): Proksimale tubulus, S3 (figur
SAU2 Nyrefunktion 2 Undervisning med Charlotte Mehlin Sørensen REABSORPTION I NEFRONET: Al reabsorption i nyrene er drevet af Na/KPumpen! Proksimale tubulus, S1 (figur A): Proksimale tubulus, S3 (figur
Teksten er stillet til rådighed af Scleroseforeningen. Se mere på foreningens hjemmeside: www.scleroseforeningen.dk
 Sclerose Teksten er stillet til rådighed af Scleroseforeningen. Se mere på foreningens hjemmeside: www.scleroseforeningen.dk Hvad er MS? Multipel sclerose (MS) er en sygdom, som angriber centralnervesystemet,
Sclerose Teksten er stillet til rådighed af Scleroseforeningen. Se mere på foreningens hjemmeside: www.scleroseforeningen.dk Hvad er MS? Multipel sclerose (MS) er en sygdom, som angriber centralnervesystemet,
Forårseksamen Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
 1 Forårseksamen 2015 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato: 10. april
1 Forårseksamen 2015 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato: 10. april
Eksamensbesvarelse 16. januar 2007. Karakteren 02 Opgave 1
 Eksamensbesvarelse 16. januar 2007 Karakteren 02 Opgave 1 Mitokondrierne danner energi til cellens eget brug ATP ADP energi(atp) Cellekernen indeholder vores genetiske arvemateriale DNA. I en celle er
Eksamensbesvarelse 16. januar 2007 Karakteren 02 Opgave 1 Mitokondrierne danner energi til cellens eget brug ATP ADP energi(atp) Cellekernen indeholder vores genetiske arvemateriale DNA. I en celle er
ANATOMI for tandlægestuderende. Henrik Løvschall Anatomisk afsnit Afd. for Tandsygdomslære Odontologisk Institut Århus Universitet
 ANATOMI for tandlægestuderende Henrik Løvschall Anatomisk afsnit Afd. for Tandsygdomslære Odontologisk Institut Århus Universitet CELLEBIOLOGI celleform kubisk celle pladeformet celle prismatisk celle
ANATOMI for tandlægestuderende Henrik Løvschall Anatomisk afsnit Afd. for Tandsygdomslære Odontologisk Institut Århus Universitet CELLEBIOLOGI celleform kubisk celle pladeformet celle prismatisk celle
Det lyder enkelt, men for at forstå hvilket ærinde forskerne er ude i, er det nødvendigt med et indblik i, hvordan celler udvikles og specialiseres.
 Epigenetik Men hvad er så epigenetik? Ordet epi er af græsk oprindelse og betyder egentlig ved siden af. Genetik handler om arvelighed, og hvordan vores gener videreføres fra generation til generation.
Epigenetik Men hvad er så epigenetik? Ordet epi er af græsk oprindelse og betyder egentlig ved siden af. Genetik handler om arvelighed, og hvordan vores gener videreføres fra generation til generation.
Hvad er Myelodysplastisk syndrom (MDS)?
 Hvad er Myelodysplastisk syndrom (MDS)? En information til patienter og pårørende Denne folder støttes af: Patientforeningen for Lymfekræft, Leukæmi og MDS Velkommen Dette hæfte er udviklet for at give
Hvad er Myelodysplastisk syndrom (MDS)? En information til patienter og pårørende Denne folder støttes af: Patientforeningen for Lymfekræft, Leukæmi og MDS Velkommen Dette hæfte er udviklet for at give
Imatinib til behandling af GIST
 Imatinib til behandling af GIST - et case study af targeted therapeutics Treatment of GIST with Imatinib a case study of targeted therapeutics December 2006 Molekylærbiologi Modul I Roskilde Universitetscenter
Imatinib til behandling af GIST - et case study af targeted therapeutics Treatment of GIST with Imatinib a case study of targeted therapeutics December 2006 Molekylærbiologi Modul I Roskilde Universitetscenter
Dansk resumé for begyndere
 Dansk resumé for begyndere Dansk resumé for begyndere Dette afsnit introducerer bakteriel genregulation for enhver uden forudgående kendskab til dette emne. Alle nødvendige, videnskabelige betegnelser
Dansk resumé for begyndere Dansk resumé for begyndere Dette afsnit introducerer bakteriel genregulation for enhver uden forudgående kendskab til dette emne. Alle nødvendige, videnskabelige betegnelser
sikrer, at enhver stigning i muskelarbejde er præcist matchet af en stigning i O 2
 RESUMÉ Den tætte kobling mellem blodgennemstrømning, O 2 tilførsel og metabolisme er essentiel da denne sikrer, at enhver stigning i muskelarbejde er præcist matchet af en stigning i O 2 tilførsel. Identificering
RESUMÉ Den tætte kobling mellem blodgennemstrømning, O 2 tilførsel og metabolisme er essentiel da denne sikrer, at enhver stigning i muskelarbejde er præcist matchet af en stigning i O 2 tilførsel. Identificering
Reeksamen Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering
 Studienummer: 1 Reeksamen 2016 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato:
Studienummer: 1 Reeksamen 2016 Titel på kursus: Uddannelse: Semester: Det hæmatologiske system og immunsystemet Bacheloruddannelsen i Medicin/Medicin med industriel specialisering 2. semester Eksamensdato:
Leucocyt-forstyrrelser
 Leucocyt-forstyrrelser Udarbejdet af KLM med inspiration fra Kako S4 pensum fra bogen Hæmatologi af H. Karle Granulocytsygdomme Lymfocytsygdomme Leukæmier M-proteinæmi Analyser Referenceområde [LKC]: 3.0
Leucocyt-forstyrrelser Udarbejdet af KLM med inspiration fra Kako S4 pensum fra bogen Hæmatologi af H. Karle Granulocytsygdomme Lymfocytsygdomme Leukæmier M-proteinæmi Analyser Referenceområde [LKC]: 3.0
Ekstrakter - rammebevillinger
 Ekstrakter - rammebevillinger Professor Bente Vilsen Aarhus Universitet Biokemi 4.736.000 kr. Natrium-kalium pumpen sidder i membranen på alle celler og er livsnødvendig for at opretholde deres funktion.
Ekstrakter - rammebevillinger Professor Bente Vilsen Aarhus Universitet Biokemi 4.736.000 kr. Natrium-kalium pumpen sidder i membranen på alle celler og er livsnødvendig for at opretholde deres funktion.
Opgave 1 Listeria. mørkviolette bakteriekolonier, se figur 1a. og b. 1. Angiv reaktionstypen for reaktion. 1 vist i figur 1b.
 Opgave 1 Listeria Bakterien Listeria monocytogenes kan være sygdomsfremkaldende for personer, der i forvejen er svækkede. For at identificere Listeria kan man anvende indikative agarplader. Her udnyttes
Opgave 1 Listeria Bakterien Listeria monocytogenes kan være sygdomsfremkaldende for personer, der i forvejen er svækkede. For at identificere Listeria kan man anvende indikative agarplader. Her udnyttes
