Institut for Molekylær Biologi
|
|
|
- Holger Kristiansen
- 8 år siden
- Visninger:
Transkript
1 Indholdsfortegnelse INDHOLDSFORTEGNELSE HOLDFORDELING...4 HOLD A...4 HOLD B...5 HOLD C...6 OVERSIGT OVER ØVELSESKURSET...7 LABORATORIEREGLER....8 HYGIEJNE....8 ARBEJDSPLADS...8 SIKKERHEDSREGLER...9 RAPPORTKRAV...11 LOV OM GENTEKNOLOGI LÆRERE, INSTRUKTORER OG LABORANTER...13 ØVELSE 1: SITE DIRECTED MUTAGENESE VALG AF PRIMERE VALG AF DNA POLYMERASE...19 VALG AF DNA TEMPLATE REFERENCER MUTAGENESE, KORT OVERSIGT MUTAGENESE, DETALJERET PLAN...23 SPØRGSMÅL TIL RAPPORT, ØVELSE ØVELSE 2: REAL TIME PCR...27 ØVELSESVEJLEDNINGENS INDHOLD...27 OVERORDENT FORMÅL...27 Eksempler på anvendelse af real time PCR fra videnskabelige literatur...27 Generelt om brugen af real time PCR...28 Hvorledes virker real time PCR?...29 Sammenligning af SYBR-Green og TaqMan-probe assays...29 PCR Instrumentet MX Amplifikationskurve og temperatur-dissociationskurve...31 Kvantificering af fluorescensdata, amplifikation og effektivitet...34 SPECIFIKKE FORMÅL MED ØVELSEN...37 INGREDIENSER VED ØVELSENS FORSØG...37 FREMGANGSMÅDE...39 Forsøg 1: SNP-analyse (polymorfier)
2 Indholdsfortegnelse Forsøg 2: Genekspression: myostatin og HO-1 mrna bestemmelse ved brug af TaqMan prober...40 Forsøg 3: Genekspression: myostatin og HO-1 mrna bestemmelse ved brug af SYBRGreen...41 BEHANDLING AF RESULTATER OG RAPPORT...43 ØVELSE 3: 2-HYBRID-ANALYSE...44 REFERENCER HYBRID-ANALYSE, EN KORT OVERSIGT HYBRID ANALYSE, DETALJERET PLAN HYBRID-ANALYSE, SPØRGSMÅL TIL RAPPORT...51 ØVELSE 4: PULL-DOWN-ANALYSE...52 REFERENCER...54 PULL-DOW- ANALYSE, KORT OVERSIGT...55 PULL-DOWN-ANALYSE, DETALJERET PLAN...56 PULL-DOWN-ANALYSE, SDS-PAGE & WESTERNBLOT...58 PULL-DOWN-ANALYSE, SPØRGSMÅL TIL RAPPORT...60 ØVELSE 5: SUBCELLULÆR LOKALISERING AF GFP-FUSIONS-PROTEINER...61 REFERENCER...63 SUBCELLULÆR LOKALISERING, EN KORT OVERSIGT...64 SUBCELLULÆR LOKALISERING AF GFP-FUSIONSPROTEINER, DETALJERET PLAN64 SUBCELLULÆR LOKALISERING, SPØRGSMÅL TIL RAPPORT...64 ØVELSE 6: HETEROLOG EKSPRESSION AF NA,K-PUMPEN I SACCHAROMYCES CEREVISIAE LIGEVÆGTSBINDING AF OUABAIN TIL NA,K-ATPASE LIGEVÆGTSBINDING AF OUABAIN TIL NA,K-ATPASE REFERENCER HETEROLOG EXPRESSION, DETALJERET PLAN SPØRGSMÅL TIL RAPPORT, ØVELSE ØVELSE 7: KLONING I PROKARYOTER...85 KLONING I PROKARYOTER, KORT OVERSIGT...92 KLONING I PROKARYOTER, DETALJERET PLAN...93 SPØRGSMÅL TIL RAPPORT, ØVELSE ØVELSE 8: ANVENDELSE AF NETBASEREDE VÆRKTØJER ØVELSE 9: TRANSFORMATION AF GÆR TRANSFORMATION AF GÆR, OVERSIGT
3 Indholdsfortegnelse TRANSFORMATION AF GÆR, DETALJERET PLAN RAPPORT SKEMA SPØRGSMÅL TIL RAPPORT, ØVELSE ØVELSE 10: ANVENDELSE AF REPORTERGENER OVERSIGT OVER ØVELSE APPENDIX STRATEGIER TIL FORØGELSE AF FRAKTIONEN AF REKOMBINANTER VED KLONING AGAROSE GELELEKTROFORESE FREMSTILLING AF AGAROSEGEL - 0.7% BRUG AF RESTRIKTIONSENZYMER Generel procedure for restriktionsskæring af DNA OPRENSNING AF DNA FRAGMENTER FRA AGAROSE GEL VED HJÆLP AF GFX PCR DNA AND GEL BAND PURIFICATION KIT FRA AMERSHAM BIOTECH DEFOSFORYLERING ALKOHOLFÆLDNING AF DNA OG RNA FENOLISERING AF DNA LIGERING TRANSFORMATION AF E.COLI Kompetente celler af E. coli: Kompetente e.coli celler til nedfrysning PLASMID MINIPREPARATION FRA E. COLI MED GFX TM MICRO PLASMID PREP KIT PLASMID PREPARATION MED FERMENTAS GENEJET TM PLASMID MINIPREP KIT..131 TRANSFORMATION AF GÆR OPRENSNING AF DNA FRA OPLØSNING MED GFXTM PCR DNA AND GEL BAND PURIFICATION KIT OPRENSNING AF DNA FRAGMENTER FRA AGAROSEGELER MED GFXTM PCR DNA AND GEL PURIFICATION KIT LIGEVÆGTSBINDING AF [ 3 H]-OUABAIN TIL GÆRMEMBRANER MÅLING AF β-galaktosidase AKTIVITET PÅ OPRENSEDE CYTOSOL FRAKTIONER MEDIER TIL GÆR OG BAKTERIER FREMSTILLING AF PLADER STANDARD BUFFERE ISOLERING AF GENOMISK DNA FRA FULDBLOD OPRENSNING AF TOTAL RNA FRA VÆV MED AF TRI REAGENT REVERS TRANSSKRIPTION TIL GENEKSPRESSION TAQMAN-PROBER SYBR-GREEN PRIMERE
4 Holdfordeling HOLDFORDELING HOLD A Hold Navne Amossen, Jeppe Resen 1 Andersen, Troels Askhøj 2 Birch, Carsten Bodholdt, Rasmus Poul 3 Christiansen, Kasper Melchior Christophersen, Daniel 4 Davidsen, Peter Kåre Ghadban, Ihab Zohair 5 Gillberg, Linn Maria Ellinor Goth, Christoffer Knak 6 Haarder, Simon Hansen, Andreas Martin 7 Hansen, Niels Ulrik Brandt Hansen, Thomas Arn 8 Hjort, Line Hougaard, Camilla Svare 9 Isidor, Marie Sophie Jaafar, Mostafa 10 Johannsen, Sine Kalsbeek-Hansen, Halfdan 11 Langkilde, Rasmus Haugaard Larsen, Jesper 12 Lolle, Signe Lund, Jeanett 4
5 Holdfordeling HOLD B Hold Navne 13 Martin, Matias Esben Mathiasen, Signe 14 Mellerup, Anders Merrild, Marie Porret 15 Moltke, Ida Møller, Jacob 16 Nielsen, Dennis Kim Nøhr, Mark Klitgaard 17 Pedersen, Annemarie Aarup Pedersen, Maria Hauge 18 Plum, Christoffer Milo Rasmussen, Magnus Wohlfahrt 19 Rasmussen, Rikke Rosberg, Mette Romer 20 Svendsen, Thomas Gerner Sørensen, Grith Parmo 21 Sørensen, Trine Holst Usman, Rabia 22 Vestergaard, Maj Linea Wessely, Dominik 23 Wibroe, Peter Popp Winther, Malene 24 5
6 Holdfordeling HOLD C Hold 25 Navne
7 Laboratorieregler OVERSIGT OVER ØVELSESKURSET Nedenstående skema viser hvor og hvornår hvert enkelt hold skal lave hvilken øvelse. Laboratorium 108 Laboratorium 112 Dato Øvelse Underviser Hold Øvelse Underviser Hold 12/11 3, 4, 5 RHP A 6, 8, 10 DM & PAP B 14/11 3, 4, 5 RHP A 6, 8, 10 DM & PAP B 19/11 3, 4, 5 RHP A 6, 8, 10 DM & PAP B 21/11 3, 4, 5 RHP A 6, 8, 10 DM & PAP B 26/11 3, 4, 5 RHP B 1, 2 HP & SM A 28/11 3, 4, 5 RHP B 1, 2 HP & SM A 3/12 3, 4, 5 RHP B 1, 2 HP & SM A 5/12 3, 4, 5 RHP B 1, 2 HP & SM A 10/12 7, 9 BR B 6, 8, 10 DM & PAP A 12/12 7, 9 BR B 6, 8, 10 DM & PAP A 17/12 7, 9 BR B 6, 8, 10 DM & PAP A 19/12 7, 9 BR B 6, 8, 10 DM & PAP A 7/1 7, 9 BR A 1, 2 HP & SM B 9/1 7, 9 BR A 1, 2 HP & SM B 14/1 7, 9 BR A 1, 2 HP & SM B 16/1 7, 9 BR A 1, 2 HP & SM B Undervisere: BR, Birgitte Regenberg; DM, Daniel Mucanovic; HP, Henriette Pilegaard; PAP, Per Amstrup Pedersen; RHP, Rasmus Hartmann-Petersen; SM, Stine Meinild. 7
8 Laboratorieregler LABORATORIEREGLER. Da arbejde med genmodificerede organismer kræver specielle forholsregler er det vigtigt at sætte sig ind i disse. Se ogå opslaget i laboratoriet med sikkerhedsregler. HYGIEJNE. Overtøj og tasker må ikke medbringes i øvelseslokalet, kun papir til optagelse af notater. Der skal altid bæres kittel i laboratoriet. Kitler udleveres og sendes til vask af instituttet Før laboratoriet forlades skal man vaske hænder med desinficerende sæbe Det er forbudt at drikke og spise i laboratoriet Det er forbudt at ryge i laboratorier, undervisningslokaler og gange mellem disse lokaler ARBEJDSPLADS. Bunsenbrændere skal altid stå på vågeblus af hensyn til varmeudvikling. Ved apparatfejl af centrifuger, vandbade fotometre etc. må man ikke selv begynde at udbedre fejlen men overlade det til lærer/instruktor. Efter endt øvelsesdag skal arbejdspladsen være omhyggeligt rengjort og tørret over med papir vædet i 70% ethanol. Der står en flaske med 70% etanol på hver arbejdsplads. Alle glas og kolber der ikke har været i kontakt med biologisk materiale sættes til opvask. Glasvarer der har været i kontakt med biologisk materiale skal sættes til autoklavering i de dertil indrettede grønne plastikkasser mærket genmodificeret affald og indholdet må ikke hældes i vasken. Reagensglas anbringes i trådkurve. Opløsninger der har været i kontakt med biologisk materiale skal opsamles i de i laboratoriet opstillede flasker til biologisk affald. Fast affald, der har været i kontakt med biologisk materiale, skal opsamles i de på hver arbejdsplads opstillede spande med autoklaveposer. 8
9 Laboratorieregler I tilfælde af mindre spild med genmodificeret materiale renses grundigt med den 0,1% Rhodalon opløsning der står på endebordet i laboratoriet og læreren kontaktes. I tilfælde af større mængder spild kontaktes læreren staks. Kemikalieaffald hældes i mærkede kontainere. Brugte kanyler opsamles i de opstillede plastikdunke mærket kanyler. Der skal slukkes for vandbade ved lyskontakten før man går. SIKKERHEDSREGLER. Arbejde med mikroorganismer indebærer altid en vis risiko for infektion. Det er derfor vigtigt at overholde de almindelige og eventuelt de skærpede laboratorieregler. Husk at laboratorieregler ikke erstatter sund fornuft. Tænk dig om før du udfører et forsøg i laboratoriet. Husk at du ikke arbejder alene; overhold reglerne både for din egen og dine medstuderendes skyld. Arbejde med ukendte mikroorganismer kan frembyde sundhedsfare med risiko for infektion og kræver skærpede laboratorieregler. Arbejde med kendte ikke-patogene mikroorganismer som veldefinerede svampearter, gærceller eller veldefinerede bakteriestammer som Escherichia coli (K-12, B, B/r) eller mælkesyrebakterier kræver kun almindelig laboratoriehygiejne som beskrevet nedenfor: 1. Vask hyppigt hænder med sæbe og tør dem med engangsservietter, især når laboratoriet forlades 2. Berør ikke ansigtet, især ikke næse og mund. Ved indtag gennem munden spyttes ud og skylles adskillige gange. Risikoen for infektion gennem munden er dog langt mindre end gennem rifter i huden 3. Spis, drik og ryg aldrig i laboratoriet 4. Undgå direkte berøring med mikroorganismerne og smittet materiale 5. Undgå aerosol-dannelse ved åbning, overhældning og spild. Der dannes især 9
10 Laboratorieregler aerosoler ved whirly-mixing, sonikering og pipettering 6. Brug altid kittel 7. Opsaml brugte glaspipetter i spande med Rodalon 8. Inficeret udstyr (pipette, podenål, tandstikker m.m.) må ikke lægges på bordene men opsamles i de autoklaveposer der er opstillet ved hver arbejdsplads. Inficeret glasudstyr anbringes i den dertil indrettede plastikkasse mærket genmodificeret affald. 8. Desinficer bordene med 70% ethanol ved slutning af øvelsen 10
11 August Krogh Institutet Rapportkrav RAPPORTKRAV. Til hver øvelse hører et eller flere rapportblade, der beskriver hvorledes data skal organisres og analyseres. Desuden er der en del spørgsmål, som skal besvares skriftligt i rapporten. I rapporten er det ikke nødvendigt at gentage teksten fra øvelsesvejledningen, men husk at gøre rede for afvigelser fra forløbet og eventuelle nye erfaringer med teknik og metoder. Hvis forsøget mislykkes gøres rede for forløbet og årsagen til at fejl opstod. Hvis det er muligt skaffes en fotokopi af resultater fra kolleger med angivelse af kilde og rapporten skrives på basis af disse data. Rapporter afleveres senest to uger efter afslutning af det samlede øvelseskursus. Rapporter afleveres enten til læreren/instruktoren eller i dueslaget på øvelsesgangen. Rapporterne kan også afleveres ved . Rapporterne returneres også hertil enten som godkendte eller med krav om rettelsen. I må selv lige hold øje med om de er godkendt eller der skal rettes i dem. 11
12 Lov om Genteknologi LOV OM GENTEKNOLOGI. Se lovteksten på 12
13 Lærere og instruktorer LÆRERE, INSTRUKTORER OG LABORANTER. Øvelse 1: Lærer: Adjunkt, Ph.D. Stine Meinild Instruktor: Cand. Scient. Mie Jensen Øvelse 2: Lærer: Lektor, Ph.D. Henriette Pilegaard Instruktor: Stud. Scient Helle Adser og Anne Hviid Jakobsen Øvelse 3, 4, 5: Lærer: Adjunkt, Ph.D. Rasmus Hartmann-Petersen Instruktor: Cand. Scient. Jakob Plough Jørgensen Øvelse 6, 8 og 10: Lærer: Professor, Ph.D. Per Amstrup Pedersen Cand. Scient. Daniel Mucanovic Instruktor: Stud. Scient. Janni Vikkelse Jeppesen Øvelse 7 og 9: Lærer: Lektor, Ph.D. Birgitte Regenberg Instruktor: Stud. Scient. Stella Vitt 13
14 Øvelse 1: Site-directed mutagenese ØVELSE 1: SITE DIRECTED MUTAGENESE. Frembringelse og studier af mutanter har altid været vigtige værktøjer i molekylærbiologien. Der findes principielt to måder, hvorpå man kan frembringe mutationer i et bestemt gen; ved random (tilfældig) mutagenese, hvor en population af individer eller gener mutageniseres, således at hver enkelt base har den samme sandsynlighed for at blive mutageniseret eller site-directed mutagenese, hvor man på forhånd vælger hvilken eller hvilke baser i DNA'et der skal ændres. Konstruktion af mutanter var i molekylærbiologiens barndom begrænset til fænotyper man kunne selektere eller screene sig frem til. Som et simpelt eksempel kan nævnes frembringelse af mutationer i en repressor der enten formindsker eller forøger repressorens aktivitet. Mutationerne var oftest enten spontane eller inducerede af kemikalier (Ethyl-methan-sulfonate, hydroxylamine) eller bestråling (UV eller røntgen). Target for disse mutagene komponenter er mere eller mindre tilfældige, så de frembragte mutationer er ikke lokaliseret til et eller flere veldefinerede nukleotider med mindre kun mutationer i en eller flere nukleotider frembringer den ønskede fænotype. Hvis den frembragte mutation kun resulterer i en let nedsat enzymaktivitet vil det i praksis være umuligt at isolere en sådan mutant. Random mutagenese lider således af den svaghed (og styrke) at arten af mutationer og mutationsstedet ikke kan kontrolleres rationelt. I dag kan random mutagenese dog også udføres uden brug af kemikalier og kortbølget lys. Man kan ved at anvende DNA polymeraser uden proofreading system, under betingelser hvor det ene nukleotid er i underskud, få inkorporeret tilfældige mutationer i sit DNA fragment. Med mulighederne for fremstilling af syntetisk DNA ved organisk kemisk syntese blev det gjort muligt at udvikle protokoller til frembringelse af mutanter efter eget valg i et stykke DNA med kendt sekvens (site-directed mutagenese). Siden har syntetisk DNA spillet en større og større rolle i moderne molekylærbiologisk forskning. Det ville i dag være utænkeligt at forestille sig et moderne molekylær biologisk laboratorium uden adgang til syntetisk DNA. Tabel 1 giver en sammenligning af klassisk random mutagenese og site directed mutagenese. 14
15 Øvelse 1: Site-directed mutagenese Tabel 1 Sammenligning af klassisk random mutagenese og oligonukleotid directed mutagenese. Klassisk mutagenese Oligonukleotid mutagenese Mutant spektrum Meget bredt Meget snævert Mutationsfrekvens Op til 100% Kendskab til target gen Kendskab til mutantens fænotype Genets DNA sekvens behøves ikke være kendt (genet kan endda være ukendt) Mutanten skal have en fænotype Genets sekvens skal være kendt Ligegyldigt om mutanten har en fænotype eller ej. Kendskab til hvilke nukleotider der er vigtige Ikke nødvendigt da de interesante mutationer har en fænotype Nødvendigt at vælge eller forudsige hvilke nukleotider der er interessante Der er efterhånden udviklet en række metoder til site-directed mutagenese med varierende succesrate. Metoderne kan deles op i metoder der anvender M13 fager eller phagmider som templates for syntese af rekombinante DNA molekyler (Kunkel, 1985; Taylor et al., 1985; Vandeyar et al., 1988; Stanssens et al., 1989; Carter et al., 1985) og metoder der involverer PCR amplifikation (Higuchi et al., 1988; Vallette et al., 1989; Kadowaki et al., 1989; Nelson and Long, 1989; Ho et al., 1989). Succesraten for de første metoder varierer i praksis mellem 1% og 80%, medens de for de for PCR baserede metoder i praksis er 100%. I denne øvelse vil vi tage udgangspunkt i plasmidet ppap2306 (figur 1), som er puc19 (kort side 88), hvori der er indsat en stop kodon i lacz α genet og der er lavet en frameshift mutation. Kombinationen af stopkodon og frameshift indebærer, at det tilsvarende LacZ(α) peptid ikke er aktiv, hvorfor en E. coli stamme indeholdende ppap2306 vil være hvid på en X-gal-IPTG plade. Samtidig betyder ændringerne i lacz genet, at der er fjernet et PaeI site i forhold til puc19). Vi vil i denne øvelse ved site directed mutagenese ændre stopkodon og re-etablere læserammen i lacz(α) i ppap2306 til den oprindelige sekvens. Dette indebærer, at E. coli transformeret med det ændrede plasmid bliver blå på en X-GAL-IPTG plade (se side135) og at plasmidet får gendannet sit PaeI site. Princippet i den her benyttede site-directed mutagenese protokol er beskrevet af Ho et al. (1989) og angivet i Figur 2. 15
16 Øvelse 1: Site-directed mutagenese Før du starter, så nedskriv den nukleotidsekvens af lacz(α) genet, der er resultatet af den udførte site-directed mutagenese og skaf dig et præcist overblik over hvilke ændringer i nukleotid sekvensen og læseramme, det er du foretager dig. 16
17 Øvelse 1: Site-directed mutagenese Sekvensen af mutant primere: Blåop: 5 -CGCCAAGCTTGCATGCCTGCAGGTCG-3 Blådo: 5 -CGACCTGCAGGCATGCAAGCTTGGCG-3 Sekvenser ydre primere: AflIII: 5 -GTTCCTGGCCTTTTGCTGGC-3 AatII: 5 -GCGCACATTTCCCCGAAAAG-3 Figur 1. Nukleotid sekvensen af ppap2306. Lokaliseringen og sekvenserneaf de primere, der anvendes til mutagenesen er angivet. ATG kodon for lacz ()-peptidet er angivet med fed. Husk på sekvensen er en cirkel hvorfor det sidst skrevne nukleotid er kovalent koblet til det første. Se eventuelt kortet over puc19 i side 88. Endvidere er angivet positionen af relevante restriktionssites. SphI genkender sekvensen GCATGC. 17
18 Øvelse 1: Site-directed mutagenese Figur 2 Skematisk oversigt over den af Ho et al (1989) beskrevne site-directed mutagenese protokol. Dobbelstrenget DNA templates og syntetiske DNA primere er angivet som orienterede linjer. Pilen angiver 5'- 3' orienteringen af den enkelte DNA streng. Mutationsstedet er angivet med en sort firkant. PCR primere er angivet med små bogstaver mens PCR produkter er angivet med store bogstaver, som angiver hvilke primere, der blev brugt til PCR amplifikationen. Den indrammede del af figuren angiver intermediæren under den afsluttende PCR reaktion, hvor de denaturerede initiale PCR fragmenter anneales i de overlappende regioner og hvor de frie 3' ender forlænges af DNA polymerasen. Resultatet er et PCR fragment indeholdende den ønskede mutation. Dette DNA fragment kan nu klones tilbage i plasmidet, idet PCR fragmentet er planlagt således at det i enderne indeholder genkendelsesekvenser for restriktions enzymer. 18
19 Øvelse 1: Site-directed mutagenese I forbindelse med site directed mutagenese udført ved hjælp af PCR teknologi er der nogle kritiske parametre at forholde sig til. Det gælder valg af PCR primere, valg af DNA polymerase samt valg af template. VALG AF PRIMERE. Vi vælger oftest at bruge primere mellem 18 og 21 nukleotider lange afhængig af basesammensætningen omkring mutations stedet og antal mutationer der ønskes introduceret. Mismatchet mellem primer og template lægges midt i primer sekvensen. Primerne vælges også sådan at deres annealing temperatur, T A, ligger omkring de 55 C. Smeltetemperaturen, T m, for oligo nukleotider mellem 14 og 20 nukleotider kan beregnes som følger: T m = 2 X (A + T) + 4 X (G + C) T A = T m - 3 C. Desuden er det vigtigt, at de valgte primere ikke kan anneale til hinanden ved den i PCR proceduren anvendte annealing temperatur, idet man så risikerer at opnå primerdimer amplifikationer. VALG AF DNA POLYMERASE. Der findes efterhånden en række termoresistente DNA polymeraser på markedet. Desværre er der ikke udført gode forsøg der på entydig måde sammenligner deres aktiviteter. Det krav, som er vigtigst at stille til DNA polymerasen i forbindelse med sitedirected mutagenese eksperimenter, er, at fejlinkorporeringen er så lav som overhovedet muligt. In vivo besidder DNA polymeraser et proofreading system der reducerer mutationsfrekvensen betragteligt. Imidlertid er proofreading funktionen (3-5' exonuklease aktiviteten) fjernet fra mange af de kommercielle termoresistente DNA polymeraser. I princippet skulle brugen af en DNA polymerase med proofreading reducere frekvensen af fejlinkorporeringer. Vi har i denne øvelse valgt at anvende AccuPOL, som er en DNA polymerase med proofreading fra firmaet Ampliqon (Cat.No: AMP ). Det er vores erfaring at dette enzym ikke giver fejlinkorporeringer. VALG AF DNA TEMPLATE. Det eneste krav til DNA template er, at DNA sekvensen er kendt, så der er mulighed for at designe primere. Vi bruger som oftest plasmider som templates. For at 19
20 Øvelse 1: Site-directed mutagenese mindske risikoen for fejlinkorporeringer og fordi alt det amplificerede DNA skal sekventeres er det tilrådeligt at amplificere så lille et stykke template som muligt. Valget af templates er ofte betinget af, at der er mulighed for at reklone PCR fragmentet indeholdende den eller de ønskede mutationer i det oprindelige plasmid. Brug af en høj initiel template koncentration minimerer også risikoen for fejlinkorporering idet template hovedsageligt amplificeres under PCR reaktionen. Det er også en god ide at anvende friske nukleotider til PCR reaktionen da partiel nedbrydning af et af de fire nukleotider vil give meget forskellige nukleotid koncentrationer. Dette har vist sig, at give en stor grad af fejlinkorporeinger. Mutagenese arbejde bliver stadigt mere udbredt i undersøgelser af proteiners struktur/funktions sammenhænge. Generelt står man over for det problem at klarlægge hvilke aminosyrer i ens favorit protein, der er direkte involveret i proteinets funktion. I denne situation er det begrænsende trin ikke så meget det tekniske i at fremstille muterede versioner af det tilsvarende gen. Dette kan være en tidskrævende og besværlig proces men er et spørgsmål om praktisk erfaring. Det første begrænsende trin er på et rationelt grundlag at beslutte sig for hvilke aminosyrer, der skal udskiftes, og hvilke aminosyrer de skal ændres til. Dette valg vil desværre ofte være baseret på alt muligt andet end røntgen krystal- eller NMR strukturen af proteinet. Det betyder, at man ofte starter ud på et spinkelt grundlag m.h.t. udvælgelse af interessante aminosyrer. I sådanne tilfælde er det værd at overveje om der kan etableres et selektions- eller screeningssytem til identifikation af vigtige aminosyrer. I et sådant system overlades det til naturen at udvælge de interessante aminosyrer. Kan et sådant etableres vil kombinationen random mutagenese og selektion/screening i første omgang være et meget stærkere værktøj end site-directed mutagenese. I den efterfølgende detail analyse kan site-directed mutagenese derimod være et frugtbart værktøj. 20
21 Øvelse 1: Site-directed mutagenese REFERENCER. Generel PCR håndbog: Dieffenback, CW and Dueksler, GS (eds) (1995):PCR Primer, A Laboratory Manual, Cold Spring Harbor Laboratory Press. Mutagenese: Kunkel, T.M.(1985): Rapid and efficient site-directed mutagenesis without phenotypic selection. Proc. Natl. Acad. Sci. USA 82: Taylor, J.W., Ott, J. and Eckstein, F.(1985): The rapid generation of oligonucleotide directed mutations at high frequences using phosphoro-thionate modyfied DNA. Nucleic Acids Res. 13: Vandeyar, M.A., Weiner, M.P., Hitton, C.J. and Batt, C.A.(1988): A simple and raid method for selection of oligodeoxynucleotide directed mutants. Gene 65 : Stanssens, P., Opsomer, C., McKeown, Y.M., Kramer, W., Zabeau, M. and Fritz, H.J.(1989): Efficient oligonucleotide-directed construction of mutations in expression vectors by gapped duplex DNA method using alternating selectable markers. Nucleic Acids Res. 17: Carter, P., Bedouelle,H. and Winter, G.(1985): Improved oligonucleotide sitedirected mutagenesis using M13 vectors. Nucleic Acids Res. 13 : Higuchi, R., Krummel, B. and Saiki, R.K.(1988): A general method of in vitro preparation and specific mutagenesis of DNA fragments: study of protein and DNA interactions. Nucleic Acids Res. 16 : Vallette,F., Mege, E., Reiss, A. and Adesnik, M.(1989): Construction of mutant and chimeric genes using the polymerase chain reaction. Nucleic Acids Res. 17 : Kadowaki, H., Kadowaki, K., Wondisford, F.E. and Taylor, S.I. (1989). Use of polymerase chain reaction catalyzed by Taq DNA polymerase for site-specific mutagenesis. Gene 76 : Nelson, R.M. and Long, G.L. (1989): A general method of site-specific mutagenesis using a modyfication of the Thermus aquaticus polymerase chain reaction. Anal. Biochem. 180 : Ho, S.H., Hunt, H.D., Horton, R.M., Pullen, J.K. and Pease, L.R. (1989): Site directed mutagenesis by overlap extension using the polymerase chain reaction. Gene 77 :
22 Øvelse 1: Site-directed mutagenese MUTAGENESE, KORT OVERSIGT. Dag 1. Fremstil ved PCR de to initielle DNA fragmenter. Verificer ved gelektroforese. Dag 2. Kør overlap ekstension PCR med de to initielle produkter som template.verificer overlap PCR ved gelektroforese. Spritfæld. Skær med Aat II og Afl III. Skær ppap2306 (vektor DNA) med Aat II, Afl III, HindIII, EcoRI og Pvu II. Verificer skæringer ved gelektroforese. Ligér og transformér. Udstryg på X-GAL / IPTG plader. Dag 3. Opgør antallet af blå og hvide kolonier. Pod en af hver op overnight (ON). Dag 4. Oprens plasmid DNA fra kulturer. Verificer ved gelektroforese. Skær med SphI. Verificer skæringer ved gelektroforese 22
23 Øvelse 1: Site-directed mutagenese MUTAGENESE, DETALJERET PLAN. Dag 1. Fremstilling af de initielle PCR fragmenter. Følgende blandes i to seperate 0,5 μl PCR rør: 10 μl ppap μl ppap μl AccuPOL buffer (10 ) 10 μl AccuPOL buffer (10 ) 10 μl AflIII primer (2 pmol/ml) 10 μl AatII primer (2 pmol/ml) 10 μl BLÅdo primer (2 pmol/ml) 10 μl BLÅup primer (2 pmol/ml) 10 μl dntp-mix (2.5 mm) 10 μl dntp-mix (2.5 mm) 1 μl AccuPOL 1 μl AccuPOL H O til 100 μl 2 H O til 100 μl 2 Prøverne køres i PCR maskinen ved følgende betingelser: 92 C i 2 min 92 C i 30 sek 55 C i 30 sek 30 cykler 72 C i 40 sek 72 C i 5 min Efter endt kørsel udtages 10 μl PCR-produkt, som tilsættes 3 μl gel loading buffer (GLB) og separeres på en 1.5% agarose gel. På grundlag af resultatet fra gel-elektroforesen fortsættes med overlap extension PCR. Overlap extension. Nedenstående blandes i et 0.5 μl PCR rør: [X] μl initiel PCR produkt 1 + [Y] μl initiel PCR produkt 2 (spørg instruktor) 10 μl AccuPOL buffer (10 ) 10 μl AflIII primer (2 pmol/ml) 10 μl AatII primer (2 pmol/ml) 10 μl dntp-mix (2.5 mm) 1 μl AccuPOL H 2 O til 100 μl 23
24 Øvelse 1: Site-directed mutagenese Prøverne køres i PCR maskinen ved følgende betingelser: 92 C i 2 min 92 C i 30 sek 55 C i 30 sek 30 cykler 72 C i 80 sek 72 C i 5 min Dag μl overlap PCR-produkt tilsættes 3 μl GLB og separeres på en 1.5% agarose gel. De resterende 90 μl PCR produkt spritfældes (side117), tørres, og resuspenderes i 100 μl TE- buffer. PCR-produkt s amt vektor (ppap 2306) skæres i to seperate eppendorf-rør: 75 μl PCR-produkt 75 μl ppap μl NE buffer 4 (10 ) 10 μl NE buffer 4 (10 ) 10 μl BSA (10 ) 10 μl BSA (10 ) 5 μl enzym-mix (Aat II + Afl III) 5 μl enzym-mix (Aat II, Afl III, HindIII, EcoRI, Pvu II) Skæringerne inkuberes ved 37 C i minimum 2 timer, hvorefter de verificeres på 1.5% agarosegeler. Der loades 10 μl af hver skæring plus 3 μl GLB. Husk at påsætte én uskåret prøve på hver gel. Skåret PCR-produkt og vektor blandes og volumen indstilles til 200 μl med H 2 O. Præcise mængder aftales med lærer på grundlag af gelelektroforese resultatet. Blandingen spritfældes (side 125), tørres og resuspenderes i 20 μl ligase buffer. Der tilsættes 1 μl Quick-Ligase og inkuberes 5 min ved stuetemperatur. Herefter sættes ligeringsblandingen straks på is. 24
25 Øvelse 1: Site-directed mutagenese Kompetente celler (100 μl) transformeres med alle 20 μl ligeringsmix og udplades på X- GAL / IPTG plader som beskrevet i appendix (side 128). Kontrol af kompetente celler: To hold transformerer kompetente celler med ppap 2306 og udstryger på X-G AL / IPTG plader som beskrevet i appendix (side 128). Dag 3. Antallet af fremkomne blå og hvide kolonier på X-GAL / IPTG pladen gøres op. Èn blå og èn hvid koloni overføres med sterile pipette spidser til to seperate rør indeholdende 5 ml LB-medie plus ampicillin. Kolonierne dyrkes op ON ved 30 C på rystebord. Dag 4. Plasmid fra de to kolonier oprenses med GFX TM miniprep kit som beskrevet i appendix (side 130) og verificeres ved elektroforese på en 1,0% agarosegel. Der loades 10 μl plasmid plus 3 μl GLB. Plasmider skæres med SphI i minimum 2 timer: [x] μl plasmid (aftal mængde med lærer) 5 μl NE-buffer 2 (10 ) 1 μl SphI enzym H2O til 50 μl Skæringer verificeres ved elektroforese på en 1,0% agarosegel. Der loades 10 μl skæring plus 3 μl GLB. 25
26 Øvelse 1: Site-directed mutagenese SPØRGSMÅL TIL RAPPORT, ØVELSE 1. A: Opgør antallet af blå og hvide kolonier efter transformation af jeres ligeringsblanding. Kommentér resultatet. B: Kommenter resultatet efter restriktions skæring af plasmid DNA blå henholdsvis hvide kolonier. isoleret fra jeres C: Hvorfor skærer vi ppap2306 med både AatII, SapI, HindIII, EcoRI og SalI før vi ligerer til det AatII, SapI skårede PCR fragment? Beskriv en alternativ strategi til at opnå det samme. D: Ofte ønsker man at fusionere to DNA fragmenter på et bestemt sted i deres nukleotidsekvenser. Det betyder også, at man oftest ikke kan ligere de to fragmenter sammen, da der ikke er restriktionssites i de ønskede fusionsområder. Tegn og beskriv, hvorledes princippet i den her beskrevne site-directed mutagenese protokol kan bruges til at konstruere en præcis fusion mellem vilkårlige DNA fragmenter med kendt sekvens uden anvendelse restriktionsenzymer. to af 26
27 Øvelse 2: Real Time PCR ØVELSE 2: REAL TIME PCR ØVELSESVEJLEDNINGENS INDHOLD A. Overordnet formål B. Eksempler på anvendelse af real time PCR C. Generelt om real time PCR D. Hvorledes virker real time PCR? E. Sammenligning af SYBRGreen og TaqMan-probe analyser F. PCR instrumentet MX4000 G. Amplifikationskurve og temperatur-dissociationskurve H. Kvantificering af fluorescensdata, amplifikation og effektivitet I. Specifikke formål med de enkelte øvelsesdele J. Ingredienser K. Fremgangsmåde L. Beregninger og rapport OVERORDENT FORMÅL At give de studerende en forståelse af principperne bag real time PCR, og at de studerende stifter bekendskab med brugen af real time PCR til undersøgelse af genekspression og polymorfier. EKSEMPLER PÅ ANVENDELSE AF REAL TIME PCR FRA VIDENSKABELIGE LITERATUR Virus: Analyser til måling af mængden af influenza A and B virus. Analyse af antallet af infektiøse mæslingevirus i virusvacciner Duplex real time assay til detektion og kvantificering af herpes simplex virus type 1 eller herpes simplex virus type 2 i læsioner på huden. Bakterier: Analyse for Escherichia coli, enterobacterier og Campylobacter jejuni ved direkte assay på fæces uden dyrkning. Analyse for patogene protozoer Giardia lamblia og Cryptosporidium parvum i drikkevand. Detektion af patogene periodontale bakterier i mundslimhinden. Væv og celler: Bestemmelser af transcriptionel aktivitet og mrna indhold for et stort antal gener; bl.a i 27
28 Øvelse 2: Real Time PCR skeletmuskulatur før og efter fysisk arbejde, effekt af træning og kost (human, rotter, mus). Induktion af cytokiner i fibroblaster fra hjerte under infektion med coxsackievirus. Kvantitativ analyse af transkripter med lavt kopital, f.eks. transcriptionsfaktorer med omkring 1 kopi per celle. Kvantificering af genmodificering (GMO) i produkter indeholdende majs eller soyabønner. Alleldiskriminering til bestemmelse af polymorfier i gener med potentiel betydning for udvikling af en lang række sygdomme. GENERELT OM BRUGEN AF REAL TIME PCR Real-timniveauer i en prøve. Real time PCR tillader hurtig analyse af genekspression udfra små PCR er den mest sensitive metode til kvantitativ analyse af DNA og cdna mængder udgangsmateriale og bliver i stigende grad valgt som metode ved kvantificering af mrna-indholdet. Ved kvantitativ analyse af mrna er de første trin præparation af total RNA fra celler eller væv og en reverse transkriptionsreaktion (RT), hvor der syntetiseres en cdna kopi af mrna et. Det er også den foretrukne metode til validering af array-analyseresultater og til måling af sirna induceret hæmning af genekspression. Præcis kvantificering af mrna i forhold til proteinprodukt er også essentiel ved karakteristik af translationel regulering af proteinsyntese. Opfindelser indenfor PCR teknologi og udvikling af fluorescensteknikker tillader registrering af DNA/cDNA produkt efter hver enkelt PCR cyklus, og PCR produktet kan således let kvantificeres i den eksponentielle fase af PCR reaktionen efter kørslen, selv om PCR reaktionen er kørt til ende. Tærskelcyklus (Ct, Treshold) kan aflæses som den første PCR cyklus, hvor stigningen i fluorescens er lineær i et semilogaritmisk plot. En standardkurve opnås ved måling af tærskelcyklus for en række fortyndinger af en kendt mængde DNA/cDNA (absolut eller relativ mængde). Efter måling af tærskelcyklus for en ukendt prøve kan mængden af template beregnes udfra standardkurven. Denne analyse er baseret på den antagelse, at effektiviteten af PCR reaktionen er den samme i de prøver der analyseres som ved analyserne til standardkurven. Som forklares senere på efterfølgende sider, kan effektiviteten af PCR reaktionen beregnes udfra hældningen af standardkurven ved afbildning af tærskelcyklus (Ct) som funktion af logaritmen til mængde DNA (eller cdna). 28
29 HVORLEDES VIRKER REAL TIME PCR? Øvelse 2: Real Time PCR Fluorescensmåling Dannelsen af PCR produkt ved real time PCR kvantificeres ved registrering af fluorescens, hvor signalet øges proportionalt med mængden af PCR produkt i reaktionen. Ved real-time PCR sker målingen af fluorescens i hver prøve efter hver enkelt cyklus. Den simpleste og mest økonomiske teknik anvender SYBRGreen, og det mest populære alternativ til SYBRGreen er TaqMan prober. SAMMENLIGNING AF SYBR-GREEN OG TAQMAN-PROBE ASSAYS SYBR Green I real time PCR reaktioner, der benytter SYBR Green (Molecular Probes), udnyttes, at SYBR Green binder til dobbeltstrenget DNA og udsender lys ved ekscitation (ex. 497 nm, em. 520 nm), mens det ikke-bundne SYBRGreen i vandig opløsning har en ca 1000 gange lavere fluorescensintensitet. SYBRGreen har høj affinitet for binding til den lille fure i dobbeltstrenget DNA. Problemet med SYBRGreen er, at det bindes til alt dobbeltstrenget DNA i prøven inklusivt primer-dimere og andre uspecifikke reaktionsprodukter, således at resultatet kan blive en overvurdering af koncentrationen af det specifikke produkt. Når primerne er godt designet, og der er tale om et enkelt PCR produkt uden primer-dimer-dannelse, kan SYBRGreen fungere fint og evt falske eller uspecifikker produkter vil først dukke op ved meget høje cyklusnumre (>35-40). TaqMan prober Ved TaqMan prober er kvantificering af produktet baseret på Fluorescence Resonance Energy Transfer (FRET), idet TaqMan proben indeholder en fluorescerende reporter på 5' basen, og en fluorescens-quencher bundet til 3' basen. Så længe TaqMan proben er intakt, vil energien fra den exciterede reporter overføres ved FRET til quenchermolekylet i stedet for at blive udsendt med reporteres karakteristiske bølgelængde (som vil blive registreret af PCR apparatet). Quencheren udsender også lys, men med en anden bølgelængde end reporteren. TaqMan proberne designes således, at de hybridiserer til en region i amplicon mellem forward og reverse primere, og således at proben har en Tm, der er 10 o C højere end for de to primere. Ved PCR reaktionen vil polymerasen starte replikationen af DNA template fra primerne. Inden længe vil polymerasen nå TaqMan proben, der også er bundet til sin specifikke sekvens i DNA et. Polymerasens 5' 29
30 Øvelse 2: Real Time PCR Fig. 1. TaqMan prober. Systemet har to specifikke primere, en forward 5-3 primer (FP) og en revers 3-5 primer (RP), og den specifikke TaqMan probe, (hvor den fluorescerende reporter (R) sidder på 5' basen, mens quencheren (Q) er bundet til 3' basen) placeret mellem de to primere. Totallængden af det amplificerede område vil oftest være baser. Tm for Taqman proben skal helst være ca 10 o C højere end for de to primere. endonuclease-aktivitet vil efterfølgende spalte proben samtidig med, at replikationen af DNA et fortsætter langs DNA template. Herved adskilles den fluorescerende reporter fra quencheren, og reporterens fluorescens hæmmes ikke længere ved energioverførsel til quencheren. Fluorescensen vil øges proportionalt med hastigheden af spaltningen af proben og parallelt med syntesen af det specifikke PCR produkt. Fluorescerende stoffer med forskellige emissions-spektre kan bindes til forskellige TaqMan prober. Dette kan benyttes f.eks i genekspressionsstudier, hvor cdna indholdet af ikke kun targetgenet, men tillige af en endogen kontrol kan bestemmes samtidigt i samme prøve (multiplex PCR). Yderligere har brug af to prober med forskellig reporter dye i samme reaktion fået stor anvendelse ved allelic distrimination, der benyttes, når polymorfier undersøges. Det er klart, at dette ikke kan opnås med SYBRGreen, idet denne probe ikke kan skelne forskellige dobbeltstrengede DNA produkter. TaqMan prober 30
31 Øvelse 2: Real Time PCR tillader analyse af meget små mængder DNA, idet proben kun vil hybridisere til den specifikke sekvens og ikke til primer-dimere og andre falske produkter, der opstår efter et stort antal PCR cykler. PCR INSTRUMENTET MX4000 Fig. 2 Foto af MX4000 QPCR instrumentet (a) og diagram over dets lysvej (b). MX4000 har indbygget en termocykler og et fiberoptisk system. MX4000 instrumentet er styret af en computer. MX4000 programmet styrer thermocycler funktionerne, samt opsamling og analyse af data. Det fiberoptikse system dirigerer en lystråle fra tungstenlampen til hver af de 96 huller i prøve-holderen. Den efterfølgende fluorescens-emission fra prøverne føres tilbage gennem lysleder-kabler til fire photo- der måler intensiteten af multipliere, fluorescenslyset. Da hvert prøverør belyses i sekvens kan instrumentet adskille og kvantificere fluorescensen fra op til fire fluorophorer i samme prøverør (multi-plex). Ved forsøgene illustreret i Fig. 3 og 4, analyseres prøverør for to fluorophorer, SYBR-Green, der svarer til FAM (ex. 497 nm, em. 520 nm) og ROX (ex. 584 nm, em. 612 nm), der fungerer som intern reference. Den grønne fluorescens fra FAM og den røde fra ROX kan adskilles i systemet. Det tillader normalisering af ikke-pcr relateret fluorescens-fluktuation. AMPLIFIKATIONSKURVE OG TEMPERATUR-DISSOCIATIONSKURVE Amplifikationskurve Ved real time PCR måles mængden af DNA/cDNA ved fluorescens-analyse efter hver 31
32 Øvelse 2: Real Time PCR PCR cyklus, hvilket sikrer en registrering og analyse af resultaterne i den eksponentielle fase. Alle real-time PCR systemer er baseret på måling af et fluorescenssignal, der er direkte proportionalt med mængden af PCR produkt i reaktionen. Fig. 3. Direkte plot af fluorescens (Rn) overfor cyklusnummer for fortyndinger (fra venstre): 10-2, 10-3, 10-4, 10-5, 10-6 og 10-7 fra SYBRGreen kørsel med myostatin-primere. Fig. 4. Semilogaritmisk plot af log (fluorescens (Rn)) overfor cyklusnummer for fortyndinger (fra venstre): 10-2, 10-3, 10-4, 10-5, 10-6 og 10-7 af en prøve fra SYBRGreen kørsel med myostatin-primere. Tærskelcyklus (Ct) aflæses ved den blå linie, der skal placeres i den eksponentielle del af amplifikationskurven. Ct I Fig. 3 ses et direkte plot af fluorescens overfor antal PCR-cykler. I starten af en PCR reaktion er reagenserne i overskud, og koncentrationerne af DNA template og produkt er så lave, at renaturering af produkt ikke konkurrerer med binding af primer til template. I den fase sker amplifikationen af DNA template ved en konstant eksponential hastighed. Denne eksponentielle fase svarer til den hastige stigning i fluorescens ved foden af de sigmoide kurver i Fig. 3, og dette forløb er en lineær funktion i det semilogaritmiske 32
33 Øvelse 2: Real Time PCR plot i Fig. 4. Det tidspunkt, hvor reaktionen ikke længere er eksponentiel og går ind i en lineær fase af amplifikation i det direkte plot i Fig. 3, afhænger af, hvornår renaturering af produkt begynder at konkurrere med binding af primere og af inaktivering af Taq- Senere falder amplifikationen til næsten nul, og kurven ender i et plateau, polymerasen. hvor der ikke dannes mere produkt. Temperatur-Dissociationskurve ved brug af SYBRGReen For at vurdere om evt primer-dimere eller uspecifikke produkter bidrager til signalet fra SYBRGreen konstrueres en temperatur-dissociationskurve. Dette gøers ved efter den egentlige PCR cyklus er kørt til ende at øge temperaturen gradvist fra 55º C til 95º C og registrere ændringen i fluorescens. I Fig. 5 ses, at SYBRGreen fluorescensen falder gradvist ved øgning af temperaturen fra 55º C til 79 o C. Fra 80º C til 95 o C ses et skarpt fald i fluorescens, når dsdna dissocierer og frisætter SYBRGreen: dette er produktets smeltetemperatur. Smeltetemperaturen afhænger af produktets basesammensætning og dets længde. Primer-dimere og andre uspecifikke reaktionsprodukter vil som regel være kortere og have et lavere smeltepunkt end det specifikke produkt, hvilket betyder, at primer-dimere og andre uspecifikke reaktionsprodukter vil føre til en ændring i området o C (se Fig 6). Fig. 5. Temperatur- plot dissociations-kurve er et af normaliseret fluorescens (Rn) over for temperatur ( o C) fra 55 o til 95 o C. 33
34 Øvelse 2: Real Time PCR Fig. 6. Temperatur-dissociationskurve hvor det første differentiale af den normaliserede fluorescens multpliceret med -1 [ -Rn (T) ] er plottet overfor temperatur ( o C) fra 55 o til 95 o C. Topppen af kurven ved 83 o C er smeltepunkt for amplicon i denne reaktion. KVANTIFICERING AF FLUORESCENSDATA, AMPLIFIKATION OG EFFEKTIVITET For både SYBRGreen og TaqMan prober er kvantificering af reaktionen baseret på identifikation af den første signifikante stigning i fluorescens. Jo flere DNA kopier prøven indeholder, jo tidligere vil der observeres en signifikant stigning i fluorescens. Analysen af real-time PCR data er sædvanligvis baseret på den antagelse, at alle de prøver, der analyseres, har samme PCR effektivitet for et givent gen. Standardkurve Hvis man ønsker præcise værdier for antallet af DNA eller mrna molekyler, skal der bruges absolute standarder. En absolut standard består af en kendt mængde template eller amplicon, som pipetteres til en fortyndingsrække (f.eks. 10-1, 10-2, 10-3, 10-4, 10-5, 10-6 ). Template kan være en kendt mægde gdna eller cdna (mrna i en revers transkriptionsreaktion). Ved at plotte tærskelcyklus (Ct) overfor fortynding eller mængde DNA fremkommer en standardkurve. De ukendte prøvers indhold af DNA/cDNA bestemmes ud fra standardkurven, og resultatet kan opgives som antal kopier af DNA eller cdna. Relative standarder. En prøve eller typisk en blanding af prøver af DNA/ cdna 34
35 Øvelse 2: Real Time PCR benyttes som udgangspunkt (1x) til en fortyndingsrække. Hverfra laves en fortyndingsrække (f.eks som ovenfor angivet). Herfra kan der genereres en standardkurve, hvor enheden er arbitrær, (relativt indhold i forhold til udgangsprøvens indhold). Relative standarder bruges, når man ønsker at bestemme, hvorledes en prøve adskiller sig fra en kontrol, f.eks. ved undersøgelse af et hormons virkning på mrna ekspressionen af et bestemt gen. Standardkurven i Fig. 7 er et retliniet plot af Ct (tærskelcyklus) som funktion af logaritmen af det initielle specifikke mrna (cdna) indhold i en fortyndingsrække. Kvantificering af mængden af cdna (mrna) i en ukendt prøve opnås ved at måle Ct og beregne mængden af cdna i prøven ud fra en sådan standardkurve. Fig. 7. Eksempel på standardkurve, d.v.s. et plot af Ct (tærskelcyklus) på Y-aksen overfor log(initiel mængde) på X-aksen. Eksemplet er fra fortyndingerne 10-2, 10-3, 10-4, 10-5, 10-6 og Formlen for eksemplets rette linie er y = * log(x) + 6.1, hvor er hældningen af den rette linie og 6.1 er skæringen med y-aksen. I et ideelt eksponentielt forløb vil antallet af template DNA fordobles for hver cyklus, svarende til en amplifikation på 2,0. Effektiviteten af PCR reaktionen er den fraktion af template molekyler, der fordobles per cyklus, og PCR effektiviteten er derfor ved en ideel amplifikation lig 1. Standardkurven ved en sådan optimal amplifikation, vil have en hældning på Dette kan ses ud fra formlen for en PCR reaktions 35
36 Øvelse 2: Real Time PCR eksponentielle amplifikation: N c =N 0 * (1+E) c, hvor N c er cdna mængde efter c cykler, N o den initielle mængde, E er effektiviteten af PCR reaktionen og c antal cykler. Hvis amplifikationens effektivitet er E=1, giver dette formlen ved en ideel amplification: N c =N 0 * 2 c. Hvis der beregnes, hvor mange cykler, der skal til for at opnå en 10 ganges stigning fås c=3.32 cykler. Hældningen af standardkurven afspejler således effektiviteten af amplifikationen. Ved udledning af formlen for PCR amplifikation fremkommer udtrykket: A = 10 (-1/slope) hvilket giver en let måde at beregne amplifikationen ud fra standardkurvens hældning. I eksemplet i Fig 7 opnås en hældning på 3.46, og ud fra dette fås derfor amplifikationen: A.46) = 10 (-1/-3 = 1.94, og effektiviteten E = =0.94. Korrelationskoefficienten (r 2 ) for kurven er En værdi for r 2 nær 1.0 er et mål for et godt fit af data til linien. Links: Methods for determination of QPCR Efficiency: Primer design tools: QPCR internet links MX Taq Copenhagen oligonucleotid syntese 36
37 Øvelse 2: Real Time PCR SPECIFIKKE FORMÅL MED ØVELSEN Forsøg 1: 1) At isolere genomisk DNA (gdna) fra fuldblod 2) At undersøge beskrevne polymorfier (på gdna isoleret fra blod) ved brug af real time PCR Forsøg 2 og 3: 1) At benytte real time PCR til at undersøge mrna ekspression 2) Konstruere standardkurve fra fortyndingsrække (relativ) og benytte denne til at beregne mrna indholdet i ukendte prøver. 3) Sammenligne og vurdere anvendelese af SYBRGreen og Taqman prober til bestemmelse af mrna ekspression. INGREDIENSER VED ØVELSENS FORSØG Ved SNP (forsøg 1) og genekspressionsforsøgene (forsøg 2) med TaqMan prober anvendes Universal MasterMix (Applied Biosystems), der er et kit, der indeholder følgende komponenter: AmpliTaq Gold DNA polymerase AmpErase uracil-glycosylase (UNG) dntps med dutp ROX MgCl 2 Bufferkomponenter Ved SYBRGreen-forsøget (forsøg 3) der indeholder følgende komponenter: benyttes et SYBRGreen-kit (Applied Biosystems), AmpliTaq Gold DNA polymerase SYBRGreen dntps med dutp 37
38 ROX MgCl 2 Bufferkomponenter Øvelse 2: Real Time PCR Om ingredienserne: AmpliTaq Gold DNA polymerase er en hot-start polymerase, og PCR reaktionen påbegyndes med et opvarmningstrin, hvor polymerasen aktiveres. Ampli Taq Gold Polymerasen har tillige nukleaseaktivitet, der vil nedbryde TaqMan proben, når polymerasen under amplifikationen møder proben bundet til DNA template. AmpErase UNG behandling forhindrer amplifikation af fragmenter, der dannes inden selve PCR reaktionen påbegyndes; dvs opsætning af PCR reaktionen behøver ikke ske på is. UNG aktive res ved 50 C, 2min efterfulgt af inaktivering ved 95 C. For at UNG behandlingen skal give udbytte benyttes dntp s med dutp (i stedet for dttp s). ROX er pass iv reference, der gør det muligt at tage hensyn til ikke-pcr relateret variation. Primere og prober til at bestemme Myostatin (MSNT) mrna og Heme oxygenase 1 (HO- 1) mrna er selvdesignede forward (FP), reverse (RP) og TaqMan probe-sæt. Ved optimering er fundet at en optimal reaktion opnås ved for både myostatin og HO-1 at bruge 300nM af hver af FP og RP samt 150nM probe. GAPDH primere og probe-sættet, der anvendes, er et færdigudviklet produkt, der fås som en færdigblanding af alle 3 oligo er. SNP-assays består af FP, RP og to prober, der er et færdigudviklet produkt, der fås som en færdigblanding af alle 4 oligo er (20X opløsning; Applied Biosystems). 38
39 Øvelse 2: Real Time PCR FREMGANGSMÅDE FORSØG 1: SNP-ANALYSE (POLYMORFIER) Isolering af gdna fra fuldblod: Der udtages blod fra en armvene i albuebøjningen fra 2-4 frivillige studerende. Fra dette blod isoleres gemomisk DNA, som angivet i appendix Klargøring til PCR OBS: Nøjagtig opsætningsprotokol vil foreligge ved øvelsen, men overordnet: Hvert hold får udleveret 0.5 ml rør Strip med 8 PCR rør og låg. Mastermix (2X opløsning) Enten mix af primere og prober til detektion af bestemt polymorfi i brain derived neutrophic factor (BDNF) eller i myostatingenet (begge som 20X opløsninger). Nuklease-frit vand PCR-kørsel PCR maskinen gøres klar til en almindelig PCR reaktion, hvor det er vigtigt at vælge både FAM, HEX og ROX. (HEX har samme fluorescens-egenskaber som VIC, som er reporter dye på den ene probe). Prøverne placeres i PCR maskinen, og kørslen startes. Temperaturprofil for PCR-reaktionen: Der startes med 2 min ved 50 C (til aktivering af UNG) efterfulgt af 10 min ved 95 C til aktivering af Taq-polymerasen. Derefter er TaqMan reactionen kun et 2-trins program: 40 cykler med 15 sec 95 C min 60 C. Når denne kørsel er forbi, køres endnu en reaktion umiddelbart bagefter, mens prøverne bevares i maskinen. Der vælges Allelic discrimination. Dette er en end-point måling og herved vil programmet analysere prøverne og vurdere hvilken allel, der er i de pågældende prøver. 39
40 Øvelse 2: Real Time PCR FORSØG 2: GENEKSPRESSION: MYOSTATIN OG HO-1 MRNA BESTEMMELSE VED BRUG AF TAQMAN PROBER Til forsøg 2 og 3 udleveres cdna prøver til analyserne. Præparation af total RNA fra human skeletmuskel og revers transskription af mrna til cdna er udført på forhånd (se appendix) og cdna prøver udleveres til hvert hold. Nøjagtig opsætningsprotokol vil foreligge ved øvelsen, men overordnet: Hvert hold bestemmer myostatin eller HO-1 på 5 prøver fra fortyndningsrække samt fra 2 ukendte prøver. Prøverne fra fortyndingsrækken bruges til at konstruere en standardkurve, hvorfra indholdet af myostatin kan bestemmes i de to ukendte prøver. Vi sørger for bestemmelse af GAPDH mrna på jeres prøver, således at I får disse resultater udleveret Hvert hold får udleveret 0.5 ml rør Strips hver med 8 PCR rør og låg (der køres ud over de 7 prøver også NTC (notemplate control) med ved hvert gen. MasterMix (2X opløsning) Myostatin eller HO-1 forward og reverse primers (begge som 5µM) Myostatin eller HO-1 TaqMan probe, 5 FAM mærket (som 5µM) Nuclease-frit vand PCR-kørsel PCR computeren gøres klar til en almindelig PCR reaktion, hvor der vælges FAM for myostatin og HO-1 samt ROX for begge. Prøverne placeres i PCR maskinen og kørslen startes. Temperaturprofil for PCR-reaktionen: Først en cyklus på 2 min ved 50 C (til aktivering af UNG) efterfulgt af 10 min ved 95ºC til aktivering af Taq-polymerasen. Derefter er TaqMan reactionen kun et 2-trins program: 40 cykler: 15 sec 95 C min 60 C. 40
En forsker har lavet et cdna insert vha PCR og har anvendt det følgende primer sæt, som producerer hele den åbne læseramme af cdna et:
 F2011-Opgave 1. En forsker har lavet et cdna insert vha PCR og har anvendt det følgende primer sæt, som producerer hele den åbne læseramme af cdna et: Forward primer: 5 CC ATG GGT ATG AAG CTT TGC AGC CTT
F2011-Opgave 1. En forsker har lavet et cdna insert vha PCR og har anvendt det følgende primer sæt, som producerer hele den åbne læseramme af cdna et: Forward primer: 5 CC ATG GGT ATG AAG CTT TGC AGC CTT
PCR (Polymerase Chain Reaction): Opkopiering af DNA
 PCR (Polymerase Chain Reaction): Opkopiering af DNA PCR til at opkopiere bestemte DNA-sekvenser i en prøve er nu en af genteknologiens absolut vigtigste værktøjer. Peter Rugbjerg, Biotech Academy PCR (Polymerase
PCR (Polymerase Chain Reaction): Opkopiering af DNA PCR til at opkopiere bestemte DNA-sekvenser i en prøve er nu en af genteknologiens absolut vigtigste værktøjer. Peter Rugbjerg, Biotech Academy PCR (Polymerase
Test dit eget DNA med PCR
 Test dit eget DNA med PCR Navn: Forsøgsvejledning Formål med forsøget Formålet med dette forsøg er at undersøge jeres arvemateriale (DNA) for et transposon kaldet Alu. Et transposon er en DNA sekvens,
Test dit eget DNA med PCR Navn: Forsøgsvejledning Formål med forsøget Formålet med dette forsøg er at undersøge jeres arvemateriale (DNA) for et transposon kaldet Alu. Et transposon er en DNA sekvens,
Test dit eget DNA med PCR
 Test dit eget DNA med PCR Forsøgsvejledning Navn: Side 1 af 7 Formål med forsøget Formålet med dette forsøg er at undersøge jeres arvemateriale (DNA) for et transposon kaldet Alu. Et transposon er en DNA
Test dit eget DNA med PCR Forsøgsvejledning Navn: Side 1 af 7 Formål med forsøget Formålet med dette forsøg er at undersøge jeres arvemateriale (DNA) for et transposon kaldet Alu. Et transposon er en DNA
Velkommen. Test dit eget DNA med PCR. Undervisningsdag på DTU Systembiologi. Undervisere:
 Velkommen Test dit eget DNA med PCR Undervisningsdag på DTU Systembiologi Undervisere: Hvem er I? 2 DTU Systembiologi, Danmarks Tekniske Universitet Hvilke baser indgår i DNA? A. Adenin, Guanin, Cytosin,
Velkommen Test dit eget DNA med PCR Undervisningsdag på DTU Systembiologi Undervisere: Hvem er I? 2 DTU Systembiologi, Danmarks Tekniske Universitet Hvilke baser indgår i DNA? A. Adenin, Guanin, Cytosin,
Test dit eget DNA med PCR
 Test dit eget DNA med PCR Navn: Forsøgsvejledning Side 1 af 8 Formål med forsøget Formålet med dette forsøg er at undersøge jeres arvemateriale (DNA) for et transposon kaldet Alu. Et transposon er en DNA
Test dit eget DNA med PCR Navn: Forsøgsvejledning Side 1 af 8 Formål med forsøget Formålet med dette forsøg er at undersøge jeres arvemateriale (DNA) for et transposon kaldet Alu. Et transposon er en DNA
GAPDH PCR modul Manual
 GAPDH PCR modul Manual Katalog nr. 166-5010EDU explorer.bio-rad.com Kopiering kun tilladt til undervisningsbrug Bemærk: Kittet indeholder temperaturfølsomme dele. Åbn derfor straks kassen og læg de pågældende
GAPDH PCR modul Manual Katalog nr. 166-5010EDU explorer.bio-rad.com Kopiering kun tilladt til undervisningsbrug Bemærk: Kittet indeholder temperaturfølsomme dele. Åbn derfor straks kassen og læg de pågældende
Test dit eget DNA med PCR
 Test dit eget DNA med PCR Navn: Forsøgsvejledning Side 1 af 8 Formål med forsøget Formålet med dette forsøg er at undersøge jeres arvemateriale (DNA) for et transposon kaldet Alu. Et transposon er en DNA-sekvens,
Test dit eget DNA med PCR Navn: Forsøgsvejledning Side 1 af 8 Formål med forsøget Formålet med dette forsøg er at undersøge jeres arvemateriale (DNA) for et transposon kaldet Alu. Et transposon er en DNA-sekvens,
Spm. A: Hvad viser data i Figur 1?
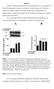 Opgave 1 Leptin er et plasma proteinhormon der primært produceres af og secerneres fra fedtceller (adipocytter). Leptin, der er kodet af ob (obecity) genet, er 16 kda stort. Leptins fysiologiske funktion
Opgave 1 Leptin er et plasma proteinhormon der primært produceres af og secerneres fra fedtceller (adipocytter). Leptin, der er kodet af ob (obecity) genet, er 16 kda stort. Leptins fysiologiske funktion
Test dit eget DNA med PCR
 Test dit eget DNA med PCR Navn: Forsøgsvejledning Side 1 af 8 Formål med forsøget Formålet med dette forsøg er at undersøge jeres arvemateriale (DNA) for et transposon kaldet Alu. Et transposon er en DNA-sekvens,
Test dit eget DNA med PCR Navn: Forsøgsvejledning Side 1 af 8 Formål med forsøget Formålet med dette forsøg er at undersøge jeres arvemateriale (DNA) for et transposon kaldet Alu. Et transposon er en DNA-sekvens,
Velkommen. Test dit eget DNA med PCR. Undervisningsdag på DTU Systembiologi. Undervisere: Sebastian, Louise og Ana
 Velkommen Test dit eget DNA med PCR Undervisningsdag på DTU Systembiologi Undervisere: Sebastian, Louise og Ana Hvem er I? 2 DTU Systembiologi, Danmarks Tekniske Universitet Dagens program 9:00 10:00 Introduktion
Velkommen Test dit eget DNA med PCR Undervisningsdag på DTU Systembiologi Undervisere: Sebastian, Louise og Ana Hvem er I? 2 DTU Systembiologi, Danmarks Tekniske Universitet Dagens program 9:00 10:00 Introduktion
Analyse af proteiner Øvelsesvejledning
 Center for Undervisningsmidler, afdeling København Analyse af proteiner Øvelsesvejledning Formål At separere og analysere proteiner i almindelige fødevarer ved brug af gelelektroforese. Teori Alle dele
Center for Undervisningsmidler, afdeling København Analyse af proteiner Øvelsesvejledning Formål At separere og analysere proteiner i almindelige fødevarer ved brug af gelelektroforese. Teori Alle dele
DNA origami øvelse. Introduktion. DNA origami øvelse 3 timer 2018
 DNA origami øvelse Introduktion I denne øvelse bruger vi DNA origami teknikken til at samle en tavle af DNA med dimensioner på 70 nm x 100 nm. Tavlen dannes af et langt enkeltstrenget DNA molekyle, der
DNA origami øvelse Introduktion I denne øvelse bruger vi DNA origami teknikken til at samle en tavle af DNA med dimensioner på 70 nm x 100 nm. Tavlen dannes af et langt enkeltstrenget DNA molekyle, der
Deltagermateriale 43230 OGM. PCR-teknikker 1
 Deltagermateriale 43230 OGM PCR-teknikker 1 POLYMERASE KÆDE REAKTION (PCR) Indholdsfortegnelse 04/02 2 af 36 1. INDLEDNING... 4 DNA's opbygning... 5 DNA-replikation.... 7 2. PCR METODEN... 10 PCR en oversigt...
Deltagermateriale 43230 OGM PCR-teknikker 1 POLYMERASE KÆDE REAKTION (PCR) Indholdsfortegnelse 04/02 2 af 36 1. INDLEDNING... 4 DNA's opbygning... 5 DNA-replikation.... 7 2. PCR METODEN... 10 PCR en oversigt...
Dette er en kladde til et genoptryk af Eksperimentel Genteknologi fra 1991. Ideer, rettelser og forslag modtages gerne. Kh Claudia.
 Transformation af E.coli K 12 Version 3. marts 2009 (C) Claudia Girnth-Diamba og Bjørn Fahnøe Dette er en kladde til et genoptryk af Eksperimentel Genteknologi fra 1991. Ideer, rettelser og forslag modtages
Transformation af E.coli K 12 Version 3. marts 2009 (C) Claudia Girnth-Diamba og Bjørn Fahnøe Dette er en kladde til et genoptryk af Eksperimentel Genteknologi fra 1991. Ideer, rettelser og forslag modtages
DNA origami øvelse DNA origami øvelse
 DNA origami øvelse Introduktion I denne øvelse bruger vi DNA origami teknikken til at samle en tavle af DNA med dimensioner på 70 nm x 100 nm. Tavlen dannes af et langt enkeltstrenget DNA molekyle, der
DNA origami øvelse Introduktion I denne øvelse bruger vi DNA origami teknikken til at samle en tavle af DNA med dimensioner på 70 nm x 100 nm. Tavlen dannes af et langt enkeltstrenget DNA molekyle, der
DNA origami øvelse 2013. DNA origami øvelse
 DNA origami øvelse Introduktion I denne øvelse bruger vi DNA origami teknikken til at samle en tavle af DNA med dimensioner på 70 nm x 100 nm. Tavlen dannes af et langt enkeltstrenget DNA molekyle, der
DNA origami øvelse Introduktion I denne øvelse bruger vi DNA origami teknikken til at samle en tavle af DNA med dimensioner på 70 nm x 100 nm. Tavlen dannes af et langt enkeltstrenget DNA molekyle, der
Regnskovens hemmeligheder
 Center for Undervisningsmidler, afdeling København Regnskovens hemmeligheder Øvelsesvejledning Formål Et gen for et kræfthelbredende protein er blevet fundet i nogle mystiske blade i regnskoven. Forskere
Center for Undervisningsmidler, afdeling København Regnskovens hemmeligheder Øvelsesvejledning Formål Et gen for et kræfthelbredende protein er blevet fundet i nogle mystiske blade i regnskoven. Forskere
KRIMINALDETEKTIVEN GERNINGSSTEDETS GÅDE PCR
 KRIMINALDETEKTIVEN GERNINGSSTEDETS GÅDE Elevvejledning PCR PCR trin for trin PCR involverer en række gentagne cykler, der hver består af følgende tre trin: Denaturering, primer påsætning og forlængelse
KRIMINALDETEKTIVEN GERNINGSSTEDETS GÅDE Elevvejledning PCR PCR trin for trin PCR involverer en række gentagne cykler, der hver består af følgende tre trin: Denaturering, primer påsætning og forlængelse
Elevvejledning pglo transformation
 Introduktion til transformation Elevvejledning pglo transformation I denne øvelse skal du lære fremgangsmåden ved genetisk transformation. Husk på, at et gen er et stykke DNA, der indeholder informationer
Introduktion til transformation Elevvejledning pglo transformation I denne øvelse skal du lære fremgangsmåden ved genetisk transformation. Husk på, at et gen er et stykke DNA, der indeholder informationer
CYP7A1 (0,1 nm) CYP7A1 (0nM) UBIC (0,1 nm)
 Opgave 1 Leveren spiller en central rolle i lipid metabolismen og i opretholdelse af lipid homeostasen i hele kroppen. Lipidmetabolismen er fejlreguleret hos blandt andet svært overvægtige personer samt
Opgave 1 Leveren spiller en central rolle i lipid metabolismen og i opretholdelse af lipid homeostasen i hele kroppen. Lipidmetabolismen er fejlreguleret hos blandt andet svært overvægtige personer samt
Biotechnology Explorer
 Biotechnology Explorer Oprensning af genomisk DNA fra plantemateriale Manual Katalog nr. 166-5005EDU explorer.bio-rad.com Oversat og bearbejdet af Birgit Sandermann Justesen, Nærum Gymnasium, februar 2009
Biotechnology Explorer Oprensning af genomisk DNA fra plantemateriale Manual Katalog nr. 166-5005EDU explorer.bio-rad.com Oversat og bearbejdet af Birgit Sandermann Justesen, Nærum Gymnasium, februar 2009
datp, dctp, dgtp, dttp, [α 32 P]-dCTP urinstofholdig polyacrylamid gel røntgen film
![datp, dctp, dgtp, dttp, [α 32 P]-dCTP urinstofholdig polyacrylamid gel røntgen film datp, dctp, dgtp, dttp, [α 32 P]-dCTP urinstofholdig polyacrylamid gel røntgen film](/thumbs/52/30168242.jpg) Opgave 1 Denne opgave omhandler osteoblast differentiering. Osteoblast celler er involveret i opbygning af knoglevæv. Osteoblast celler dannes ud fra såkaldte calvarial celler. For at forstå det molekylære
Opgave 1 Denne opgave omhandler osteoblast differentiering. Osteoblast celler er involveret i opbygning af knoglevæv. Osteoblast celler dannes ud fra såkaldte calvarial celler. For at forstå det molekylære
Hvad er så vigtigt ved målinger?
 Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab Spændende opdagelse i blodceller fra patienter med Huntingtons Sygdom Mængden af huntingtinprotein
Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab Spændende opdagelse i blodceller fra patienter med Huntingtons Sygdom Mængden af huntingtinprotein
Protokol for genetisk bestemmelse af ABO blodtyper
 Page1 Udarbejdet i samarbejde mellem: Kåre Lehmann, Annabeth Høgh Petersen, Anne Rusborg Nygaard og Jørn M. Clausen Page2 VIGTIGT: SKIFT PIPETTE SPIDSER/TIPS EFTER HVER GANG!! Så undgår du at forurene
Page1 Udarbejdet i samarbejde mellem: Kåre Lehmann, Annabeth Høgh Petersen, Anne Rusborg Nygaard og Jørn M. Clausen Page2 VIGTIGT: SKIFT PIPETTE SPIDSER/TIPS EFTER HVER GANG!! Så undgår du at forurene
DNA origami øvelse DNA origami øvelse
 DNA origami øvelse Introduktion I denne øvelse bruger vi DNA origami teknikken til at samle en tavle af DNA med dimensioner på 70 nm x 100 nm. Tavlen dannes af et langt enkeltstrenget DNA molekyle, der
DNA origami øvelse Introduktion I denne øvelse bruger vi DNA origami teknikken til at samle en tavle af DNA med dimensioner på 70 nm x 100 nm. Tavlen dannes af et langt enkeltstrenget DNA molekyle, der
Biotechnology Explorer. Protein Fingerprinting
 Biotechnology Explorer Protein Fingerprinting Instruktionsmanual Katalognummer 166-0100EDU explorer.bio-rad.com Delene i dette kit er sendt i seperate æsker. Opbevar proteinstandarderne i fryseren, ved
Biotechnology Explorer Protein Fingerprinting Instruktionsmanual Katalognummer 166-0100EDU explorer.bio-rad.com Delene i dette kit er sendt i seperate æsker. Opbevar proteinstandarderne i fryseren, ved
Ligerings- og transformationsmodul inklusiv plasmidoprensning og restriktionsanalyse
 Biotechnology Explorer Ligerings- og transformationsmodul inklusiv plasmidoprensning og restriktionsanalyse Katalog nr. 166-5015EDU explorer.bio-rad.com Kopiering kun tilladt til undervisningsbrug Bemærk:
Biotechnology Explorer Ligerings- og transformationsmodul inklusiv plasmidoprensning og restriktionsanalyse Katalog nr. 166-5015EDU explorer.bio-rad.com Kopiering kun tilladt til undervisningsbrug Bemærk:
Besvarelse af opgaverne til den Spm.A: efter TGA TCA Spm. B:
 Besvarelse af opgaverne til den 20-9-06 Spm.A: Her vil vi gerne sætte et relativt lille stykke DNA (FLAG) sammen med et relativt stort stykke (PRB1). Det lille stykke er for lille til at vi kan PCR amplificere
Besvarelse af opgaverne til den 20-9-06 Spm.A: Her vil vi gerne sætte et relativt lille stykke DNA (FLAG) sammen med et relativt stort stykke (PRB1). Det lille stykke er for lille til at vi kan PCR amplificere
Løsninger til opgaverne den Opgave 2 januar 2003 Spm. 1:
 Løsninger til opgaverne den 6-9-06 Opgave 2 januar 2003 Spm. 1: Fidusen er her at vi kender den primære struktur af glukoamylasen fra tre forskellige svampe, en ascomycet, en basidiomycet og en zygomycet.
Løsninger til opgaverne den 6-9-06 Opgave 2 januar 2003 Spm. 1: Fidusen er her at vi kender den primære struktur af glukoamylasen fra tre forskellige svampe, en ascomycet, en basidiomycet og en zygomycet.
Studienummer: MeDIS Exam 2015. Husk at opgive studienummer ikke navn og cpr.nr. på alle ark, der skal medtages i bedømmelsen
 MeDIS Exam 2015 Titel på kursus: Uddannelse: Semester: Videregående biokemi og medicinudvikling Bachelor i Medis 5. semester Eksamensdato: 26-01-2015 Tid: kl. 09.00-11.00 Bedømmelsesform 7-trin Vigtige
MeDIS Exam 2015 Titel på kursus: Uddannelse: Semester: Videregående biokemi og medicinudvikling Bachelor i Medis 5. semester Eksamensdato: 26-01-2015 Tid: kl. 09.00-11.00 Bedømmelsesform 7-trin Vigtige
Konkurrence mellem to bakteriearter
 1 Biologi-forsøg: Populationsbiologi/evolution Konkurrence mellem to bakteriearter Forsøget undersøger, hvordan en ydre miljøfaktor (temperatur) påvirker konkurrencen mellem to forskellige arter. I dette
1 Biologi-forsøg: Populationsbiologi/evolution Konkurrence mellem to bakteriearter Forsøget undersøger, hvordan en ydre miljøfaktor (temperatur) påvirker konkurrencen mellem to forskellige arter. I dette
FORSØG ØL verdens første svar på anvendt
 FORSØG ØL verdens første svar på anvendt bioteknologi Biotech Academy BioCentrum-DTU Søltofts Plads DTU - Bygning 221 2800 Kgs. Lyngby www.biotechacademy.dk bioteket@biocentrum.dtu.dk INDHOLDSFORTEGNELSE
FORSØG ØL verdens første svar på anvendt bioteknologi Biotech Academy BioCentrum-DTU Søltofts Plads DTU - Bygning 221 2800 Kgs. Lyngby www.biotechacademy.dk bioteket@biocentrum.dtu.dk INDHOLDSFORTEGNELSE
Spm. 1.: Hvis den totale koncentration af monomer betegnes med CT hvad er så sammenhængen mellem CT, [D] og [M]?
![Spm. 1.: Hvis den totale koncentration af monomer betegnes med CT hvad er så sammenhængen mellem CT, [D] og [M]? Spm. 1.: Hvis den totale koncentration af monomer betegnes med CT hvad er så sammenhængen mellem CT, [D] og [M]?](/thumbs/32/15386991.jpg) DNA-smeltetemperaturbestemmelse KemiF2-2008 DNA-smeltetemperaturbestemmelse Introduktion Oligonucleotider er ofte benyttet til at holde nanopartikler sammen med hinanden. Den ene enkeltstreng er kovalent
DNA-smeltetemperaturbestemmelse KemiF2-2008 DNA-smeltetemperaturbestemmelse Introduktion Oligonucleotider er ofte benyttet til at holde nanopartikler sammen med hinanden. Den ene enkeltstreng er kovalent
Laboratorieprotokol for manuel isolering af DNA fra 0,5 ml prøve
 Laboratorieprotokol for manuel isolering af DNA fra 0,5 ml prøve Til isolering af genomisk DNA fra indsamlingssætserierne Oragene - og ORAcollect. Du kan finde flere sprog og protokoller på vores webside
Laboratorieprotokol for manuel isolering af DNA fra 0,5 ml prøve Til isolering af genomisk DNA fra indsamlingssætserierne Oragene - og ORAcollect. Du kan finde flere sprog og protokoller på vores webside
Løsninger til opgaverne den Spm. A: Spm. B Spm. C:
 Løsninger til opgaverne den 12-9-07 Spm. A: Her er vi i en situation at det eneste der kendes til vores receptor er, at den kan binde en ligand, som vi har til rådighed i en radioaktiv mærket version.
Løsninger til opgaverne den 12-9-07 Spm. A: Her er vi i en situation at det eneste der kendes til vores receptor er, at den kan binde en ligand, som vi har til rådighed i en radioaktiv mærket version.
Besvarelse til opgave 1 januar 1999 Spm. A: Spm. B:
 Besvarelse til opgave 1 januar 1999 Spm. A: Vi må lave et genomisk bibliotek i en lambdafag, cosmid, BAC eller YAC plasmid. Til dette vil vi skære det genomiske DNA partielt med Sau3A, så vi får stykker
Besvarelse til opgave 1 januar 1999 Spm. A: Vi må lave et genomisk bibliotek i en lambdafag, cosmid, BAC eller YAC plasmid. Til dette vil vi skære det genomiske DNA partielt med Sau3A, så vi får stykker
Gerningsstedets gåde Den usynlige sandhed - DNA PCR Basics Kit. Katalog nr. 166-2600EDU
 1 Gerningsstedets gåde Den usynlige sandhed - DNA PCR Basics Kit Katalog nr. 166-2600EDU Bemærk: Kittet indeholder temperaturfølsomme dele. Åbn derfor straks pakken og læg de dele, der er mærket med -20
1 Gerningsstedets gåde Den usynlige sandhed - DNA PCR Basics Kit Katalog nr. 166-2600EDU Bemærk: Kittet indeholder temperaturfølsomme dele. Åbn derfor straks pakken og læg de dele, der er mærket med -20
Øvelse med tarmkræftceller i kultur.
 Øvelse med tarmkræftceller i kultur. Baggrund Hver 3. dansker bliver ramt af kræft, inden de er blevet 75 år. Tyktarmskræft er den 3. hyppigste kræftform hos både mænd og kvinder, hvor henholdsvis 7.3
Øvelse med tarmkræftceller i kultur. Baggrund Hver 3. dansker bliver ramt af kræft, inden de er blevet 75 år. Tyktarmskræft er den 3. hyppigste kræftform hos både mænd og kvinder, hvor henholdsvis 7.3
Anvendelse af DNA markører i planteforædlingen
 Anvendelse af DNA markører i planteforædlingen Forsker Gunter Backes, Afdeling for Planteforskning, Forskningscentret Risø DNA-markører på kontaktfladen mellem molekylær genetik og klassisk planteforædling
Anvendelse af DNA markører i planteforædlingen Forsker Gunter Backes, Afdeling for Planteforskning, Forskningscentret Risø DNA-markører på kontaktfladen mellem molekylær genetik og klassisk planteforædling
Mælkesyrebakterier og holdbarhed
 Mælkesyrebakterier og holdbarhed Navn: Forsøgsvejledning Mælkesyrebakterier og holdbarhed Formål med forsøget Formålet med denne øvelse er at undersøge mælkesyrebakteriers og probiotikas evne til at øge
Mælkesyrebakterier og holdbarhed Navn: Forsøgsvejledning Mælkesyrebakterier og holdbarhed Formål med forsøget Formålet med denne øvelse er at undersøge mælkesyrebakteriers og probiotikas evne til at øge
[BESØGSSERVICE INSTITUT FOR MOLEKYLÆRBIOLOGI OG GENETIK, AU]
![[BESØGSSERVICE INSTITUT FOR MOLEKYLÆRBIOLOGI OG GENETIK, AU] [BESØGSSERVICE INSTITUT FOR MOLEKYLÆRBIOLOGI OG GENETIK, AU]](/thumbs/72/66305306.jpg) Enzymkinetik INTRODUKTION Enzymer er biologiske katalysatorer i alle levende organismer som er essentielle for liv. Selektivt og effektivt katalyserer enzymerne kemiske reaktioner som ellers ikke ville
Enzymkinetik INTRODUKTION Enzymer er biologiske katalysatorer i alle levende organismer som er essentielle for liv. Selektivt og effektivt katalyserer enzymerne kemiske reaktioner som ellers ikke ville
Appendix 1: Udregning af mængde cellesuspention til udsåning. Faktor mellem total antal celler og antal celler der ønskes udsås:
 Appendix Appendix 1: Udregning af mængde cellesuspention til udsåning Fortyndingsfaktor: Efter trypsinering og centrifugering af celler fra cellestokken, opblandes cellerne i 1 ml medie. For at lave en
Appendix Appendix 1: Udregning af mængde cellesuspention til udsåning Fortyndingsfaktor: Efter trypsinering og centrifugering af celler fra cellestokken, opblandes cellerne i 1 ml medie. For at lave en
Bioteknologi A. Gymnasiale uddannelser. Vejledende opgavesæt 1. Mandag den 31. maj 2010 kl. 9.40-14.40. 5 timers skriftlig prøve
 Vejledende opgavesæt 1 Bioteknologi A Gymnasiale uddannelser 5 timers skriftlig prøve Vejledende opgavesæt 1 Mandag den 31. maj 2010 kl. 9.40-14.40 Side 1 af 8 sider pgave 1. Genmodificeret ris Vitamin
Vejledende opgavesæt 1 Bioteknologi A Gymnasiale uddannelser 5 timers skriftlig prøve Vejledende opgavesæt 1 Mandag den 31. maj 2010 kl. 9.40-14.40 Side 1 af 8 sider pgave 1. Genmodificeret ris Vitamin
Bilag til Kvantitativ bestemmelse af glucose
 Bilag til Kvantitativ bestemmelse af glucose Det synlige formål med øvelsen er at lære, hvorledes man helt præcist kan bestemme små mængder af glucose i en vandig opløsning ved hjælp af målepipetter, spektrofotometer
Bilag til Kvantitativ bestemmelse af glucose Det synlige formål med øvelsen er at lære, hvorledes man helt præcist kan bestemme små mængder af glucose i en vandig opløsning ved hjælp af målepipetter, spektrofotometer
FORSØG ØL verdens første svar på anvendt
 FORSØG ØL verdens første svar på anvendt bioteknologi Biotech Academy BioCentrum-DTU Søltofts Plads DTU - Bygning 221 2800 Kgs. Lyngby www.biotechacademy.dk bioteket@biocentrum.dtu.dk INDHOLDSFORTEGNELSE
FORSØG ØL verdens første svar på anvendt bioteknologi Biotech Academy BioCentrum-DTU Søltofts Plads DTU - Bygning 221 2800 Kgs. Lyngby www.biotechacademy.dk bioteket@biocentrum.dtu.dk INDHOLDSFORTEGNELSE
Restriktionsenzymer findes Genkendelsessekvens
 Restriktionsenzymer Skanning Restriktionsenzymer findes i bakterier (forsvarsmekanisme) IKKE i eukaryote celler 3-5 - 5-3 - Restriktionsenzyme Genkendelsessekvens Palindromisk Otto, Anna, radar Madam I
Restriktionsenzymer Skanning Restriktionsenzymer findes i bakterier (forsvarsmekanisme) IKKE i eukaryote celler 3-5 - 5-3 - Restriktionsenzyme Genkendelsessekvens Palindromisk Otto, Anna, radar Madam I
Mælkesyrebakterier og holdbarhed
 Mælkesyrebakterier og holdbarhed Formål Formålet med denne øvelse er at undersøge mælkesyrebakteriers og probiotikas evne til at øge holdbarheden af kød ved at: 1. Undersøge forskellen på bakterieantal
Mælkesyrebakterier og holdbarhed Formål Formålet med denne øvelse er at undersøge mælkesyrebakteriers og probiotikas evne til at øge holdbarheden af kød ved at: 1. Undersøge forskellen på bakterieantal
Som substrat i forsøgene anvender vi para nitrophenylfosfat, der vha. enzymet omdannes til paranitrofenol
 Enzymkinetik Introduktion I disse forsøg skal I arbejde med enzymet alkalisk fosfatase. Fosfataser er meget almindelige i levende organismer og er enzymer med relativt bred substrat specificitet. De katalyserer
Enzymkinetik Introduktion I disse forsøg skal I arbejde med enzymet alkalisk fosfatase. Fosfataser er meget almindelige i levende organismer og er enzymer med relativt bred substrat specificitet. De katalyserer
Statusrapport for projektet: Afprøvning af den nye PCR teknik til test for virus i kartoffelknolde til erstatning for den gamle ELISA-teknik
 Bilag 2 Statusrapport for projektet: Afprøvning af den nye PCR teknik til test for virus i kartoffelknolde til erstatning for den gamle ELISA-teknik ved forsker Mogens Nicolaisen, Danmarks JordbrugsForskning,
Bilag 2 Statusrapport for projektet: Afprøvning af den nye PCR teknik til test for virus i kartoffelknolde til erstatning for den gamle ELISA-teknik ved forsker Mogens Nicolaisen, Danmarks JordbrugsForskning,
Elektroforese. Navne: Rami Kassim Kaddoura Roman Averin Safa Sarac Magnus Høegh Jensen Frederik Gaarde Lindskov
 Elektroforese Navne: Rami Kassim Kaddoura Roman Averin Safa Sarac Magnus Høegh Jensen Frederik Gaarde Lindskov Klasse: 1.4 Fag: Biologi Vejleder: Brian Christensen Skole: Roskilde tekniske gymnasium, Htx
Elektroforese Navne: Rami Kassim Kaddoura Roman Averin Safa Sarac Magnus Høegh Jensen Frederik Gaarde Lindskov Klasse: 1.4 Fag: Biologi Vejleder: Brian Christensen Skole: Roskilde tekniske gymnasium, Htx
Nr 1. Fra gen til protein
 Nr 1 Fra gen til protein Med udgangspunkt i vedlagte illustrationer bedes du besvare følgende: Hvordan er sammenhængen mellem DNA ets nukleotider og proteinets aminosyrer? Beskriv hvad der sker ved henholdsvis
Nr 1 Fra gen til protein Med udgangspunkt i vedlagte illustrationer bedes du besvare følgende: Hvordan er sammenhængen mellem DNA ets nukleotider og proteinets aminosyrer? Beskriv hvad der sker ved henholdsvis
Anmeldelse af genteknologiske forskningsprojekter samt genteknologisk storskalaforsøg eller produktion
 Anmeldelse af genteknologiske forskningsprojekter samt genteknologisk storskalaforsøg eller produktion Anmeldelse til Arbejdstilsynet efter Arbejdsministeriets bekendtgørelse om genteknolog og arbejdsmiljø
Anmeldelse af genteknologiske forskningsprojekter samt genteknologisk storskalaforsøg eller produktion Anmeldelse til Arbejdstilsynet efter Arbejdsministeriets bekendtgørelse om genteknolog og arbejdsmiljø
OPTIMERING AF PCR MHP. DETEKTION AF SNP ER I CERS6.
 OPTIMERING AF PCR MHP. DETEKTION AF SNP ER I CERS6. Bachelorprojekt Udarbejdet af Sandra Reinholt Nielsen 14.08.1981 Projektperiode: 6. April 9.juni 2009 Vejledere: Søren Jensen, Lektor, Professionshøjskolen
OPTIMERING AF PCR MHP. DETEKTION AF SNP ER I CERS6. Bachelorprojekt Udarbejdet af Sandra Reinholt Nielsen 14.08.1981 Projektperiode: 6. April 9.juni 2009 Vejledere: Søren Jensen, Lektor, Professionshøjskolen
Analyse af benzoxazinoider i brød
 Analyse af benzoxazinoider i brød Øvelsesvejledning til kemi-delen af øvelsen. Af Stine Krogh Steffensen, Institut for Agroøkologi, AU Eleven har forberedt før øvelsen: 1. Eleven har udfyldt skemaet herunder
Analyse af benzoxazinoider i brød Øvelsesvejledning til kemi-delen af øvelsen. Af Stine Krogh Steffensen, Institut for Agroøkologi, AU Eleven har forberedt før øvelsen: 1. Eleven har udfyldt skemaet herunder
Spm. 1.: Hvis den totale koncentration af monomer betegnes med CT hvad er så sammenhængen mellem CT, [D] og [M]?
![Spm. 1.: Hvis den totale koncentration af monomer betegnes med CT hvad er så sammenhængen mellem CT, [D] og [M]? Spm. 1.: Hvis den totale koncentration af monomer betegnes med CT hvad er så sammenhængen mellem CT, [D] og [M]?](/thumbs/54/34467777.jpg) DNA-smeltetemperaturbestemmelse KemiF2-2008 DNA-smeltetemperaturbestemmelse Introduktion Oligonucleotider er ofte benyttet til at holde nanopartikler sammen med hinanden. Den ene enkeltstreng er kovalent
DNA-smeltetemperaturbestemmelse KemiF2-2008 DNA-smeltetemperaturbestemmelse Introduktion Oligonucleotider er ofte benyttet til at holde nanopartikler sammen med hinanden. Den ene enkeltstreng er kovalent
Udarbejdet af Anna-Alexandra Grube Hoppe
 METODER - BIOKEMI For medicinstuderende - Panuminstituttet UDARBEJDET AF ANNA-ALEXANDRA GRUBE HOPPE RESTRIKTIONSENZYM ANALYSE (E: 329-330) Restriktionsenzym analyse er en metode, der bruges til at kortlægge
METODER - BIOKEMI For medicinstuderende - Panuminstituttet UDARBEJDET AF ANNA-ALEXANDRA GRUBE HOPPE RESTRIKTIONSENZYM ANALYSE (E: 329-330) Restriktionsenzym analyse er en metode, der bruges til at kortlægge
Kapitel 1 Genteknologi (1/6)
 Kapitel 1 Genteknologi (1/6) Transformation FOTO: SØREN LUNDBERG FORMÅL At isolere plasmider fra plasmidbærende bakterier og overføre dem til andre bakterier. TEORI Transformation er den teknik, hvor generne
Kapitel 1 Genteknologi (1/6) Transformation FOTO: SØREN LUNDBERG FORMÅL At isolere plasmider fra plasmidbærende bakterier og overføre dem til andre bakterier. TEORI Transformation er den teknik, hvor generne
Forsøgsprotokol til larveforsøg: Tilsætning af 3 dage gamle larver til gødning inficeret med patogene bakterier
 Forsøgsprotokol til larveforsøg: Tilsætning af 3 dage gamle larver til gødning inficeret med patogene bakterier Formål: at undersøge udviklingen i mængden af tilsatte patogene bakterier til hønsegødning.
Forsøgsprotokol til larveforsøg: Tilsætning af 3 dage gamle larver til gødning inficeret med patogene bakterier Formål: at undersøge udviklingen i mængden af tilsatte patogene bakterier til hønsegødning.
Konkurrence mellem to bakteriearter
 1 Biologi-forsøg: Populationsbiologi/evolution Konkurrence mellem to bakteriearter Forsøget undersøger, hvordan en ydre miljøfaktor (temperatur) påvirker konkurrencen mellem to forskellige arter. I dette
1 Biologi-forsøg: Populationsbiologi/evolution Konkurrence mellem to bakteriearter Forsøget undersøger, hvordan en ydre miljøfaktor (temperatur) påvirker konkurrencen mellem to forskellige arter. I dette
Protokol for genetisk bestemmelse af ABO blodtyper
 Page1 Udarbejdet i samarbejde mellem: Kåre Lehmann, Annabeth Høgh Petersen, Anne Rusborg Nygaard og Jørn M. Clausen Page2 VIGTIGT: SKIFT PIPETTE SPIDSER/TIPS EFTER HVER GANG!! Så undgår du at forurene
Page1 Udarbejdet i samarbejde mellem: Kåre Lehmann, Annabeth Høgh Petersen, Anne Rusborg Nygaard og Jørn M. Clausen Page2 VIGTIGT: SKIFT PIPETTE SPIDSER/TIPS EFTER HVER GANG!! Så undgår du at forurene
Materialeliste: Ready-to-loadTM DNA prøver til elektroforese. Medfølgende reagenser og tilbehør. Egne materialer
 Elevvejledning 1 Materialeliste: Ready-to-loadTM DNA prøver til elektroforese A B C D E F Plasmid DNA (uskåret) Plasmid skåret med Bgl I Plasmid skåret med Eco RI Lambda DNA (uskåret) Lambda DNA skåret
Elevvejledning 1 Materialeliste: Ready-to-loadTM DNA prøver til elektroforese A B C D E F Plasmid DNA (uskåret) Plasmid skåret med Bgl I Plasmid skåret med Eco RI Lambda DNA (uskåret) Lambda DNA skåret
August Krogh Building Copenhagen University. Universitetsparken 13 2100 Copenhagen OE PAPedersen@aki.ku.dk
 Per Amstrup Pedersen Institute of Molecular Biology August Krogh Building Copenhagen University Universitetsparken 13 2100 Copenhagen OE PAPedersen@aki.ku.dk En genteknologisk værktøjskasse. Version 2007
Per Amstrup Pedersen Institute of Molecular Biology August Krogh Building Copenhagen University Universitetsparken 13 2100 Copenhagen OE PAPedersen@aki.ku.dk En genteknologisk værktøjskasse. Version 2007
Trin 1: Oprensning af genomisk DNA (DeoxyriboNucleicAcid)
 Trin 1: Oprensning af genomisk DNA (DeoxyriboNucleicAcid) (Denne del tager ca. 3 timer, max 14 prøver) ELEVVEJLEDNING forsøgskasse nr. 1 AAU Oprensning af DNA-prøven foregår gennem fem trin, se figur 1:
Trin 1: Oprensning af genomisk DNA (DeoxyriboNucleicAcid) (Denne del tager ca. 3 timer, max 14 prøver) ELEVVEJLEDNING forsøgskasse nr. 1 AAU Oprensning af DNA-prøven foregår gennem fem trin, se figur 1:
Kvalitetskontrol i molekylærbiologisk rutinediagnostik
 i molekylærbiologisk rutinediagnostik Respirationsvejsvirus som model Mette Høgh, cand. scient, ph.d. Klinisk Mikrobiologisk Afdeling, Hvidovre Hospital Mette.hoegh@hvh.regionh.dk Oversigt Introduktion
i molekylærbiologisk rutinediagnostik Respirationsvejsvirus som model Mette Høgh, cand. scient, ph.d. Klinisk Mikrobiologisk Afdeling, Hvidovre Hospital Mette.hoegh@hvh.regionh.dk Oversigt Introduktion
Klip-og-kopier DNA: reparér mutationer med 'genom-redigering' DNA, RNA og protein
 Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab Klip-og-kopier DNA: reparér mutationer med 'genom-redigering' Forskere kan lave præcise ændringer
Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab Klip-og-kopier DNA: reparér mutationer med 'genom-redigering' Forskere kan lave præcise ændringer
Kvantitativ bestemmelse af reducerende sukker (glukose)
 Kvantitativ bestemmelse af reducerende sukker (glukose) Baggrund: Det viser sig at en del af de sukkerarter vi indtager med vores mad er hvad man i fagsproget kalder reducerende sukkerarter. Disse vil
Kvantitativ bestemmelse af reducerende sukker (glukose) Baggrund: Det viser sig at en del af de sukkerarter vi indtager med vores mad er hvad man i fagsproget kalder reducerende sukkerarter. Disse vil
Excel tutorial om indekstal og samfundsfag 2008
 Excel tutorial om indekstal og samfundsfag 2008 I denne note skal vi behandle data fra CD-rommen Samfundsstatistik 2008, som indeholder en mængde data, som er relevant i samfundsfag. Vi skal specielt analysere
Excel tutorial om indekstal og samfundsfag 2008 I denne note skal vi behandle data fra CD-rommen Samfundsstatistik 2008, som indeholder en mængde data, som er relevant i samfundsfag. Vi skal specielt analysere
Jernindhold i fødevarer bestemt ved spektrofotometri
 Bioteknologi 4, Tema 8 Forsøg www.nucleus.dk Linkadresserne fungerer pr. 1.7.2011. Forlaget tager forbehold for evt. ændringer i adresserne. Jernindhold i fødevarer bestemt ved spektrofotometri Formål
Bioteknologi 4, Tema 8 Forsøg www.nucleus.dk Linkadresserne fungerer pr. 1.7.2011. Forlaget tager forbehold for evt. ændringer i adresserne. Jernindhold i fødevarer bestemt ved spektrofotometri Formål
Vi går derfor ud fra, at I ved, at DNA molekyler er meget lange molekyler
 DNA-profil analyse Indledning DNA-profil analyser eller i daglig tale DNA-fingeraftryk er en metode, der bruges, når man skal finde ud af, hvem der er far et barn, hvis der altså er flere muligheder. Det
DNA-profil analyse Indledning DNA-profil analyser eller i daglig tale DNA-fingeraftryk er en metode, der bruges, når man skal finde ud af, hvem der er far et barn, hvis der altså er flere muligheder. Det
BIOTEKNOLOGI HØJT NIVEAU
 STUDENTEREKSAMEN 2007 2007-BT-1 BITEKNLGI HØJT NIVEAU Torsdag den 31. maj 2007 kl. 9.00 14.00 Sættet består af 1 stor og 2 små opgaver samt 1 bilag i 2 eksemplarer. Det ene eksemplar af bilaget afleveres
STUDENTEREKSAMEN 2007 2007-BT-1 BITEKNLGI HØJT NIVEAU Torsdag den 31. maj 2007 kl. 9.00 14.00 Sættet består af 1 stor og 2 små opgaver samt 1 bilag i 2 eksemplarer. Det ene eksemplar af bilaget afleveres
[BESØGSSERVICE INSTITUT FOR MOLEKYLÆRBIOLOGI OG GENETIK, AU]
![[BESØGSSERVICE INSTITUT FOR MOLEKYLÆRBIOLOGI OG GENETIK, AU] [BESØGSSERVICE INSTITUT FOR MOLEKYLÆRBIOLOGI OG GENETIK, AU]](/thumbs/39/19540330.jpg) Enzymkinetik INTRODUKTION Enzymer er biologiske katalysatorer i alle levende organismer som er essentielle for liv. Selektivt og effektivt katalyserer enzymerne kemiske reaktioner som ellers ikke ville
Enzymkinetik INTRODUKTION Enzymer er biologiske katalysatorer i alle levende organismer som er essentielle for liv. Selektivt og effektivt katalyserer enzymerne kemiske reaktioner som ellers ikke ville
3y Bioteknologi A. Lærere TK og JM. Eksamensspørgsmål uden bilag
 3y Bioteknologi A Lærere TK og JM Eksamensspørgsmål uden bilag 1: DNA, proteiner og gensplejsning Med inddragelse af de vedlagte bilag samt øvelsen med pglo skal du diskutere og vurdere brugen af DNA og
3y Bioteknologi A Lærere TK og JM Eksamensspørgsmål uden bilag 1: DNA, proteiner og gensplejsning Med inddragelse af de vedlagte bilag samt øvelsen med pglo skal du diskutere og vurdere brugen af DNA og
Isolering af DNA fra løg
 Isolering af DNA fra løg Formål: At afprøve en metode til isolering af DNA fra et levende væv. At anvende enzymer.. Indledning: Isolering af DNA fra celler er første trin i mange molekylærbiologiske undersøgelser.
Isolering af DNA fra løg Formål: At afprøve en metode til isolering af DNA fra et levende væv. At anvende enzymer.. Indledning: Isolering af DNA fra celler er første trin i mange molekylærbiologiske undersøgelser.
STUDERENDES ØVELSESARK TIL EKSPERIMENT A: NATURLIGE NANOMATERIALER
 STUDERENDES ØVELSESARK TIL EKSPERIMENT A: NATURLIGE NANOMATERIALER Navn: Dato:.. MÅL: - Lær om eksistensen af naturlige nanomaterialer - Lysets interaktion med kolloider - Gelatine og mælk som eksempler
STUDERENDES ØVELSESARK TIL EKSPERIMENT A: NATURLIGE NANOMATERIALER Navn: Dato:.. MÅL: - Lær om eksistensen af naturlige nanomaterialer - Lysets interaktion med kolloider - Gelatine og mælk som eksempler
Bioteknologi A. Studentereksamen. Af opgaverne 1 og 2 skal begge opgaver besvares. Af opgaverne 3 og 4 skal en og kun en af opgaverne besvares.
 Bioteknologi A Studentereksamen Af opgaverne 1 og 2 skal begge opgaver besvares. Af opgaverne 3 og 4 skal en og kun en af opgaverne besvares. frs111-btk/a-31052011 Tirsdag den 31. maj 2011 kl. 9.00-14.00
Bioteknologi A Studentereksamen Af opgaverne 1 og 2 skal begge opgaver besvares. Af opgaverne 3 og 4 skal en og kun en af opgaverne besvares. frs111-btk/a-31052011 Tirsdag den 31. maj 2011 kl. 9.00-14.00
Find enzymer til miljøvenligt vaskepulver
 Find enzymer til miljøvenligt vaskepulver Enzymer, der er aktive under kolde forhold, har adskillige bioteknologiske anvendelsesmuligheder. Nye smarte og bæredygtige produkter kan nemlig blive udviklet
Find enzymer til miljøvenligt vaskepulver Enzymer, der er aktive under kolde forhold, har adskillige bioteknologiske anvendelsesmuligheder. Nye smarte og bæredygtige produkter kan nemlig blive udviklet
Er der flere farver i sort?
 Er der flere farver i sort? Hvad er kromatografi? Kromatografi benyttes inden for mange forskellige felter og forskningsområder og er en anvendelig og meget benyttet analytisk teknik. Kromatografi bruges
Er der flere farver i sort? Hvad er kromatografi? Kromatografi benyttes inden for mange forskellige felter og forskningsområder og er en anvendelig og meget benyttet analytisk teknik. Kromatografi bruges
DNA smeltepunktsbestemmelse
 DNA smeltepunktsbestemmelse Troels Linnet Christine Hartmann Mads Topp 29. november 2006 Resumé DNA smeltepunktet bestemmes teoretisk og praktisk til sammenligning. Ved opvarmning forventes et højere smeltepunkt
DNA smeltepunktsbestemmelse Troels Linnet Christine Hartmann Mads Topp 29. november 2006 Resumé DNA smeltepunktet bestemmes teoretisk og praktisk til sammenligning. Ved opvarmning forventes et højere smeltepunkt
Biologiske signaler i graviditeten - Genetisk information
 Biologiske signaler i graviditeten - Genetisk information 2 I forbindelse med vores studie af graviditeten ønsker vi at foretage undersøgelser af arvematerialet (DNA og RNA). Disse genetiske undersøgelser
Biologiske signaler i graviditeten - Genetisk information 2 I forbindelse med vores studie af graviditeten ønsker vi at foretage undersøgelser af arvematerialet (DNA og RNA). Disse genetiske undersøgelser
Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab Ofte stillede spørgsmål, januar 2011
 Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab Ofte stillede spørgsmål, januar 2011 Svar på ofte stillede spørgsmål om HD - den første i en
Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab Ofte stillede spørgsmål, januar 2011 Svar på ofte stillede spørgsmål om HD - den første i en
Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab En baglæns besked gemt i HD-genet?
 Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab En baglæns besked gemt i HD-genet? Lyn dine gener op! En baglæns besked, gemt i 'backup-dna'et'
Forskningsnyheder om Huntingtons Sygdom På hverdagssprog Skrevet af forskere. Til det globale HS-fællesskab En baglæns besked gemt i HD-genet? Lyn dine gener op! En baglæns besked, gemt i 'backup-dna'et'
Banan DNA 1/6. Formål: Formålet med øvelsen er at give eleverne mulighed for at se DNA strenge med det blotte øje.
 Banan DNA Formål: Formålet med øvelsen er at give eleverne mulighed for at se DNA strenge med det blotte øje. Baggrundsviden: Om vi er mennesker, dyr eller planter, så har alle organismer DNA i deres celler.
Banan DNA Formål: Formålet med øvelsen er at give eleverne mulighed for at se DNA strenge med det blotte øje. Baggrundsviden: Om vi er mennesker, dyr eller planter, så har alle organismer DNA i deres celler.
Tilstandskontrol. ved hjælp af vibrationsanalyse
 VIBRO CONSULT Palle Aggerholm Tilstandskontrol ved hjælp af vibrationsanalyse Et minikursus med særlig henvendelse til vindmølleejere Adresse: Balagervej 69 Telefon: 86 14 95 84 Mobil: 40 14 95 84 E-mail:
VIBRO CONSULT Palle Aggerholm Tilstandskontrol ved hjælp af vibrationsanalyse Et minikursus med særlig henvendelse til vindmølleejere Adresse: Balagervej 69 Telefon: 86 14 95 84 Mobil: 40 14 95 84 E-mail:
Algedråber og fotosyntese
 Algedråber og fotosyntese Fotosyntesen er en utrolig kompleks proces, som kan være svær at forstå. Heldigvis kan fotosyntesen illustreres på en måde, så alle kan forstå, hvad der helt præcist foregår i
Algedråber og fotosyntese Fotosyntesen er en utrolig kompleks proces, som kan være svær at forstå. Heldigvis kan fotosyntesen illustreres på en måde, så alle kan forstå, hvad der helt præcist foregår i
Matematiske modeller Forsøg 1
 Matematiske modeller Forsøg 1 At måle absorbansen af forskellige koncentrationer af brilliant blue og derefter lave en standardkurve. 2 ml pipette 50 og 100 ml målekolber Kuvetter Engangspipetter Stamopløsning
Matematiske modeller Forsøg 1 At måle absorbansen af forskellige koncentrationer af brilliant blue og derefter lave en standardkurve. 2 ml pipette 50 og 100 ml målekolber Kuvetter Engangspipetter Stamopløsning
pglo-transformationskit
 Katalog nummer 166-0003-EDU pglo-transformationskit arac ori pglo bla GFP Oversat og bearbejdet af Birgit Sandermann Justesen og Lars Moeslund, 2004 Brugen af dette kit til undervisningsbrug skal varetages
Katalog nummer 166-0003-EDU pglo-transformationskit arac ori pglo bla GFP Oversat og bearbejdet af Birgit Sandermann Justesen og Lars Moeslund, 2004 Brugen af dette kit til undervisningsbrug skal varetages
Nye og traditionelle metoder i planteforædling. Søren K. Rasmussen Institut for Plante- og Jordbrugsvidenskab, 27. september 2016
 Nye og traditionelle metoder i planteforædling Søren K. Rasmussen Institut for Plante- og Jordbrugsvidenskab, 27. september 2016 12-10-2016 2 Traditionel forædling Vælge forældrene Krydse forældrene Selektere
Nye og traditionelle metoder i planteforædling Søren K. Rasmussen Institut for Plante- og Jordbrugsvidenskab, 27. september 2016 12-10-2016 2 Traditionel forædling Vælge forældrene Krydse forældrene Selektere
3M Food Safety 3M Molecular Detection System. Patogentesting. Enkelt og nemt
 3M Food Safety 3M Molecular Detection System Patogentesting Enkelt og nemt Fødevareproduktion er dit fagområde Fødevaresikkerhed er vores Forbrugerne stoler på at din virksomhed producerer fødevarer af
3M Food Safety 3M Molecular Detection System Patogentesting Enkelt og nemt Fødevareproduktion er dit fagområde Fødevaresikkerhed er vores Forbrugerne stoler på at din virksomhed producerer fødevarer af
1 Idékatalog til øvelser: Bioanalytikeruddannelsen UCSJ, Parkvej 190, 4700 Næstved
 1 Idékatalog til øvelser: Bioanalytikeruddannelsen UCSJ, Parkvej 190, 2 Idékatalog til øvelser: Bioanalytikeruddannelsen UCSJ, Parkvej 190, Indhold Realtime PCR på β-actin... 3 CSI og retsgenetik... 3
1 Idékatalog til øvelser: Bioanalytikeruddannelsen UCSJ, Parkvej 190, 2 Idékatalog til øvelser: Bioanalytikeruddannelsen UCSJ, Parkvej 190, Indhold Realtime PCR på β-actin... 3 CSI og retsgenetik... 3
Undervisningsbeskrivelse fra august 2014
 Undervisningsbeskrivelse fra august 2014 Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Oktober 2015 Institution Hansenberg Gymnasium Uddannelse Fag og niveau Lærer(e) Hold HTX Bioteknologi
Undervisningsbeskrivelse fra august 2014 Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Oktober 2015 Institution Hansenberg Gymnasium Uddannelse Fag og niveau Lærer(e) Hold HTX Bioteknologi
Det Teknisk-Naturvidenskabelige Fakultet
 Analyse af geners ekspressionsprofil i arkiveret lymfoidt materiale: Undersøgelse af metode til kvalitetsbaseret udvælgelse af tumorvæv, der er fikseret i formalin og indstøbt i paraffin Afgangsprojekt
Analyse af geners ekspressionsprofil i arkiveret lymfoidt materiale: Undersøgelse af metode til kvalitetsbaseret udvælgelse af tumorvæv, der er fikseret i formalin og indstøbt i paraffin Afgangsprojekt
Nye metoder til bestemmelse af KCl i halm
 RESUME for Eltra PSO-F&U projekt nr. 3136 Juli 2002 Nye metoder til bestemmelse af KCl i halm Indhold af vandopløselige salte som kaliumchlorid (KCl) i halm kan give anledning til en række forskellige
RESUME for Eltra PSO-F&U projekt nr. 3136 Juli 2002 Nye metoder til bestemmelse af KCl i halm Indhold af vandopløselige salte som kaliumchlorid (KCl) i halm kan give anledning til en række forskellige
Biologi opgave Opsamling: Cellebiologi (Bioanalytiker modul3)
 1 Delphine Bonneau Biologi opgave Opsamling: Cellebiologi 1-6 Pelle har spist en kæmpe stor kage, og efterfølgende stiger hans blodsukker. Derfor sender kroppen besked til de endokrine kirtler i bugspytkirtlen
1 Delphine Bonneau Biologi opgave Opsamling: Cellebiologi 1-6 Pelle har spist en kæmpe stor kage, og efterfølgende stiger hans blodsukker. Derfor sender kroppen besked til de endokrine kirtler i bugspytkirtlen
Immunologi- det store overblik. Dyrlæge Rikke Søgaard Teknisk rådgiver, Merial Norden A/S
 Immunologi- det store overblik Dyrlæge Rikke Søgaard Teknisk rådgiver, Merial Norden A/S Hvem er jeg Rikke Søgaard Uddannet dyrlæge i 1998 Ansat 5 år i praksis både blandet og svinepraksis Ansat 5 år på
Immunologi- det store overblik Dyrlæge Rikke Søgaard Teknisk rådgiver, Merial Norden A/S Hvem er jeg Rikke Søgaard Uddannet dyrlæge i 1998 Ansat 5 år i praksis både blandet og svinepraksis Ansat 5 år på
dobbelt strenget DNA hvor de enkelte nukleotider er komplementære. Tm: Smeltetemperaturen for en given DNA sekvensmængde hvoraf 50% er denatureret.
 Titel: Sporadiske DNA mutationer og sensitiviteten af målemetoder. Undertitel: Screening af DNA for sporadiske mutationer stiller store krav til sensitiviteten af de anvendte målemetoder. I en prøve der
Titel: Sporadiske DNA mutationer og sensitiviteten af målemetoder. Undertitel: Screening af DNA for sporadiske mutationer stiller store krav til sensitiviteten af de anvendte målemetoder. I en prøve der
Formål At analysere for myosin i muskelvæv fra fisk ved brug af western blotting
 Center for Undervisningsmidler, afdeling København Western blotting Øvelsesvejledning Formål At analysere for myosin i muskelvæv fra fisk ved brug af western blotting Teori Proteomik er studiet af celleproteiners
Center for Undervisningsmidler, afdeling København Western blotting Øvelsesvejledning Formål At analysere for myosin i muskelvæv fra fisk ved brug af western blotting Teori Proteomik er studiet af celleproteiners
Brugsvejledning for 7827.10 dialyseslange
 Brugsvejledning for 7827.10 dialyseslange 14.06.07 Aa 7827.10 1. Præsentation Dialyseslangen er 10 m lang og skal klippes i passende stykker og blødgøres med vand for at udføre forsøgene med osmose og
Brugsvejledning for 7827.10 dialyseslange 14.06.07 Aa 7827.10 1. Præsentation Dialyseslangen er 10 m lang og skal klippes i passende stykker og blødgøres med vand for at udføre forsøgene med osmose og
Testet i udlandet. Oversigt af udenlandske analyser rekvireret fra Færøerne i 2013 11-11-2013. Forfatter: Janus Vang, Ph.D.
 11-11-2013 Testet i udlandet Oversigt af udenlandske analyser rekvireret fra Færøerne i 2013 Forfatter: Janus Vang, Ph.D. ANSVARLIG: REGIN W. DALSGAARD, BESTYRELSESFORMAND FOR VINNUFRAMI INTRODUKTION Færøernes
11-11-2013 Testet i udlandet Oversigt af udenlandske analyser rekvireret fra Færøerne i 2013 Forfatter: Janus Vang, Ph.D. ANSVARLIG: REGIN W. DALSGAARD, BESTYRELSESFORMAND FOR VINNUFRAMI INTRODUKTION Færøernes
