BILAG I PRODUKTRESUMÉ
|
|
|
- Gerda Steensen
- 6 år siden
- Visninger:
Transkript
1 BILAG I PRODUKTRESUMÉ
2 1. LÆGEMIDLETS NAVN Omidria 10 mg/ml + 3 mg/ml koncentrat til intraokulær skyllevæske, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hvert hætteglas med 4 ml opløsning indeholder phenylephrinhydrochlorid svarende til 40,6 mg (10,2 mg/ml) phenylephrin og ketorolactrometamol svarende til 11,5 mg (2,88 mg/ml) ketorolac. Efter fortynding i 500 ml skyllevæske, indeholder opløsningen 0,081 mg/ml phenylephrin og 0,023 mg/ml ketorolac. Alle hjælpestoffer er anført under pkt LÆGEMIDDELFORM Koncentrat til intraokulær skyllevæske, opløsning. Klar, farveløs til let gullig opløsning med et ph på: 6,3 ±0,3. 4. KLINISKE OPLYSNINGER 4.1 Terapeutiske indikationer Omidria er indiceret til opretholdelse af intraoperativ mydriase, forebyggelse af intraoperativ miose og nedsættelse af akut postoperativ øjensmerte i forbindelse med intraokulær linseudskiftningskirurgi hos voksne. 4.2 Dosering og administration Omidria skal administreres under kontrollerede kirurgiske forhold af en kvalificeret øjenkirurg, der har erfaring med intraokulær linseudskiftningskirurgi. Dosering Den anbefalede dosis er 4,0 ml Omidria fortyndet med 500 ml skyllevæske administreret som intraokulær skylning af det pågældende øje under indgrebet. For instruktioner om fortynding af lægemidlet før administration, se pkt Særlige populationer Patienter med nedsat nyre- og leverfunktion Der er ikke udført formelle studier med Omidria hos patienter med nedsat nyre- eller leverfunktion. Der forventes ikke at være behov for dosisjustering eller særlige overvejelser hos patienter med nedsat nyre- eller leverfunktion (se pkt. 5.2). Ældre Der er udført kliniske studier hos ældre patienter. Der kræves ingen dosisjustering. Pædiatrisk population Omidrias sikkerhed og virkning hos børn under 18 år er ikke klarlagt. Der foreligger ingen data.
3 Administration Intraokulær anvendelse. Kun til engangsbrug. Omidria er ikke blevet evalueret i fravær af standard præoperative mydriatika og anæstetika. Præoperative antibiotika, anæstetika, kortikosteroider, mydriatika og NSAID-øjendråber kan administreres efter den behandlende øjenlæges skøn. Før administration af lægemidlet Omidria skal fortyndes med 500 ml skyllevæske før brug. For instruktioner om fortynding, se pkt Skyllevæsken med Omidria er beregnet til brug under det kirurgiske indgreb på samme måde som standard skyllevæsker ville blive brugt. 4.3 Kontraindikationer Overfølsomhed over for de aktive stoffer eller et eller flere af hjælpestofferne anført i pkt Patienter med snævervinklet glaukom. 4.4 Særlige advarsler og forsigtighedsregler vedrørende brugen Dette lægemiddel skal fortyndes før intraokulær anvendelse. Omidria er kun indiceret som tilsætning til skyllevæske til brug under intraokulære linseudskiftningsindgreb. Omidria er ikke indiceret til ufortyndet brug, som intravitreal injektion, generel, lokal oftalmisk anvendelse eller ikke-okulær systemisk anvendelse. Omidrias sikkerhed og virkning er ikke blevet evalueret hos patienter med uveitis, iristraume eller brug af alfa-adrenerge antagonister i anamnesen. I forbindelse med brugen af Omidria skal der tages højde for nedenstående advarsler og forsigtighedsregler vedrørende lokal oftalmisk anvendelse af phenylephrin og ketorolac: Kardiovaskulære reaktioner Der har været indberetninger om alvorlige kardiovaskulære reaktioner, herunder ventrikulære arytmier og myokardieinfarker, hos patienter, der bruger oftalmisk phenylephrin. Disse episoder, hvoraf nogle var dødelige, forekom normalt hos patienter med allerede eksisterende kardiovaskulære sygdomme. Der har været indberetninger om signifikante stigninger i blodtrykket efter instillation af lokal okulær phenylephrin. Den forventede systemiske eksponering er minimal og forbigående. Der skal dog udvises forsigtighed ved behandling af patienter med dårligt kontrolleret hypertension. Risikoen for forhøjelse af blodtrykket kan øges hos patienter, der kræver langvarige kirurgiske indgreb. Hyperthyreoidisme og ustabil kardiovaskulær sygdom skal behandles inden det kirurgiske indgreb. Krydsallergi Der kan forekomme krydsallergi over for acetylsalicylsyre, phenyleddikesyrederivater og andre nonsteroide antiinflammatoriske midler (NSAID'er). Der har været indberetninger om bronkospasme eller eksacerbation af astma i forbindelse med brugen af ketorolac oftalmisk opløsning hos patienter, som enten har en kendt overfølsomhed over for aspirin/nsaid'er eller astma i anamnesen. Derfor skal
4 Omidria anvendes med forsigtighed hos personer, der tidligere har udvist overfølsomhed over for disse aktive stoffer. Brugen af Omidria under intraokulær linseudskiftningskirurgi kan medføre en midlertidig påvirkning af synet (se punkt 4.7). 4.5 Interaktion med andre lægemidler og andre former for interaktion Der er ikke udført interaktionsstudier. Intraokulære metaboliske interaktioner er usandsynlige, fordi phenylephrin og ketorolac fjernes fra det anteriore kammer ved skylning under indgrebet og på grund af den normale cirkulation af humor aquosus efter operationen. Omfanget af Omidrias mydriatiske effekt kan være ændret hos patienter, som samtidig får lægemidler, der kan påvirke pupilstørrelsen, som f.eks. opioider (miotika eller nonsederende antihistaminer (mydriatika). Samtidig brug af phenylephrin og atropin kan øge pressoreffekten og inducere takykardi hos visse patienter. Phenylephrin kan potentiere den kardiovaskulære hæmmende virkning, som visse inhalationsanæstetika kan have. I et farmakokinetisk studie, hvor Omidria blev evalueret, var den systemiske eksponering for henholdsvis phenylephrin og ketorolac minimal og forbigående. Derfor forventes der ingen interaktioner. 4.6 Fertilitet, graviditet og amning Kvinder i den fertile alder Omidria bør ikke anvendes til kvinder i den fertile alder, som ikke anvender antikonception. Graviditet Der er ingen data fra anvendelse af Omidria hos gravide kvinder. Omidria bør ikke anvendes under graviditet. Amning Det er ukendt, om phenylephrin udskilles i human mælk. Ketorolac udskilles i human mælk efter systemisk administration. En risiko for det ammede barn kan ikke udelukkes. Omidria bør ikke anvendes under amning. Fertilitet Der er utilstrækkelige data vedrørende den menneskelige fertilitet ved anvendelse af phenylephrinhydrochlorid eller ketorolactrometamol. 4.7 Virkning på evnen til at føre motorkøretøj og betjene maskiner Omidria kan i væsentlig grad påvirke evnen til at føre motorkøretøj og betjene maskiner. Eftersom synet kan være midlertidigt påvirket efter intraokulær linseudskiftning hos patienter, som får Omidria, bør disse advares om ikke at føre motorkøretøj eller betjene maskiner, før synet er klart. Se pkt. 4.8 for yderligere oplysninger vedrørende mulige synsforstyrrelser. 4.8 Bivirkninger Sammenfatning af sikkerhedsprofilen Omidrias sikkerhedsprofil er baseret på data fra 459 voksne patienter indsamlet under den kliniske udvikling fra randomiserede kontrollerede forsøg. De bivirkninger, der blev indberettet hos patienter,
5 som fik Omidria, opstod typisk efter operationen, og de fleste var af mild til moderat intensitet og gik i sig selv uden intervention eller residualeffekter. De hyppigst indberette bivirkninger var øjensmerter (4,8 %), inflammation af det anteriore kammer (3,9 %), konjunktival hyperæmi (2,2 %), fotofobi (1,7 %), corneaødem (1,3 %) og inflammation (1,3 %). Hvert af disse samme fund blev indberettet med en ensartet hyppighed hos patienter, der fik placebo. Tabel over bivirkninger Bivirkningernes hyppighed defineres som følger: meget almindelig ( 1/10), almindelig ( 1/100 til <1/10), ikke almindelig ( 1/1.000 til <1/100), sjælden ( 1/ til <1/1.000), meget sjælden (<1/10.000), ikke kendte (kan ikke estimeres ud fra forhåndenværende data). Systemorganklasse Almindelig Ikke almindelig Nervesystemet Hovedpine Øjne Mave-tarm-kanalen Almene symptomer og reaktioner på administrationsstedet Indberetning af formodede bivirkninger Øjensmerter Inflammation af det anteriore kammer Konjunktival hyperæmi Corneaødem Fotofobi Inflammation Okulært ubehag Inflammation af øjet Øjenirritation Konjunktivalt ødem Hornhindelidelse Mydriase Sløret syn Nedsat synsskarphed Mouches volantes Øjenpruritus Øjenlågssmerte Følelse af fremmedlegeme i øjet Blænding Forhøjet intraokulært tryk Kvalme Smerte Når lægemidlet er godkendt, er indberetning af formodede bivirkninger vigtig. Det muliggør løbende overvågning af benefit/risk-forholdet for lægemidlet. Læger og sundhedspersonale anmodes om at indberette alle formodede bivirkninger via det nationale rapporteringssystem anført i Appendiks V. 4.9 Overdosering I tilfælde af utilsigtet intrakameral injektion af den koncentrerede opløsning skal det anteriore kammer øjeblikkeligt tømmes og skylles med standard oftalmologisk skyllevæske. Systemisk overdosering af phenylephrin kan medføre en hurtig stigning i blodtrykket. Det kan også medføre hovedpine, angst, kvalme og opkastning samt ventrikulære arytmier. I tilfælde af overdosering af phenylephrin anbefales øjeblikkelig injektion af et hurtigtvirkende alfa-adrenergt blokeringsmiddel som f.eks. phentolamin. 5. FARMAKOLOGISKE EGENSKABER 5.1 Farmakodynamiske egenskaber Farmakoterapeutisk klassifikation: {endnu ikke tildelt}, ATC-kode: {endnu ikke tildelt}
6 Virkningsmekanisme Phenylephrin og ketorolac i Omidria har forskellige virkningsmekanismer til opretholdelse af intraoperativ mydriase, forebyggelse af intraoperativ miose og reduktion af akut postoperativ smerte. Phenylephrin er en α1-adrenerg receptoragonist, der fungerer som et mydriatikum ved at kontrahere m. dilator pupillae, hvorved pupillen dilateres med ringe eller ingen cykloplegi. Der opstår vasokonstriktion i det konjunktivale kredsløb og i andre blodkar i øjet i den udstrækning de udsættes for lægemidlet. Ketorolac er en NSAID, som hæmmer de to cyclooxygenaseenzymer (COX1 og COX2), og dermed reducerer smerte og inflammation ved at sænke vævskoncentrationen af prostaglandiner, der skyldes kirurgisk traume. Ved at hæmme prostaglandinsyntese sekundær til øjenkirurgisk insult eller direkte mekanisk stimulation af iris kan ketorolac også bidrage til forebyggelsen af kirurgisk induceret miose. Klinisk virkning og sikkerhed Omidrias virkning og sikkerhed blev evalueret i to randomiserede, multicenter, dobbeltmaskerede, placebokontrollerede kliniske fase 3-forsøg hos 808 voksne patienter, der gennemgik intraokulær linseudskiftning. Populationen i forsøgene var 26 til 90 år gamle (59 % kvinder, 41 % mænd, 80 % hvide, 12 % sorte og 8 % anden race). 19 % af katarakttilfældene var LOCS II-kernegrad 2 eller % af patienterne havde brune øje, 28 % havde blå øjne og 19 % havde en anden øjenfarve. Patienterne blev randomiseret til enten Omidria eller placebo (1:1). Alle patienterne blev behandlet med standardiserede præoperative lokale mydriatika og anæstetika. Pupildiameteren blev målt under hele det kirurgiske forløb. Postoperativ smerte blev evalueret ved hjælp af en selvadministreret mm visuel analog skala (VAS). Statistiske tests for ændringen af pupildiameteren (mm) under indgreb fra baseline blev udført med CMH-test (Cochran-Mantel-Haenszel) justeret for randomiseringsstrata. I studie 1 var den CMHvægtede middelforskel (Omidria placebo) i middelarealet under kurven (AUC) 0,58 mm [95 % konfidensinterval: 0,48, 0,68] (P < 0,0001). I studie 2 var den CMH-vægtede middelforskel (Omidria - placebo) i middel-auc 0,59 mm [95 % konfidensinterval: 0,49, 0,69] (P < 0,0001). Mydriase blev opretholdt i de Omidria-behandlede grupper, mens de placebobehandlede grupper oplevede progressiv konstriktion af pupillen (se figuren).
7 Ændring af intraoperativ pupildiameter (mm) fra baseline Studie 1 Ændring i middel pupildiameter (mm) fra baseline p< 0,001 Studie 2 Placebo Placebo p< 0,001 Minutter fra indledende kirurgisk incision Forebyggelse af miose blev bekræftet i en kategorisk analyse. I studie 1 havde kun 4 % af patienterne i Omidria-gruppen en pupildiameter < 6 mm på tidspunktet for kortical oprensning sammenlignet med 23 % af patienterne i placebogruppen, og 3 % af patienterne i Omidria-gruppen sammenlignet med 28 % af patienterne i placebogruppen havde en pupilkonstriktion 2,5 mm (P< 0,0001 i begge tilfælde, khi i anden-test). I studie 2 havde kun 4 % af patienterne i Omidria-gruppen en pupildiameter < 6 mm ved kortical oprensning sammenlignet med 23 % af patienterne i placebogruppen, og 1% af
8 patienterne i Omidria-gruppen sammenlignet med 27% af patienterne i placebogruppen havde en pupilkonstriktion 2,5 mm (P< 0,0001 i begge tilfælde, khi i anden-test). Studie 1 Analysesæt (n) AUC-ændring fra baseline i pupildiameter (mm) under indgrebet (co-primært endepunkt) [Middel(SD)] Placebo Omidria N=201 N=201 (n=180) (n=184) -0,5 (0,58) 0,1 (0,41) Diameter < 6 mm på ethvert tidspunkt 85 (47 %) 19 (10 %) Diameter < 6 mm ved kortical oprensning 41 (23 %) 7 (4 %) 2,5 mm pupilkonstriktion 50 (28 %) 6 (3 %) Studie 2 Analysesæt (n) AUC-ændring fra baseline i pupildiameter (mm) under indgrebet (co-primært endepunkt) [MiddelSD] N=204 (n=200) N=202 (n=195) -0,5 (0,57) 0,1 (0,43) Diameter < 6 mm på ethvert tidspunkt 76 (38 %) 18 (9 %) Diameter < 6 mm ved kortical oprensning 46 (23 %) 8 (4 %) 2,5 mm pupilkonstriktion 53 (27 %) 2 (1 %) Der påvistes desuden en signifikant reduktion af den okulære smerte i løbet af de første timer efter indgrebet. Der blev udført statistiske tests for smerte som bestemt ud fra 100 VAS med en CMHtest justeret for randomiseringsstrata. I studie 1 var den CMH-vægtede middelforskel (Omidria - placebo) i middel-auc -5,20 mm [95 % konfidensinterval: -7,31, -3,09] (P < 0,001). I studie 2 var den CMH-vægtede middelforskel (Omidria - placebo) i middel-auc -4,58 mm [95 % konfidensinterval: - 6,92, -2,24] (P < 0,001). Studie 1 Analysesæt (n) AUC 12-timers okulær smerte VAS-score (co-primært endepunkt) [Middel±SD] Placebo Omidria N=201 N=201 (n=201) (n=201) 9,2 ± 12,9 4,1 ± 8,07 Forsøgspersoner med VAS = 0 på alle tidspunkter 28 (14 %) 48 (24 %) Forsøgspersoner med VAS 40 på alle tidspunkter 30 (15 %) 13 (7 %) Studie 2 Analysesæt (n) AUC 12-timers okulær smerte VAS-score (co-primært endepunkt) [Middel±SD] N=204 (n=202) N=202 (n=202) 8,9 ± 15,19 4,3 ± 8,75 Forsøgspersoner med VAS = 0 på alle tidspunkter 41 (20 %) 56 (28 %) Forsøgspersoner med VAS 40 på alle tidspunkter 27 (13 %) 16 (8 %) Histologisk undersøgelse i ikke-kliniske toksikologiske studier påviste ingen behandlingsrelaterede virkninger på cornea, og i kliniske forsøg med Omidria observeredes der ingen negativ indvirkning på bedst korrigeret synsskarphed (BCVA). Der blev ikke udført endotelcelletællinger i løbet af de kliniske studier.
9 Pædiatrisk population Det Europæiske Lægemiddelagentur har udsat forpligtelsen til at fremlægge resultaterne af studier med Omidria i en eller flere undergrupper af den pædiatriske population ved terapeutiske linseindgreb (se pkt. 4.2 for oplysninger om pædiatrisk anvendelse). 5.2 Farmakokinetiske egenskaber I et farmakokinetisk studie, der evaluerede Omidria, var den systemiske eksponering for både phenylephrin og ketorolac minimal og forbigående. Der observeredes kun detekterbare plasmakoncentrationer af phenylephrin hos én ud af 14 patienter. Den maksimale koncentration, der observeredes hos denne patient, var 1,7 ng/ml, som forekom efter instillation af lokale præoperative phenylephrindråber og før eksponering for Omidria. Der fandtes ketorolac i plasma hos 11 ud af 14 patienter. Den maksimale ketorolackoncentration, der sås, var 4,2 ng/ml. 5.3 Prækliniske sikkerhedsdata De prækliniske data for de individuelle komponenter i Omidria, der har været rapporteret i litteraturen, viste ingen speciel risiko for mennesker vurderet ud fra konventionelle studier af sikkerhedsfarmakologi, toksicitet efter gentagne doser, genotoksicitet, karcinogenicitet samt reproduktions- og udviklingstoksicitet. Der blev udført et enkeltdosis toksikologistudie i afrikanske grønne aber, der blev eksponeret for okulære skyllevæsker, der indeholdt den kombination af phenylephrin og ketorolac, der anvendes under linseudskiftningskirurgi. Der observeredes ingen lægemiddelrelaterede bivirkninger eller patologiske fund med kombinationer af phenylephrin og ketorolac i skyllevæsker administreret ved koncentrationer op til 7200 µm phenylephrin og 900 µm ketorolac. Disse koncentrationer er over 10 gange højere, end den koncentration af de to midler der administreres klinisk til patienter, der får Omidria. 6. FARMACEUTISKE OPLYSNINGER 6.1 Hjælpestoffer Citronsyremonohydrat Natriumcitratdihydrat Natriumhydroxid (til justering af ph) Saltsyre (til justering af ph) Vand til injektionsvæsker 6.2 Uforligeligheder Dette lægemiddel må ikke blandes med andre lægemidler end dem, der er anført under pkt Holdbarhed Uåbnet: 30 måneder Efter åbning skal lægemidlet fortyndes straks. Efter fortynding er der påvist kemisk og fysisk brugsholdbarhed i 6 timer ved 25 C. Skal bruges inden for 6 timer efter fortynding. Ud fra et mikrobiologisk synspunkt bør lægemidlet anvendes straks efter
10 fortynding. Hvis det ikke straks efter fortynding, er opbevaringstider og -betingelser indtil anvendelsen på brugerens ansvar. 6.4 Særlige opbevaringsforhold Må ikke opbevares ved temperaturer over 25 C. Opbevar hætteglasset i den ydre karton for at beskytte mod lys. Må ikke opbevares ved temperaturer over 25 C efter fortynding 6.5 Emballagetype og pakningsstørrelser Farveløst 5 ml hætteglas af type I-glas med en butylgummiprop og en polypropylen afrivningshætte. Hvert enkelt hætteglas til engangsbrug er pakket i en papkarton. Multipakning med 10 (1 pakning med 10) hætteglas til engangsbrug. 6.6 Regler for bortskaffelse og anden håndtering Omidria klargøres til intraokulær skylning ved at fortynde 4,0 ml koncentrat med 500 ml standard oftalmologisk skyllevæske. Følgende vejledning skal overholdes: Hætteglasset skal undersøges visuelt for partikler. Opløsningen må kun anvendes, hvis den er klar, farveløs til let gullig og uden synlige partikler. Træk 4,0 ml koncentratopløsning op med en egnet steril nål under anvendelse af aseptisk teknik. De 4,0 ml koncentratopløsning skal injiceres i en 500 ml pose/flaske med skylleopløsning. Posen skal forsigtig vendes op og ned for at blande opløsningen. Opløsningen skal bruges inden for 6 timer efter klargøring. Posen skal undersøges visuelt for partikler. Opløsningen må kun anvendes, hvis den er klar og farveløs og uden synlige partikler. Der må ikke tilsættes andre lægemidler til skyllevæsken. Det brugte hætteglas og eventuel ubrugt skyllevæske skal kasseres efter en enkelt anvendelse i henhold til lokale retningslinjer. 7. INDEHAVER AF MARKEDSFØRINGSTILLADELSEN Omeros London Limited Berkeley Square London, W1J 6BD Det Forenede Kongerige Tlf.: Fax: regulatory@omeros.co.uk 8. MARKEDSFØRINGSTILLADELSESNUMMER (-NUMRE) EU/1/15/1018/001
11 9. DATO FOR FØRSTE MARKEDSFØRINGSTILLADELSE/FORNYELSE AF TILLADELSEN Dato for første markedsføringstilladelse: <dato for EU-beslutning> 10. DATO FOR ÆNDRING AF TEKSTEN Yderligere oplysninger om dette lægemiddel findes på Det Europæiske Lægemiddelagenturs hjemmeside
12 BILAG II A. FREMSTILLER(E) ANSVARLIG(E) FOR BATCHFRIGIVELSE B. BETINGELSER ELLER BEGRÆNSNINGER VEDRØRENDE UDLEVERING OG ANVENDELSE C. ANDRE FORHOLD OG BETINGELSER FOR MARKEDSFØRINGSTILLADELSEN D. BETINGELSER ELLER BEGRÆNSNINGER MED HENSYN TIL SIKKER OG EFFEKTIV ANVENDELSE AF LÆGEMIDLET
13 A. FREMSTILLER(E) ANSVARLIG(E) FOR BATCHFRIGIVELSE Navn og adresse på den fremstiller (de fremstillere), der er ansvarlig(e) for batchfrigivelse Almac Pharma Services Limited Seagoe Industrial Estate, Craigavon, Co. Armagh BT63 5QD Nordirland B. BETINGELSER ELLER BEGRÆNSNINGER VEDRØRENDE UDLEVERING OG ANVENDELSE Lægemidlet må kun udleveres efter ordination på en recept udstedt af en begrænset lægegruppe (se bilag I: Produktresumé, pkt. 4.2). C. ANDRE FORHOLD OG BETINGELSER FOR MARKEDSFØRINGSTILLADELSEN Periodiske, opdaterede sikkerhedsberetninger (PSUR er) Indehaveren af markedsføringstilladelsen skal fremsende den første PSUR for dette lægemiddel inden for seks måneder efter godkendelsen. Indehaveren af markedsføringstilladelsen skal derefter fremsende PSUR er i overensstemmelse med kravene på listen over EU-referencedatoer (EURD list), som fastsat i artikel 107c, stk. 7, i direktiv 2001/83/EF og offentliggjort på den europæiske webportal for lægemidler. D. BETINGELSER ELLER BEGRÆNSNINGER VEDRØRENDE SIKKER OG EFFEKTIV ANVENDELSE AF LÆGEMIDLET Risikostyringsplan (RMP) Indehaveren af markedsføringstilladelsen skal udføre de påkrævede aktiviteter og foranstaltninger vedrørende lægemiddelovervågning, som er beskrevet i den godkendte RMP, der fremgår af modul i markedsføringstilladelsen, og enhver efterfølgende godkendt opdatering af RMP. En opdateret RMP skal fremsendes: på anmodning fra Det Europæiske Lægemiddelagentur når risikostyringssystemet ændres, særlig som følge af, at der er modtaget nye oplysninger, der kan medføre en væsentlig ændring i risk/benefit-forholdet, eller som følge af, at en vigtig milepæl (lægemiddelovervågning eller risikominimering) er nået. Hvis tidsfristen for en PSUR og for opdatering af en RMP er sammenfaldende, kan de fremsendes samtidig.
14 BILAG III ETIKETTERING OG INDLÆGSSEDDEL
15 A. ETIKETTERING
16 OPLYSNINGER, DER SKAL ANFØRES PÅ DEN YDRE EMBALLAGE YDERKARTON 1. LÆGEMIDLETS NAVN Omidria 10 mg/ml + 3 mg/ml koncentrat til intraokulær skyllevæske, opløsning Phenylephrin/ketorolac 2. ANGIVELSE AF AKTIVT STOF/AKTIVE STOFFER Ét 4 ml hætteglas indeholder phenylephrinhydrochlorid svarende til 40,6 mg (10,2 mg/ml) phenylephrin og ketorolactrometamol svarende til 11,5 mg (2,88 mg/ml) ketorolac. Efter fortynding indeholder opløsningen 0,081 mg/ml phenylephrin og 0,023 mg/ml ketorolac. 3. LISTE OVER HJÆLPESTOFFER Hjælpestoffer: citronsyremonohydrat, natriumcitratdihydrat, natriumhydroxid/saltsyre (til justering af ph), vand til injektionsvæsker 4. LÆGEMIDDELFORM OG INDHOLD (PAKNINGSSTØRRELSE) Koncentrat til intraokulær skyllevæske, opløsning Multipakning: 10 (1 pakning med 10) hætteglas 5. ANVENDELSESMÅDE OG ADMINISTRATIONSVEJ(E) Kun til engangsbrug. Læs indlægssedlen før brug. Intraokulær anvendelse efter fortynding. 6. SÆRLIG ADVARSEL OM, AT LÆGEMIDLET SKAL OPBEVARES UTILGÆNGELIGT FOR BØRN Opbevares utilgængeligt for børn. 7. EVENTUELLE ANDRE SÆRLIGE ADVARSLER Skal anvendes umiddelbart efter fortynding. 8. UDLØBSDATO EXP 9. SÆRLIGE OPBEVARINGSBETINGELSER Må ikke opbevares ved temperaturer over 25 C.
17 Opbevar hætteglasset i den ydre karton for at beskytte mod lys. 10. EVENTUELLE SÆRLIGE FORHOLDSREGLER VED BORTSKAFFELSE AF IKKE ANVENDT LÆGEMIDDEL SAMT AFFALD HERAF NAVN OG ADRESSE PÅ INDEHAVEREN AF MARKEDSFØRINGSTILLADELSEN Omeros London Limited London, W1J 6BD Det Forenede Kongerige 12. MARKEDSFØRINGSTILLADELSESNUMMER (-NUMRE) EU/1/15/1018/ BATCHNUMMER Lot 14. GENEREL KLASSIFIKATION FOR UDLEVERING INSTRUKTIONER VEDRØRENDE ANVENDELSEN INFORMATION I BRAILLESKRIFT Fritaget fra krav om brailleskrift.
18 OPLYSNINGER, DER SKAL ANFØRES PÅ DEN YDRE EMBALLAGE KARTON TIL DELPAKNING 1. LÆGEMIDLETS NAVN Omidria 10 mg/ml + 3 mg/ml koncentrat til intraokulær skyllevæske, opløsning phenylephrin/ketorolac 2. ANGIVELSE AF AKTIVT STOF/AKTIVE STOFFER Ét 4 ml hætteglas indeholder phenylephrinhydrochlorid svarende til 40,6 mg phenylephrin og ketorolactrometamol svarende til 11,5 mg ketorolac. Efter fortynding indeholder opløsningen 0,081 mg/ml phenylephrin og 0,023 mg/ml ketorolac. 3. LISTE OVER HJÆLPESTOFFER Hjælpestoffer: citronsyremonohydrat, natriumcitratdihydrat, natriumhydroxid/saltsyre (til justering af ph), vand til injektionsvæsker 4. LÆGEMIDDELFORM OG INDHOLD (PAKNINGSSTØRRELSE) Koncentrat til intraokulær skyllevæske, opløsning 1 hætteglas. Del af multipakning, må ikke sælges separat. 5. ANVENDELSESMÅDE OG ADMINISTRATIONSVEJ(E) Kun til engangsbrug. Læs indlægssedlen før brug. Intraokulær anvendelse efter fortynding. 6. SÆRLIG ADVARSEL OM, AT LÆGEMIDLET SKAL OPBEVARES UTILGÆNGELIGT FOR BØRN Opbevares utilgængeligt for børn. 7. EVENTUELLE ANDRE SÆRLIGE ADVARSLER Skal anvendes umiddelbart efter fortynding. 8. UDLØBSDATO EXP 9. SÆRLIGE OPBEVARINGSBETINGELSER
19 Må ikke opbevares ved temperaturer over 25 C. Opbevar hætteglasset i den ydre karton for at beskytte mod lys. 10. EVENTUELLE SÆRLIGE FORHOLDSREGLER VED BORTSKAFFELSE AF IKKE ANVENDT LÆGEMIDDEL SAMT AFFALD HERAF NAVN OG ADRESSE PÅ INDEHAVEREN AF MARKEDSFØRINGSTILLADELSEN Omeros London Limited London, W1J 6BD Det Forenede Kongerige 12. MARKEDSFØRINGSTILLADELSESNUMMER (-NUMRE) EU/1/15/1018/ BATCHNUMMER Lot 14. GENEREL KLASSIFIKATION FOR UDLEVERING INSTRUKTIONER VEDRØRENDE ANVENDELSEN INFORMATION I BRAILLESKRIFT Fritaget fra krav om brailleskrift.
20 MINDSTEKRAV TIL MÆRKNING PÅ SMÅ INDRE EMBALLAGER HÆTTEGLAS 1. LÆGEMIDLETS NAVN, STYRKE OG/ELLER ADMINISTRATIONSVEJ(E) Omidria 10 mg/ml + 3 mg/ml koncentrat til intraokulær skyllevæske, opløsning phenylephrin/ketorolac 2. ADMINISTRATIONSMETODE Intraokulær anvendelse efter fortynding. Kun til engangsbrug. Læs indlægssedlen før brug. 3. UDLØBSDATO EXP 4. BATCHNUMMER Lot 5. INDHOLD ANGIVET SOM VÆGT, VOLUMEN ELLER ANTAL DOSER 6. ANDET
21 B. INDLÆGSSEDDEL
22 Indlægsseddel: Information til brugeren Omidria 10 mg/ml + 3 mg/ml koncentrat til intraokulær skyllevæske, opløsning phenylephrin/ketorolac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. - Gem indlægssedlen. Du kan få brug for at læse den igen. - Spørg lægen eller sundhedspersonalet, hvis der er mere, du vil vide. - Kontakt lægen, apotekspersonalet eller sundhedspersonalet, hvis en bivirkning bliver værre, eller du får bivirkninger, som ikke er nævnt her. Se punkt 4. Oversigt over indlægssedlen 1. Virkning og anvendelse 2. Det skal du vide, før du begynder at bruge Omidria 3. Sådan skal du bruge Omidria 4. Bivirkninger 5. Opbevaring 6. Pakningsstørrelser og yderligere oplysninger 1. Virkning og anvendelse Omidria er et lægemiddel, som anvendes i forbindelse med øjenoperation. Det indeholder de aktive stoffer phenylephrin og ketorolac. Phenylephrin virker ved at udvide pupillen. Ketorolac er et smertestillende middel, som tilhører gruppen, der kaldes nonsteroide antiinflammatoriske lægemidler (NSAID'er). Det medvirker også til at forhindre, at pupillen trækker sig sammen. Omidria bruges til voksne til at skylle øjet under operation med henblik på indsættelse af en ny linse (den del i øjet, som fokuserer det lys, der passerer igennem pupillen, så du kan se klart). Dette indgreb kendes som intraokulær linseudskiftning. Lægemidlet benyttes til at holde pupillen udvidet under indgrebet og reducere smerterne i øjet efter indgrebet. 2. Det skal du vide, før du begynder at bruge Omidria Brug ikke Omidria: - hvis du er allergisk over for phenylephrin eller ketorolac eller et af de øvrige indholdsstoffer (angivet i punkt 6) - hvis du har en øjenlidelse, som kaldes snævervinklet glaukom. Advarsler og forsigtighedsregler Kontakt lægen eller sundhedspersonalet, før du bruger Omidria, hvis du: - har en hjertesygdom - har forhøjet blodtryk - har overaktiv skjoldbruskkirtel (hypertyreoidisme) - er allergisk over for acetylsalicylsyre eller andre smertestillende midler fra familien, der kaldes nonsteroide antiinflammatoriske lægemidler (NSAID'er) - har astma. Fortæl det til din læge, hvis noget af ovenstående gælder for dig. Lægen vil beslutte, om Omidria er rigtigt for dig.
23 Børn og unge Omidria bør ikke bruges til børn og unge under 18 år, da det ikke er blevet undersøgt hos denne aldersgruppe. Brug af anden medicin sammen med Omidria Fortæl det altid til lægen, hvis du bruger anden medicin, har gjort det for nylig eller påtænker at gøre det. - Det er især vigtigt, at du siger det til lægen, hvis du bruger atropin, som er et lægemiddel, der anvendes til at udvide pupillen. Hvis du bruger atropin, samtidig med at du bliver behandlet med Omidria, kan det føre til forhøjet blodtryk og puls hos visse patienter. - Et af de aktive stoffer i Omidria kan reagere med adskillige typer af bedøvelsesmidler. Din læge ved mere om dette. Hvis du skal i fuld narkose under indgrebet, skal du tale med lægen om dette. Graviditet og amning Hvis du er gravid eller ammer, har mistanke om, at du er gravid, eller planlægger at blive gravid, skal du spørge din læge til råds, før du bruger dette lægemiddel. Omidria må ikke anvendes under graviditet. Hvis du kan blive gravid, bør du bruge et egnet svangerskabsforebyggende middel, før du får Omidria. Omidria må ikke anvendes under amning. Trafik- og arbejdssikkerhed Dette lægemiddel kan have stor virkning på evnen til at føre motorkøretøj eller betjene maskiner. Eftersom synet kan blive påvirket, bør du ikke køre bil eller betjene maskiner, før dit syn er klart igen. 3. Sådan skal du bruge Omidria Du vil få Omidria på et hospital eller en klinik af en kvalificeret læge eller kirurg med speciale i øjenkirurgi. Omidria bruges som en væske til at skylle øjnene (skyllevæske) under et kirurgisk indgreb med henblik på udskiftning af linsen. Hvis du har fået for meget Omidria Phenylephrin, der er et af de aktive stoffer i Omidria, kan forårsage en hurtig stigning i blodtrykket, hvis der gives for meget, og der passerer en tilstrækkelig mængde over i blodet til at påvirke andre dele af kroppen. Det kan også give anledning til hovedpine, angst, kvalme, opkastning og en unormalt hurtig puls. Din læge vil holde øje med eventuelle tegn og symptomer på bivirkninger og behandle disse efter behov. Spørg lægen eller sundhedspersonalet, hvis der er noget, du er i tvivl om. 4. Bivirkninger Dette lægemiddel kan som al anden medicin give bivirkninger, men ikke alle får bivirkninger. De bivirkninger, der er anført herunder, er typisk milde til moderate i intensitet og går normalt over af sig selv uden langsigtede virkninger.
24 Bivirkninger, der påvirker øjnene: Almindelige bivirkninger (forekommer hos op til 1 ud af 10 personer): - øjensmerter - betændelse i den forreste del af øjet - røde øjne - hævelse af hornhinden (den gennemsigtige hinde, der dækker det forreste af øjet) - lysfølsomhed Ikke almindelige bivirkninger (forekommer hos op til 1 ud af 100 personer): - øjenubehag - øjenbetændelse - øjenirritation - røde øjne - problemer med hornhinden - udvidede pupiller - sløret syn - nedsat synsskarphed - små mørke pletter, der bevæger sig i synsfeltet - kløende øjne - øjenlågssmerte - følelse af fremmedlegemer i øjet - blænding - forhøjet tryk i øjet Bivirkninger, der påvirker kroppen: Almindelige bivirkninger: - betændelse Ikke almindelige bivirkninger: - kvalme - smerter - hovedpine Indberetning af bivirkninger Hvis du oplever bivirkninger, bør du tale med din læge. Dette gælder også mulige bivirkninger, som ikke er medtaget i denne indlægsseddel. Du eller dine pårørende kan også indberette bivirkninger direkte til Sundhedsstyrelsen via det nationale rapporteringssystem anført i Appendiks V. Ved at indrapportere bivirkninger kan du hjælpe med at fremskaffe mere information om sikkerheden af dette lægemiddel. 5. Opbevaring Opbevar lægemidlet utilgængeligt for børn. Brug ikke lægemidlet efter den udløbsdato, der står på pakningen efter EXP. Udløbsdatoen er den sidste dag i den nævnte måned. Må ikke opbevares ved temperaturer over 25 C. Opbevar hætteglasset i den originale pakning for at beskytte mod lys. Brug ikke opløsningen, hvis den er uklar eller hvis den indeholder partikler. Den fortyndede opløsning skal bruges inden for 6 timer efter fortynding. Spørg på apoteket, hvordan du skal bortskaffe medicinrester. Af hensyn til miljøet må du ikke smide medicinrester i afløbet, toilettet eller skraldespanden.
25 6. Pakningsstørrelser og yderligere oplysninger Omidria indeholder Aktive stoffer: phenylephedrin (som hydroklorid) og ketorolac (som trometamol). Hvert 4,0 ml hætteglas med opløsning indeholder 40,6 mg (10,2 mg/ml) phenylephrin og 11,5 mg (2,88 mg/ml) ketorolac. Øvrige indholdsstoffer: - citronsyremonohydrat - natriumcitratdihydrat - natriumhydroxid (surhedsregulerende middel) - saltsyre (surhedsregulerende middel) - vand til injektionsvæsker Udseende og pakningsstørrelser Klart, farveløst til let gulligt sterilt koncentrat til intraokulær skylning, opløsning. Leveres i et hætteglas til engangsbrug beregnet til at give 4,0 ml koncentrat til fortynding med 500 ml skyllevæske til anvendelse i øjnene. Farveløst 5 ml hætteglas af type 1-glas med en butylgummiprop og en polypropylen afrivningshætte. Multipakning, der indeholder 10 kartoner, hver karton indeholder et hætteglas til engangsbrug. Indehaver af markedsføringstilladelsen Omeros London Limited Berkeley Square London, W1J 6BD Det Forenede Kongerige Tlf.: Fax: regulatory@omeros.co.uk Fremstiller Almac Pharma Services Limited Seagoe Industrial Estate, Craigavon, Co. Armagh BT63 5QD Nordirland Hvis du ønsker yderligere oplysninger om dette lægemiddel, skal du henvende dig til indehaveren af markedsføringstilladelsen: Denne indlægsseddel blev senest ændret <dato for Kommissionens afgørelse> Nedenstående oplysninger er til læger og sundhedspersonale: Omidria klargøres til intraokulær skylning ved at fortynde 4,0 ml Omidria-koncentrat med 500 ml standard oftalmologisk skyllevæske.
26 Følgende vejledning skal overholdes: Hætteglasset skal undersøges visuelt for partikler. Opløsningen må kun anvendes, hvis den er klar, farveløs til let gullig og uden synlige partikler. Træk 4,0 ml koncentratopløsning op med en egnet steril nål under anvendelse af aseptisk teknik. De 4,0 ml koncentratopløsning skal injiceres i en 500 ml pose/flaske med skylleopløsning. Posen skal forsigtig vendes op og ned for at blande opløsningen. Opløsningen skal bruges inden for 6 timer efter klargøring. Posen skal undersøges visuelt for partikler. Opløsningen må kun anvendes, hvis den er klar og farveløs og uden synlige partikler. Der må ikke tilsættes andre lægemidler til skyllevæsken. Det brugte hætteglas og eventuel ubrugt skyllevæske skal kasseres efter en enkelt anvendelse i henhold til lokale retningslinjer.
PRODUKTRESUMÉ. for. Zaditen, øjendråber, opløsning, enkeltdosisbeholder
 18. februar 2015 PRODUKTRESUMÉ for Zaditen, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 20678 1. LÆGEMIDLETS NAVN Zaditen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 0,4 ml indeholder 0,138 mg
18. februar 2015 PRODUKTRESUMÉ for Zaditen, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 20678 1. LÆGEMIDLETS NAVN Zaditen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 0,4 ml indeholder 0,138 mg
Indlægsseddel: Information til patienten. Emadine 0,5 mg/ml øjendråber, opløsning i enkeltdosisbeholder. emedastin
 Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning i enkeltdosisbeholder. emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning i enkeltdosisbeholder. emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
Indlægsseddel: Information til brugeren. Aprokam 50 mg pulver til injektionsvæske, opløsning. Cefuroxim
 Indlægsseddel: Information til brugeren Aprokam 50 mg pulver til injektionsvæske, opløsning Cefuroxim Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Aprokam 50 mg pulver til injektionsvæske, opløsning Cefuroxim Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Voltaren Ophtha, øjendråber i enkeltdosisbeholder
 15. april 2013 PRODUKTRESUMÉ for Voltaren Ophtha, øjendråber i enkeltdosisbeholder 0. D.SP.NR. 3588 1. LÆGEMIDLETS NAVN Voltaren Ophtha 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml Voltaren Ophtha indeholder
15. april 2013 PRODUKTRESUMÉ for Voltaren Ophtha, øjendråber i enkeltdosisbeholder 0. D.SP.NR. 3588 1. LÆGEMIDLETS NAVN Voltaren Ophtha 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml Voltaren Ophtha indeholder
Indlægsseddel: Information til patienten. Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin
 Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Glycerylnitrat SAD, koncentrat til infusionsvæske, opløsning 5 mg/ml. glyceryltrinitrat
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Glycerylnitrat SAD, koncentrat til infusionsvæske, opløsning 5 mg/ml glyceryltrinitrat Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Glycerylnitrat SAD, koncentrat til infusionsvæske, opløsning 5 mg/ml glyceryltrinitrat Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
Indlægsseddel: Information til brugeren. Voltaren Ophtha 1 mg/ml, øjendråber, opløsning diclofenac
 Indlægsseddel: Information til brugeren Voltaren Ophtha 1 mg/ml, øjendråber, opløsning diclofenac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Voltaren Ophtha 1 mg/ml, øjendråber, opløsning diclofenac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Otrivin ukonserveret, næsespray, opløsning
 13. januar 2014 PRODUKTRESUMÉ for Otrivin ukonserveret, næsespray, opløsning 0. D.SP.NR. 2164 1. LÆGEMIDLETS NAVN Otrivin ukonserveret 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Xylometazolinhydrochlorid
13. januar 2014 PRODUKTRESUMÉ for Otrivin ukonserveret, næsespray, opløsning 0. D.SP.NR. 2164 1. LÆGEMIDLETS NAVN Otrivin ukonserveret 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Xylometazolinhydrochlorid
Indlægsseddel: Information til brugeren. OPATANOL 1 mg/ml øjendråber, opløsning Olopatadin
 Indlægsseddel: Information til brugeren OPATANOL 1 mg/ml øjendråber, opløsning Olopatadin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren OPATANOL 1 mg/ml øjendråber, opløsning Olopatadin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. Antepsin 1g tabletter Sucralfat. Den senest reviderede indlægsseddel kan findes på
 Indlægsseddel: Information til brugeren Antepsin 1g tabletter Sucralfat Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger. Tag altid dette
Indlægsseddel: Information til brugeren Antepsin 1g tabletter Sucralfat Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger. Tag altid dette
Information for Kodimagnyl Ikke-stoppende DAK filmovertrukne tabletter
 Information for Kodimagnyl Ikke-stoppende DAK filmovertrukne tabletter Denne information findes i 2 udgaver. Hvis du har købt en pakning med op til 20 tabletter, skal du læse den information, der starter
Information for Kodimagnyl Ikke-stoppende DAK filmovertrukne tabletter Denne information findes i 2 udgaver. Hvis du har købt en pakning med op til 20 tabletter, skal du læse den information, der starter
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Allergodil 0,5 mg/ml øjendråber, opløsning. Azelastinhydrochlorid
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Magnevist 2 mmol/l, injektionsvæske, opløsning Gadopentetinsyre Læs denne indlægsseddel grundigt, inden du begynder at bruge medicinen. Gem indlægssedlen. Du kan
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Magnevist 2 mmol/l, injektionsvæske, opløsning Gadopentetinsyre Læs denne indlægsseddel grundigt, inden du begynder at bruge medicinen. Gem indlægssedlen. Du kan
Indlægsseddel: Information til brugeren. Ciloxan 3 mg/ml, øjendråber, opløsning. ciprofloxacin
 Indlægsseddel: Information til brugeren Ciloxan 3 mg/ml, øjendråber, opløsning ciprofloxacin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Ciloxan 3 mg/ml, øjendråber, opløsning ciprofloxacin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Mucomyst brusetabletter 200 mg. Acetylcystein
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Mucomyst brusetabletter 200 mg Acetylcystein Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Mucomyst brusetabletter 200 mg Acetylcystein Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
Zovir 5 % creme Aciclovir
 11. november 2016 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
11. november 2016 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN ECOPORC SHIGA injektionsvæske, suspension til svin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis på 1 ml indeholder: Aktivt stof: Genetisk modificeret
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN ECOPORC SHIGA injektionsvæske, suspension til svin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis på 1 ml indeholder: Aktivt stof: Genetisk modificeret
Indlægsseddel: Information til brugeren. Klorzoxazon DAK tabletter 250 mg. chlorzoxazon
 Indlægsseddel: Information til brugeren Klorzoxazon DAK tabletter 250 mg chlorzoxazon Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger
Indlægsseddel: Information til brugeren Klorzoxazon DAK tabletter 250 mg chlorzoxazon Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger
Indlægsseddel: Information til brugeren. Mydriacyl 5 mg/ml og 10 mg/ml øjendråber, opløsning. tropicamid
 Indlægsseddel: Information til brugeren Mydriacyl 5 mg/ml og 10 mg/ml øjendråber, opløsning tropicamid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Mydriacyl 5 mg/ml og 10 mg/ml øjendråber, opløsning tropicamid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren. Betnovat 1 mg/ml kutanopløsning Betamethason
 Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. Dalacin. 10 mg/ ml kutanopløsning Til udvortes brug clindamycinphosphat
 Indlægsseddel: Information til brugeren Dalacin 10 mg/ ml kutanopløsning Til udvortes brug clindamycinphosphat Læs denne indlægsseddel grundigt, inden De begynder at bruge dette lægemiddel, da den indeholder
Indlægsseddel: Information til brugeren Dalacin 10 mg/ ml kutanopløsning Til udvortes brug clindamycinphosphat Læs denne indlægsseddel grundigt, inden De begynder at bruge dette lægemiddel, da den indeholder
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Gripovac 3 injektionsvæske, suspension, til svin. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 2 ml indeholder: Aktive stoffer: Stammer af
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Gripovac 3 injektionsvæske, suspension, til svin. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 2 ml indeholder: Aktive stoffer: Stammer af
Indlægsseddel: Information til brugeren. Arax Junior 250 mg tabletter paracetamol
 INDLÆGSSEDDEL 1 Indlægsseddel: Information til brugeren Arax Junior 250 mg tabletter paracetamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette læge middel, da den indeholder vigtige
INDLÆGSSEDDEL 1 Indlægsseddel: Information til brugeren Arax Junior 250 mg tabletter paracetamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette læge middel, da den indeholder vigtige
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Hydrocortison med Terramycin og Polymyxin B 15 mg/ml / 5 mg/ml / 1 mg/ml Øjen- og øredråber, suspension hydrocortisonacetat/oxytetracyclinhydrochlorid/polymyxin
Indlægsseddel: Information til brugeren Hydrocortison med Terramycin og Polymyxin B 15 mg/ml / 5 mg/ml / 1 mg/ml Øjen- og øredråber, suspension hydrocortisonacetat/oxytetracyclinhydrochlorid/polymyxin
PRODUKTRESUMÉ. for. Hyobac App 2 Vet., injektionsvæske, emulsion. Actinobacillus pleuropneumoniae, serotype 2, RP > 1*
 10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning
 Indlægsseddel: Information til brugeren Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning hypromellose Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Viskøse
Indlægsseddel: Information til brugeren Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning hypromellose Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Viskøse
Indlægsseddel: Information til patienten
 GE Healthcare Indlægsseddel: Information til patienten SeHCAT, 370 kbq, kapsel Tauroselkolsyre ( 75 Se) Læs denne indlægsseddel grundigt, inden du får dette lægemiddel, da den indeholder vigtige oplysninger.
GE Healthcare Indlægsseddel: Information til patienten SeHCAT, 370 kbq, kapsel Tauroselkolsyre ( 75 Se) Læs denne indlægsseddel grundigt, inden du får dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Dulcolax 10 mg, suppositorier Bisacodyl
 Indlægsseddel: Information til brugeren Dulcolax 10 mg, suppositorier Bisacodyl Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Brug
Indlægsseddel: Information til brugeren Dulcolax 10 mg, suppositorier Bisacodyl Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Brug
Pantoloc pulver til injektionsvæske, opløsning 40 mg
 Pantoloc pulver til injektionsvæske, opløsning 40 mg Læs denne indlægsseddel grundigt inden du begynder at tage medicinen Gem indlægssedlen. Du kan få brug for at læse den igen. Spørg lægen eller på apoteket
Pantoloc pulver til injektionsvæske, opløsning 40 mg Læs denne indlægsseddel grundigt inden du begynder at tage medicinen Gem indlægssedlen. Du kan få brug for at læse den igen. Spørg lægen eller på apoteket
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Heparin LEO IE/ml, hætteglas, injektionsvæske, opløsning Heparinnatrium
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Heparin LEO 5.000 IE/ml, hætteglas, injektionsvæske, opløsning Heparinnatrium Læs denne indlægsseddel grundigt inden du begynder at tage Heparin LEO, da den indeholder
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Heparin LEO 5.000 IE/ml, hætteglas, injektionsvæske, opløsning Heparinnatrium Læs denne indlægsseddel grundigt inden du begynder at tage Heparin LEO, da den indeholder
Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat
 Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Tag altid
Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Tag altid
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Syntocinon, næsespray, opløsning 6,7 mikrogram/dosis oxytocin
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Syntocinon, næsespray, opløsning 6,7 mikrogram/dosis oxytocin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Syntocinon, næsespray, opløsning 6,7 mikrogram/dosis oxytocin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Dulcolax, suppositorier
 10. januar 2011 PRODUKTRESUMÉ for Dulcolax, suppositorier 0. D.SP.NR. 1603 1. LÆGEMIDLETS NAVN Dulcolax 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Bisacodyl 10 mg Hjælpestoffer er anført under pkt. 6.1.
10. januar 2011 PRODUKTRESUMÉ for Dulcolax, suppositorier 0. D.SP.NR. 1603 1. LÆGEMIDLETS NAVN Dulcolax 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Bisacodyl 10 mg Hjælpestoffer er anført under pkt. 6.1.
Indlægsseddel: Information til brugeren. Tobrex Depot 3 mg/ml, depotøjendråber, opløsning. tobramycin
 Indlægsseddel: Information til brugeren Tobrex Depot 3 mg/ml, depotøjendråber, opløsning tobramycin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Tobrex Depot 3 mg/ml, depotøjendråber, opløsning tobramycin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Terramycin-Polymyxin B, salve
 Produktinformation for Terramycin-Polymyxin B (Oxytetracyclin og Polymyxin B) Salve 30+1 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke Pakningsstørrelse 13 50 46 Salve 30+1 mg/g 15 g Dagsaktuel
Produktinformation for Terramycin-Polymyxin B (Oxytetracyclin og Polymyxin B) Salve 30+1 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke Pakningsstørrelse 13 50 46 Salve 30+1 mg/g 15 g Dagsaktuel
PRODUKTRESUMÉ. for. Galieve Cool Mint, oral suspension
 12. maj 2015 PRODUKTRESUMÉ for Galieve Cool Mint, oral suspension 0. D.SP.NR. 27229 1. LÆGEMIDLETS NAVN Galieve Cool Mint 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én dosis/10 ml indeholder: 500 mg natriumalginat
12. maj 2015 PRODUKTRESUMÉ for Galieve Cool Mint, oral suspension 0. D.SP.NR. 27229 1. LÆGEMIDLETS NAVN Galieve Cool Mint 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én dosis/10 ml indeholder: 500 mg natriumalginat
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Ventoline 0,4 mg/ml oral opløsning Salbutamol
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Ventoline 0,4 mg/ml oral opløsning Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Ventoline 0,4 mg/ml oral opløsning Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Lidokain FarmaPlus injektionsvæske, opløsning 10 mg/ml og 20 mg/ml Lidocainhydrochlorid
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Lidokain FarmaPlus injektionsvæske, opløsning 10 mg/ml og 20 mg/ml Lidocainhydrochlorid Læs denne indlægsseddel grundigt, inden du får indgivet medicinen. Gem indlægssedlen.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Lidokain FarmaPlus injektionsvæske, opløsning 10 mg/ml og 20 mg/ml Lidocainhydrochlorid Læs denne indlægsseddel grundigt, inden du får indgivet medicinen. Gem indlægssedlen.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Zymelin menthol ukonserveret 1 mg/ml næsespray, opløsning Xylometazolinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Zymelin menthol ukonserveret 1 mg/ml næsespray, opløsning Xylometazolinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1/19 1. VETERINÆRLÆGEMIDLETS NAVN Eurican Herpes 205 pulver og solvens til injektionsvæske, emulsion. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof 1 dosis á 1 ml indeholder:
BILAG I PRODUKTRESUME 1/19 1. VETERINÆRLÆGEMIDLETS NAVN Eurican Herpes 205 pulver og solvens til injektionsvæske, emulsion. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof 1 dosis á 1 ml indeholder:
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Zofran 0,8 mg/ml oral opløsning ondansetron Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Zofran 0,8 mg/ml oral opløsning ondansetron Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
OPLYSNINGER DER SKAL ANFØRES PÅ DEN YDRE EMBALLAGE (PAKNING MED 1 SPRØJTE)
 A. ETIKETTERING 1 OPLYSNINGER DER SKAL ANFØRES PÅ DEN YDRE EMBALLAGE (PAKNING MED 1 SPRØJTE) 1. LÆGEMIDLETS NAVN Rebif 22 mikrogram - Injektionsvæske Interferon beta-1a 2. ANGIVELSE AF AKTIVT STOF/AKTIVE
A. ETIKETTERING 1 OPLYSNINGER DER SKAL ANFØRES PÅ DEN YDRE EMBALLAGE (PAKNING MED 1 SPRØJTE) 1. LÆGEMIDLETS NAVN Rebif 22 mikrogram - Injektionsvæske Interferon beta-1a 2. ANGIVELSE AF AKTIVT STOF/AKTIVE
PRODUKTRESUMÉ. for. Antistina-Privin, øjendråber, opløsning
 25. marts 2013 PRODUKTRESUMÉ for Antistina-Privin, øjendråber, opløsning 0. D.SP.NR 1222 1. LÆGEMIDLETS NAVN Antistina-Privin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Antazolinsulfat 5 mg/ml + naphazolinnitrat
25. marts 2013 PRODUKTRESUMÉ for Antistina-Privin, øjendråber, opløsning 0. D.SP.NR 1222 1. LÆGEMIDLETS NAVN Antistina-Privin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Antazolinsulfat 5 mg/ml + naphazolinnitrat
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Xalatan 50 mikrogram/ml, øjendråber, opløsning latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Xalatan 50 mikrogram/ml, øjendråber, opløsning latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Urilin, syrup
 21. juni 2011 PRODUKTRESUMÉ for Urilin, syrup 0. D.SP.NR 27072 1. VETERINÆRLÆGEMIDLETS NAVN Urilin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Phenylpropanolamin 40,29 mg (svarende
21. juni 2011 PRODUKTRESUMÉ for Urilin, syrup 0. D.SP.NR 27072 1. VETERINÆRLÆGEMIDLETS NAVN Urilin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Phenylpropanolamin 40,29 mg (svarende
Bilag III. Ændringer til relevante afsnit i produktresuméer og indlægssedler
 Bilag III Ændringer til relevante afsnit i produktresuméer og indlægssedler Note: De pågældende punkter i produktresuméet og indlægssedlen er resultatet af referral proceduren. Produktinformationen kan
Bilag III Ændringer til relevante afsnit i produktresuméer og indlægssedler Note: De pågældende punkter i produktresuméet og indlægssedlen er resultatet af referral proceduren. Produktinformationen kan
OPIUM NMI 10 mg/ml, orale dråber, opløsning Medicinsk opium (vandfri morfin)
 INDLÆGSSEDDEL: INFORMATION TIL PATIENTEN OPIUM NMI 10 mg/ml, orale dråber, opløsning Medicinsk opium (vandfri morfin) Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den
INDLÆGSSEDDEL: INFORMATION TIL PATIENTEN OPIUM NMI 10 mg/ml, orale dråber, opløsning Medicinsk opium (vandfri morfin) Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Melovem 5 mg/ml injektionsvæske, opløsning til kvæg og grise 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktivt stof: Meloxicam 5
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Melovem 5 mg/ml injektionsvæske, opløsning til kvæg og grise 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktivt stof: Meloxicam 5
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Ventoline 4 mg tabletter Salbutamol
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Ventoline 4 mg tabletter Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger. - Gem indlægssedlen.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Ventoline 4 mg tabletter Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger. - Gem indlægssedlen.
NeuroBloc Botulismetoksin type B injektionsvæske, opløsning 5.000 E/ml
 NeuroBloc Botulismetoksin type B injektionsvæske, opløsning 5.000 E/ml Vigtig sikkerhedsinformation til læger Formålet med denne vejledning er at informere læger, der er godkendt til at ordinere og administrere
NeuroBloc Botulismetoksin type B injektionsvæske, opløsning 5.000 E/ml Vigtig sikkerhedsinformation til læger Formålet med denne vejledning er at informere læger, der er godkendt til at ordinere og administrere
Indlægsseddel: Information til brugeren. Finasterid Orion 5 mg filmovertrukne tabletter. Finasterid
 Indlægsseddel: Information til brugeren Finasterid Orion 5 mg filmovertrukne tabletter Finasterid Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Finasterid Orion 5 mg filmovertrukne tabletter Finasterid Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren. Unixan 200 mg depottabletter Unixan 300 mg depottabletter Unixan 400 mg depottabletter theophyllin
 Indlægsseddel: Information til brugeren Unixan 200 mg depottabletter Unixan 300 mg depottabletter Unixan 400 mg depottabletter theophyllin Læs hele denne indlægsseddel grundigt, inden du begynder at tage
Indlægsseddel: Information til brugeren Unixan 200 mg depottabletter Unixan 300 mg depottabletter Unixan 400 mg depottabletter theophyllin Læs hele denne indlægsseddel grundigt, inden du begynder at tage
Zovir 5 % creme Aciclovir
 11. januar 2018 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
11. januar 2018 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Isotrex 0,05 % gel Isotretinoin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Gem indlægssedlen.
Indlægsseddel: Information til brugeren Isotrex 0,05 % gel Isotretinoin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Gem indlægssedlen.
INDLÆGSSEDDEL. NAVIREL 10 MG/ML KONCENTRAT TIL INFUSIONSVÆSKE, OPLØSNING (Vinorelbin)
 INDLÆGSSEDDEL NAVIREL 10 MG/ML KONCENTRAT TIL INFUSIONSVÆSKE, OPLØSNING (Vinorelbin) Læs denne indlægsseddel grundigt, før du begynder at bruge medicinen. - Gem denne indlægsseddel. Du kan få brug for
INDLÆGSSEDDEL NAVIREL 10 MG/ML KONCENTRAT TIL INFUSIONSVÆSKE, OPLØSNING (Vinorelbin) Læs denne indlægsseddel grundigt, før du begynder at bruge medicinen. - Gem denne indlægsseddel. Du kan få brug for
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. theophyllin
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Theo-Dur 200 mg, depottabletter Theo-Dur 300 mg, depottabletter theophyllin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Theo-Dur 200 mg, depottabletter Theo-Dur 300 mg, depottabletter theophyllin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
INDLÆGSSEDDEL : INFORMATION TIL BRUGEREN. Redap 1 mg/g gel. Adapalen
 INDLÆGSSEDDEL : INFORMATION TIL BRUGEREN Redap 1 mg/g gel Adapalen Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. - Gem indlægssedlen.
INDLÆGSSEDDEL : INFORMATION TIL BRUGEREN Redap 1 mg/g gel Adapalen Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. - Gem indlægssedlen.
Indlægsseddel: Information til brugeren. Benaliv 0,5 mg/ml øjendråber, suspension. Levocabastin
 Indlægsseddel: Information til brugeren Benaliv 0,5 mg/ml øjendråber, suspension Levocabastin Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Benaliv 0,5 mg/ml øjendråber, suspension Levocabastin Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason (som betamethasonvalerat) Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason (som betamethasonvalerat) Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
Aciclovir 1A Farma, 200 mg 400 mg og 800 mg tabletter aciclovir
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Aciclovir 1A Farma, 200 mg 400 mg og 800 mg tabletter aciclovir Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Aciclovir 1A Farma, 200 mg 400 mg og 800 mg tabletter aciclovir Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Voltabak, øjendråber, opløsning
 22. februar 2013 PRODUKTRESUMÉ for Voltabak, øjendråber, opløsning 0. D.SP.NR. 27464 1. LÆGEMIDLETS NAVN Voltabak 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diclofenacnatrium 1 mg/ml Hjælpestof: Polyoxyleret
22. februar 2013 PRODUKTRESUMÉ for Voltabak, øjendråber, opløsning 0. D.SP.NR. 27464 1. LÆGEMIDLETS NAVN Voltabak 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diclofenacnatrium 1 mg/ml Hjælpestof: Polyoxyleret
Ketoconazole Shampoo "Actavis" 2 %
 Indlægsseddel: Information til brugeren Ketoconazole Shampoo "Actavis" 2 % shampoo 20 mg/g ketoconazol Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Ketoconazole Shampoo "Actavis" 2 % shampoo 20 mg/g ketoconazol Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren. TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension. tobramycin og dexamethason
 Indlægsseddel: Information til brugeren TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension tobramycin og dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
Indlægsseddel: Information til brugeren TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension tobramycin og dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN RESPIPORC FLUpan H1N1 injektionsvæske, suspension til grise 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis på 1 ml indeholder: Aktivt stof (Aktive
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN RESPIPORC FLUpan H1N1 injektionsvæske, suspension til grise 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis på 1 ml indeholder: Aktivt stof (Aktive
Indlægsseddel: Information til brugeren Norske Brystdråber DAK, oral opløsning ekstrakt af lakridsrod
 Indlægsseddel: Information til brugeren Norske Brystdråber DAK, oral opløsning ekstrakt af lakridsrod Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Norske Brystdråber DAK, oral opløsning ekstrakt af lakridsrod Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
Indlægsseddel Information til brugeren Kemadrin 5 mg tabletter Procyclidinhydrochlorid
 Indlægsseddel Information til brugeren Kemadrin 5 mg tabletter Procyclidinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel Information til brugeren Kemadrin 5 mg tabletter Procyclidinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
meget svimmel under behandlingen, da det kan være tegn på lavt blodtryk, som kan medføre besvimelse.
 Indlægsseddel: Information til brugeren Flolan 0,5 mg og 1,5 mg pulver og solvens til infusionsvæske, opløsning Epoprostenol Læs denne indlægsseddel grundigt, inden du får medicinen. - Gem indlægssedlen.
Indlægsseddel: Information til brugeren Flolan 0,5 mg og 1,5 mg pulver og solvens til infusionsvæske, opløsning Epoprostenol Læs denne indlægsseddel grundigt, inden du får medicinen. - Gem indlægssedlen.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Ventoline 5 mg/ml inhalationsvæske til nebulisator, opløsning Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Ventoline 5 mg/ml inhalationsvæske til nebulisator, opløsning Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder
PRODUKTRESUMÉ. for. Uniferon, injektionsvæske, opløsning, beregnet til pattegrise
 9. april 2015 PRODUKTRESUMÉ for Uniferon, injektionsvæske, opløsning, beregnet til pattegrise 0. D.SP.NR 08324 1. VETERINÆRLÆGEMIDLETS NAVN Uniferon 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
9. april 2015 PRODUKTRESUMÉ for Uniferon, injektionsvæske, opløsning, beregnet til pattegrise 0. D.SP.NR 08324 1. VETERINÆRLÆGEMIDLETS NAVN Uniferon 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
Indlægsseddel: Information til brugeren. Nevanac 3 mg/ml øjendråber, suspension nepafenac
 Indlægsseddel: Information til brugeren Nevanac 3 mg/ml øjendråber, suspension nepafenac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Nevanac 3 mg/ml øjendråber, suspension nepafenac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Porcilis PCV M Hyo injektionsvæske, emulsion, til svin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én dosis på 2 ml indeholder: Aktive stoffer: Porcint
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Porcilis PCV M Hyo injektionsvæske, emulsion, til svin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én dosis på 2 ml indeholder: Aktive stoffer: Porcint
Indlægsseddel: Information til brugeren. Aciclovir 1A Farma, 200 mg 400 mg og 800 mg tabletter. aciclovir
 Indlægsseddel: Information til brugeren Aciclovir 1A Farma, 200 mg 400 mg og 800 mg tabletter aciclovir Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Aciclovir 1A Farma, 200 mg 400 mg og 800 mg tabletter aciclovir Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
Bilag III. Ændringer til relevante afsnit af produktinformationen
 Bilag III Ændringer til relevante afsnit af produktinformationen Bemærk: Disse ændringer til de relevante afsnit i produktresuméet og indlægssedlen er resultatet af referral-proceduren. Produktinformationen
Bilag III Ændringer til relevante afsnit af produktinformationen Bemærk: Disse ændringer til de relevante afsnit i produktresuméet og indlægssedlen er resultatet af referral-proceduren. Produktinformationen
Indlægsseddel: Information til brugeren. Atrovent 0,250 mg/ml, inhalationsvæske til nebulisator i enkeltdosisbeholder ipratropiumbromid
 Indlægsseddel: Information til brugeren Atrovent 0,250 mg/ml, inhalationsvæske til nebulisator i enkeltdosisbeholder ipratropiumbromid Læs denne indlægsseddel grundigt, inden du begynder at tage dette
Indlægsseddel: Information til brugeren Atrovent 0,250 mg/ml, inhalationsvæske til nebulisator i enkeltdosisbeholder ipratropiumbromid Læs denne indlægsseddel grundigt, inden du begynder at tage dette
PRODUKTRESUMÉ. for. Strepsils Citrus Sukkerfri, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils Citrus Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Citrus Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4-diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils Citrus Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Citrus Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4-diklorbenzylalkohol
Antepsin 200 mg/ml oral suspension
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Antepsin 200 mg/ml oral suspension Sucralfat Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. - Du kan få Antepsin uden recept. For at opnå
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Antepsin 200 mg/ml oral suspension Sucralfat Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. - Du kan få Antepsin uden recept. For at opnå
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Ingelvac CircoFLEX injektionvæske, suspension til grise 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En dosis à 1 ml inaktiveret vaccine indeholder: Aktivt
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Ingelvac CircoFLEX injektionvæske, suspension til grise 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En dosis à 1 ml inaktiveret vaccine indeholder: Aktivt
Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste.
 1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
Indlægsseddel: Information til patienten. Selincro 18 mg filmovertrukne tabletter nalmefen
 Indlægsseddel: Information til patienten Selincro 18 mg filmovertrukne tabletter nalmefen Dette lægemiddel er underlagt supplerende overvågning. Dermed kan der hurtigt tilvejebringes oplysninger om sikkerheden.
Indlægsseddel: Information til patienten Selincro 18 mg filmovertrukne tabletter nalmefen Dette lægemiddel er underlagt supplerende overvågning. Dermed kan der hurtigt tilvejebringes oplysninger om sikkerheden.
Indlægsseddel: Information til brugeren. Thycapzol 5 mg tabletter thiamazol
 Indlægsseddel: Information til brugeren Thycapzol 5 mg tabletter thiamazol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger. Gem indlægssedlen,
Indlægsseddel: Information til brugeren Thycapzol 5 mg tabletter thiamazol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger. Gem indlægssedlen,
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Otrivin Junior ukonserveret, næsespray, opløsning. Xylometazolinhydrochlorid 0,5 mg/ml
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Otrivin Junior ukonserveret, næsespray, opløsning Xylometazolinhydrochlorid 0,5 mg/ml Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Otrivin Junior ukonserveret, næsespray, opløsning Xylometazolinhydrochlorid 0,5 mg/ml Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
Information til brugeren. Bemærk, at der findes to indlægssedler til Pinex 500 mg filmovertrukne tabletter.
 Information til brugeren. Bemærk, at der findes to indlægssedler til Pinex 500 mg filmovertrukne tabletter. Hvis du har en håndkøbspakning med maks. 20 tabletter, skal du læse indlægssedlen på side 2.
Information til brugeren. Bemærk, at der findes to indlægssedler til Pinex 500 mg filmovertrukne tabletter. Hvis du har en håndkøbspakning med maks. 20 tabletter, skal du læse indlægssedlen på side 2.
Indlægsseddel: Information til brugeren. Nix 5 %, creme permethrin
 Indlægsseddel: Information til brugeren Nix 5 %, creme permethrin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Brug altid Nix nøjagtigt
Indlægsseddel: Information til brugeren Nix 5 %, creme permethrin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Brug altid Nix nøjagtigt
Indlægssseddel: Information til brugeren. Ketogan 5 mg/25 mg tabletter Ketobemidonhydrochlorid / 3-dimethylamino-1,1-diphenylbuten-(1)-hydrochlorid
 Indlægssseddel: Information til brugeren Ketogan 5 mg/25 mg tabletter Ketobemidonhydrochlorid / 3-dimethylamino-1,1-diphenylbuten-(1)-hydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at
Indlægssseddel: Information til brugeren Ketogan 5 mg/25 mg tabletter Ketobemidonhydrochlorid / 3-dimethylamino-1,1-diphenylbuten-(1)-hydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Zofran 4 mg og 8 mg frysetørrede tabletter ondansetron Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Zofran 4 mg og 8 mg frysetørrede tabletter ondansetron Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. CANESTEN, vaginalcreme 1 % Aktivt stof: Clotrimazol
 Indlægsseddel: Information til brugeren CANESTEN, vaginalcreme 1 % Aktivt stof: Clotrimazol Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Canesten uden recept. For at
Indlægsseddel: Information til brugeren CANESTEN, vaginalcreme 1 % Aktivt stof: Clotrimazol Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Canesten uden recept. For at
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Primcillin, 250 mg, 400 mg og 800 mg filmovertrukne tabletter. Phenoxymethylpenicillinkalium
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Primcillin, 250 mg, 400 mg og 800 mg filmovertrukne tabletter Phenoxymethylpenicillinkalium Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel,
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Primcillin, 250 mg, 400 mg og 800 mg filmovertrukne tabletter Phenoxymethylpenicillinkalium Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel,
PRODUKTRESUMÉ. for. Sofradex, øjen- og øredråber, opløsning (2care4)
 28. november 2012 PRODUKTRESUMÉ for Sofradex, øjen- og øredråber, opløsning (2care4) 0. D.SP.NR. 2508 1. LÆGEMIDLETS NAVN Sofradex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dexamethason 0,5 mg/ml som
28. november 2012 PRODUKTRESUMÉ for Sofradex, øjen- og øredråber, opløsning (2care4) 0. D.SP.NR. 2508 1. LÆGEMIDLETS NAVN Sofradex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dexamethason 0,5 mg/ml som
Indlægsseddel: Information til brugeren. Maxidex 1 mg/ml, øjendråber, suspension. dexamethason
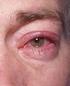 Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. Lodoxamid
 Indlægsseddel: Information til brugeren Alomide 1 mg/ml, øjendråber, opløsning Lodoxamid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Alomide 1 mg/ml, øjendråber, opløsning Lodoxamid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. DUKORAL suspension og brusegranulat til oral suspension Vaccine mod kolera (inaktiveret, oral).
 B. INDLÆGSSEDDEL 1 Indlægsseddel: Information til brugeren DUKORAL suspension og brusegranulat til oral suspension Vaccine mod kolera (inaktiveret, oral). Læs denne indlægsseddel grundigt, inden De begynder
B. INDLÆGSSEDDEL 1 Indlægsseddel: Information til brugeren DUKORAL suspension og brusegranulat til oral suspension Vaccine mod kolera (inaktiveret, oral). Læs denne indlægsseddel grundigt, inden De begynder
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Porcilis PCV, injektionsvæske, emulsion til svin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis af 2 ml indeholder: Aktivt stof Porcint circovirus
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Porcilis PCV, injektionsvæske, emulsion til svin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis af 2 ml indeholder: Aktivt stof Porcint circovirus
PRODUKTRESUMÉ. for. Creon 25.000, hårde enterokapsler
 24. august 2015 PRODUKTRESUMÉ for Creon 25.000, hårde enterokapsler 0. D.SP.NR 818 1. LÆGEMIDLETS NAVN Creon 25.000 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 kapsel indeholder 300 mg pankreatin svarende
24. august 2015 PRODUKTRESUMÉ for Creon 25.000, hårde enterokapsler 0. D.SP.NR 818 1. LÆGEMIDLETS NAVN Creon 25.000 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 kapsel indeholder 300 mg pankreatin svarende
PRODUKTRESUMÉ. for. Mhyogen, injektionsvæske, emulsion
 17. juni 2015 PRODUKTRESUMÉ for Mhyogen, injektionsvæske, emulsion 0. D.SP.NR. 29159 1. VETERINÆRLÆGEMIDLETS NAVN Mhyogen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis (2 ml) indeholder: Aktive stoffer
17. juni 2015 PRODUKTRESUMÉ for Mhyogen, injektionsvæske, emulsion 0. D.SP.NR. 29159 1. VETERINÆRLÆGEMIDLETS NAVN Mhyogen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis (2 ml) indeholder: Aktive stoffer
Indlægsseddel: Information til brugeren. Atrovent 20 mikrogram/dosis, inhalationsspray ipratropiumbromid
 Indlægsseddel: Information til brugeren Atrovent 20 mikrogram/dosis, inhalationsspray ipratropiumbromid Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Atrovent 20 mikrogram/dosis, inhalationsspray ipratropiumbromid Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
Indlægsseddel: information til brugeren
 Indlægsseddel: information til brugeren Ventoline 5 mg/ml inhalationsvæske til nebulisator, opløsning Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder
Indlægsseddel: information til brugeren Ventoline 5 mg/ml inhalationsvæske til nebulisator, opløsning Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder
Indlægsseddel: Information til brugeren. Panodil Hot 500 mg pulver til oral opløsning, brev paracetamol
 Indlægsseddel: Information til brugeren Panodil Hot 500 mg pulver til oral opløsning, brev paracetamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Panodil Hot 500 mg pulver til oral opløsning, brev paracetamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Mydriasert, øjenlamel
 10. april 2012 PRODUKTRESUMÉ for Mydriasert, øjenlamel 0. D.SP.NR. 23325 1. LÆGEMIDLETS NAVN Mydriasert 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En øjenlamel indeholder 0,28 mg tropicamid og 5,4 mg phenylephrin
10. april 2012 PRODUKTRESUMÉ for Mydriasert, øjenlamel 0. D.SP.NR. 23325 1. LÆGEMIDLETS NAVN Mydriasert 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En øjenlamel indeholder 0,28 mg tropicamid og 5,4 mg phenylephrin
Indlægsseddel: Information til brugeren. Panodil Junior 125 og 250 mg suppositorier paracetamol
 Indlægsseddel: Information til brugeren Panodil Junior 125 og 250 mg suppositorier paracetamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Panodil Junior 125 og 250 mg suppositorier paracetamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Purevax Rabies, injektionsvæske, suspension. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 1 ml indeholder: Aktivt stof: Rabies rekombinant
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Purevax Rabies, injektionsvæske, suspension. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 1 ml indeholder: Aktivt stof: Rabies rekombinant
