BILAG I PRODUKTRESUME
|
|
|
- Kirsten Eriksen
- 10 år siden
- Visninger:
Transkript
1 BILAG I PRODUKTRESUME
2 1. LÆGEMIDLETS NAVN TRAVATAN 40 mikrogram/ml øjendråber, opløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 40 mikrogram travoprost Hjælpestoffer er anført under Afsnit LÆGEMIDDELFORM Øjendråber, opløsning TRAVATAN er en klar, farveløs opløsning 4. KLINISKE OPLYSNINGER 4.1 Terapeutiske indikationer Nedsættelse af et forhøjet tryk hos patienter med okulær hypertension og åbenvinklet glaukom, som ikke tolererer eller er utilstrækkeligt responderende på andre intraokulær tryksænkende midler. Kan bruges som monoterapi eller som supplerende terapi (se Afsnit 5.1) 4.2 Dosering og indgivelsesmåde Til okulær brug. Dosering Voksne (ældre inkluderet): Dosis er en 1 dråbe TRAVATAN appliceret i den konjunktivale sæk i det relevante øje(ne) dagligt. Optimal effekt opnås, hvis dosis administreres om aftenen. Nasolacrimal okkulation eller rolig lukning af øjenlåget efter drypning anbefales. Dette kan reducere den systemiske absorption af medicin administreret via øjet og resultere i færre systemiske bivirkninger. Ved anvendelse af mere end et øjendråbe-præparat skal applikationen af de forskellige præparater foregå med mindst 5 minutters mellemrum (se Afsnit 4.5). Hvis TRAVATAN erstatter andre øjendråber mod glaukom, seponeres disse og behandling med TRAVATAN påbegyndes den efterfølgende dag. Børn og unge Da sikkerhed og effekt ved behandling af børn under 18 år ikke er fastslået, anbefales TRAVATAN ikke til disse patienter før flere data er tilgængelige. Brug ved nedsat lever- og nyrefunktion TRAVATAN er blevet undersøg hos patienter med mild til svær nedsat leverfunktion og hos patienter med mild til svær nedsat nyrefunktion (creatinin clearance så lav som 14 ml/min). Ingen dosis justering er nødvendigt for disse patienter. Administrations vejledning
3 Patienten skal fjerne beskyttelses folien umiddelbart før brug. For at undgå kontaminering af dråbespidsen og opløsningen, må man være opmærksom på ikke at berøre øjenlåget, omgivende områder eller andre overflader med spidsen af flasken. 4.3 Kontraindikationer Overfølsomhed overfor travoprost eller et af de øvrige indholdsstoffer. 4.4 Særlige advarsler og forsigtighedsregler vedrørende brugen TRAVATAN kan gradvis ændre øjenfarven ved at øge antallet af melanosomer (pigment granula) i melanocyterne. Før behandling påbegyndes skal patienterne informeres om dette. Unilateral behandling kan resultere i permanent heterochromia. Langtidseffekten på melanocyterne og konsekvenserne heraf er endnu ukendt. Ændring af irisfarven sker langsomt, og den vil først ses efter måneder eller år. Det er ukendt om farveændringen er reversibel når man stopper med at bruge TRAVATAN. Effekten ved vedvarende brug af TRAVATAN efter forekomst af iris pigmentering er indtil videre ukendt. Ændringen i øjenfarve har været dominerende hos patienter med blandede øjenfarve, f.eks. blå-brun, grå-brun, gul-brun og grøn-brun, men er også blevet observeret hos patienter med brune øjne. Det typiske billede er, at den brune pigmentering rundt om pupillen spredes koncentrisk mod periferien af det berørte øje, men hele iris eller dele af den kan blive mere brunligt. Efter at behandlingen er stoppet er der ikke observeret en stigning i brun iris pigmentering. Indtil videre findes der ingen kliniske data vedrørende behandling med TRAVATAN i længere end et år. I kontrollerede kliniske forsøg er mørkfarvning af huden omkring øjet og/eller øjenlåget blevet rapporteret hos 0,6% af patienter ved anvendelse af TRAVATAN. TRAVATAN kan gradvis ændre øjenvipperne i det behandlede øje/øjne. Disse ændringer blev observeret hos cirka halvdelen af de patienter som indgik i de kliniske afprøvninger og omfatter forøget længde, tykkelse, farve og/eller antal af øjenvipper. Mekanismen ved øjenvippe forandringer og deres konsekvenser på langt sigt er i dag ukendt TRAVATAN har vist at forårsage øget palebral fissur hos aber. Men denne effekt blev ikke observeret under de kliniske studier og bliver betragtet som specie specifik. Der er ingen erfaring med TRAVATAN ved inflammatoriske øjenlidelser eller ved neovaskulær, lukket vinkel, trang vinklet eller medfødt glaukom og kun begrænset erfaring ved tyroid øje sygdom, åbenviklet glaukom hos pseudophakiske patienter, pigmentglaukom eller pseudoexfoliativ glaukom. Macula ødem inklusiv cystoidt macula ødem, er blevet rapporteret ved behandling med prostagladin F2α analoger. Disse rapporteringer er hovedsageligt forekommet hos aphake patienter, pseudophake patienter med ødelagt posterior linse eller hos patienter med kendt macula-ødem risikofaktorer. Hudkontakt med TRAVATAN skal undgåes da transdermal absorption af travoprost er blevet observeret i kaninstudier (se Afsnit 6.6). Benzalkoniumchlorid, som ofte anvendes som konserveringsmiddel i øjen-præparater, kan ifølge rapporter forårsage punktformet keratopati og/eller toksisk ulcerøs keratopati. Da TRAVATAN indeholder benzalkoniumchlorid, er tæt opfølgning nødvendig ved hyppig eller langvarig brug hos patienter med tørre øjne eller ved tilfælde, hvor cornea er kompromitteret. Da TRAVATAN indeholder konserveringsmidlet benzalkoniumklorid, kan dette give irritation og er kendt for at kunne misfarve bløde kontaktlinser. Patienter skal derfor fjene kontaktlinserne før applikation og instrueres i at vente 15 minutter efter applikation af TRAVATAN, før kontaktlinserne isættes igen. 4.5 Interaktion med andre lægemidler og andre former for interaktion
4 Interaktioner af TRAVATAN med andre lægemidler er ikke specifikt blevet evalueret. 4.6 Graviditet og amning Graviditet: Der er ikke tilstrækkelige data vedrørende brug af travoprost hos gravide. Dyrestudier har vist reproduktion toksisitet (se Afsnit 5.3). Den potentielle risiko for mennesket er ukendt. Derfor bør TRAVATN ikke bruges under graviditet, medmindre det er meget nødvendigt. Kvinder som overvejer at blive gravide: TRAVATAN må ikke bruges til kvinder som overvejer eller har risiko for at blive gravide. Amning: Dyrestudier indikere at det er sandsynligt at travoprost og dennes metabolitter passerer over i modermælken. TRAVATAN kan derfor ikke anbefales til ammende kvinder. 4.7 Virkninger på evnen til at føre motorkøretøj eller betjene maskiner Som med alle andre øjendråber kan der opstå slørret syn eller andre synsforstyrrelser, som kan påvirke evnen til at køre bil eller betjene maskiner. Hvis slørret syn forekommer efter drypning skal patienten vente med at køre bil eller betjene maskiner indtil at synet er klart igen. 4.8 Bivirkninger I kliniske studier med over 850 patienter blev TRAVATAN administreret 1 gang dagligt som monoterapi eller som tillægsterapi til timolol 0.5%. Ingen alvorlige oftamologiske eller systemiske bivirkninger relateret til TRAVATAN er blevet rapporteret i de kliniske studier. Den hyppigste rapporterede behandlingsrelaterede bivirkning var okular hyperæmi (36,7%), hvilken var mild hos 91,7% af disse patienter. Hyperæmi faldt over tiden hos disse patienter. 2,5% af patienter stoppede behandlingen på grund af hyperæmi. Følgende uønskede bivirkninger som definitivt, sandsynligvis eller muligvis er relateret til behandlingen, blev rapporteret under de kliniske studier på TRAVATAN. Deres forekomst var enten meget hyppige (mere end 10,0%), hyppige (1,0% til 10%,; den hyppigste forekommende bivirkning sås dog kun hos 4,8%) eller usædvanlige (0,2% til mindre end 1,0%). Alle andre bivirkninger blev rapporteret som enkeltstående tilfælde hvoraf ingen var alvorlige og relateret. Øjenbivirkninger Meget hyppige: Okulær hyperæmi Hyppige: Okulær pruritus, okulær ubehag (brændende eller sviende fornemmelse lige efter drypning), okulær smerte, tørre øjne, fremmedlegeme fornemmelse, farvning af iris, lysfølsomhed, celler, keratitis og flare. Usædvanlige: Tårerflod, slørret syn, conjunktivitis, forøget længde af øjenvipper, okular irritation, iritis, øjenlågsødem, klistret fornemmelse, conjunktivale follikler, nedsat synsskarphed, blepharitis, pandesmerter svarende til øjenbrynene og conjunktival pipillae. Systemiske bivirkninger Hele kroppen Hyppige: Hovedpine Kardiovaskulær Usædvanlige: Hypotension & bradykardi Hud og overflade Usædvanlige: Farvning af huden omkring øjnene
5 Som med andre prostaglandin analoger (klasseeffekt), kan TRAVATAN gradvis ændre øjenvipperne i det behandlede øje(ne), disse ændringer blev observeret hos cirka halvdelen af de patienter som indgik i de kliniske afprøvninger og omfatter: forøget længde, tykkelse, farve og/eller antal af øjenvipper. Mekanismen ved øjenvippe forandringer og deres konsekvenser på langt sigt er i dag ukendt. 4.9 Overdosering Hvis overdosering med TRAVATAN optræder, skal behandlingen være symptomatisk. 5. FARMAKOLOGISKE EGENSKABER 5.1 Farmakodynamiske egenskaber Farmakoterapeutisk klassifikation: Andre anti-glaukom produkter. ATC-kode: S01EX Travoprost, en prostaglandin F2α analog, er en fuld agonist som er meget selektiv og har en høj affinitet for prostaglandin FP receptoren. Nedsætter det intraokulære tryk ved at øge outflow et af kammervæsken. Nedsættelsen af det intraokulære tryk i mennesker starter cirka 2 timer efter administrationen og den maksimale effekt opnås efter 12 timer. Tryk nedsættelsen opretholdes i mindst 24 timer. Den eksakte virkningsmekanisme med hvilken travopost reducerer det intraokulære tryk er ikke fuld ud klarlagt. Som andre topikale prostaglandin analoger tænkes travoprost at øge det uveoscleral outflow. Data for kombinationsbehandling med TRAVATAN sammen med timolol 0,5% og begrænset data sammen med brimonidine 0,2% blev indsamlet under de kliniske studier som konfirmerede den additive effekt ved samtidig behandling med TRAVATAN og disse glaukom produkter. Der findes ingen kliniske data for kombinationsbehandling med andre hypotensive okulære lægemidler. 5.2 Farmakokinetiske egenskaber Travopost er et ester prodrug. Det absorberes gennem cornea, hvor isopropyl esteren hydrolyseres til den aktive frie syre. Studier i kaniner har vist peak koncentrationer på 20 ng/g af den frie syre i kammervæsken én til to timer efter topikal administration af TRAVATAN. Koncentrationen i kammervandet falder med en halveringstid på cirka 1,5 timer Metabolisme er det dominerede eliminationsvej for både travoprost og den aktive frie syre. Den systemiske metabolisme er parallel til den for endogen prostaglandin-f2α, som er karakteriseret ved reduktion af dobbeltbindingen, oxidation af 15-hydroxyl og β-oxidativ spaltning af den øverste sidekæde. Ved topikal okulær administration af TRAVATAN på raske frivillige blev der kun demonstreret lav systemisk påvirkning af den aktive frie syre. Peak plasma koncentration af den fri syre på 25 pg/ml eller mindre blev observeret 10 og 30 minutter efter administration. Herefter faldt plasma niveauet hurtigt til under detektionsgrænsen på 10 pg/ml på mindre end 1 time efter administration. På grund af den lave plasma koncentration og den hurtige udskillelse efter topikal administration kan man ikke bestemme eliminations halveringstid i mennesker på den aktive frie syre. TRAVATAN er blevet undersøg hos patienter med mild til svær nedsat leverfunktion og hos patienter med mild til svær nedsat nyrefunktion (creatinin clearance så lav som 14 ml/min). Ingen dosis justering er nødvendigt for disse patienter.
6 5.3 Prækliniske sikkerhedsdata Sekundær farmakologi: Den potentielle effekt af travoprost på blodgennemstrømning til synsnerven er blevet evalueret hos kaniner, idet reduceret blod gennemstrømning kan være en faktor ved etiologien af glaukom. I modsætning til dette forøger travoprost signifikant blodgennemstrømningen gennem synsnerven hos kaniner efter 7 dages topikal okulær administration (1,4 mikrogram, en gang dagligt). Der forekom ingen ændringer i retina funktionen, undersøgt ved elektroretinogram, ved en enkelt subcutan dosis (100 mikrogram/kg) af travoprost hos kaniner målt enten efter én time eller én uge efter dosering. Sikkerhedsdata: Den okulære såvel som den systemiske toksisitet af travoprost er blevet undersøgt i adskillige dyre arter. Travoprost er generelt veltolereret med en sikkerhedsmargin mellem klinisk okulær dosis og systemisk toksisitet på mindst 250 gange. Enkelt dosis toksisitet er lav, med ingen signifikant pharmakotoksisk observationer i rotter ved i.v. dosis på 10 mg/kg, hvilket er mindst gange den kliniske dose og over 13,000 gange den mulige eksponering fra hele indholdet af en flaske. Et 6 måneders toksisitets studie i rotter med subkutan administration viste sporadisk til mild hyperostose og/eller endotal fibrose observeret ved 30 og 100 mikrogram/kg, med et non-effekt niveau på 10 mikrogram/kg/dag (200 gange den kliniske dose). Tilsvarende observationer var tilstede ved 10 mikrogram/kg/dag efter 2 års behandling i rotter. Topikal okulær administration af travoprost i aber med koncentrationer op til 0.012% i højre øje, 2 gange dagligt i et år resulterede i ingen systemisk toksisitet. Reproduktions toksisitets studier er blevet udført i rotter, mus og kaniner ved systemisk administration. Fund er relateret til FP receptor agonist aktivitet i uterus med tidlig embryonal letalitet (foster død), post-implantation tab, føtal-toksisitet (fostertoksisitet). Hos gravide rotter resulterede systemisk administration af travopost på doser mere end 200 gange højere end den kliniske dose gennem organogenesis perioden i et forøget antal misdannelser. Lave niveauer af radioaktivitet blev målt i amniotisk væske og foetalt væv fra gravide rotter som havde fået indgivet 3H-travoprost. Reproduktions- og udviklingsstudier har vist en potent effekt på foetal tab med en høj frekvens hos rotter og mus (henholdsvis 180 pg/ml og 30 pg/ml plasma) ved eksponering 1,2 to 6 gange den kliniske eksponering (op til 25 pg/ml). Okulare toksisitets studier med aber viste, ved administration af travopost på en dose på 0,45 mikrogram to gange om dagen, at kunne forsage øget palpebral fissur. Karcinogenitet 2 års bioassays, i hvilken rotter og mus blev doseret med travoprost subkutan injektion på doser op til 100 mikrogram/kg/dag (2.500 gange den kliniske dosis) gav ingen formodning om en karcinogen effekt. Der blev observeret nogen signifikans af nogle statistiske tumor analyser, men de blev betragtet som tilfældige og ikke relateret til behandling med travoprost. Mutagenitet Travoprost var ikke mutagent i bakterier, i et muse lymfoid assay, i et muse micronucelleus assay eller i rotte kromosom afvigelses test. I et andet muse lymfoid assay var mutageniteten equivokal i én af to replikationer ved tilstedeværelsen af aktiveringsenzymer, men ikke ved fraværet af disse. 6. FARMACEUTISKE OPLYSNINGER 6.1 Fortegnelse over hjælpestoffer
7 Benzalkoniumklorid Polyoxyetylen hydrogeneret ricinusolie 40 (HCO-40) Trometamol Dinatriumedetat Borsyre (E284) Mannitol (E421) Natriumhydroxid og/eller saltsyre (til at justere ph) Renset vand. 6.2 Uforligeligheder Ikke kendt Specifikke in vitro interaktions studier er gennemført med TRAVATAN og lægemidler indeholdende thiomersal. Der blev ikke observeret nogen udfældning. 6.3 Opbevaringstid 2 år Smides ud 4 uger efter åbning. 6.4 Særlige opbevaringsforhold Ingen særlige forholdsregler vedrørende opbevaringen 6.5 Emballage (art og indhold) 2.5 ml oval dråbeflaske med skruelåg (polypropylen). Følgende paknings størrelser er tilgængelige: æske som indeholder 1 eller 3 flasker af 2,5 ml. Det er ikke alle lande som markedsfører begge pakningsstørrelser. 6.6 Instruktioner vedrørende anvendelse og håndtering Patienten bør først fjerne beskyttelsesfolien umiddelbart før første brug. Da prostaglandiner er biologisk aktive stoffer, og da de kan absorberes gennem huden, bør gravide eller kvinder der forsøger at blive gravide, tage passende forholdsregler for at undgå direkte påvirkning af flaskens indhold. Hvis der ved et uheld er kontakt med indholdet i en flaske, vaskes det berørte kontakt området grundigt og med det samme. 7. INDEHAVER AF MARKEDSFØRINGSTILLADELSEN Alcon Laboratories (UK) Ldt. Boundary Way Hemel Hempstead Herts HP2 7UD Storbritanien 8. NUMMER (NUMRE) I EU-REGISTRET FOR LÆGEMIDLER 9. DATO FOR FØRSTE TILLADELSE/FORNYELSE AF TILLADELSEN 10. DATO FOR ÆNDRING AF TEKSTEN
8 BILAG II A. INDEHAVER AF VIRKSOMHEDSGODKENDELSE ANSVARLIG FOR BATCHFRIGIVELSE B. BETINGELSER FOR MARKEDSFØRINGSTILLADELSEN
9 A. INDEHAVER AF VIRKSOMHEDSGODKENDELSE ANSVARLIG FOR BATCHFRIGIVELSE Navn og adresse på fremstilleren ansvarlig for batchfrigivelse S.A. Alcon-Couvreur N.V. Rijksweg 14 B-2870, Puurs Belgien B. BETINGELSER FOR MARKEDSFØRINGSTILLADELSEN BETINGELSER ELLER BEGRÆNSNINGER PÅLAGT INDEHAVEREN AF MARKEDSFØRINGSTILLADELSEN VEDRØRENDE UDLEVERING OG BRUG Lægemidlet må kun udleveres efter recept. ANDRE BETINGELSER Indehaveren af denne markedsføringstilladelse skal underrette Europa-Kommissionen om markedsføringsplanerne for det lægemiddel, der er godkendt ved denne beslutning.
10 BILAG III ETIKETTERING OG INDLÆGSSEDDEL
11 A. ETIKETTERING
12 OPLYSNINGER, DER SKAL ANFØRES PÅ DEN YDRE EMBALLAGE ELLER, NÅR EN SÅDAN IKKE FINDES, PÅ DEN INDRE EMBALLAGE YDRE KARTON TIL ENKELT FLASKE 1. LÆGEMIDLETS NAVN TRAVATAN 40 mikrogram/ml øjendråber, opløsning travoprost 2. ANGIVELSE AF AKTIVT STOF/AKTIVE STOFFER 1 ml opløsning indeholder 40 mikrogram travoprost 3. LISTE OVER HJÆLPESTOFFER Benzalkoniumklorid, polyoxyetylen hydrogeneret ricinusolie 40 (HCO-40), trometamol, dinatriumedetat, borsyre (E284), mannitol (E421) natriumhydroxid og/eller saltsyre (til at justere ph) og renset vand. 4. LÆGEMIDDELFORM OG INDHOLDSMÆNGDE (PAKNINGSSTØRRELSE) Øjendråber, opløsning; 2,5 ml 5. ANVENDELSESMÅDE OG INDGIVELSESVEJ(E) Okulær anvendelse. Læs indlægssedlen før brug. 6. ADVARSEL OM, AT LÆGEMIDLET SKAL OPBEVARES UTILGÆNGELIGT FOR BØRN Opbevares utilgængeligt for børn 7. EVENTUELLE ANDRE SÆRLIGE ADVARSLER 8. UDLØBSDATO Exp: xx/yyyy Holdbar 4 uger efter første åbning. Åbnet: 9. SÆRLIGE OPBEVARINGSBETINGELSER 10. EVENTUELLE SÆRLIGE FORHOLDSREGLER VED BORTSKAFFELSE AF UBRUGTE LÆGEMIDLER ELLER AFFALD FRA SÅDANNE
13 11. NAVN OG ADRESSE PÅ INDEHAVEREN AF MARKEDSFØRINGSTILLADELSEN Alcon Laboratories (UK) Ltd. Boundary Way Hemel Hempstead Herts, HP2 7UD Storbritannien 12. NUMMER (NUMRE) I EU-REGISTRET FOR LÆGEMIDLER EU/0/00/000/ FREMSTILLERENS BATCHNUMMER Batch nr.: xxxxx 14. GENEREL KLASSIFIKATION FOR UDLEVERING Receptpligtigt lægemiddel. 15. INSTRUKTIONER VEDRØRENDE ANVENDELSEN
14 OPLYSNINGER, DER SKAL ANFØRES PÅ DEN YDRE EMBALLAGE ELLER, NÅR EN SÅDAN IKKE FINDES, PÅ DEN INDRE EMBALLAGE YDRE KARTON INDEHOLDENDE 3 FLASKER 1. LÆGEMIDLETS NAVN TRAVATAN 40 mikrogram/ml øjendråber, opløsning travoprost 2. ANGIVELSE AF AKTIVT STOF/AKTIVE STOFFER 1 ml opløsning indeholder 40 mikrogram travoprost 3. LISTE OVER HJÆLPESTOFFER Benzalkoniumklorid, polyoxyetylen hydrogeneret ricinusolie 40 (HCO-40), trometamol, dinatriumedetat, borsyre (E284), mannitol (E421) natriumhydroxid og/eller saltsyre (til at justere ph) og renset vand. 4. LÆGEMIDDELFORM OG INDHOLDSMÆNGDE (PAKNINGSSTØRRELSE) Øjendråber, opløsning; 3 x 2,5 ml 5. ANVENDELSESMÅDE OG INDGIVELSESVEJ(E) Okulær anvendelse. Læs indlægssedlen før brug. 6. ADVARSEL OM, AT LÆGEMIDLET SKAL OPBEVARES UTILGÆNGELIGT FOR BØRN Opbevares utilgængeligt for børn 7. EVENTUELLE ANDRE SÆRLIGE ADVARSLER 8. UDLØBSDATO Exp: xx/yyyy Holdbar 4 uger efter første åbning. Åbnet (1): Åbnet (2): Åbnet (3): 9. SÆRLIGE OPBEVARINGSBETINGELSER
15 10. EVENTUELLE SÆRLIGE FORHOLDSREGLER VED BORTSKAFFELSE AF UBRUGTE LÆGEMIDLER ELLER AFFALD FRA SÅDANNE 11. NAVN OG ADRESSE PÅ INDEHAVEREN AF MARKEDSFØRINGSTILLADELSEN Alcon Laboratories (UK) Ltd. Boundary Way Hemel Hempstead Herts, HP2 7UD Storbritannien 12. NUMMER (NUMRE) I EU-REGISTRET FOR LÆGEMIDLER EU/0/00/000/ FREMSTILLERENS BATCHNUMMER Batch nr.: xxxxx 14. GENEREL KLASSIFIKATION FOR UDLEVERING Receptpligtigt lægemiddel. 15. INSTRUKTIONER VEDRØRENDE ANVENDELSEN
16 MINDSTEKRAV TIL OPLYSNINGER, DER SKAL ANFØRES PÅ SMÅ INDRE EMBALLAGER ETIKET 1. LÆGEMIDLETS NAVN, STYRKE OG/ELLER INDGIVELSESVEJ(E) TRAVATAN 40 mikrogram/ml øjendråber, opløsning 2. ANVENDELSESMÅDE Læs indlægssedlen før brug. Holdbar 4 uger efter første åbning. Åbnet: <For yderligere informationer, fold etiketten ud ved pilen> 3. UDLØBSDATO Exp: xx/xxxx 4. BATCHNUMMER Batch nr.: 5. INDHOLDSMÆNGDE ANGIVET SOM VÆGT, VOLUMEN ELLER ANTAL DOSER 2,5 ml
17 MINDSTEKRAV TIL OPLYSNINGER, DER SKAL ANFØRES PÅ SMÅ INDRE EMBALLAGER BESKYTTELSESFOLIE 1. LÆGEMIDLETS NAVN, STYRKE OG/ELLER INDGIVELSESVEJ(E) TRAVATAN 40 mikrogram/ml øjendråber, opløsning travoprost 2. ANVENDELSESMÅDE Læs indlægssedlen før brug. Holdbar 4 uger efter første åbning. 3. UDLØBSDATO Exp: xx/xxxx 4. BATCHNUMMER Batch nr.: 5. INDHOLDSMÆNGDE ANGIVET SOM VÆGT, VOLUMEN ELLER ANTAL DOSER 2,5 ml
18 B. INDLÆGSSEDDEL
19 INDLÆGSSEDDEL TRAVATAN 40 mikrogram/ml øjendråber, opløsning Travoprost Læs hele denne indlægsseddel omhyggeligt, inden du begynder at anvende dette lægemiddel. Dette lægemiddel er ordineret til dig personligt, og du bør ikke give det videre til andre. Det kunne skade dem, selv om deres symptomer er de samme som dine egne. Gem indlægssedlen. Du får muligvis behov for at læse den igen. Hvis du har yderligere spørgsmål efter at have læst den, bedes du kontakte din læge eller apotek. Den aktive substans er travoprost 40 mikrogram/ml De øvrige indholdsstoffer er benzalkoniumklorid, polyoxyetylen hydrogeneret ricinusolie 40 (HCO- 40), trometamol, dinatriumedetat, borsyre (E284), mannitol (E421) og renset vand. Små mængder saltsyre/natriumhydroxid er tilsat for at holde surhedsgraden (ph-niveauet) normal. Indehaver af markedsføringstilladelsen for TRAVATAN er Alcon Laboratories (UK) Ltd., Boundary Way, Hemel Hempstead, Herts., HP2 7UD Storbritannien. TRAVATAN bliver fremstillet af S.A. Alcon-Couvreur N.V., Rijksweg 14, B-2870 Puurs, Belgien. 1. HVORDAN VIRKER TRAVATAN TRAVATAN bruges til at sænke forhøjet tryk i øjet. Forhøjet tryk kan føre til en sygdom kaldet glaukom (grøn stær). Forhøjet tryk i øjet. Dine øjne indeholder en klar, vandig væske som giver næring til indersiden af øjnene. Væsken løber ud af øjet samtidig med at ny væske produceres. Hvis øjnene fyldes hurtigere end de tømmes, øger trykket i øjet. Hvis trykket bliver for højt kan det beskadige dit syn. TRAVATAN tilhører en gruppe lægemidler til glaukom der kaldes prostaglandin analoger. Det virker ved at øge væskeafløbet, hvilket sænker trykket i øjet. Det kan anvendes alene eller sammen med andre øjendråber f.eks. betablokkere, som også sænker trykket i øjet. TRAVATAN er en væske (en klar, farveløs opløsning), som fås i en pakning med en 2,5 ml plastik flaske med skruelåg eller i en pakning med tre 2,5 ml plastik flasker med skruelåg. Hver flaske er pakket i en beskyttelsesfolie. Det er ikke alle lande som markedsfører begge pakningsstørrelser. 2. INDEN DU ANVENDER TRAVATAN Du bør ikke bruge TRAVATAN - hvis du er overfølsom (allergisk) over for prostaglandiner eller et af de øvrige indholdsstoffer. - hvis du er gravid, eller forsøger at blive gravid Spørg din læge om råd. Vær særlig forsigtig med at anvende TRAVATAN. - hvis du bruger bløde kontaktlinser. Anvend ikke øjendråber når dine kontaktlinser er i øjet. Vent 15 minuter inden du sætter kontaktlinserne på igen. Et konserveringsmiddel i TRAVATAN (benzalkoniumklorid) kan misfarve bløde kontaktlinser.
20 - hvis du ammer. TRAVATAN kan gå over i modermælken. Spørg din læge om råd. - TRAVATAN må ikke anvendes til personer under 18 år. - TRAVATAN kan give længere eller tykkere øjenvipper og kan ændre farven og/eller antal hår af dine øjenvipper. - TRAVATAN kan ændre din irisfarve (den farvede del af dine øjne). Bilkørsel og betjening af maskiner: Du kan opleve at dit syn bliver midlertidigt uklart efter at du har anvendt TRAVATAN. Du bør ikke køre bil eller betjene maskiner før dette er forsvundet. Hvis du tager eller for nylig har taget andre lægemidler, bør du oplyse din læge eller apotek herom, også hvis der er tale om ikke-receptpligtige lægemidler (håndkøbsmedicin). 3. HVORDAN ANVENDES TRAVATAN Normaldosering: Voksne: 1 dråbe i øjet eller øjnene, én gang dagligt om aftenen. Brug kun TRAVATAN i begge øjne, hvis din læge har ordineret det. Brug øjendråberne så længe som din læge har ordineret det. TRAVATAN må kun bruges i øjnene. Se modsat side for yderligere information Vend 3. HVORDAN ANVENDES TRAVATAN (fortsat) Figur 1 Figur 2 Figur 3 Figur 4 Hvormeget skal der bruges Se side 1 Umiddelbart før brug for første gang, fjernes beskyttelses folien og flasken tages ud (Figur 1) og åbningsdatoen skrives hvor der er gjort plads på etiketten. Hent TRAVATAN flasken og et spejl. Vask dine hænder. Skru hætten af. Hold flasken i hånden, pegende nedad, mellem din tommelfinger og din langefinger. Bøj hovedet bagover og træk forsigtig ned i dit nederste øjenlåg indtil der former sig en lomme mellem dit øjenlåg og dit øje. Dråben skal lægge sig der (Figur 2). Før dråbespidsen på flasken tæt på øjet. Brug spejlet hvis det gør det nemmere. Undgå at berøre øjet eller øjenlåget, omgivende områder eller andre overflader med spidsen af flasken. Det kan forurene dråberne. Tryk forsigtigt på flasken for at frigøre en dråbe TRAVATAN(Figur 3).
21 Efter at have dryppet med TRAVATAN, trykkes en finger mod øjenkrogen ind mod næsen (Figur 4). Det forhindrer at TRAVATAN kommer ud i resten af kroppen. Gentag processen i det andet øje, hvis det er ordineret af din læge. Skru hætten på flasken igen direkte efter brug. Brug kun én flaske af gangen. Bryd ikke beskyttelses folien på en ny flaske før du har brug for en ny flaske. Hvis dråben ikke rammer øjet, prøv da igen med en ny dråbe. Hvis du får for meget i dine øjne, skylles det da ud med lunkent vand. Dryp ikke flere dråber i øjnene før det er tid til næste dosis. Hvis du glemmer at tage TRAVATAN, så genoptag behandlingen med det samme og fortsæt derefter i det normale mønster. Anvend aldrig dobbeltdosis som erstatning for glemte doser. Hvis du anvender andre øjendråber, så vent mindst 5 minutter mellem TRAVATAN og de andre dråber. 4. HVILKE MULIGE BIVIRKNINGER HAR TRAVATAN Nogle personer som anvender TRAVATAN kan få bivirkninger. De kan være ubehagelige, men de fleste går hurtigt over. Du kan oftest fortsætte med at anvende dine øjendråber, hvis bivirkningerne ikke er alvorlige. Hvis du er usikker, tal da med din læge eller apoteket. Hyppigste bivirkninger: Følgende kan forekomme hos cirka 1 ud af 3 personer Røde øjne En eller flere af disse kan forekomme hos op til 5 ud af 100 personer Bivirkninger i øjet: brændende eller sviende fornemmelse lige efter du har dryppet øjet, kløe, ændring i farven af regnbuehinden, tørre øjne, følelse af at have fået noget i øjet, øjen- eller øjenlågsinflammation (hævelse/rødme), smerte i øjet, sløret syn, nedsat synsskarphed, lysfølsomhed. Bivirkninger i kroppen: hovedpine, nedsat puls, fald i blodtryk, farveændring omkring øjenlågene. Hvis du bemærker bivirkninger, som ikke er nævnt i denne indlægsseddel, bør du oplyse din læge eller apotek herom. 5. OPBEVARING AF TRAVATAN Flasken skal smides ud 4 uger efter, at den er åbnet første gang for at forhindre, at indholdet bliver forurenet. Skriv åbningsdato, hvor der er plads nedenfor samt på hver etikette og på kartonen. For den pakning der kun indeholder en enkelt flaske, skrives kun en dato. Åbnet (1): Åbnet (2): Åbnet (3): Opbevar øjendråberne på et sikkert sted, hvor børn ikke kan se eller nå dem.
22 Må ikke anvendes efter den udløbsdato ( Exp ) som er angivet på etiketten eller kartonen. Hvis du har spørgsmål til dit lægemiddel, bør du spørge din læge eller apoteket. Denne indlægsseddel blev sidst godkendt xxxxxx Yderligere oplysninger For yderligere oplysninger om disse øjendråber bedes du kontakte det lokale Alcon kontor. België/Belgique/Belgien SA Alcon-Couvreur NV Rijksweg 14 B-2870 Puurs + 32 (0) Danmark Alcon Danmark ApS Rødovre Parkvej 25 DK-2610 Rødovre Deutschland Alcon Pharma GmbH Blankreutestrasse 1 D Freiburg + 49 (0) Ελλάδα Άλκον Λαμποράτορις Ελλάς ΑΕΒΕ Κηφισίας 18 GR Μαρούσι + 30 (0) España Alcon Cusí, S.A. c/camil Fabra, 58 E El Masnou-Barcelona Luxembourg/Luxemburg SA Alcon-Couvreur NV Rijksweg 14 B-2870 Puurs + 32 (0) Nederland Alcon Nederland BV Avelingen-West 5 NL-4202 MS Gorinchem + 31 (0) Norge Alcon Norge AS Eyvind Lyches v 10, Postboks.22 N-1300 Sandvika Österreich Alcon Ophthalmika GmbH Mariahilferstr. 121b A-1060 Wien + 43 (0) Portugal Alcon Portugal Produtos e Equipamentos Oftalmolόgicos, Lda. Quinta da Fonte Edifício D. Sancho I Piso 3 Porto Salvo P Paço D Arcos France Laboratoires Alcon Immeuble Les Colonnades 4, Rue Henri Sainte-Claire Deville F Rueil-Malmaison Cedex + 33 (0) Suomi/Finland Alcon Finland Oy PL 13 FIN Vantaa (0)
23 Ireland Alcon Laboratories (UK) Ltd Pentagon Park Boundary Way Hemel Hempstead Herts., HP2 7UD UK + 44 (0) Ísland K. Pétursson hf. Ljárskógar 15 IS-109 Reykjavík Sverige Alcon Sverige AB Box S Stockholm + 46 (0) United Kingdom Alcon Laboratories (UK) Ltd Pentagon Park Boundary Way Hemel Hempstead Herts., HP2 7UD. U.K (0) Italia Alcon Italia S.p.A. Viale Giulio Richard, 1/B Milano + 39 (0)
ETIKETTERING OG INDLÆGSSEDDEL
 BILAG III ETIKETTERING OG INDLÆGSSEDDEL 1.1.1.1.1 A. ETIKETTERING 1 YDRE EMBALLAGE (KARTON), 5 ML. EMADINE øjendråber, opløsning 0,05% Emadastin 0,05% (som difumarat) 5 ml. Benzalkon.chlorid0,01%, trometamol,
BILAG III ETIKETTERING OG INDLÆGSSEDDEL 1.1.1.1.1 A. ETIKETTERING 1 YDRE EMBALLAGE (KARTON), 5 ML. EMADINE øjendråber, opløsning 0,05% Emadastin 0,05% (som difumarat) 5 ml. Benzalkon.chlorid0,01%, trometamol,
Indlægsseddel: Information til patienten. Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin
 Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1. LÆGEMIDLETS NAVN OPATANOL 1 mg/ml øjendråber, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder 1 mg olopatadin (som hydroklorid). Hjælpestoffer er anført under
BILAG I PRODUKTRESUME 1. LÆGEMIDLETS NAVN OPATANOL 1 mg/ml øjendråber, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder 1 mg olopatadin (som hydroklorid). Hjælpestoffer er anført under
Indlægsseddel: Information til brugeren. Ciloxan 3 mg/ml, øjendråber, opløsning. ciprofloxacin
 Indlægsseddel: Information til brugeren Ciloxan 3 mg/ml, øjendråber, opløsning ciprofloxacin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Ciloxan 3 mg/ml, øjendråber, opløsning ciprofloxacin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. Tobrex Depot 3 mg/ml, depotøjendråber, opløsning. tobramycin
 Indlægsseddel: Information til brugeren Tobrex Depot 3 mg/ml, depotøjendråber, opløsning tobramycin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Tobrex Depot 3 mg/ml, depotøjendråber, opløsning tobramycin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren. OPATANOL 1 mg/ml øjendråber, opløsning Olopatadin
 Indlægsseddel: Information til brugeren OPATANOL 1 mg/ml øjendråber, opløsning Olopatadin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren OPATANOL 1 mg/ml øjendråber, opløsning Olopatadin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. Mydriacyl 5 mg/ml og 10 mg/ml øjendråber, opløsning. tropicamid
 Indlægsseddel: Information til brugeren Mydriacyl 5 mg/ml og 10 mg/ml øjendråber, opløsning tropicamid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Mydriacyl 5 mg/ml og 10 mg/ml øjendråber, opløsning tropicamid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning
 Indlægsseddel: Information til brugeren Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning hypromellose Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Viskøse
Indlægsseddel: Information til brugeren Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning hypromellose Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Viskøse
Indlægsseddel: Information til brugeren. Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder. Latanoprost
 Indlægsseddel: Information til brugeren Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder Latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
Indlægsseddel: Information til brugeren Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder Latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
Indlægsseddel: Information til brugeren. Nevanac 3 mg/ml øjendråber, suspension nepafenac
 Indlægsseddel: Information til brugeren Nevanac 3 mg/ml øjendråber, suspension nepafenac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Nevanac 3 mg/ml øjendråber, suspension nepafenac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Allergodil 0,5 mg/ml øjendråber, opløsning. Azelastinhydrochlorid
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
PRODUKTRESUMÉ. for. Zaditen, øjendråber, opløsning, enkeltdosisbeholder
 18. februar 2015 PRODUKTRESUMÉ for Zaditen, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 20678 1. LÆGEMIDLETS NAVN Zaditen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 0,4 ml indeholder 0,138 mg
18. februar 2015 PRODUKTRESUMÉ for Zaditen, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 20678 1. LÆGEMIDLETS NAVN Zaditen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 0,4 ml indeholder 0,138 mg
PRODUKTRESUMÉ. for. Antistina-Privin, øjendråber, opløsning
 25. marts 2013 PRODUKTRESUMÉ for Antistina-Privin, øjendråber, opløsning 0. D.SP.NR 1222 1. LÆGEMIDLETS NAVN Antistina-Privin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Antazolinsulfat 5 mg/ml + naphazolinnitrat
25. marts 2013 PRODUKTRESUMÉ for Antistina-Privin, øjendråber, opløsning 0. D.SP.NR 1222 1. LÆGEMIDLETS NAVN Antistina-Privin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Antazolinsulfat 5 mg/ml + naphazolinnitrat
Indlægsseddel: Information til brugeren. Maxidex 1 mg/ml, øjendråber, suspension. dexamethason
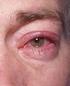 Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. Cyclogyl 1%, øjendråber, opløsning. cyclopentolathydrochlorid
 Indlægsseddel: Information til brugeren Cyclogyl 1%, øjendråber, opløsning cyclopentolathydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Cyclogyl 1%, øjendråber, opløsning cyclopentolathydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren. TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension. tobramycin og dexamethason
 Indlægsseddel: Information til brugeren TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension tobramycin og dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
Indlægsseddel: Information til brugeren TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension tobramycin og dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
PRODUKTRESUMÉ. for. Regaine Forte, kutanopløsning
 28. juni 2007 PRODUKTRESUMÉ for Regaine Forte, kutanopløsning 0. D.SP.NR. 6550 1. LÆGEMIDLETS NAVN Regaine Forte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Minoxidil 50 mg/ml Hjælpestoffer se pkt. 6.1.
28. juni 2007 PRODUKTRESUMÉ for Regaine Forte, kutanopløsning 0. D.SP.NR. 6550 1. LÆGEMIDLETS NAVN Regaine Forte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Minoxidil 50 mg/ml Hjælpestoffer se pkt. 6.1.
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. LÆGEMIDLETS NAVN DuoTrav 40 mikrogram/ml + 5 mg/ml øjendråber, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 40 mikrogram travoprost og 5 mg
BILAG I PRODUKTRESUME 1 1. LÆGEMIDLETS NAVN DuoTrav 40 mikrogram/ml + 5 mg/ml øjendråber, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 40 mikrogram travoprost og 5 mg
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Gripovac 3 injektionsvæske, suspension, til svin. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 2 ml indeholder: Aktive stoffer: Stammer af
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Gripovac 3 injektionsvæske, suspension, til svin. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 2 ml indeholder: Aktive stoffer: Stammer af
Indlægsseddel: Information til brugeren. TRAVATAN 40 mikrogram/ml øjendråber, opløsning Travoprost
 Indlægsseddel: Information til brugeren TRAVATAN 40 mikrogram/ml øjendråber, opløsning Travoprost Læs denne indlægssedlen grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren TRAVATAN 40 mikrogram/ml øjendråber, opløsning Travoprost Læs denne indlægssedlen grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1/19 1. VETERINÆRLÆGEMIDLETS NAVN Eurican Herpes 205 pulver og solvens til injektionsvæske, emulsion. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof 1 dosis á 1 ml indeholder:
BILAG I PRODUKTRESUME 1/19 1. VETERINÆRLÆGEMIDLETS NAVN Eurican Herpes 205 pulver og solvens til injektionsvæske, emulsion. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof 1 dosis á 1 ml indeholder:
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN INCURIN 1 mg tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: estriol 1 mg/tablet Se afsnit 6.1 for en fuldstændig fortegnelse over
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN INCURIN 1 mg tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: estriol 1 mg/tablet Se afsnit 6.1 for en fuldstændig fortegnelse over
PRODUKTRESUMÉ. for. Voltaren Ophtha, øjendråber i enkeltdosisbeholder
 15. april 2013 PRODUKTRESUMÉ for Voltaren Ophtha, øjendråber i enkeltdosisbeholder 0. D.SP.NR. 3588 1. LÆGEMIDLETS NAVN Voltaren Ophtha 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml Voltaren Ophtha indeholder
15. april 2013 PRODUKTRESUMÉ for Voltaren Ophtha, øjendråber i enkeltdosisbeholder 0. D.SP.NR. 3588 1. LÆGEMIDLETS NAVN Voltaren Ophtha 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml Voltaren Ophtha indeholder
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Ingelvac CircoFLEX injektionvæske, suspension til grise 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En dosis à 1 ml inaktiveret vaccine indeholder: Aktivt
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Ingelvac CircoFLEX injektionvæske, suspension til grise 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En dosis à 1 ml inaktiveret vaccine indeholder: Aktivt
Indlægsseddel: Information til brugeren. TRAVATAN 40 mikrogram/ml øjendråber, opløsning Travoprost
 Indlægsseddel: Information til brugeren TRAVATAN 40 mikrogram/ml øjendråber, opløsning Travoprost Læs denne indlægssedlen grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren TRAVATAN 40 mikrogram/ml øjendråber, opløsning Travoprost Læs denne indlægssedlen grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren. Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning. Dexamethasonnatriumphosphat/chloramphenicol
 Indlægsseddel: Information til brugeren Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning Dexamethasonnatriumphosphat/chloramphenicol Læs denne indlægsseddel grundigt, inden du begynder at bruge
Indlægsseddel: Information til brugeren Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning Dexamethasonnatriumphosphat/chloramphenicol Læs denne indlægsseddel grundigt, inden du begynder at bruge
PRODUKTRESUMÉ. for. Terramycin-Polymyxin B, salve
 Produktinformation for Terramycin-Polymyxin B (Oxytetracyclin og Polymyxin B) Salve 30+1 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke Pakningsstørrelse 13 50 46 Salve 30+1 mg/g 15 g Dagsaktuel
Produktinformation for Terramycin-Polymyxin B (Oxytetracyclin og Polymyxin B) Salve 30+1 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke Pakningsstørrelse 13 50 46 Salve 30+1 mg/g 15 g Dagsaktuel
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Porcilis PCV, injektionsvæske, emulsion til svin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis af 2 ml indeholder: Aktivt stof Porcint circovirus
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Porcilis PCV, injektionsvæske, emulsion til svin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis af 2 ml indeholder: Aktivt stof Porcint circovirus
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Purevax Rabies, injektionsvæske, suspension. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 1 ml indeholder: Aktivt stof: Rabies rekombinant
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Purevax Rabies, injektionsvæske, suspension. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 1 ml indeholder: Aktivt stof: Rabies rekombinant
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Iopidine øjendråber, opløsning 5 mg/ml Apraclonidin (som hydrochlorid)
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Iopidine øjendråber, opløsning 5 mg/ml Apraclonidin (som hydrochlorid) Læs denne indlægsseddel grundigt, inden du begynder at bruge medicinen.gem indlægssedlen.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Iopidine øjendråber, opløsning 5 mg/ml Apraclonidin (som hydrochlorid) Læs denne indlægsseddel grundigt, inden du begynder at bruge medicinen.gem indlægssedlen.
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Hydrocortison med Terramycin og Polymyxin B 15 mg/ml / 5 mg/ml / 1 mg/ml Øjen- og øredråber, suspension hydrocortisonacetat/oxytetracyclinhydrochlorid/polymyxin
Indlægsseddel: Information til brugeren Hydrocortison med Terramycin og Polymyxin B 15 mg/ml / 5 mg/ml / 1 mg/ml Øjen- og øredråber, suspension hydrocortisonacetat/oxytetracyclinhydrochlorid/polymyxin
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Nobivac Myxo-RHD lyofilisat og solvens til injektionsvæske, suspension til kaniner 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis rekonstitueret
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Nobivac Myxo-RHD lyofilisat og solvens til injektionsvæske, suspension til kaniner 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis rekonstitueret
BILAG I PRODUKTRESUME. Medicinal product no longer authorised
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Nobivac Piro lyofilisat og solvens til injektionsvæske, suspension til hunde 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Pr. 1 ml dosis: Aktivt stof
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Nobivac Piro lyofilisat og solvens til injektionsvæske, suspension til hunde 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Pr. 1 ml dosis: Aktivt stof
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Isotrex 0,05 % gel Isotretinoin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Gem indlægssedlen.
Indlægsseddel: Information til brugeren Isotrex 0,05 % gel Isotretinoin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Gem indlægssedlen.
Indlægsseddel: Information til brugeren. Maxidex 1 mg/ml, øjendråber, suspension. dexamethason
 Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
BILAG I PRODUKTRESUMÉ
 BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN TRAVATAN 40 mikrogram/ml øjendråber, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml opløsning indeholder 40 mikrogram travoprost. Hjælpestoffer,
BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN TRAVATAN 40 mikrogram/ml øjendråber, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml opløsning indeholder 40 mikrogram travoprost. Hjælpestoffer,
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. LÆGEMIDLETS NAVN AZOPT 10 mg/ml, øjendråber, suspension 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Brinzolamid 10 mg/ml Hjælpestoffer er anført under pkt. 6.1. 3. LÆGEMIDDELFORM
BILAG I PRODUKTRESUME 1 1. LÆGEMIDLETS NAVN AZOPT 10 mg/ml, øjendråber, suspension 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Brinzolamid 10 mg/ml Hjælpestoffer er anført under pkt. 6.1. 3. LÆGEMIDDELFORM
Indlægsseddel: Information til brugeren. Betnovat 1 mg/ml kutanopløsning Betamethason
 Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
PRODUKTRESUMÉ. for. Urilin, syrup
 21. juni 2011 PRODUKTRESUMÉ for Urilin, syrup 0. D.SP.NR 27072 1. VETERINÆRLÆGEMIDLETS NAVN Urilin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Phenylpropanolamin 40,29 mg (svarende
21. juni 2011 PRODUKTRESUMÉ for Urilin, syrup 0. D.SP.NR 27072 1. VETERINÆRLÆGEMIDLETS NAVN Urilin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Phenylpropanolamin 40,29 mg (svarende
PRODUKTRESUMÉ. for. Strepsils Citrus Sukkerfri, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils Citrus Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Citrus Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4-diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils Citrus Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Citrus Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4-diklorbenzylalkohol
INDLÆGSSEDDEL : INFORMATION TIL BRUGEREN. Redap 1 mg/g gel. Adapalen
 INDLÆGSSEDDEL : INFORMATION TIL BRUGEREN Redap 1 mg/g gel Adapalen Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. - Gem indlægssedlen.
INDLÆGSSEDDEL : INFORMATION TIL BRUGEREN Redap 1 mg/g gel Adapalen Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. - Gem indlægssedlen.
PRODUKTRESUMÉ. for. Kelactin Vet., oral opløsning
 4. maj 2015 PRODUKTRESUMÉ for Kelactin Vet., oral opløsning 0. D.SP.NR 27896 1. VETERINÆRLÆGEMIDLETS NAVN Kelactin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml af produktet indeholder: Aktivt stof:
4. maj 2015 PRODUKTRESUMÉ for Kelactin Vet., oral opløsning 0. D.SP.NR 27896 1. VETERINÆRLÆGEMIDLETS NAVN Kelactin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml af produktet indeholder: Aktivt stof:
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Allergodil 0,5 mg/ml øjendråber, opløsning. Azelastinhydrochlorid
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Allergodil uden
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Allergodil uden
Indlægsseddel: Information til brugeren. Dalacin. 10 mg/ ml kutanopløsning Til udvortes brug clindamycinphosphat
 Indlægsseddel: Information til brugeren Dalacin 10 mg/ ml kutanopløsning Til udvortes brug clindamycinphosphat Læs denne indlægsseddel grundigt, inden De begynder at bruge dette lægemiddel, da den indeholder
Indlægsseddel: Information til brugeren Dalacin 10 mg/ ml kutanopløsning Til udvortes brug clindamycinphosphat Læs denne indlægsseddel grundigt, inden De begynder at bruge dette lægemiddel, da den indeholder
PRODUKTRESUMÉ. for. Otrivin ukonserveret, næsespray, opløsning
 13. januar 2014 PRODUKTRESUMÉ for Otrivin ukonserveret, næsespray, opløsning 0. D.SP.NR. 2164 1. LÆGEMIDLETS NAVN Otrivin ukonserveret 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Xylometazolinhydrochlorid
13. januar 2014 PRODUKTRESUMÉ for Otrivin ukonserveret, næsespray, opløsning 0. D.SP.NR. 2164 1. LÆGEMIDLETS NAVN Otrivin ukonserveret 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Xylometazolinhydrochlorid
Øjenvipper, medicinsk behandling
 rev. nov. 2018 - næste rev. nov. 2020 Kraftigere, længere, tættere og mørkere ved medicinsk behandling Baggrund Bimatoprost øjendråber 0,03% er et receptpligtigt præparat til behandling af grøn stær. Det
rev. nov. 2018 - næste rev. nov. 2020 Kraftigere, længere, tættere og mørkere ved medicinsk behandling Baggrund Bimatoprost øjendråber 0,03% er et receptpligtigt præparat til behandling af grøn stær. Det
PRODUKTRESUMÉ. for. Voltabak, øjendråber, opløsning
 22. februar 2013 PRODUKTRESUMÉ for Voltabak, øjendråber, opløsning 0. D.SP.NR. 27464 1. LÆGEMIDLETS NAVN Voltabak 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diclofenacnatrium 1 mg/ml Hjælpestof: Polyoxyleret
22. februar 2013 PRODUKTRESUMÉ for Voltabak, øjendråber, opløsning 0. D.SP.NR. 27464 1. LÆGEMIDLETS NAVN Voltabak 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diclofenacnatrium 1 mg/ml Hjælpestof: Polyoxyleret
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Nobivac L4, injektionsvæske, suspension til hunde 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis af 1 ml indeholder: Aktive stoffer: Inaktiveret
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Nobivac L4, injektionsvæske, suspension til hunde 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver dosis af 1 ml indeholder: Aktive stoffer: Inaktiveret
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Zymelin menthol ukonserveret 1 mg/ml næsespray, opløsning Xylometazolinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Zymelin menthol ukonserveret 1 mg/ml næsespray, opløsning Xylometazolinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Syntocinon, næsespray, opløsning 6,7 mikrogram/dosis oxytocin
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Syntocinon, næsespray, opløsning 6,7 mikrogram/dosis oxytocin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Syntocinon, næsespray, opløsning 6,7 mikrogram/dosis oxytocin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Terramycin-Polymyxin B, øjensalve
 25. november 2011 PRODUKTRESUMÉ for Terramycin-Polymyxin B, øjensalve 0. D.SP.NR. 0071 1. LÆGEMIDLETS NAVN Terramycin-Polymyxin B 2. KVALITATIV OG KAVNTITATIV SAMMENSÆTNING Oxytetracyclin 5 mg/g som oxytetracyclinhydrochlorid
25. november 2011 PRODUKTRESUMÉ for Terramycin-Polymyxin B, øjensalve 0. D.SP.NR. 0071 1. LÆGEMIDLETS NAVN Terramycin-Polymyxin B 2. KVALITATIV OG KAVNTITATIV SAMMENSÆTNING Oxytetracyclin 5 mg/g som oxytetracyclinhydrochlorid
Zovir 5 % creme Aciclovir
 11. november 2016 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
11. november 2016 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
BILAG I PRODUKTRESUMÉ
 BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN IZBA 30 mikrogram/ml øjendråber, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 30 mikrogram travoprost. Hjælpestoffer med kendt
BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN IZBA 30 mikrogram/ml øjendråber, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 30 mikrogram travoprost. Hjælpestoffer med kendt
PRODUKTRESUMÉ. for. Strepsils Jordbær Sukkerfri, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils Jordbær Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Jordbær Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils Jordbær Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Jordbær Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat
 Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Tag altid
Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Tag altid
PRODUKTRESUMÉ. for. Zovir, creme 5%, 2 g
 15. september 2014 PRODUKTRESUMÉ for Zovir, creme 5%, 2 g 0. D.SP.NR 8902 1. LÆGEMIDLETS NAVN Zovir 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aciclovir 50 mg/g Hjælpestoffer er anført under pkt. 6.1.
15. september 2014 PRODUKTRESUMÉ for Zovir, creme 5%, 2 g 0. D.SP.NR 8902 1. LÆGEMIDLETS NAVN Zovir 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aciclovir 50 mg/g Hjælpestoffer er anført under pkt. 6.1.
Øjenvipper, medicinsk behandling
 rev. jan. 2017 - næste rev. jan. 2019 Kraftigere, længere, tættere og mørkere ved medicinsk behandling Baggrund Bimatoprost øjendråber 0,03% er et receptpligtigt præparat til behandling af grøn stær. Det
rev. jan. 2017 - næste rev. jan. 2019 Kraftigere, længere, tættere og mørkere ved medicinsk behandling Baggrund Bimatoprost øjendråber 0,03% er et receptpligtigt præparat til behandling af grøn stær. Det
Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste.
 1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Wartec 5 mg/ml kutanopløsning Podophyllotoxin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Wartec 5 mg/ml kutanopløsning Podophyllotoxin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Acular 5 mg/ml, øjendråber, opløsning. Ketorolactrometamol
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Acular 5 mg/ml, øjendråber, opløsning Ketorolactrometamol Læs denne indlægsseddel grundigt, inden De begynder at bruge medicinen. Gem indlægssedlen. De kan få brug
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Acular 5 mg/ml, øjendråber, opløsning Ketorolactrometamol Læs denne indlægsseddel grundigt, inden De begynder at bruge medicinen. Gem indlægssedlen. De kan få brug
INDLÆGSSEDEL: INFORMATION TIL BRUGEREN Finacea 15% Gel Azelainsyre
 INDLÆGSSEDEL: INFORMATION TIL BRUGEREN Finacea 15% Gel Azelainsyre Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger Gem indlægssedlen.
INDLÆGSSEDEL: INFORMATION TIL BRUGEREN Finacea 15% Gel Azelainsyre Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger Gem indlægssedlen.
Indlægsseddel. Information til brugeren
 Indlægsseddel Information til brugeren Sebiprox 1,5 % shampoo Ciclopiroxolamin Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Sebiprox uden recept. For at opnå den bedste
Indlægsseddel Information til brugeren Sebiprox 1,5 % shampoo Ciclopiroxolamin Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Sebiprox uden recept. For at opnå den bedste
PRODUKTRESUMÉ. for. Hyobac App 2 Vet., injektionsvæske, emulsion. Actinobacillus pleuropneumoniae, serotype 2, RP > 1*
 10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
PRODUKTRESUMÉ. for. Sofradex, øjen- og øredråber, opløsning (2care4)
 28. november 2012 PRODUKTRESUMÉ for Sofradex, øjen- og øredråber, opløsning (2care4) 0. D.SP.NR. 2508 1. LÆGEMIDLETS NAVN Sofradex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dexamethason 0,5 mg/ml som
28. november 2012 PRODUKTRESUMÉ for Sofradex, øjen- og øredråber, opløsning (2care4) 0. D.SP.NR. 2508 1. LÆGEMIDLETS NAVN Sofradex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dexamethason 0,5 mg/ml som
PRODUKTRESUMÉ. for. Dulcolax, suppositorier
 10. januar 2011 PRODUKTRESUMÉ for Dulcolax, suppositorier 0. D.SP.NR. 1603 1. LÆGEMIDLETS NAVN Dulcolax 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Bisacodyl 10 mg Hjælpestoffer er anført under pkt. 6.1.
10. januar 2011 PRODUKTRESUMÉ for Dulcolax, suppositorier 0. D.SP.NR. 1603 1. LÆGEMIDLETS NAVN Dulcolax 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Bisacodyl 10 mg Hjælpestoffer er anført under pkt. 6.1.
Indlægsseddel: Information til brugeren. Cilodex 3 mg/ml / 1 mg/ml øredråber, suspension. ciprofloxacin / dexamethason
 Indlægsseddel: Information til brugeren Cilodex 3 mg/ml / 1 mg/ml øredråber, suspension ciprofloxacin / dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
Indlægsseddel: Information til brugeren Cilodex 3 mg/ml / 1 mg/ml øredråber, suspension ciprofloxacin / dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
Ketoconazole Shampoo "Actavis" 2 %
 Indlægsseddel: Information til brugeren Ketoconazole Shampoo "Actavis" 2 % shampoo 20 mg/g ketoconazol Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Ketoconazole Shampoo "Actavis" 2 % shampoo 20 mg/g ketoconazol Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Riprazo 300 mg filmovertrukne tabletter Aliskiren
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Riprazo 300 mg filmovertrukne tabletter Aliskiren Læs denne indlægsseddel grundigt inden du begynder at tage medicinen. - Gem indlægssedlen. Du kan få brug for at
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Riprazo 300 mg filmovertrukne tabletter Aliskiren Læs denne indlægsseddel grundigt inden du begynder at tage medicinen. - Gem indlægssedlen. Du kan få brug for at
BILAG 1 PRODUKTRESUMÉ
 BILAG 1 PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN EMADINE 0,5 mg/ml, Øjendråber, opløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 0,5 mg/ml emedastin (som difumarat). Hjælpestof,
BILAG 1 PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN EMADINE 0,5 mg/ml, Øjendråber, opløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 0,5 mg/ml emedastin (som difumarat). Hjælpestof,
Indlægsseddel: Information til brugeren. Nix 5 %, creme permethrin
 Indlægsseddel: Information til brugeren Nix 5 %, creme permethrin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Brug altid Nix nøjagtigt
Indlægsseddel: Information til brugeren Nix 5 %, creme permethrin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Brug altid Nix nøjagtigt
PRODUKTRESUMÉ. for. Uniferon, injektionsvæske, opløsning, beregnet til pattegrise
 9. april 2015 PRODUKTRESUMÉ for Uniferon, injektionsvæske, opløsning, beregnet til pattegrise 0. D.SP.NR 08324 1. VETERINÆRLÆGEMIDLETS NAVN Uniferon 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
9. april 2015 PRODUKTRESUMÉ for Uniferon, injektionsvæske, opløsning, beregnet til pattegrise 0. D.SP.NR 08324 1. VETERINÆRLÆGEMIDLETS NAVN Uniferon 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Panacur AquaSol 200 mg/ml, oral suspension til brug i drikkevand, til svin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder : Aktivt stof:
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Panacur AquaSol 200 mg/ml, oral suspension til brug i drikkevand, til svin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder : Aktivt stof:
IOPIDINE 1%w/v Øjendråber, opløsning (Apraclonidin Hydrochlorid)
 Indlægsseddel: Information til brugeren IOPIDINE 1%w/v Øjendråber, opløsning (Apraclonidin Hydrochlorid) Læs denne information grundigt, inden du begynder at bruge medicinen Gem indlægssedlen. Du kan få
Indlægsseddel: Information til brugeren IOPIDINE 1%w/v Øjendråber, opløsning (Apraclonidin Hydrochlorid) Læs denne information grundigt, inden du begynder at bruge medicinen Gem indlægssedlen. Du kan få
