PRODUKTRESUMÉ. for. Monoprost, øjendråber, opløsning, enkeltdosisbeholder
|
|
|
- Oscar Marcussen
- 10 år siden
- Visninger:
Transkript
1 10. november 2014 PRODUKTRESUMÉ for Monoprost, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR LÆGEMIDLETS NAVN Monoprost 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning indeholder 50 mikrogram latanoprost. Én øjendråbe indeholder cirka 1,5 mikrogram latanoprost. Hjælpestof, som behandleren skal være opmærksom på: 1 ml øjendråber, opløsning indeholder 50 mg macrogolglycerolhydroxystearat 40 (ricinusolie, hydrogeneret, polyoxyleret). Alle hjælpestoffer er anført under pkt LÆGEMIDDELFORM Øjendråber, opløsning i enkeltdosisbeholder. Opløsningen er en svagt gul og opalescerende opløsning. ph-værdi: 6,5 7,5 Osmolalitet: mosmol/kg. 4. KLINISKE OPLYSNINGER 4.1 Terapeutiske indikationer Reduktion af forhøjet intraokulært tryk hos patienter med åben-vinkel glaukom og okulær hypertension. 4.2 Dosering og indgivelsesmåde Dosering Anbefalet dosering til voksne (inklusive ældre): Anbefalet behandling er én dråbe i det/de angrebne øje/øjne én gang dagligt. Optimal virkning opnås, hvis Monoprost administreres om aftenen. Monoprost bør kun doseres en gang dagligt, da det er vist, at hyppigere administration mindsker den intraokulære trykreducerende virkning. Hvis en dosis springes over, bør behandlingen fortsættes med næste dosis som normalt. Monoprost,+øjendråber,+opløsning,+enkeltdosisbeholder+50+mikg-ml.docx Side 1 af 10
2 Pædiatrisk population: Der foreligger ingen data for Monoprost-formuleringen. Administration Okulær anvendelse. Ligesom med andre øjendråber anbefales det at sammenpresse tåresækken ved den mediale øjenkrog (punktlig okklusion) i et minut for at mindske muligheden for systemisk absorption. Dette bør gøres umiddelbart efter inddrypning af hver øjendråbe. Kontaktlinser bør fjernes, inden drypning med øjendråberne, og kan genindsættes 15 minutter efter drypning. Såfremt der anvendes mere end et topikalt øjenmiddel, bør lægemidlerne administreres med mindst 5 minutters mellemrum. En enkeltdosisbeholder indeholder nok øjendråber til behandling af begge øjne. Kun til engangsbrug. Dette lægemiddel en steril opløsning, som ikke indeholder konserveringsmidler. Opløsningen i én enkeltdosisbeholder skal anvendes umiddelbart efter anbrud til administration i det/de berørte øje/øjne. Da sterilitet ikke kan opretholdes, efter at den enkelte enkeltdosisbeholder er anbrudt, skal restindhold bortskaffes umiddelbart efter administration. Patienter bør instrueres i: at undgå konktakt mellem flaskens spids og øjet eller øjenlåget at anvende opløsningen med øjendråber umiddelbart efter første anbrud af enkeltdosisbeholderen og at bortskaffe enkeltdosisbeholderen efter brug. 4.3 Kontraindikationer Overfølsomhed over for det det aktive stof eller over for et eller flere af hjælpestofferne anført i pkt Særlige advarsler og forsigtighedsregler vedrørende brugen Latanoprost kan gradvist ændre øjenfarven ved at øge mængden af brunt pigment i iris. Før behandling indledes, bør patienten oplyses om risikoen for permanent ændring af øjenfarven. Unilateral behandling kan resultere i permanent heterochromi. Ændringen i øjenfarven er overvejende set hos patienter med blandet farvning af iris, f.eks. blå-brun, grå-brun, gul-brun og grøn-brun. I studier med latanoprost ses ændringen sædvanligvis i de første 8 måneder af behandlingen, sjældent ved behandlingen igennem to og tre år og er ikke set efter fjerde års behandling. Hastigheden hvormed irispigmenteringen sker aftager med tiden og er stabil i fem år. Effekten på øget irispigmentering er ikke evalueret efter mere end fem års behandling. I et åbent 5-års sikkerhedsstudie med latanoprost udviklede 33% af patienterne irispigmentering (se pkt. 4.8). Farveændringen af iris er i størstedelen af tilfældene svag, og ofte kan den ikke ses klinisk. Hyppigheden hos patienter med blandet farvning af iris ligger mellem 7% og 85% med den største hyppighed ved gul-brun iris. Hos patienter med homogene blå øjne er der ikke set ændringer, og hos patienter med homogene grå, grønne eller brune øjne er ændringen kun sjældent set. Farveændringen skyldes øget melaninindhold i stroma melanocytterne i iris, og ikke en stigning i antallet af melanocytter. Den brune pigmentering breder sig typisk koncentrisk omkring pupillen mod periferien af det behandlede øje, men hele iris eller dele af denne kan blive mere brunlig. Der er ikke iagttaget yderligere stigning af brunt pigment i iris efter Monoprost,+øjendråber,+opløsning,+enkeltdosisbeholder+50+mikg-ml.docx Side 2 af 10
3 seponering af behandlingen. I de kliniske afprøvninger har den indtil nu ikke været forbundet med symptomer eller patologiske ændringer. Hverken naevi eller pletter på iris er blevet påvirket af behandling. Akkumulation af pigment i trabekelværket eller andetsteds i forkammeret er ikke iagttaget i kliniske afprøvninger. Øget irispigmentering har efter 5 års klinisk erfaring ikke vist sig at have negative kliniske følger, og behandling med latanoprost kan fortsætte selv om der opstår irispigmentering. Patienterne bør dog undersøges regelmæssigt, og hvis den kliniske situation berettiger det, kan latanoprost behandlingen seponeres. Der er begrænset klinisk erfaring med latanoprost ved kronisk lukket-vinkel glaukom, åben-vinkel glaukom hos pseudophakiske patienter og ved pigmentglaukom. Der er ingen erfaring med latanoprost ved inflammatorisk og neovaskulært glaukom, inflammatoriske øjenlidelser og medfødt glaukom. Latanoprost har ingen eller kun ringe virkning på pupillen, men der er ingen erfaring ved akutte anfald af lukket-vinkel glaukom. Det anbefales derfor, at latanoprost bruges med forsigtighed ved disse tilstande, indtil mere erfaring er opnået. Der er begrænsede forsøgsdata for brug af latanoprost i den peri-operative periode ved katarakt operation. Latanoprost bør anvendes med forsigtighed til disse patienter. Latanoprost bør anvendes med forsigtighed til patienter med herpetisk keratitis i anamnesen og bør undgås i tilfælde af aktiv herpes simplex keratitis og hos patienter med tidligere tilbagevendende herpetisk keratitis specifikt forbundet med prostaglandinanaloger. Der er rapporteret om maculaødem (se pkt. 4.8) især hos aphakiske patienter, pseudophakiske patienter med iturevet bageste linsekapsel eller med forkammerlinser, samt til patienter med kendt risiko for cystoidt maculaødem (så som diabetes retinopati og retinalvene okklusion). Latanoprost bør anvendes med forsigtighed til aphakiske patienter, til pseudophagiske patienter med iturevet linsekapsel eller forkammerlinse, samt til patienter med kendt risiko for cystoidt maculaødem. Hos prædisponerede patienter med kendte risikofaktorer for iritis/uveitis kan latanoprost anvendes med forsigtighed. Der er begrænset erfaring med patienter med astma, men der er efter markedsføring rapporteret tilfælde af forværring af astma og/eller dyspnø. Astmapatienter bør derfor behandles med forsigtighed, indtil der er opnået tilstrækkelig erfaring, se også pkt Der er set periorbital misfarvning af huden, hvor hovedparten af tilfældene stammer fra japanske patienter. Den hidtidige erfaring viser, at periorbital misfarvning af huden ikke er permanent og har i nogle tilfælde været reversibel ved fortsat behandling med latanoprost. Latanoprost kan gradvis ændre øjenvipper og vellushår ved det behandlede øje og dets omgivelser. Disse ændringer omfatter øget længde, tykkelse og pigmentering, øget antal øjenvipper eller hår og øjenvipper, som vokser i forkert retning. Ændringer i øjenvipper forsvinder efter ophør af behandling. Monoprost indeholder macrogolglycerolhydroxystearat (ricinusolie, hydrogeneret, polyoxyleret) som kan medføre hudreaktioner. På nuværende tidspunkt er sikkerhedsdata fra langtidsstudier for dette hjælpestof ikke tilgængelige. Monoprost,+øjendråber,+opløsning,+enkeltdosisbeholder+50+mikg-ml.docx Side 3 af 10
4 4.5 Interaktion med andre lægemidler og andre former for interaktion Definitive data vedrørende lægemiddelinteraktion er ikke tilgængelige. Der er rapporteret paradoksale stigninger i det intraokulære tryk efter samtidig oftalmisk brug af to prostaglandinanaloger. Det frarådes derfor at bruge to eller flere prostaglandiner, prostaglandinanaloger eller prostaglandinderivater samtidigt. 4.6 Graviditet og amning Graviditet Sikkerheden ved brug af dette lægemiddel under graviditet er ikke fastslået. Latanoprost har potentielt skadelige farmakologiske virkninger med hensyn til graviditetsforløb, det ufødte eller det nyfødte barn. Monoprost bør derfor ikke anvendes under graviditet. Amning Latanoprost og dets metabolitter kan passere over i modermælken og Monoprost bør derfor ikke anvendes af ammende kvinder eller amningen bør ophøre. Fertilitet Dyrestudier med latanoprost har ikke vist påvirkning af fertilitet hos hverken mænd eller kvinder (se pkt. 5.3). 4.7 Virkninger på evnen til at føre motorkøretøj eller betjene maskiner Ikke mærkning. Der er ikke udført studier af dette lægemiddel med hensyn til evnen til at føre motorkøretøj. Som ved andre øjenpræparater kan inddrypning af øjendråber forårsage forbigående sløring af synet. Patienten bør ikke færdes i trafikken eller betjene maskiner før synet atter er normalt. 4.8 Bivirkninger Størstedelen af bivirkningerne er relateret til øjnene. I et åbent 5-års sikkerhedsforsøg med latanoprost udviklede 33 % af patienterne irispigmentering (se pkt. 4.4). Øvrige øjenbivirkninger er generelt forbigående og forekommer i forbindelse med drypning. Bivirkninger og deres hyppigheder angivet nedenfor, er dem der er beskrevet for referenceproduktet. Bivirkningerne er anført efter følgende hyppighed: meget almindelig ( 1/10), almindelig ( 1/100 til <1/10), ikke almindelig ( 1/1000 til <1/100), sjælden ( 1/ til <1/1.000) og meget sjælden (<1/10.000), ikke kendt (kan ikke estimeres ud fra forhåndenværende data). Infektioner og parasitære sygdomme Ikke kendt: herpetisk keratitis Øjne: Meget almindelig: Øget irispigmentering; let til moderat konjunktival hyperæmi; øjenirritation (brændende fornemmelse, kløe, svien og fremmedlegemefornemmelse ); ændring af øjenvipper og vellushår (øget længde, tykkelse, pigmentering og antal) (langt størstedelen er indberetninger fra den japanske population). Monoprost,+øjendråber,+opløsning,+enkeltdosisbeholder+50+mikg-ml.docx Side 4 af 10
5 Almindelig: Forbigående punktformig erosion af epitelet uden symptomer hos de fleste; blefaritis, øjensmerter; Ikke almindelig: Øjenlågsødem, tørre øjne, keratitis, sløret syn og konjunktivitis. Sjælden: Iritis/uveitis (især rapporteret hos patienter med samtidige prædisponerende faktorer); maculaødem; symptomgivende ødemer og erosioner i cornea; periorbitalt ødem; øjenvipper, der vender forkert, der sommetider kan give øjenirritation; ekstra række af øjenhår ved de meibomske kirtlers åbning (distichiasis), fotofobi. Meget sjældne: Periorbitale og øjenlågsforandringer, der medfører mere udtalt øjenlågs sulcus. Ikke kendt: Iriscyste. Nervesystemet: Ikke kendt: Hovedpine, svimmelhed. Hjerte: Meget sjælden: Forværring af angina pectoris hos patienter med forudgående sygdom. Ikke kendt: Palpitationer. Luftveje, thorax og mediastinum: Sjældne: Astma, astma eksacerbation og dyspnø. Hud og subkutane væv: Ikke almindelig: Hududslæt. Sjælden: Lokal hudirritation på øjenlågene, mørkfarvning af øjenlågshuden. Knogler, led, muskler og bindevæv: Ikke kendt: Muskelsmerter, ledsmerter. Almene symptomer og reaktioner på administrationsstedet: Meget sjælden: Brystsmerter. Det er væsentligt, at vi får information om bivirkninger. Det tillader en fortsat overvågning af risk / benefit af lægemidlet. Både sundhedsfagligt personale og medicinbrugere/pårørende kan melde bivirkninger direkte til Sundhedsstyrelsen. Sundhedsstyrelsen Axel Heides Gade 1 DK-2300 København S Websted: [email protected] 4.9 Overdosering Bortset fra okulær irritation og konjunktival hyperæmi kendes ingen andre okulære bivirkninger ved overdosering af Monoprost. Hvis Monoprost indtages utilsigtet kan følgende information være nyttig: én enkeltdosisbeholder indeholder 10 mikrogram latanoprost. Mere end 90 % metaboliseres Monoprost,+øjendråber,+opløsning,+enkeltdosisbeholder+50+mikg-ml.docx Side 5 af 10
6 ved firstpass metabolisme i leveren. Intravenøs infusion af 3 mikrogram/kg til raske frivillige resulterede i en gennemsnitlig plasmakoncentration, som var 200 gange højere end ved klinisk behandling og gav ingen symptomer, men en dosis på 5,5-10 mikrogram/kg forårsagede kvalme, abdominale smerter, svimmelhed, træthed, hedeture og svedtendens. Latanoprost er blevet infunderet intravenøst hos aber i doser op til 500 mikrogram/kg uden større virkning på det kardiovaskulære system. Intravenøs administration af latanoprost til aber har været forbundet med forbigående bronkokonstriktion. Bronkokonstriktion blev imidlertid ikke induceret af latanoprost hos patienter med moderat bronkial astma, når det er blevet givet lokalt i øjnene i doser der var 7 gange den kliniske dosis af Monoprost. Behandlingen bør være symptomatisk, hvis der forekommer en overdosis med Monoprost Udlevering B 5. FARMAKOLOGISKE EGENSKABER 5.0 Terapeutisk klassifikation ATC-kode: S01EE01. Antiglaukommidler og miotika; prostaglandinanaloger. 5.1 Farmakodynamiske egenskaber Virkningsmekanisme: Den aktive substans latanoprost, en prostagladin F 2α analog, er en selektiv prostanoid FP receptoragonist, som reducerer det intraokulære tryk ved at øge kammervandsafløbet. Studier med dyr og mennesker tyder på, at den væsentligste virkningsmekanisme er øget uveoscleralt afløb, selvom der er rapporteret en vis øgning i afløbskapaciteten (reduktion af afløbsmodstand) hos mennesker. Farmakodynamisk virkning: Reduktion af det intraokulære tryk hos mennesker indsætter ca. 3-4 timer efter administration, og maksimal virkning nås efter 8-12 timer. Trykreduktion opretholdes i mindst 24 timer. Pivotale studier har vist, at latanoprost er effektiv som monoterapi. Der er endvidere udført kliniske forsøg med kombinationsbehandling. Disse omfatter forsøg som viser, at latanoprost er effektivt i kombination med beta-adrenerge antagonister (timolol). Korttidsstudier (1 eller 2 uger) tyder på, at latanoprosts virkning er additiv ved kombination med adrenerge agonister (dipivalyl epinephrin), orale carboanhydrase hæmmere (acetazolamid) og i hvert fald delvis additiv med kolinerge agonister (pilocarpin). Kliniske afprøvninger har vist, at latanoprost ikke har signifikant virkning på produktionen af kammervand. Latanoprost har ikke vist sig at have nogen virkning på blodkammervands-barrieren. Monoprost,+øjendråber,+opløsning,+enkeltdosisbeholder+50+mikg-ml.docx Side 6 af 10
7 Latanoprost har ingen eller kun ubetydelig virkning på den intraokulære blodcirkulation, når det anvendes i kliniske doser hos aber. Let til moderat konjunktival eller episcleral hyperæmi kan imidlertid opstå under lokal behandling. Kronisk behandling med latanoprost af abeøjne, der har gennemgået ekstrakapsulær linseekstraktion, påvirkede ikke blodkarrene i retina. Dette blev påvist ved fluorescein angiografi. Latanoprost har ikke induceret fluorescein lækage i det bageste kammer i pseudophakiske humane øjne efter korttidsbehandling. Latanoprost i kliniske doser har ikke vist nogen signifikant farmakologisk virkning på det kardiovaskulære system eller respirationssystemet. Klinisk virkning og sikkerhed: Monoprost blev evalueret i et 3-måneders, randomiseret, investigator-maskeret studie, der sammenlignede ikke-konserverede Monoprost med det konserverede referenceprodukt, latanoprost 0,005% hos 404 patienter med okulær hypertension eller glaukom. Den primære effektparameter var ændring i intraokulært tryk mellem baseline og dag 84. På dag 84 var den intraokulære trykreduktion, induceret af Monoprost, på -8,6 mmhg dvs. -36%. Det svarede til resultatet for det konserverede referenceprodukt, latanoprost 0,005%. Mest berørte øje (mitt population) Baseline (D0) D84 Gennemsnitlig ændring (D0 D84) Statistisk analyse n Gnsn. ± SD n Gnsn. ± SD n Gnsn. ± SD [95% CI] E (SE) [95%CI] Monoprost ,1 ± 1, ,4 ± 2, ,6 ± 2,6 [-9,0 ; -8,3] 0,417 ± 0,215 [-0,006; 0,840] Referenceprodukt ,0 ± 1, ,0 ± 2, ,0 ± 2,4 [-9,4 ; -8,7] Dette 3-måneders studie viste de følgende bivirkninger for henholdsvis Monoprost og latanoprost referenceproduktet: irritation/brænden/svien ikke efter instillation (på dag 84, 6,8% for Monoprost og 12,9 % for latanoprost referenceprodukt) og konjunktival hyperæmi (på dag 84, 21,4% for Monoprost og 29,1% for latanoprost referenceprodukt). Med hensyn til systemiske bivirkninger, blev der ikke observeret store forskelle mellem de to behandlingsgrupper. 5.2 Farmakokinetiske egenskaber Latanoprost (mw 432,58) er et isopropylester prodrug, som i sig selv er inaktivt, men som efter hydrolyse til latanoprostsyre bliver biologisk aktiv. Absorption Prodrug absorberes godt gennem cornea, og alt stof, der passerer over i kammervandet, hydrolyseres ved passagen gennem cornea. Monoprost,+øjendråber,+opløsning,+enkeltdosisbeholder+50+mikg-ml.docx Side 7 af 10
8 Distribution Studier med mennesker tyder på, at maksimal koncentration i kammervandet nås ca. 2 timer efter topikal administration. Efter topikal applikation hos aber fordeles latanoprost primært i forreste kammer, bindehinder og øjenlåg. Kun ubetydelige mængder af stoffet når bageste kammer. I et tre-måneders, cross-over, randomiseret, pilot-studie med 30 patienter med hypertension eller glaukom blev plasmaniveauet af latanoprost målt og 30 minutter efter instillation, sås der hos næsten alle patienter værdier, som var under LOQ (40 pg/ml). Biotransformation og elimination Der er stort set ingen metabolisme af latanoprostsyre i øjet. Hovedmetabolismen finder sted i leveren. Plasmahalveringstiden er 17 minutter hos mennesker. Hovedmetabolitterne, 1,2-dinor og 1,2,3,4-tetranor metabolitterne udviser ingen eller kun svag biologisk aktivitet i dyrestudier og udskilles primært i urinen. 5.3 Prækliniske sikkerhedsdata Latanoprosts okulære såvel som systemiske toksicitet er undersøgt hos adskillige dyrearter. Generelt tåles latanoprost godt med en sikkerhedsmargen mellem klinisk okulær dosis og systemisk toksicitet på mindst 1000 gange. Høje latanoprostdoser, ca. 100 gange klinisk dosis/kg legemsvægt administreret intravenøst til ikke-bedøvede aber øger respirationsfrekvensen, sandsynligvis pga. kortvarig bronkokonstriktion. Latanoprost har ikke vist sig at have allergene egenskaber i dyrestudier. Der er ikke påvist toksiske virkninger i øjet ved doser op til 100 mikrogram/øje/dag hos kaniner eller aber (klinisk dosis er ca. 1,5 mikrogram/øje/dag). Latanoprost forårsager imidlertid øget pigmentering af iris hos aber. Mekanismen for øget pigmentering er tilsyneladende stimulation af melaninproduktionen i melanocytterne i iris, uden at der er iagttaget nogen proliferative ændringer. Farveændringen af iris kan være permanent. Kroniske okulære toksicitetsstudier viser, at administration af latanoprost 6 mikrogram/øje/dag forårsager øget palpebral fissur. Denne virkning er reversibel og opstår ved doser over klinisk niveau. Denne effekt er ikke set hos mennesker. Latanoprost er fundet negativ i revers mutationstests med bakterier, genmutation i muselymfomer og muse-mikronucleus test. Kromosom-ændringer er iagttaget in vitro med humane lymfocytter. Lignende virkninger er iagttaget med prostagladin F 2α, et naturligt forekommende prostaglandin, hvilket tyder på at dette er en klasseeffekt. Yderligere mutagenicitetsstudier in vitro/in vivo med ikke-planlagt DNA-syntese hos rotter var negative og tyder på, at latanoprost ikke har mutagent potentiale. Karcinogenicitetsstudier med mus og rotter var negative. Latanoprost har ikke nogen virkning på mandlig eller kvindelig fertilitet i dyrestudier. I embryotoksicitetsstudier på rotter blev der ikke iagttaget nogen embryotoksicitet ved intravenøse doser (5, 50 og 250 mikrogram/kg/dag). Latanoprost forårsagede imidlertid embryoletal virkning hos kaniner ved doser på 5 µg/kg/dag og derover. Monoprost,+øjendråber,+opløsning,+enkeltdosisbeholder+50+mikg-ml.docx Side 8 af 10
9 Dosen på 5 mikrogram/kg/dag (ca. 100 gange klinisk dosis) forårsagede signifikant embryoføtal toksicitet karakteriseret ved øget hyppighed af sen resorption og abort samt nedsat fostervægt. Der blev ikke påvist teratogent potentiale. Okulær toksicitet Okulær administration af Monoprost øjendråber til dyr to gange dagligt i 28 dage viste ingen lokal eller systemisk toksisk virkning. 6. FARMACEUTISKE OPLYSNINGER 6.1 Hjælpestoffer Macrogolglycerolhydroxystearat 40 Sorbitol Carbomer 974P Macrogol 4000 Dinatriumedetat Natriumhydroxid (ph-justering) Vand til injektionsvæsker 6.2 Uforligeligheder Ikke relevant. 6.3 Opbevaringstid 2 år i den ydre pakning. Efter åbning af brevet: anvend enkeltdosisbeholderen inden for 7 dage. Efter åbning af enkeltdosisbeholderen: anvendes straks og bortskaf enkeltdosisbeholderen efter brug. 6.4 Særlige opbevaringsforhold Opbevares ved temperaturer under 25 o C. For opbevaring efter første anbrud, se pkt Emballagetyper og pakningsstørrelser 5 enkeltdosisbeholdere (LDPE) med 0,2 ml øjendråber, opløsning uden konserveringsmiddel, i breve (polyethylen/aluminium/copolymer), æsker med 1, 2, 6 eller 18 breve. En pakningsstørrelse indeholder: 5 (1x5), 10 (2x5), 30 (6x5) eller 90 (18x5) enkeltdosisbeholdere. Ikke alle pakningsstørrelser er nødvendigvis markedsført. 6.6 Regler for destruktion og anden håndtering Ingen særlige forholdsregler. 7. INDEHAVER AF MARKEDSFØRINGSTILLADELSEN Laboratoires Thea 12 Rue Louis Bleriot Monoprost,+øjendråber,+opløsning,+enkeltdosisbeholder+50+mikg-ml.docx Side 9 af 10
10 63017 Clermont-Ferrand Cedex 2 Frankrig 8. MARKEDSFØRINGSTILLADELSESNUMMER (NUMRE) DATO FOR FØRSTE MARKEDSFØRINGSTILLADELSE 19. september DATO FOR ÆNDRING AF TEKSTEN 10. november 2014 Monoprost,+øjendråber,+opløsning,+enkeltdosisbeholder+50+mikg-ml.docx Side 10 af 10
PRODUKTRESUMÉ. for. Xalatan, øjendråber, opløsning. 1 dråbe indeholder ca. 1,5 mikrogram latanoprost
 Produktinformation for Xalatan (Latanoprost) Øjendråber 50 mikg/ml Markedsførte pakninger: Vnr Lægemiddelform og styrke 58 31 05 Øjendråber 50 mikg/ml 04 90 91 Øjendråber 50 mikg/ml Pakningsstørrelse 2,5
Produktinformation for Xalatan (Latanoprost) Øjendråber 50 mikg/ml Markedsførte pakninger: Vnr Lægemiddelform og styrke 58 31 05 Øjendråber 50 mikg/ml 04 90 91 Øjendråber 50 mikg/ml Pakningsstørrelse 2,5
PRODUKTRESUMÉ. for. Zaditen, øjendråber, opløsning, enkeltdosisbeholder
 18. februar 2015 PRODUKTRESUMÉ for Zaditen, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 20678 1. LÆGEMIDLETS NAVN Zaditen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 0,4 ml indeholder 0,138 mg
18. februar 2015 PRODUKTRESUMÉ for Zaditen, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 20678 1. LÆGEMIDLETS NAVN Zaditen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 0,4 ml indeholder 0,138 mg
Indlægsseddel: Information til brugeren. Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder. Latanoprost
 Indlægsseddel: Information til brugeren Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder Latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
Indlægsseddel: Information til brugeren Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder Latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
PRODUKTRESUMÉ. for. Latanoprost Pfizer, øjendråber, opløsning
 18. januar 2017 PRODUKTRESUMÉ for Latanoprost Pfizer, øjendråber, opløsning 0. D.SP.NR. 27319 1. LÆGEMIDLETS NAVN Latanoprost Pfizer 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
18. januar 2017 PRODUKTRESUMÉ for Latanoprost Pfizer, øjendråber, opløsning 0. D.SP.NR. 27319 1. LÆGEMIDLETS NAVN Latanoprost Pfizer 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
PRODUKTRESUMÉ. for. Voltaren Ophtha, øjendråber i enkeltdosisbeholder
 15. april 2013 PRODUKTRESUMÉ for Voltaren Ophtha, øjendråber i enkeltdosisbeholder 0. D.SP.NR. 3588 1. LÆGEMIDLETS NAVN Voltaren Ophtha 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml Voltaren Ophtha indeholder
15. april 2013 PRODUKTRESUMÉ for Voltaren Ophtha, øjendråber i enkeltdosisbeholder 0. D.SP.NR. 3588 1. LÆGEMIDLETS NAVN Voltaren Ophtha 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml Voltaren Ophtha indeholder
PRODUKTRESUMÉ. for. Antistina-Privin, øjendråber, opløsning
 25. marts 2013 PRODUKTRESUMÉ for Antistina-Privin, øjendråber, opløsning 0. D.SP.NR 1222 1. LÆGEMIDLETS NAVN Antistina-Privin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Antazolinsulfat 5 mg/ml + naphazolinnitrat
25. marts 2013 PRODUKTRESUMÉ for Antistina-Privin, øjendråber, opløsning 0. D.SP.NR 1222 1. LÆGEMIDLETS NAVN Antistina-Privin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Antazolinsulfat 5 mg/ml + naphazolinnitrat
PRODUKTRESUMÉ. for. Latanoprost Pfizer, øjendråber, opløsning
 21. september 2017 PRODUKTRESUMÉ for Latanoprost Pfizer, øjendråber, opløsning 0. D.SP.NR. 27319 1. LÆGEMIDLETS NAVN Latanoprost Pfizer 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
21. september 2017 PRODUKTRESUMÉ for Latanoprost Pfizer, øjendråber, opløsning 0. D.SP.NR. 27319 1. LÆGEMIDLETS NAVN Latanoprost Pfizer 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
PRODUKTRESUMÉ. for. Voltabak, øjendråber, opløsning
 22. februar 2013 PRODUKTRESUMÉ for Voltabak, øjendråber, opløsning 0. D.SP.NR. 27464 1. LÆGEMIDLETS NAVN Voltabak 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diclofenacnatrium 1 mg/ml Hjælpestof: Polyoxyleret
22. februar 2013 PRODUKTRESUMÉ for Voltabak, øjendråber, opløsning 0. D.SP.NR. 27464 1. LÆGEMIDLETS NAVN Voltabak 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diclofenacnatrium 1 mg/ml Hjælpestof: Polyoxyleret
PRODUKTRESUMÉ. for. Xalatan, øjendråber, opløsning
 21. september 2017 PRODUKTRESUMÉ for Xalatan, øjendråber, opløsning 0. D.SP.NR. 09707 1. LÆGEMIDLETS NAVN Xalatan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 100 ml øjendråber indeholder 5 mg latanoprost
21. september 2017 PRODUKTRESUMÉ for Xalatan, øjendråber, opløsning 0. D.SP.NR. 09707 1. LÆGEMIDLETS NAVN Xalatan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 100 ml øjendråber indeholder 5 mg latanoprost
PRODUKTRESUMÉ. for. Zovir, creme 5%, 2 g
 15. september 2014 PRODUKTRESUMÉ for Zovir, creme 5%, 2 g 0. D.SP.NR 8902 1. LÆGEMIDLETS NAVN Zovir 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aciclovir 50 mg/g Hjælpestoffer er anført under pkt. 6.1.
15. september 2014 PRODUKTRESUMÉ for Zovir, creme 5%, 2 g 0. D.SP.NR 8902 1. LÆGEMIDLETS NAVN Zovir 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aciclovir 50 mg/g Hjælpestoffer er anført under pkt. 6.1.
PRODUKTRESUMÉ. for. Terramycin-Polymyxin B, salve
 Produktinformation for Terramycin-Polymyxin B (Oxytetracyclin og Polymyxin B) Salve 30+1 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke Pakningsstørrelse 13 50 46 Salve 30+1 mg/g 15 g Dagsaktuel
Produktinformation for Terramycin-Polymyxin B (Oxytetracyclin og Polymyxin B) Salve 30+1 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke Pakningsstørrelse 13 50 46 Salve 30+1 mg/g 15 g Dagsaktuel
PRODUKTRESUMÉ. for. Monopex, øjendråber, opløsning, enkeltdosisbeholder
 10. april 2014 PRODUKTRESUMÉ for Monopex, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 28299 1. LÆGEMIDLETS NAVN Monopex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 1
10. april 2014 PRODUKTRESUMÉ for Monopex, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 28299 1. LÆGEMIDLETS NAVN Monopex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 1
PRODUKTRESUMÉ. for. Xalcom, øjendråber, opløsning
 Produktinformation for Xalcom (Latanoprost + timolol) Øjendråber 5 mg/ml+50 mikg/ml Markedsførte pakninger: Vnr Lægemiddelform og styrke 00 74 34 Øjendråber 5 mg/ml+50 mikg/ml 00 77 21 Øjendråber 5 mg/ml+50
Produktinformation for Xalcom (Latanoprost + timolol) Øjendråber 5 mg/ml+50 mikg/ml Markedsførte pakninger: Vnr Lægemiddelform og styrke 00 74 34 Øjendråber 5 mg/ml+50 mikg/ml 00 77 21 Øjendråber 5 mg/ml+50
PRODUKTRESUMÉ. for. Otrivin ukonserveret, næsespray, opløsning
 13. januar 2014 PRODUKTRESUMÉ for Otrivin ukonserveret, næsespray, opløsning 0. D.SP.NR. 2164 1. LÆGEMIDLETS NAVN Otrivin ukonserveret 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Xylometazolinhydrochlorid
13. januar 2014 PRODUKTRESUMÉ for Otrivin ukonserveret, næsespray, opløsning 0. D.SP.NR. 2164 1. LÆGEMIDLETS NAVN Otrivin ukonserveret 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Xylometazolinhydrochlorid
PRODUKTRESUMÉ. for. Dulcolax, suppositorier
 10. januar 2011 PRODUKTRESUMÉ for Dulcolax, suppositorier 0. D.SP.NR. 1603 1. LÆGEMIDLETS NAVN Dulcolax 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Bisacodyl 10 mg Hjælpestoffer er anført under pkt. 6.1.
10. januar 2011 PRODUKTRESUMÉ for Dulcolax, suppositorier 0. D.SP.NR. 1603 1. LÆGEMIDLETS NAVN Dulcolax 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Bisacodyl 10 mg Hjælpestoffer er anført under pkt. 6.1.
PRODUKTRESUMÉ. for. Regaine Forte, kutanopløsning
 28. juni 2007 PRODUKTRESUMÉ for Regaine Forte, kutanopløsning 0. D.SP.NR. 6550 1. LÆGEMIDLETS NAVN Regaine Forte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Minoxidil 50 mg/ml Hjælpestoffer se pkt. 6.1.
28. juni 2007 PRODUKTRESUMÉ for Regaine Forte, kutanopløsning 0. D.SP.NR. 6550 1. LÆGEMIDLETS NAVN Regaine Forte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Minoxidil 50 mg/ml Hjælpestoffer se pkt. 6.1.
PRODUKTRESUMÉ. for. Galieve Cool Mint, oral suspension
 12. maj 2015 PRODUKTRESUMÉ for Galieve Cool Mint, oral suspension 0. D.SP.NR. 27229 1. LÆGEMIDLETS NAVN Galieve Cool Mint 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én dosis/10 ml indeholder: 500 mg natriumalginat
12. maj 2015 PRODUKTRESUMÉ for Galieve Cool Mint, oral suspension 0. D.SP.NR. 27229 1. LÆGEMIDLETS NAVN Galieve Cool Mint 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én dosis/10 ml indeholder: 500 mg natriumalginat
PRODUKTRESUMÉ. for. Terramycin-Polymyxin B, øjensalve
 25. november 2011 PRODUKTRESUMÉ for Terramycin-Polymyxin B, øjensalve 0. D.SP.NR. 0071 1. LÆGEMIDLETS NAVN Terramycin-Polymyxin B 2. KVALITATIV OG KAVNTITATIV SAMMENSÆTNING Oxytetracyclin 5 mg/g som oxytetracyclinhydrochlorid
25. november 2011 PRODUKTRESUMÉ for Terramycin-Polymyxin B, øjensalve 0. D.SP.NR. 0071 1. LÆGEMIDLETS NAVN Terramycin-Polymyxin B 2. KVALITATIV OG KAVNTITATIV SAMMENSÆTNING Oxytetracyclin 5 mg/g som oxytetracyclinhydrochlorid
PRODUKTRESUMÉ. for. Strepsils Citrus Sukkerfri, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils Citrus Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Citrus Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4-diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils Citrus Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Citrus Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4-diklorbenzylalkohol
PRODUKTRESUMÉ. for. Strepsils Jordbær Sukkerfri, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils Jordbær Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Jordbær Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils Jordbær Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Jordbær Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
PRODUKTRESUMÉ. for. Uniferon, injektionsvæske, opløsning, beregnet til pattegrise
 9. april 2015 PRODUKTRESUMÉ for Uniferon, injektionsvæske, opløsning, beregnet til pattegrise 0. D.SP.NR 08324 1. VETERINÆRLÆGEMIDLETS NAVN Uniferon 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
9. april 2015 PRODUKTRESUMÉ for Uniferon, injektionsvæske, opløsning, beregnet til pattegrise 0. D.SP.NR 08324 1. VETERINÆRLÆGEMIDLETS NAVN Uniferon 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
PRODUKTRESUMÉ. for. Urilin, syrup
 21. juni 2011 PRODUKTRESUMÉ for Urilin, syrup 0. D.SP.NR 27072 1. VETERINÆRLÆGEMIDLETS NAVN Urilin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Phenylpropanolamin 40,29 mg (svarende
21. juni 2011 PRODUKTRESUMÉ for Urilin, syrup 0. D.SP.NR 27072 1. VETERINÆRLÆGEMIDLETS NAVN Urilin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Phenylpropanolamin 40,29 mg (svarende
PRODUKTRESUMÉ. for. Mydriasert, øjenlamel
 10. april 2012 PRODUKTRESUMÉ for Mydriasert, øjenlamel 0. D.SP.NR. 23325 1. LÆGEMIDLETS NAVN Mydriasert 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En øjenlamel indeholder 0,28 mg tropicamid og 5,4 mg phenylephrin
10. april 2012 PRODUKTRESUMÉ for Mydriasert, øjenlamel 0. D.SP.NR. 23325 1. LÆGEMIDLETS NAVN Mydriasert 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En øjenlamel indeholder 0,28 mg tropicamid og 5,4 mg phenylephrin
PRODUKTRESUMÉ. for. Softacort, øjendråber, opløsning, enkeltdosisbeholder
 3. april 2017 PRODUKTRESUMÉ for Softacort, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 29514 1. LÆGEMIDLETS NAVN Softacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
3. april 2017 PRODUKTRESUMÉ for Softacort, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 29514 1. LÆGEMIDLETS NAVN Softacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
PRODUKTRESUMÉ. for. Benylan, oral opløsning
 28. juni 2007 PRODUKTRESUMÉ for Benylan, oral opløsning 0. D.SP.NR. 0958 1. LÆGEMIDLETS NAVN Benylan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diphenhydraminhydrochlorid 2,8 mg/ml Hjælpestoffer se pkt.
28. juni 2007 PRODUKTRESUMÉ for Benylan, oral opløsning 0. D.SP.NR. 0958 1. LÆGEMIDLETS NAVN Benylan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diphenhydraminhydrochlorid 2,8 mg/ml Hjælpestoffer se pkt.
PRODUKTRESUMÉ. for. Aurovet, oralt pulver
 12. januar 2015 PRODUKTRESUMÉ for Aurovet, oralt pulver 0. D.SP.NR 24814 1. VETERINÆRLÆGEMIDLETS NAVN Aurovet 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Chlortetracyclin (som chlortetracyclinhydrochlorid)
12. januar 2015 PRODUKTRESUMÉ for Aurovet, oralt pulver 0. D.SP.NR 24814 1. VETERINÆRLÆGEMIDLETS NAVN Aurovet 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Chlortetracyclin (som chlortetracyclinhydrochlorid)
PRODUKTRESUMÉ. for. Sofradex, øjen- og øredråber, opløsning (2care4)
 28. november 2012 PRODUKTRESUMÉ for Sofradex, øjen- og øredråber, opløsning (2care4) 0. D.SP.NR. 2508 1. LÆGEMIDLETS NAVN Sofradex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dexamethason 0,5 mg/ml som
28. november 2012 PRODUKTRESUMÉ for Sofradex, øjen- og øredråber, opløsning (2care4) 0. D.SP.NR. 2508 1. LÆGEMIDLETS NAVN Sofradex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dexamethason 0,5 mg/ml som
PRODUKTRESUMÉ. for. Equimucin Vet., oralt pulver
 29. oktober 2009 PRODUKTRESUMÉ for Equimucin Vet., oralt pulver 0. D.SP.NR. 22316 1. VETERINÆRLÆGEMIDLETS NAVN Equimucin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Acetylcystein 2 g Alle
29. oktober 2009 PRODUKTRESUMÉ for Equimucin Vet., oralt pulver 0. D.SP.NR. 22316 1. VETERINÆRLÆGEMIDLETS NAVN Equimucin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Acetylcystein 2 g Alle
Indlægsseddel: Information til brugeren. Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning. Dexamethasonnatriumphosphat/chloramphenicol
 Indlægsseddel: Information til brugeren Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning Dexamethasonnatriumphosphat/chloramphenicol Læs denne indlægsseddel grundigt, inden du begynder at bruge
Indlægsseddel: Information til brugeren Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning Dexamethasonnatriumphosphat/chloramphenicol Læs denne indlægsseddel grundigt, inden du begynder at bruge
PRODUKTRESUMÉ. for. Panodil Brus, brusetabletter
 7. januar 2013 PRODUKTRESUMÉ for Panodil Brus, brusetabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Brus 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver brusetablet indeholder 500 mg paracetamol.
7. januar 2013 PRODUKTRESUMÉ for Panodil Brus, brusetabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Brus 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver brusetablet indeholder 500 mg paracetamol.
PRODUKTRESUMÉ. for. Hyobac App 2 Vet., injektionsvæske, emulsion. Actinobacillus pleuropneumoniae, serotype 2, RP > 1*
 10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
PRODUKTRESUMÉ. for. Panodil, filmovertrukne tabletter
 7. januar 2013 PRODUKTRESUMÉ for Panodil, filmovertrukne tabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver tablet indeholder 500 mg eller 1000 mg paracetamol.
7. januar 2013 PRODUKTRESUMÉ for Panodil, filmovertrukne tabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver tablet indeholder 500 mg eller 1000 mg paracetamol.
PRODUKTRESUMÉ. for. Mucolysin Skovbær, brusetabletter
 1. februar 2012 PRODUKTRESUMÉ for Mucolysin Skovbær, brusetabletter 0. D.SP.NR. 22946 1. LÆGEMIDLETS NAVN Mucolysin Skovbær 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En brusetablet indeholder 200 mg acetylcystein.
1. februar 2012 PRODUKTRESUMÉ for Mucolysin Skovbær, brusetabletter 0. D.SP.NR. 22946 1. LÆGEMIDLETS NAVN Mucolysin Skovbær 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En brusetablet indeholder 200 mg acetylcystein.
PRODUKTRESUMÉ. for. Mega C 1500 "Tolico", depottabletter 1500 mg
 10. november 2010 PRODUKTRESUMÉ for Mega C 1500 "Tolico", depottabletter 1500 mg 0. D.SP.NR. - 1. LÆGEMIDLETS NAVN Mega C 1500 Tolico 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 depottablet indeholder:
10. november 2010 PRODUKTRESUMÉ for Mega C 1500 "Tolico", depottabletter 1500 mg 0. D.SP.NR. - 1. LÆGEMIDLETS NAVN Mega C 1500 Tolico 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 depottablet indeholder:
for Olbetam, kapsler, hårde
 Produktinformation for Olbetam (Acipimox) Kapsler 250 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 41 24 00 Kapsler 250 mg 90 stk. Dagsaktuel pris findes på www.medicinpriser.dk
Produktinformation for Olbetam (Acipimox) Kapsler 250 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 41 24 00 Kapsler 250 mg 90 stk. Dagsaktuel pris findes på www.medicinpriser.dk
PRODUKTRESUMÉ. for. Dilaterol Vet. syrup. Aktivt stof 25 mikrogram clenbuterolhydrochlorid (svarende til 22 mikrogram clenbuterol).
 16. marts 2018 PRODUKTRESUMÉ for Dilaterol Vet. syrup 0. D.SP.NR 28075 1. VETERINÆRLÆGEMIDLETS NAVN Dilaterol Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktivt stof 25 mikrogram
16. marts 2018 PRODUKTRESUMÉ for Dilaterol Vet. syrup 0. D.SP.NR 28075 1. VETERINÆRLÆGEMIDLETS NAVN Dilaterol Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktivt stof 25 mikrogram
PRODUKTRESUMÉ. for. Strepsils med Honning & Citron, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils med Honning & Citron, sugetabletter 0. D.SP.NR. 1854 1. LÆGEMIDLETS NAVN Strepsils med Honning & Citron 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils med Honning & Citron, sugetabletter 0. D.SP.NR. 1854 1. LÆGEMIDLETS NAVN Strepsils med Honning & Citron 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
PRODUKTRESUMÉ. for. Antepsin, tabletter
 26. oktober 2012 PRODUKTRESUMÉ for Antepsin, tabletter 0. D.SP.NR. 3919 1. LÆGEMIDLETS NAVN Antepsin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Sucralfat 1 g Alle hjælpestoffer er anført under pkt. 6.1.
26. oktober 2012 PRODUKTRESUMÉ for Antepsin, tabletter 0. D.SP.NR. 3919 1. LÆGEMIDLETS NAVN Antepsin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Sucralfat 1 g Alle hjælpestoffer er anført under pkt. 6.1.
PRODUKTRESUMÉ. for. Panodil Hot, pulver til oral opløsning, brev
 7. januar 2013 PRODUKTRESUMÉ for Panodil Hot, pulver til oral opløsning, brev 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Hot 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hvert brev indeholder 500 mg paracetamol.
7. januar 2013 PRODUKTRESUMÉ for Panodil Hot, pulver til oral opløsning, brev 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Hot 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hvert brev indeholder 500 mg paracetamol.
PRODUKTRESUMÉ. for. Felden, gel. Hjælpestof, som behandleren skal være opmærksom på: Propylenglycol
 Produktinformation for Felden (Piroxicam) Gel, 0,5% Markedsførte pakninger: Vnr Lægemiddelform og styrke 15 23 48 Gel 0,5% 06 14 65 Gel 0,5% 08 58 16 Gel 0,5% Pakningsstørrelse 25 g 50 g 112 g Dagsaktuel
Produktinformation for Felden (Piroxicam) Gel, 0,5% Markedsførte pakninger: Vnr Lægemiddelform og styrke 15 23 48 Gel 0,5% 06 14 65 Gel 0,5% 08 58 16 Gel 0,5% Pakningsstørrelse 25 g 50 g 112 g Dagsaktuel
PRODUKTRESUMÉ. for. Kelactin Vet., oral opløsning
 4. maj 2015 PRODUKTRESUMÉ for Kelactin Vet., oral opløsning 0. D.SP.NR 27896 1. VETERINÆRLÆGEMIDLETS NAVN Kelactin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml af produktet indeholder: Aktivt stof:
4. maj 2015 PRODUKTRESUMÉ for Kelactin Vet., oral opløsning 0. D.SP.NR 27896 1. VETERINÆRLÆGEMIDLETS NAVN Kelactin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml af produktet indeholder: Aktivt stof:
PRODUKTRESUMÉ. for. Pracetam Vet., opløsning til anvendelse til drikkevand
 12. januar 2015 PRODUKTRESUMÉ for Pracetam Vet., opløsning til anvendelse til drikkevand 0. D.SP.NR 22642 1. VETERINÆRLÆGEMIDLETS NAVN Pracetam Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
12. januar 2015 PRODUKTRESUMÉ for Pracetam Vet., opløsning til anvendelse til drikkevand 0. D.SP.NR 22642 1. VETERINÆRLÆGEMIDLETS NAVN Pracetam Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste.
 1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
PRODUKTRESUMÉ. for. Creon 25.000, hårde enterokapsler
 24. august 2015 PRODUKTRESUMÉ for Creon 25.000, hårde enterokapsler 0. D.SP.NR 818 1. LÆGEMIDLETS NAVN Creon 25.000 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 kapsel indeholder 300 mg pankreatin svarende
24. august 2015 PRODUKTRESUMÉ for Creon 25.000, hårde enterokapsler 0. D.SP.NR 818 1. LÆGEMIDLETS NAVN Creon 25.000 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 kapsel indeholder 300 mg pankreatin svarende
PRODUKTRESUMÉ. for. Toltarox, oral suspension
 2. januar 2013 PRODUKTRESUMÉ for Toltarox, oral suspension 0. D.SP.NR 26780 1. VETERINÆRLÆGEMIDLETS NAVN Toltarox 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml oral suspension indeholder: Aktivt stof
2. januar 2013 PRODUKTRESUMÉ for Toltarox, oral suspension 0. D.SP.NR 26780 1. VETERINÆRLÆGEMIDLETS NAVN Toltarox 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml oral suspension indeholder: Aktivt stof
PRODUKTRESUMÉ. for. Canesten, vaginaltabletter (Orifarm)
 27. september 2010 PRODUKTRESUMÉ for Canesten, vaginaltabletter (Orifarm) 0. D.SP.NR. 3105 1. LÆGEMIDLETS NAVN Canesten 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Clotrimazol 100 mg og 500 mg 3. Lægemiddelform
27. september 2010 PRODUKTRESUMÉ for Canesten, vaginaltabletter (Orifarm) 0. D.SP.NR. 3105 1. LÆGEMIDLETS NAVN Canesten 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Clotrimazol 100 mg og 500 mg 3. Lægemiddelform
Indlægsseddel: Information til brugeren. Ciloxan 3 mg/ml, øjendråber, opløsning. ciprofloxacin
 Indlægsseddel: Information til brugeren Ciloxan 3 mg/ml, øjendråber, opløsning ciprofloxacin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Ciloxan 3 mg/ml, øjendråber, opløsning ciprofloxacin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Amning: Vivotif bør kun anvendes på tvingende indikation i ammeperioden.
 8. december 2008 PRODUKTRESUMÉ for Vivotif, hårde enterokapsler 0. D.SP.NR. 6673 1. LÆGEMIDLETS NAVN Vivotif 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis indeholder: Mindst 2 x 10 9 levende organismer
8. december 2008 PRODUKTRESUMÉ for Vivotif, hårde enterokapsler 0. D.SP.NR. 6673 1. LÆGEMIDLETS NAVN Vivotif 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis indeholder: Mindst 2 x 10 9 levende organismer
PRODUKTRESUMÉ. for. Mini-Pe, tabletter
 Produktinformation for Mini-Pe (Norethisteron) Tabletter 0,35 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 17 53 23 Tabletter 0,35 mg 3 x 28 stk. (blister) Dagsaktuel pris
Produktinformation for Mini-Pe (Norethisteron) Tabletter 0,35 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 17 53 23 Tabletter 0,35 mg 3 x 28 stk. (blister) Dagsaktuel pris
Indlægsseddel: Information til brugeren. Maxidex 1 mg/ml, øjendråber, suspension. dexamethason
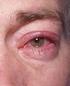 Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
PRODUKTRESUMÉ. for. Metomotyl, injektionsvæske, opløsning
 12. december 2017 PRODUKTRESUMÉ for Metomotyl, injektionsvæske, opløsning 0. D.SP.NR. 28870 1. VETERINÆRLÆGEMIDLETS NAVN Metomotyl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml i 2,5 mg/ml opløsning
12. december 2017 PRODUKTRESUMÉ for Metomotyl, injektionsvæske, opløsning 0. D.SP.NR. 28870 1. VETERINÆRLÆGEMIDLETS NAVN Metomotyl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml i 2,5 mg/ml opløsning
PRODUKTRESUMÉ. for. Bricanyl, infusionsvæske, opløsning, koncentrat til
 10. januar 2012 PRODUKTRESUMÉ for Bricanyl, infusionsvæske, opløsning, koncentrat til 0. D.SP.NR. 2900 1. LÆGEMIDLETS NAVN Bricanyl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Terbutalinsulfat
10. januar 2012 PRODUKTRESUMÉ for Bricanyl, infusionsvæske, opløsning, koncentrat til 0. D.SP.NR. 2900 1. LÆGEMIDLETS NAVN Bricanyl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Terbutalinsulfat
PRODUKTRESUMÉ. for. Malaseb Vet., shampoo
 15. juli 2010 PRODUKTRESUMÉ for Malaseb Vet., shampoo 0. D.SP.NR 25817 1. VETERINÆRLÆGEMIDLETS NAVN Malaseb Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktive stoffer: Chlorhexidindigluconat
15. juli 2010 PRODUKTRESUMÉ for Malaseb Vet., shampoo 0. D.SP.NR 25817 1. VETERINÆRLÆGEMIDLETS NAVN Malaseb Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktive stoffer: Chlorhexidindigluconat
Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat
 Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Tag altid
Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Tag altid
PRODUKTRESUMÉ. for. Isovorin, injektionsvæske, opløsning
 Produktinformation for Isovorin (Levofolinsyre som calciumlevofolin) Injektionsvæske, opl. 10 Markedsførte pakninger: Vnr Lægemiddelform og styrke 09 12 66 Injektionsvæske, opl. 10 09 12 77 Injektionsvæske,
Produktinformation for Isovorin (Levofolinsyre som calciumlevofolin) Injektionsvæske, opl. 10 Markedsførte pakninger: Vnr Lægemiddelform og styrke 09 12 66 Injektionsvæske, opl. 10 09 12 77 Injektionsvæske,
Zovir 5 % creme Aciclovir
 11. november 2016 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
11. november 2016 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
PRODUKTRESUMÉ. for. Brentacort, creme
 6. juli 2015 PRODUKTRESUMÉ for Brentacort, creme 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
6. juli 2015 PRODUKTRESUMÉ for Brentacort, creme 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
PRODUKTRESUMÉ. for. Mucolysin, brusetabletter
 6. marts 2013 PRODUKTRESUMÉ for Mucolysin, brusetabletter 0. D.SP.NR. 06338 1. LÆGEMIDLETS NAVN Mucolysin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En brusetablet indeholder eller 600 mg acetylcystein.
6. marts 2013 PRODUKTRESUMÉ for Mucolysin, brusetabletter 0. D.SP.NR. 06338 1. LÆGEMIDLETS NAVN Mucolysin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En brusetablet indeholder eller 600 mg acetylcystein.
PRODUKTRESUMÉ. for. Dapson Scanpharm, tabletter
 PRODUKTRESUMÉ 14. juni 2007 for Dapson Scanpharm, tabletter 0. D.SP.NR. 6766 1. LÆGEMIDLETS NAVN Dapson Scanpharm 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dapson 50 mg og 100 mg Hjælpestoffer, se pkt
PRODUKTRESUMÉ 14. juni 2007 for Dapson Scanpharm, tabletter 0. D.SP.NR. 6766 1. LÆGEMIDLETS NAVN Dapson Scanpharm 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dapson 50 mg og 100 mg Hjælpestoffer, se pkt
PRODUKTRESUMÉ. for. Romefen Vet., tabletter
 29. oktober 2012 PRODUKTRESUMÉ for Romefen Vet., tabletter 0. D.SP.NR 8710 1. VETERINÆRLÆGEMIDLETS NAVN Romefen Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Ketoprofen 10 mg og 20 mg. 3. LÆGEMIDDELFORM
29. oktober 2012 PRODUKTRESUMÉ for Romefen Vet., tabletter 0. D.SP.NR 8710 1. VETERINÆRLÆGEMIDLETS NAVN Romefen Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Ketoprofen 10 mg og 20 mg. 3. LÆGEMIDDELFORM
PRODUKTRESUMÉ. for. Nixema, medicinsk plaster
 10. april 2007 PRODUKTRESUMÉ for Nixema, medicinsk plaster 0. D.SP.NR. 22894 1. LÆGEMIDLETS NAVN Nixema 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Mængde anført på mærkningen Aktivt stof mg/cm 2 mg/brik
10. april 2007 PRODUKTRESUMÉ for Nixema, medicinsk plaster 0. D.SP.NR. 22894 1. LÆGEMIDLETS NAVN Nixema 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Mængde anført på mærkningen Aktivt stof mg/cm 2 mg/brik
PRODUKTRESUMÉ. for. Brentacort, salve
 22. december 2011 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
22. december 2011 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Allergodil 0,5 mg/ml øjendråber, opløsning. Azelastinhydrochlorid
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
PRODUKTRESUMÉ. for. Baytril Vet., tabletter
 21. marts 2014 PRODUKTRESUMÉ for Baytril Vet., tabletter 0. D.SP.NR 08259 1. VETERINÆRLÆGEMIDLETS NAVN Baytril Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 tablet indeholder: Aktive stoffer: 50 mg
21. marts 2014 PRODUKTRESUMÉ for Baytril Vet., tabletter 0. D.SP.NR 08259 1. VETERINÆRLÆGEMIDLETS NAVN Baytril Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 tablet indeholder: Aktive stoffer: 50 mg
Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning
 Indlægsseddel: Information til brugeren Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning hypromellose Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Viskøse
Indlægsseddel: Information til brugeren Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning hypromellose Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Viskøse
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1/19 1. VETERINÆRLÆGEMIDLETS NAVN Eurican Herpes 205 pulver og solvens til injektionsvæske, emulsion. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof 1 dosis á 1 ml indeholder:
BILAG I PRODUKTRESUME 1/19 1. VETERINÆRLÆGEMIDLETS NAVN Eurican Herpes 205 pulver og solvens til injektionsvæske, emulsion. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof 1 dosis á 1 ml indeholder:
INDLÆGSSEDDEL : INFORMATION TIL BRUGEREN. Redap 1 mg/g gel. Adapalen
 INDLÆGSSEDDEL : INFORMATION TIL BRUGEREN Redap 1 mg/g gel Adapalen Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. - Gem indlægssedlen.
INDLÆGSSEDDEL : INFORMATION TIL BRUGEREN Redap 1 mg/g gel Adapalen Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. - Gem indlægssedlen.
PRODUKTRESUMÉ. for. Brentacort, salve
 26. november 2013 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
26. november 2013 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
Indlægsseddel: Information til brugeren. Tobrex Depot 3 mg/ml, depotøjendråber, opløsning. tobramycin
 Indlægsseddel: Information til brugeren Tobrex Depot 3 mg/ml, depotøjendråber, opløsning tobramycin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Tobrex Depot 3 mg/ml, depotøjendråber, opløsning tobramycin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Tamoxifen A-Pharma, tabletter (A-Pharma)
 27. september 2012 PRODUKTRESUMÉ for Tamoxifen A-Pharma, tabletter (A-Pharma) 0. D.SP.NR. 6472 1. LÆGEMIDLETS NAVN Tamoxifen A-Pharma. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Tamoxifen 20 mg som tamoxifencitrat.
27. september 2012 PRODUKTRESUMÉ for Tamoxifen A-Pharma, tabletter (A-Pharma) 0. D.SP.NR. 6472 1. LÆGEMIDLETS NAVN Tamoxifen A-Pharma. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Tamoxifen 20 mg som tamoxifencitrat.
PRODUKTRESUMÉ. for. Promon Vet., tabletter
 9. april 2014 PRODUKTRESUMÉ for Promon Vet., tabletter 0. D.SP.NR 3787 1. VETERINÆRLÆGEMIDLETS NAVN Promon Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: 1 tablet indeholder: Medroxyprogesteronacetat
9. april 2014 PRODUKTRESUMÉ for Promon Vet., tabletter 0. D.SP.NR 3787 1. VETERINÆRLÆGEMIDLETS NAVN Promon Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: 1 tablet indeholder: Medroxyprogesteronacetat
PRODUKTRESUMÉ. for. Lestid, oralt pulver, enkeltdosisbeholder
 Produktinformation for Lestid (Colestipol) Pulv. til oral susp., endos. 5 g Markedsførte pakninger: Vnr Lægemiddelform og styrke 52 58 16 Pulv. til oral susp., endos. 5 mg Pakningsstørrelse 50 stk. Dagsaktuel
Produktinformation for Lestid (Colestipol) Pulv. til oral susp., endos. 5 g Markedsførte pakninger: Vnr Lægemiddelform og styrke 52 58 16 Pulv. til oral susp., endos. 5 mg Pakningsstørrelse 50 stk. Dagsaktuel
INDLÆGSSEDEL: INFORMATION TIL BRUGEREN Finacea 15% Gel Azelainsyre
 INDLÆGSSEDEL: INFORMATION TIL BRUGEREN Finacea 15% Gel Azelainsyre Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger Gem indlægssedlen.
INDLÆGSSEDEL: INFORMATION TIL BRUGEREN Finacea 15% Gel Azelainsyre Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger Gem indlægssedlen.
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Hydrocortison med Terramycin og Polymyxin B 15 mg/ml / 5 mg/ml / 1 mg/ml Øjen- og øredråber, suspension hydrocortisonacetat/oxytetracyclinhydrochlorid/polymyxin
Indlægsseddel: Information til brugeren Hydrocortison med Terramycin og Polymyxin B 15 mg/ml / 5 mg/ml / 1 mg/ml Øjen- og øredråber, suspension hydrocortisonacetat/oxytetracyclinhydrochlorid/polymyxin
Indlægsseddel: Information til brugeren. TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension. tobramycin og dexamethason
 Indlægsseddel: Information til brugeren TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension tobramycin og dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
Indlægsseddel: Information til brugeren TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension tobramycin og dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
4.2 Terapeutiske indikationer med angivelse af dyrearter, som lægemidlet er beregnet til
 1. VETERINÆRLÆGEMIDLETS NAVN MELOXIDYL 0,5 mg/ml oral suspension til katte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml MELOXIDYL 0,5 mg/ml oral suspension til katte indeholder: Aktivt stof: Meloxicam
1. VETERINÆRLÆGEMIDLETS NAVN MELOXIDYL 0,5 mg/ml oral suspension til katte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml MELOXIDYL 0,5 mg/ml oral suspension til katte indeholder: Aktivt stof: Meloxicam
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason (som betamethasonvalerat) Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason (som betamethasonvalerat) Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
BILAG I PRODUKTRESUMÉ
 BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN IZBA 30 mikrogram/ml øjendråber, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 30 mikrogram travoprost. Hjælpestoffer med kendt
BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN IZBA 30 mikrogram/ml øjendråber, opløsning 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 30 mikrogram travoprost. Hjælpestoffer med kendt
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Ventoline 0,4 mg/ml oral opløsning Salbutamol
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Ventoline 0,4 mg/ml oral opløsning Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Ventoline 0,4 mg/ml oral opløsning Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. Nix 5 %, creme permethrin
 Indlægsseddel: Information til brugeren Nix 5 %, creme permethrin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Brug altid Nix nøjagtigt
Indlægsseddel: Information til brugeren Nix 5 %, creme permethrin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Brug altid Nix nøjagtigt
PRODUKTRESUMÉ. for. Beclomet Easyhaler, inhalationspulver
 8. marts 2011 PRODUKTRESUMÉ for Beclomet Easyhaler, inhalationspulver 0. D.SP.NR. 9844 1. LÆGEMIDLETS NAVN Beclomet Easyhaler 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En afmålt dosis indeholder henholdsvis
8. marts 2011 PRODUKTRESUMÉ for Beclomet Easyhaler, inhalationspulver 0. D.SP.NR. 9844 1. LÆGEMIDLETS NAVN Beclomet Easyhaler 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En afmålt dosis indeholder henholdsvis
Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste.
 1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
Indlægsseddel: Information til brugeren. Betnovat 1 mg/ml kutanopløsning Betamethason
 Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
PRODUKTRESUMÉ. for. Vilocare, premix til foderlægemiddel
 11. januar 2016 PRODUKTRESUMÉ for Vilocare, premix til foderlægemiddel 0. D.SP.NR. 29440 1. VETERINÆRLÆGEMIDLETS NAVN Vilocare 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Zinkoxid 1000 mg/g.
11. januar 2016 PRODUKTRESUMÉ for Vilocare, premix til foderlægemiddel 0. D.SP.NR. 29440 1. VETERINÆRLÆGEMIDLETS NAVN Vilocare 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Zinkoxid 1000 mg/g.
