PRODUKTRESUMÉ. for. Softacort, øjendråber, opløsning, enkeltdosisbeholder
|
|
|
- Margrethe Mølgaard
- 8 år siden
- Visninger:
Transkript
1 3. april 2017 PRODUKTRESUMÉ for Softacort, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR LÆGEMIDLETS NAVN Softacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning indeholder 3,35 mg hydrocortisonnatriumphosphat. En dråbe indeholder ca. 0,12 mg hydrocortisonnatriumphosphat. Alle hjælpestoffer er anført under pkt LÆGEMIDDELFORM Øjendråber, opløsning i enkeltdosisbeholder Opløsningen er en næsten klar, farveløs til let gullig opløsning og så godt som fri for synlige partikler. ph: 6,9 7,5 Osmolaritet: mosmol/kg 4. KLINISKE OPLYSNINGER 4.1 Terapeutiske indikationer Behandling af milde, ikke-infektiøse allergiske eller milde, ikke-infektiøse inflammatoriske lidelser i konjunktiva. 4.2 Dosering og indgivelsesmåde Dosering Den anbefalede dosis er 2 dråber i det angrebne øje 2-4 gange daglig. Behandlingsvarigheden varierer generelt fra et par dage til højst 14 dage. Gradvis nedtrapning til 1 administration hver anden dag kan anbefales for at undgå tilbagefald. Softacort SPC Side 1 af 7
2 I tilfælde af insufficient respons anbefales et mere potent kortikosteroid. Pædiatrisk population Softacorts sikkerhed og virkning hos børn er ikke klarlagt. Se pkt Ældre Dosisjustering er ikke nødvendig hos ældre patienter. Administration Okulær anvendelse. En enkeltdosisbeholder indeholder tilstrækkelig opløsning til behandling af begge øjne. Kun til engangsbrug. Dette lægemiddel er en steril opløsning som ikke indeholder konserveringsmidler. Opløsningen i én enkelt enkeltdosisbeholder skal anvendes straks efter åbning og indgives i de(t) angrebne øjne/øje (se pkt. 6.3). Patienter bør instrueres i at: - undgå berøring af øjet eller øjenomgivelser med spidsen af beholderen, - anvende øjendråberne straks efter åbning af enkeltdosisbeholderen og kassere enkeltdosisbeholderen efter brug. Ved nasolakrimal okklusion ved kompression af tårekanalen i et minut reduceres den systemiske absorption. I tilfælde af samtidig behandling med andre øjendråber bør lægemidlerne administreres med mindst 5 minutters mellemrum. 4.3 Kontraindikationer Overfølsomhed over for det aktive stof eller over for et eller flere af hjælpestofferne anført i pkt. 6.1; Kendt glukokortikoid-induceret okulær hypertension og andre typer okulær hypertension; Akut herpes-simplex virusinfektion og størstedelen af øvrige virusinfektioner i cornea med akut ulceration (bortset fra ved kombination med specifikke kemoterapeutika mod herpes virus), konjunktivitis med ulcerativ keratitis selv på det initiale stadie (positiv fluorescein-test); Okulær tuberkulose; Okulær mykose; Akut okulær purulent infektion, purulent konjunktivitis og purulent blepharitis, bygkorn og herpesinfektion, som kan maskeres eller forværres ved anvendelse af antiinflammatoriske lægemidler. 4.4 Særlige advarsler og forsigtighedsregler vedrørende brugen Topikale steroider må aldrig gives for ikke-diagnosticerede røde øjne. Anvendelse af Softacort frarådes til behandling af keratitis forårsaget af herpes simplex virus, men, hvis det er nødvendigt, kan Softacort anvendes sammen med antiviral behandling og under tæt overvågning af en oftalmolog. Softacort SPC Side 2 af 7
3 Udtynding af cornea og sclera (på grund af sygdom) kan øge risikoen for perforation ved brug af topikale steroider. Svampeinfektion bør mistænkes, hvis der opstår cornea-ulceration under eller efter langvarig behandling med et steroid. Patienter bør monitoreres med hyppige mellemrum under behandlingen med hydrocortison øjendråber. Længerevarende brug af kortikosteroid-behandling er vist at medføre okulær hypertension/glaukom især hos patienter med tidligere steroid-induceret øget intraokulært tryk (IOP) eller med eksisterende IOP eller glaukom (se pkt. 4.3 og 4.8) samt dannelse af katarakt hos især børn og ældre. Brug af kortikosteroider kan ligeledes forårsage opportunistiske øjeninfektioner pga. af nedsat modstandskraft hos patienten eller forsinket sårheling hos patienten. Derudover kan topikale okulære kortikosteroider fremme, forværre eller skjule tegn og symptomer på opportunistiske øjeninfektioner. Anvendelse af kontaktlinser under behandling med kortikosteroide øjendråber bør undgås. Pædiatrisk population Hos børn kan langvarig kontinuerlig kortikosteroid-behandling medføre adrenal suppression (se pkt. 4.2). Hypertensiv okulært respons over for topikale kortikosteroider hos børn forekommer hyppigere, i sværere grad og hurtigere end hos voksne. 4.5 Interaktion med andre lægemidler og andre former for interaktion Der er ikke udført interaktionsstudier. Samtidig behandling med CYP3A-hæmmere, herunder cobicistat-holdige lægemidler, forventes at øge risikoen for systemiske bivirkninger. Kombinationen bør undgås med mindre fordelene opvejer den øgede risiko for systemiske kortikosteroid-relaterede bivirkninger. I disse tilfælde bør patienten monitoreres for systemiske kortikosteroidrelaterede bivirkninger. 4.6 Graviditet og amning Fertilitet Der foreligger ingen data om hydrocortisonnatriumphosphats påvirkning af fertiliteten. Graviditet Der foreligger ingen eller kun begrænsede data for brug af Softacort hos gravide kvinder. Kortikosteroider passerer placenta. Dyrestudier har vist reproduktionstoksicitet, herunder dannelse af ganespalte (se pkt. 5.3). Den kliniske relevans af denne observation er ikke kendt. Efter systemisk anvendelse af kortikosteroider i højere doser er der rapporteret om bivirkninger hos det ufødte/nyfødte barn (intrauterin væksthæmning, hæmning af binyrebarkens funktion). Disse bivirkninger er dog ikke observeret efter okulær anvendelse. Softacort frarådes under graviditet, medmindre det er tvingende nødvendigt. Softacort SPC Side 3 af 7
4 Amning Systemisk administrerede glukokortikoider udskilles i modermælk og kan forårsage væksthæmning, hæmme endogen kortikoidproduktion eller medføre andre bivirkninger. Det vides ikke, om Softacort udskilles i modermælken hos mennesker. En risiko for nyfødte/spædbørn kan ikke udelukkes 4.7 Virkninger på evnen til at føre motorkøretøj eller betjene maskiner Ikke mærkning. Der er ikke udført studier af virkningen på evnen til at føre motorkøretøj eller betjene maskiner. Midlertidigt sløret syn eller andre synsforstyrrelser kan påvirke evnen til at føre motorkøretøj eller betjene maskiner. Hvis der opstår sløret syn, skal patienten vente med at føre motorkøretøj eller betjene maskiner, indtil patienten har klart syn. 4.8 Bivirkninger Oversigt over bivirkninger: Bivirkningerne er anført efter følgende hyppighed: meget almindelig ( 1/10), almindelig ( 1/100 til <1/10), ikke almindelig ( 1/1.000 til <1/100), sjælden ( 1/ til <1/1.000), meget sjælden (<1/10.000), ikke kendt (kan ikke estimeres ud fra forhåndenværende data). Hydrocortison Øjne: - Ikke kendt: Brænden*, svien*. Bivirkninger ved kortikoidklassen Følgende bivirkninger er observeret med hydrocortison, men er også observeret med andre topikale kortikosteroider. Øjne: - Ikke kendt: Allergiske reaktioner og overfølsomhedsreaktioner, forsinket sårheling, posterior kapselkatarakt*, opportunistiske infektioner (herpes simplex infektion, svampeinfektion, se pkt. 4.4), glaukom*, mydriasis, ptosis, kortikosteroid-induceret uveitis, ændringer i corneas tykkelse*, krystallinsk keropati. * Se afsnittet Beskrivelse af udvalgte bivirkninger Der er i meget sjældne tilfælde rapporteret om calcifikation af cornea i forbindelse med brug af phosphat-holdige øjendråber hos patienter med signifikante corneaskader. Beskrivelse af udvalgte bivirkninger Brænden og svien kan forekomme umiddelbart efter inddrypning. Disse bivirkninger er sædvanligvis milde og kortvarige og uden følger. Længerevarende brug af kortikosteroider har vist at medføre okulær hypertension/glaukom (især hos patienter med tidligere steroid-induceret øget intraokulært tryk (IOP) eller med eksisterende IOP eller glaukom) samt dannelse af katarakt. Især børn og ældre er mere tilbøjelige til at udvikle steroid-induceret øget IOP (se pkt. 4.4). Softacort SPC Side 4 af 7
5 Øget intraokulært tryk, der er induceret af topikal kortikosteroid-behandling er generelt observeret inden for 2 uger efter behandling (se pkt. 4.4). Diabetikere er også mere tilbøjelige til at udvikle subkapsulær katarakt efter topikal administration af steroider. I tilfælde af sygdomme, der forårsager atrofi af cornea kan brugen af topikale steroider i nogle tilfælde medføre perforation (se pkt. 4.4). Indberetning af formodede bivirkninger Når lægemidlet er godkendt, er indberetning af formodede bivirkninger vigtig. Det muliggør løbende overvågning af benefit/risk-forholdet for lægemidlet. Læger og sundhedspersonale anmodes om at indberette alle formodede bivirkninger via Lægemiddelstyrelsen Axel Heides Gade 1 DK-2300 København S Websted: [email protected] 4.9 Overdosering Ved topikal overdosering associeret med længerevarende øjenirritation skal øjet(øjnene) skylles med sterilt vand. Længerevarende overdosering kan medføre okulær hypertension. I så fald skal behandlingen seponeres. Symptomatologien ved utilsigtet indtagelse er ikke kendt. Som for andre kortikosteroider kan lægen dog overveje ventrikelskylning eller emesis Udlevering B 5. FARMAKOLOGISKE EGENSKABER 5.0 Terapeutisk klassifikation ATC-kode: S 01 BA 02. Antiinflammatoriske stoffer - cortikosteroider, usammensatte. 5.1 Farmakodynamiske egenskaber Virkningsmekanisme Hydrocortison eller cortisol er et glukokortikoid, som udskilles i binyrerne. Dets antiinflammatoriske aktivitet gør det i stand til at udskille og inducere syntese af den specifikke PLA2-hæmmer (lipocortin) og derved blokere arakidonsyrekaskaden og dannelsen af inflammationsskabende faktorer som f.eks. prostaglandiner, thromboxaner, (SRS-A) leukotriener. Denne virkningsmekanisme ligger til grund for hydrocortisons antiinflammatoriske og anti-allergiske aktivitet. 5.2 Farmakokinetiske egenskaber Et farmakokinetisk studie med kaniner udført med Softacort viste, at hydrocortison hurtigt blev fordelt i kammervæske, cornea og conjunctiva. Absorptionen af hydrocortison var størst i cornea efterfulgt af conjunctiva og var meget lav i kammervæske. En mindre systemisk absorption af hydrocortison blev ligeledes observeret (< 2% af indgivet dosis). Softacort SPC Side 5 af 7
6 5.3 Prækliniske sikkerhedsdata Vedvarende, gentagen systemisk administration af hydrocortison til dyr reducerede vægtøgning og øgede glukoneogenese og hyperglykæmi, thymolyse og okulær hypertension. Reproduktionstoksicitet Hos mus har hydrocortison vist at forårsage føtal resorption og ganespalte. Hos kaniner har hydrocortison forårsaget føtal resorption og flere misdannelser i hoved og abdomen. Derudover er der rapporteret om intrauterine vækstforstyrrelser og ændringer i centralnervesystemets funktionelle udvikling efter administration af kortikosteroider til drægtige dyr. 6. FARMACEUTISKE OPLYSNINGER 6.1 Hjælpestoffer Dinatriumphosphatdodecahydrat Natriumdihydrogenphosphatmonohydrat Natriumchlorid Dinatriumedetat Saltsyre (til ph-justering) Vand til injektionsvæsker 6.2 Uforligeligheder Ikke relevant. 6.3 Opbevaringstid 2 år i yderpakning. Efter åbning af brevet: Enkeltdosisbeholderen anvendes inden for 1 måned. Efter åbning af enkeltdosisbeholderen: Anvendes straks, og enkeltdosisbeholderen bortskaffes efter brug. Eftersom steriliteten ikke kan opretholdes efter åbning af en enkeltdosisbeholder, skal enhver ubrugt rest kasseres straks efter administration. 6.4 Særlige opbevaringsforhold Må ikke opbevares ved temperaturer over 25 C. Opbevar enkeltdosisbeholderen i brevet for at beskytte mod lys. Opbevaringsforhold efter anbrud af lægemidlet, se pkt Emballagetyper og pakningsstørrelser 10 enkeltdosisbeholdere (LDPE) med 0,4 ml øjendråber, opløsning pakket i et brev bestående af fire lag papir/polyethylen/aluminium/ethylencopolymer. Pakningsstørrelser: 10 (1x10), 20 (2x10), 30 (3x10) eller 60 (6 x 10) enkeltdosisbeholdere. Ikke alle pakningsstørrelser er nødvendigvis markedsført. Softacort SPC Side 6 af 7
7 6.6 Regler for destruktion og anden håndtering Ikke anvendt lægemiddel samt affald heraf skal bortskaffes i henhold til lokale retningslinjer. 7. INDEHAVER AF MARKEDSFØRINGSTILLADELSEN Laboratoires THEA 12, rue Louis Blériot Clermont-Ferrand Cedex 2 Frankrig Repræsentant Thea Nordic AB Storgatan Örebro Sverige 8. MARKEDSFØRINGSTILLADELSESNUMMER (NUMRE) DATO FOR FØRSTE MARKEDSFØRINGSTILLADELSE 3. april DATO FOR ÆNDRING AF TEKSTEN - Softacort SPC Side 7 af 7
PRODUKTRESUMÉ. for. Monopex, øjendråber, opløsning, enkeltdosisbeholder
 10. april 2014 PRODUKTRESUMÉ for Monopex, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 28299 1. LÆGEMIDLETS NAVN Monopex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 1
10. april 2014 PRODUKTRESUMÉ for Monopex, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 28299 1. LÆGEMIDLETS NAVN Monopex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 1
PRODUKTRESUMÉ. for. Zaditen, øjendråber, opløsning, enkeltdosisbeholder
 18. februar 2015 PRODUKTRESUMÉ for Zaditen, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 20678 1. LÆGEMIDLETS NAVN Zaditen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 0,4 ml indeholder 0,138 mg
18. februar 2015 PRODUKTRESUMÉ for Zaditen, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 20678 1. LÆGEMIDLETS NAVN Zaditen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 0,4 ml indeholder 0,138 mg
PRODUKTRESUMÉ. for. Sofradex, øjen- og øredråber, opløsning (2care4)
 28. november 2012 PRODUKTRESUMÉ for Sofradex, øjen- og øredråber, opløsning (2care4) 0. D.SP.NR. 2508 1. LÆGEMIDLETS NAVN Sofradex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dexamethason 0,5 mg/ml som
28. november 2012 PRODUKTRESUMÉ for Sofradex, øjen- og øredråber, opløsning (2care4) 0. D.SP.NR. 2508 1. LÆGEMIDLETS NAVN Sofradex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dexamethason 0,5 mg/ml som
PRODUKTRESUMÉ. for. Zovir, creme 5%, 2 g
 15. september 2014 PRODUKTRESUMÉ for Zovir, creme 5%, 2 g 0. D.SP.NR 8902 1. LÆGEMIDLETS NAVN Zovir 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aciclovir 50 mg/g Hjælpestoffer er anført under pkt. 6.1.
15. september 2014 PRODUKTRESUMÉ for Zovir, creme 5%, 2 g 0. D.SP.NR 8902 1. LÆGEMIDLETS NAVN Zovir 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aciclovir 50 mg/g Hjælpestoffer er anført under pkt. 6.1.
PRODUKTRESUMÉ. for. Terramycin-Polymyxin B, salve
 Produktinformation for Terramycin-Polymyxin B (Oxytetracyclin og Polymyxin B) Salve 30+1 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke Pakningsstørrelse 13 50 46 Salve 30+1 mg/g 15 g Dagsaktuel
Produktinformation for Terramycin-Polymyxin B (Oxytetracyclin og Polymyxin B) Salve 30+1 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke Pakningsstørrelse 13 50 46 Salve 30+1 mg/g 15 g Dagsaktuel
PRODUKTRESUMÉ. for. Voltaren Ophtha, øjendråber i enkeltdosisbeholder
 15. april 2013 PRODUKTRESUMÉ for Voltaren Ophtha, øjendråber i enkeltdosisbeholder 0. D.SP.NR. 3588 1. LÆGEMIDLETS NAVN Voltaren Ophtha 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml Voltaren Ophtha indeholder
15. april 2013 PRODUKTRESUMÉ for Voltaren Ophtha, øjendråber i enkeltdosisbeholder 0. D.SP.NR. 3588 1. LÆGEMIDLETS NAVN Voltaren Ophtha 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml Voltaren Ophtha indeholder
PRODUKTRESUMÉ. for. Voltabak, øjendråber, opløsning
 22. februar 2013 PRODUKTRESUMÉ for Voltabak, øjendråber, opløsning 0. D.SP.NR. 27464 1. LÆGEMIDLETS NAVN Voltabak 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diclofenacnatrium 1 mg/ml Hjælpestof: Polyoxyleret
22. februar 2013 PRODUKTRESUMÉ for Voltabak, øjendråber, opløsning 0. D.SP.NR. 27464 1. LÆGEMIDLETS NAVN Voltabak 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diclofenacnatrium 1 mg/ml Hjælpestof: Polyoxyleret
PRODUKTRESUMÉ. for. Antistina-Privin, øjendråber, opløsning
 25. marts 2013 PRODUKTRESUMÉ for Antistina-Privin, øjendråber, opløsning 0. D.SP.NR 1222 1. LÆGEMIDLETS NAVN Antistina-Privin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Antazolinsulfat 5 mg/ml + naphazolinnitrat
25. marts 2013 PRODUKTRESUMÉ for Antistina-Privin, øjendråber, opløsning 0. D.SP.NR 1222 1. LÆGEMIDLETS NAVN Antistina-Privin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Antazolinsulfat 5 mg/ml + naphazolinnitrat
PRODUKTRESUMÉ. for. Terramycin-Polymyxin B, øjensalve
 25. november 2011 PRODUKTRESUMÉ for Terramycin-Polymyxin B, øjensalve 0. D.SP.NR. 0071 1. LÆGEMIDLETS NAVN Terramycin-Polymyxin B 2. KVALITATIV OG KAVNTITATIV SAMMENSÆTNING Oxytetracyclin 5 mg/g som oxytetracyclinhydrochlorid
25. november 2011 PRODUKTRESUMÉ for Terramycin-Polymyxin B, øjensalve 0. D.SP.NR. 0071 1. LÆGEMIDLETS NAVN Terramycin-Polymyxin B 2. KVALITATIV OG KAVNTITATIV SAMMENSÆTNING Oxytetracyclin 5 mg/g som oxytetracyclinhydrochlorid
PRODUKTRESUMÉ. for. Otrivin ukonserveret, næsespray, opløsning
 13. januar 2014 PRODUKTRESUMÉ for Otrivin ukonserveret, næsespray, opløsning 0. D.SP.NR. 2164 1. LÆGEMIDLETS NAVN Otrivin ukonserveret 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Xylometazolinhydrochlorid
13. januar 2014 PRODUKTRESUMÉ for Otrivin ukonserveret, næsespray, opløsning 0. D.SP.NR. 2164 1. LÆGEMIDLETS NAVN Otrivin ukonserveret 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Xylometazolinhydrochlorid
PRODUKTRESUMÉ. for. Galieve Cool Mint, oral suspension
 12. maj 2015 PRODUKTRESUMÉ for Galieve Cool Mint, oral suspension 0. D.SP.NR. 27229 1. LÆGEMIDLETS NAVN Galieve Cool Mint 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én dosis/10 ml indeholder: 500 mg natriumalginat
12. maj 2015 PRODUKTRESUMÉ for Galieve Cool Mint, oral suspension 0. D.SP.NR. 27229 1. LÆGEMIDLETS NAVN Galieve Cool Mint 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én dosis/10 ml indeholder: 500 mg natriumalginat
PRODUKTRESUMÉ. for. Strepsils Citrus Sukkerfri, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils Citrus Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Citrus Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4-diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils Citrus Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Citrus Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4-diklorbenzylalkohol
PRODUKTRESUMÉ. for. Regaine Forte, kutanopløsning
 28. juni 2007 PRODUKTRESUMÉ for Regaine Forte, kutanopløsning 0. D.SP.NR. 6550 1. LÆGEMIDLETS NAVN Regaine Forte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Minoxidil 50 mg/ml Hjælpestoffer se pkt. 6.1.
28. juni 2007 PRODUKTRESUMÉ for Regaine Forte, kutanopløsning 0. D.SP.NR. 6550 1. LÆGEMIDLETS NAVN Regaine Forte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Minoxidil 50 mg/ml Hjælpestoffer se pkt. 6.1.
PRODUKTRESUMÉ. for. Mydriasert, øjenlamel
 10. april 2012 PRODUKTRESUMÉ for Mydriasert, øjenlamel 0. D.SP.NR. 23325 1. LÆGEMIDLETS NAVN Mydriasert 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En øjenlamel indeholder 0,28 mg tropicamid og 5,4 mg phenylephrin
10. april 2012 PRODUKTRESUMÉ for Mydriasert, øjenlamel 0. D.SP.NR. 23325 1. LÆGEMIDLETS NAVN Mydriasert 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En øjenlamel indeholder 0,28 mg tropicamid og 5,4 mg phenylephrin
PRODUKTRESUMÉ. for. Strepsils Jordbær Sukkerfri, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils Jordbær Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Jordbær Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils Jordbær Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Jordbær Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
PRODUKTRESUMÉ. for. Romefen Vet., tabletter
 29. oktober 2012 PRODUKTRESUMÉ for Romefen Vet., tabletter 0. D.SP.NR 8710 1. VETERINÆRLÆGEMIDLETS NAVN Romefen Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Ketoprofen 10 mg og 20 mg. 3. LÆGEMIDDELFORM
29. oktober 2012 PRODUKTRESUMÉ for Romefen Vet., tabletter 0. D.SP.NR 8710 1. VETERINÆRLÆGEMIDLETS NAVN Romefen Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Ketoprofen 10 mg og 20 mg. 3. LÆGEMIDDELFORM
Indlægsseddel: Information til brugeren. Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning. Dexamethasonnatriumphosphat/chloramphenicol
 Indlægsseddel: Information til brugeren Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning Dexamethasonnatriumphosphat/chloramphenicol Læs denne indlægsseddel grundigt, inden du begynder at bruge
Indlægsseddel: Information til brugeren Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning Dexamethasonnatriumphosphat/chloramphenicol Læs denne indlægsseddel grundigt, inden du begynder at bruge
PRODUKTRESUMÉ. for. Hyobac App 2 Vet., injektionsvæske, emulsion. Actinobacillus pleuropneumoniae, serotype 2, RP > 1*
 10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
PRODUKTRESUMÉ. for. Toltarox, oral suspension
 2. januar 2013 PRODUKTRESUMÉ for Toltarox, oral suspension 0. D.SP.NR 26780 1. VETERINÆRLÆGEMIDLETS NAVN Toltarox 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml oral suspension indeholder: Aktivt stof
2. januar 2013 PRODUKTRESUMÉ for Toltarox, oral suspension 0. D.SP.NR 26780 1. VETERINÆRLÆGEMIDLETS NAVN Toltarox 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml oral suspension indeholder: Aktivt stof
PRODUKTRESUMÉ. for. Uniferon, injektionsvæske, opløsning, beregnet til pattegrise
 9. april 2015 PRODUKTRESUMÉ for Uniferon, injektionsvæske, opløsning, beregnet til pattegrise 0. D.SP.NR 08324 1. VETERINÆRLÆGEMIDLETS NAVN Uniferon 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
9. april 2015 PRODUKTRESUMÉ for Uniferon, injektionsvæske, opløsning, beregnet til pattegrise 0. D.SP.NR 08324 1. VETERINÆRLÆGEMIDLETS NAVN Uniferon 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
PRODUKTRESUMÉ. for. Hydrocortison med Terramycin, salve
 26. maj 2014 PRODUKTRESUMÉ for Hydrocortison med Terramycin, salve 0. D.SP.NR. 299 1. LÆGEMIDLETS NAVN Hydrocortison med Terramycin 2. KVALITATIV OG KAVNTITATIV SAMMENSÆTNING Hydrocortison 10 mg/g + oxytetracyclin
26. maj 2014 PRODUKTRESUMÉ for Hydrocortison med Terramycin, salve 0. D.SP.NR. 299 1. LÆGEMIDLETS NAVN Hydrocortison med Terramycin 2. KVALITATIV OG KAVNTITATIV SAMMENSÆTNING Hydrocortison 10 mg/g + oxytetracyclin
PRODUKTRESUMÉ. for. Mega C 1500 "Tolico", depottabletter 1500 mg
 10. november 2010 PRODUKTRESUMÉ for Mega C 1500 "Tolico", depottabletter 1500 mg 0. D.SP.NR. - 1. LÆGEMIDLETS NAVN Mega C 1500 Tolico 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 depottablet indeholder:
10. november 2010 PRODUKTRESUMÉ for Mega C 1500 "Tolico", depottabletter 1500 mg 0. D.SP.NR. - 1. LÆGEMIDLETS NAVN Mega C 1500 Tolico 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 depottablet indeholder:
Indlægsseddel: Information til brugeren. TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension. tobramycin og dexamethason
 Indlægsseddel: Information til brugeren TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension tobramycin og dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
Indlægsseddel: Information til brugeren TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension tobramycin og dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
PRODUKTRESUMÉ. for. Strepsils med Honning & Citron, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils med Honning & Citron, sugetabletter 0. D.SP.NR. 1854 1. LÆGEMIDLETS NAVN Strepsils med Honning & Citron 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils med Honning & Citron, sugetabletter 0. D.SP.NR. 1854 1. LÆGEMIDLETS NAVN Strepsils med Honning & Citron 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
PRODUKTRESUMÉ. for. Dulcolax, suppositorier
 10. januar 2011 PRODUKTRESUMÉ for Dulcolax, suppositorier 0. D.SP.NR. 1603 1. LÆGEMIDLETS NAVN Dulcolax 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Bisacodyl 10 mg Hjælpestoffer er anført under pkt. 6.1.
10. januar 2011 PRODUKTRESUMÉ for Dulcolax, suppositorier 0. D.SP.NR. 1603 1. LÆGEMIDLETS NAVN Dulcolax 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Bisacodyl 10 mg Hjælpestoffer er anført under pkt. 6.1.
PRODUKTRESUMÉ. for. Metomotyl, injektionsvæske, opløsning
 12. december 2017 PRODUKTRESUMÉ for Metomotyl, injektionsvæske, opløsning 0. D.SP.NR. 28870 1. VETERINÆRLÆGEMIDLETS NAVN Metomotyl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml i 2,5 mg/ml opløsning
12. december 2017 PRODUKTRESUMÉ for Metomotyl, injektionsvæske, opløsning 0. D.SP.NR. 28870 1. VETERINÆRLÆGEMIDLETS NAVN Metomotyl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml i 2,5 mg/ml opløsning
PRODUKTRESUMÉ. for. Hydrocortison med Terramycin og Polymyxin B, øjen- og øredråber, suspension
 13. juni 2012 PRODUKTRESUMÉ for Hydrocortison med Terramycin og Polymyxin B, øjen- og øredråber, suspension 0. D.SP.NR. 2566 1. LÆGEMIDLETS NAVN Hydrocortison med Terramycin og Polymyxin B 2. KVALITATIV
13. juni 2012 PRODUKTRESUMÉ for Hydrocortison med Terramycin og Polymyxin B, øjen- og øredråber, suspension 0. D.SP.NR. 2566 1. LÆGEMIDLETS NAVN Hydrocortison med Terramycin og Polymyxin B 2. KVALITATIV
PRODUKTRESUMÉ. for. Spersadex Comp., øjendråber, opløsning 1+5 mg/ml
 3. september 2012 PRODUKTRESUMÉ for Spersadex Comp., øjendråber, opløsning 1+5 mg/ml 0. D.SP.NR. 9134 1. LÆGEMIDLETS NAVN Spersadex Comp. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder 1 mg
3. september 2012 PRODUKTRESUMÉ for Spersadex Comp., øjendråber, opløsning 1+5 mg/ml 0. D.SP.NR. 9134 1. LÆGEMIDLETS NAVN Spersadex Comp. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder 1 mg
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Allergodil 0,5 mg/ml øjendråber, opløsning. Azelastinhydrochlorid
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
PRODUKTRESUMÉ. for. Brentacort, salve
 22. december 2011 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
22. december 2011 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
PRODUKTRESUMÉ. for. Brentacort, creme
 6. juli 2015 PRODUKTRESUMÉ for Brentacort, creme 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
6. juli 2015 PRODUKTRESUMÉ for Brentacort, creme 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
PRODUKTRESUMÉ. for. Urilin, syrup
 21. juni 2011 PRODUKTRESUMÉ for Urilin, syrup 0. D.SP.NR 27072 1. VETERINÆRLÆGEMIDLETS NAVN Urilin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Phenylpropanolamin 40,29 mg (svarende
21. juni 2011 PRODUKTRESUMÉ for Urilin, syrup 0. D.SP.NR 27072 1. VETERINÆRLÆGEMIDLETS NAVN Urilin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Phenylpropanolamin 40,29 mg (svarende
PRODUKTRESUMÉ. for. Nixema, medicinsk plaster
 10. april 2007 PRODUKTRESUMÉ for Nixema, medicinsk plaster 0. D.SP.NR. 22894 1. LÆGEMIDLETS NAVN Nixema 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Mængde anført på mærkningen Aktivt stof mg/cm 2 mg/brik
10. april 2007 PRODUKTRESUMÉ for Nixema, medicinsk plaster 0. D.SP.NR. 22894 1. LÆGEMIDLETS NAVN Nixema 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Mængde anført på mærkningen Aktivt stof mg/cm 2 mg/brik
PRODUKTRESUMÉ. for. Pevisone, creme
 18. december 2014 PRODUKTRESUMÉ for Pevisone, creme 0. D.SP.NR. 3858 1. LÆGEMIDLETS NAVN Pevisone 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Triamcinolonacetonid 1 mg/g + econazolnitrat 10 mg/g Alle hjælpestoffer
18. december 2014 PRODUKTRESUMÉ for Pevisone, creme 0. D.SP.NR. 3858 1. LÆGEMIDLETS NAVN Pevisone 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Triamcinolonacetonid 1 mg/g + econazolnitrat 10 mg/g Alle hjælpestoffer
PRODUKTRESUMÉ. for. Panodil, filmovertrukne tabletter
 7. januar 2013 PRODUKTRESUMÉ for Panodil, filmovertrukne tabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver tablet indeholder 500 mg eller 1000 mg paracetamol.
7. januar 2013 PRODUKTRESUMÉ for Panodil, filmovertrukne tabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver tablet indeholder 500 mg eller 1000 mg paracetamol.
PRODUKTRESUMÉ. for. Promon Vet., tabletter
 9. april 2014 PRODUKTRESUMÉ for Promon Vet., tabletter 0. D.SP.NR 3787 1. VETERINÆRLÆGEMIDLETS NAVN Promon Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: 1 tablet indeholder: Medroxyprogesteronacetat
9. april 2014 PRODUKTRESUMÉ for Promon Vet., tabletter 0. D.SP.NR 3787 1. VETERINÆRLÆGEMIDLETS NAVN Promon Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: 1 tablet indeholder: Medroxyprogesteronacetat
PRODUKTRESUMÉ. for. Panodil Brus, brusetabletter
 7. januar 2013 PRODUKTRESUMÉ for Panodil Brus, brusetabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Brus 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver brusetablet indeholder 500 mg paracetamol.
7. januar 2013 PRODUKTRESUMÉ for Panodil Brus, brusetabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Brus 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver brusetablet indeholder 500 mg paracetamol.
PRODUKTRESUMÉ. for. Brentacort, salve
 26. november 2013 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
26. november 2013 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning
 Indlægsseddel: Information til brugeren Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning hypromellose Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Viskøse
Indlægsseddel: Information til brugeren Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning hypromellose Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Viskøse
Indlægsseddel: Information til brugeren. Ciloxan 3 mg/ml, øjendråber, opløsning. ciprofloxacin
 Indlægsseddel: Information til brugeren Ciloxan 3 mg/ml, øjendråber, opløsning ciprofloxacin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Ciloxan 3 mg/ml, øjendråber, opløsning ciprofloxacin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. Maxidex 1 mg/ml, øjendråber, suspension. dexamethason
 Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
PRODUKTRESUMÉ. for. Canidryl, tabletter. 50.0 mg/tablet 100.0 mg/tablet Hjælpestoffer Se pkt. 6.1 for en fuldstændig fortegnelse over hjælpestoffer.
 29. oktober 2012 PRODUKTRESUMÉ for Canidryl, tabletter 0. D.SP.NR 23484 1. VETERINÆRLÆGEMIDLETS NAVN Canidryl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof Carprofen 20.0 mg/tablet 50.0 mg/tablet
29. oktober 2012 PRODUKTRESUMÉ for Canidryl, tabletter 0. D.SP.NR 23484 1. VETERINÆRLÆGEMIDLETS NAVN Canidryl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof Carprofen 20.0 mg/tablet 50.0 mg/tablet
PRODUKTRESUMÉ. for. Stabox Vet, oralt pulver
 22. august 2017 PRODUKTRESUMÉ for Stabox Vet, oralt pulver 0. D.SP.NR 09911 1. VETERINÆRLÆGEMIDLETS NAVN Stabox Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hvert gram indeholder: Aktivt stof: Amoxicillin
22. august 2017 PRODUKTRESUMÉ for Stabox Vet, oralt pulver 0. D.SP.NR 09911 1. VETERINÆRLÆGEMIDLETS NAVN Stabox Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hvert gram indeholder: Aktivt stof: Amoxicillin
PRODUKTRESUMÉ. for. Antepsin, tabletter
 26. oktober 2012 PRODUKTRESUMÉ for Antepsin, tabletter 0. D.SP.NR. 3919 1. LÆGEMIDLETS NAVN Antepsin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Sucralfat 1 g Alle hjælpestoffer er anført under pkt. 6.1.
26. oktober 2012 PRODUKTRESUMÉ for Antepsin, tabletter 0. D.SP.NR. 3919 1. LÆGEMIDLETS NAVN Antepsin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Sucralfat 1 g Alle hjælpestoffer er anført under pkt. 6.1.
PRODUKTRESUMÉ. for. Kelactin Vet., oral opløsning
 4. maj 2015 PRODUKTRESUMÉ for Kelactin Vet., oral opløsning 0. D.SP.NR 27896 1. VETERINÆRLÆGEMIDLETS NAVN Kelactin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml af produktet indeholder: Aktivt stof:
4. maj 2015 PRODUKTRESUMÉ for Kelactin Vet., oral opløsning 0. D.SP.NR 27896 1. VETERINÆRLÆGEMIDLETS NAVN Kelactin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml af produktet indeholder: Aktivt stof:
PRODUKTRESUMÉ. for. Creon 25.000, hårde enterokapsler
 24. august 2015 PRODUKTRESUMÉ for Creon 25.000, hårde enterokapsler 0. D.SP.NR 818 1. LÆGEMIDLETS NAVN Creon 25.000 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 kapsel indeholder 300 mg pankreatin svarende
24. august 2015 PRODUKTRESUMÉ for Creon 25.000, hårde enterokapsler 0. D.SP.NR 818 1. LÆGEMIDLETS NAVN Creon 25.000 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 kapsel indeholder 300 mg pankreatin svarende
Indlægsseddel: Information til brugeren. Aprokam 50 mg pulver til injektionsvæske, opløsning. Cefuroxim
 Indlægsseddel: Information til brugeren Aprokam 50 mg pulver til injektionsvæske, opløsning Cefuroxim Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Aprokam 50 mg pulver til injektionsvæske, opløsning Cefuroxim Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Equimucin Vet., oralt pulver
 29. oktober 2009 PRODUKTRESUMÉ for Equimucin Vet., oralt pulver 0. D.SP.NR. 22316 1. VETERINÆRLÆGEMIDLETS NAVN Equimucin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Acetylcystein 2 g Alle
29. oktober 2009 PRODUKTRESUMÉ for Equimucin Vet., oralt pulver 0. D.SP.NR. 22316 1. VETERINÆRLÆGEMIDLETS NAVN Equimucin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Acetylcystein 2 g Alle
PRODUKTRESUMÉ. for. Coxofen, injektionsvæske, opløsning
 7. januar 2013 PRODUKTRESUMÉ for Coxofen, injektionsvæske, opløsning 0. D.SP.NR 27784 1. VETERINÆRLÆGEMIDLETS NAVN Coxofen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én ml indeholder: Aktivt stof: Ketoprofen
7. januar 2013 PRODUKTRESUMÉ for Coxofen, injektionsvæske, opløsning 0. D.SP.NR 27784 1. VETERINÆRLÆGEMIDLETS NAVN Coxofen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én ml indeholder: Aktivt stof: Ketoprofen
PRODUKTRESUMÉ. for. Beclomet Easyhaler, inhalationspulver
 8. marts 2011 PRODUKTRESUMÉ for Beclomet Easyhaler, inhalationspulver 0. D.SP.NR. 9844 1. LÆGEMIDLETS NAVN Beclomet Easyhaler 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En afmålt dosis indeholder henholdsvis
8. marts 2011 PRODUKTRESUMÉ for Beclomet Easyhaler, inhalationspulver 0. D.SP.NR. 9844 1. LÆGEMIDLETS NAVN Beclomet Easyhaler 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En afmålt dosis indeholder henholdsvis
18. maj 2011 PRODUKTRESUMÉ. for. Canaural, øredråber, suspension 0. D.SP.NR. 3209. 1. VETERINÆRLÆGEMIDLETS NAVN Canaural
 18. maj 2011 PRODUKTRESUMÉ for Canaural, øredråber, suspension 0. D.SP.NR. 3209 1. VETERINÆRLÆGEMIDLETS NAVN Canaural 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 g suspension indeholder: Aktive stoffer:
18. maj 2011 PRODUKTRESUMÉ for Canaural, øredråber, suspension 0. D.SP.NR. 3209 1. VETERINÆRLÆGEMIDLETS NAVN Canaural 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 g suspension indeholder: Aktive stoffer:
Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste.
 1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
PRODUKTRESUMÉ. for. Avipro THYMOVAC, lyofilisat til anvendelse i drikkevand
 21. december 2009 PRODUKTRESUMÉ for Avipro THYMOVAC, lyofilisat til anvendelse i drikkevand 0. D.SP.NR 08763 1. VETERINÆRLÆGEMIDLETS NAVN Avipro THYMOVAC 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis
21. december 2009 PRODUKTRESUMÉ for Avipro THYMOVAC, lyofilisat til anvendelse i drikkevand 0. D.SP.NR 08763 1. VETERINÆRLÆGEMIDLETS NAVN Avipro THYMOVAC 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis
PRODUKTRESUMÉ. for. Panodil Hot, pulver til oral opløsning, brev
 7. januar 2013 PRODUKTRESUMÉ for Panodil Hot, pulver til oral opløsning, brev 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Hot 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hvert brev indeholder 500 mg paracetamol.
7. januar 2013 PRODUKTRESUMÉ for Panodil Hot, pulver til oral opløsning, brev 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Hot 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hvert brev indeholder 500 mg paracetamol.
Zovir 5 % creme Aciclovir
 11. november 2016 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
11. november 2016 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
Indlægsseddel: Information til brugeren. Maxidex 1 mg/ml, øjendråber, suspension. dexamethason
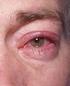 Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
PRODUKTRESUMÉ. for. Benylan, oral opløsning
 28. juni 2007 PRODUKTRESUMÉ for Benylan, oral opløsning 0. D.SP.NR. 0958 1. LÆGEMIDLETS NAVN Benylan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diphenhydraminhydrochlorid 2,8 mg/ml Hjælpestoffer se pkt.
28. juni 2007 PRODUKTRESUMÉ for Benylan, oral opløsning 0. D.SP.NR. 0958 1. LÆGEMIDLETS NAVN Benylan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diphenhydraminhydrochlorid 2,8 mg/ml Hjælpestoffer se pkt.
Ketoconazole Shampoo "Actavis" 2 %
 Indlægsseddel: Information til brugeren Ketoconazole Shampoo "Actavis" 2 % shampoo 20 mg/g ketoconazol Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Ketoconazole Shampoo "Actavis" 2 % shampoo 20 mg/g ketoconazol Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til patienten. Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin
 Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Purevax Rabies, injektionsvæske, suspension. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 1 ml indeholder: Aktivt stof: Rabies rekombinant
BILAG I PRODUKTRESUME 1 1. VETERINÆRLÆGEMIDLETS NAVN Purevax Rabies, injektionsvæske, suspension. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis på 1 ml indeholder: Aktivt stof: Rabies rekombinant
Indlægsseddel: Information til brugeren. Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder. Latanoprost
 Indlægsseddel: Information til brugeren Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder Latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
Indlægsseddel: Information til brugeren Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder Latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
PRODUKTRESUMÉ. for. Baytril Vet., tabletter
 21. marts 2014 PRODUKTRESUMÉ for Baytril Vet., tabletter 0. D.SP.NR 08259 1. VETERINÆRLÆGEMIDLETS NAVN Baytril Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 tablet indeholder: Aktive stoffer: 50 mg
21. marts 2014 PRODUKTRESUMÉ for Baytril Vet., tabletter 0. D.SP.NR 08259 1. VETERINÆRLÆGEMIDLETS NAVN Baytril Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 tablet indeholder: Aktive stoffer: 50 mg
Indlægsseddel: Information til brugeren. Betnovat 1 mg/ml kutanopløsning Betamethason
 Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Betnovat 1 mg/ml kutanopløsning Betamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
PRODUKTRESUMÉ. for. Brentacort, creme
 26. november 2013 PRODUKTRESUMÉ for Brentacort, creme 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
26. november 2013 PRODUKTRESUMÉ for Brentacort, creme 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
PRODUKTRESUMÉ. for. Florgane, injektionsvæske, suspension
 16. april 2012 PRODUKTRESUMÉ for Florgane, injektionsvæske, suspension 0. D.SP.NR 26482 1. VETERINÆRLÆGEMIDLETS NAVN Florgane 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Florfenicol
16. april 2012 PRODUKTRESUMÉ for Florgane, injektionsvæske, suspension 0. D.SP.NR 26482 1. VETERINÆRLÆGEMIDLETS NAVN Florgane 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Florfenicol
Amning: Vivotif bør kun anvendes på tvingende indikation i ammeperioden.
 8. december 2008 PRODUKTRESUMÉ for Vivotif, hårde enterokapsler 0. D.SP.NR. 6673 1. LÆGEMIDLETS NAVN Vivotif 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis indeholder: Mindst 2 x 10 9 levende organismer
8. december 2008 PRODUKTRESUMÉ for Vivotif, hårde enterokapsler 0. D.SP.NR. 6673 1. LÆGEMIDLETS NAVN Vivotif 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis indeholder: Mindst 2 x 10 9 levende organismer
PRODUKTRESUMÉ. for. Canicaral Vet., tabletter 40 mg
 25. juni 2015 PRODUKTRESUMÉ for Canicaral Vet., tabletter 40 mg 0. D.SP.NR. 29383 1. VETERINÆRLÆGEMIDLETS NAVN Canicaral Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 tablet indeholder: Aktivt stof:
25. juni 2015 PRODUKTRESUMÉ for Canicaral Vet., tabletter 40 mg 0. D.SP.NR. 29383 1. VETERINÆRLÆGEMIDLETS NAVN Canicaral Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 tablet indeholder: Aktivt stof:
PRODUKTRESUMÉ. for. Aurovet, oralt pulver
 12. januar 2015 PRODUKTRESUMÉ for Aurovet, oralt pulver 0. D.SP.NR 24814 1. VETERINÆRLÆGEMIDLETS NAVN Aurovet 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Chlortetracyclin (som chlortetracyclinhydrochlorid)
12. januar 2015 PRODUKTRESUMÉ for Aurovet, oralt pulver 0. D.SP.NR 24814 1. VETERINÆRLÆGEMIDLETS NAVN Aurovet 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Chlortetracyclin (som chlortetracyclinhydrochlorid)
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1/19 1. VETERINÆRLÆGEMIDLETS NAVN Eurican Herpes 205 pulver og solvens til injektionsvæske, emulsion. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof 1 dosis á 1 ml indeholder:
BILAG I PRODUKTRESUME 1/19 1. VETERINÆRLÆGEMIDLETS NAVN Eurican Herpes 205 pulver og solvens til injektionsvæske, emulsion. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof 1 dosis á 1 ml indeholder:
PRODUKTRESUMÉ. for. Fucibet, creme (EuroPharmaDK)
 30. august 2012 PRODUKTRESUMÉ for Fucibet, creme (EuroPharmaDK) 0. D.SP.NR. 6395 1. LÆGEMIDLETS NAVN Fucibet 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Fusidinsyre 20 mg/g og betamethasonvalerat svarende
30. august 2012 PRODUKTRESUMÉ for Fucibet, creme (EuroPharmaDK) 0. D.SP.NR. 6395 1. LÆGEMIDLETS NAVN Fucibet 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Fusidinsyre 20 mg/g og betamethasonvalerat svarende
NeuroBloc Botulismetoksin type B injektionsvæske, opløsning 5.000 E/ml
 NeuroBloc Botulismetoksin type B injektionsvæske, opløsning 5.000 E/ml Vigtig sikkerhedsinformation til læger Formålet med denne vejledning er at informere læger, der er godkendt til at ordinere og administrere
NeuroBloc Botulismetoksin type B injektionsvæske, opløsning 5.000 E/ml Vigtig sikkerhedsinformation til læger Formålet med denne vejledning er at informere læger, der er godkendt til at ordinere og administrere
Indlægsseddel: Information til brugeren. Nix 5 %, creme permethrin
 Indlægsseddel: Information til brugeren Nix 5 %, creme permethrin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Brug altid Nix nøjagtigt
Indlægsseddel: Information til brugeren Nix 5 %, creme permethrin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Brug altid Nix nøjagtigt
for Olbetam, kapsler, hårde
 Produktinformation for Olbetam (Acipimox) Kapsler 250 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 41 24 00 Kapsler 250 mg 90 stk. Dagsaktuel pris findes på www.medicinpriser.dk
Produktinformation for Olbetam (Acipimox) Kapsler 250 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 41 24 00 Kapsler 250 mg 90 stk. Dagsaktuel pris findes på www.medicinpriser.dk
11. juli 2005 PRODUKTRESUMÉ. for. Gammanorm, injektionsvæske, opløsning 0. D.SP.NR. 9322. 1. LÆGEMIDLETS NAVN Gammanorm
 11. juli 2005 PRODUKTRESUMÉ for Gammanorm, injektionsvæske, opløsning 0. D.SP.NR. 9322 1. LÆGEMIDLETS NAVN Gammanorm 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Normalt immunglobulin, humant 165 mg/ml Hjælpestoffer
11. juli 2005 PRODUKTRESUMÉ for Gammanorm, injektionsvæske, opløsning 0. D.SP.NR. 9322 1. LÆGEMIDLETS NAVN Gammanorm 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Normalt immunglobulin, humant 165 mg/ml Hjælpestoffer
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Hydrocortison med Terramycin og Polymyxin B 15 mg/ml / 5 mg/ml / 1 mg/ml Øjen- og øredråber, suspension hydrocortisonacetat/oxytetracyclinhydrochlorid/polymyxin
Indlægsseddel: Information til brugeren Hydrocortison med Terramycin og Polymyxin B 15 mg/ml / 5 mg/ml / 1 mg/ml Øjen- og øredråber, suspension hydrocortisonacetat/oxytetracyclinhydrochlorid/polymyxin
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Magnevist 2 mmol/l, injektionsvæske, opløsning Gadopentetinsyre Læs denne indlægsseddel grundigt, inden du begynder at bruge medicinen. Gem indlægssedlen. Du kan
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Magnevist 2 mmol/l, injektionsvæske, opløsning Gadopentetinsyre Læs denne indlægsseddel grundigt, inden du begynder at bruge medicinen. Gem indlægssedlen. Du kan
PRODUKTRESUMÉ. for. Hydrocortison med Terramycin, salve
 Produktinformation for Hydrocortison m. Terramycin (Hydrocortison+ oxytetracyclin) Salve, 10 + 30 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke 18 07 45 Salve 10+30 mg/g 05 42 62 Salve 10+30
Produktinformation for Hydrocortison m. Terramycin (Hydrocortison+ oxytetracyclin) Salve, 10 + 30 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke 18 07 45 Salve 10+30 mg/g 05 42 62 Salve 10+30
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Zymelin menthol ukonserveret 1 mg/ml næsespray, opløsning Xylometazolinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Zymelin menthol ukonserveret 1 mg/ml næsespray, opløsning Xylometazolinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
Indlægsseddel: Information til brugeren. Tobrex Depot 3 mg/ml, depotøjendråber, opløsning. tobramycin
 Indlægsseddel: Information til brugeren Tobrex Depot 3 mg/ml, depotøjendråber, opløsning tobramycin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Tobrex Depot 3 mg/ml, depotøjendråber, opløsning tobramycin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Progressis Vet., injektionsvæske, emulsion
 29. oktober 2012 PRODUKTRESUMÉ for Progressis Vet., injektionsvæske, emulsion 0. D.SP.NR 20644 1. VETERINÆRLÆGEMIDLETS NAVN Progressis Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis (2 ml) indeholder:
29. oktober 2012 PRODUKTRESUMÉ for Progressis Vet., injektionsvæske, emulsion 0. D.SP.NR 20644 1. VETERINÆRLÆGEMIDLETS NAVN Progressis Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis (2 ml) indeholder:
PRODUKTRESUMÉ. for. Malaseb Vet., shampoo
 15. juli 2010 PRODUKTRESUMÉ for Malaseb Vet., shampoo 0. D.SP.NR 25817 1. VETERINÆRLÆGEMIDLETS NAVN Malaseb Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktive stoffer: Chlorhexidindigluconat
15. juli 2010 PRODUKTRESUMÉ for Malaseb Vet., shampoo 0. D.SP.NR 25817 1. VETERINÆRLÆGEMIDLETS NAVN Malaseb Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktive stoffer: Chlorhexidindigluconat
PRODUKTRESUMÉ. for. Mucolysin Skovbær, brusetabletter
 1. februar 2012 PRODUKTRESUMÉ for Mucolysin Skovbær, brusetabletter 0. D.SP.NR. 22946 1. LÆGEMIDLETS NAVN Mucolysin Skovbær 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En brusetablet indeholder 200 mg acetylcystein.
1. februar 2012 PRODUKTRESUMÉ for Mucolysin Skovbær, brusetabletter 0. D.SP.NR. 22946 1. LÆGEMIDLETS NAVN Mucolysin Skovbær 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En brusetablet indeholder 200 mg acetylcystein.
PRODUKTRESUMÉ. for. Mini-Pe, tabletter
 Produktinformation for Mini-Pe (Norethisteron) Tabletter 0,35 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 17 53 23 Tabletter 0,35 mg 3 x 28 stk. (blister) Dagsaktuel pris
Produktinformation for Mini-Pe (Norethisteron) Tabletter 0,35 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 17 53 23 Tabletter 0,35 mg 3 x 28 stk. (blister) Dagsaktuel pris
