BILAG I VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF BETINGELSERNE FOR MARKEDSFØRINGSTILLADELSEN/-TILLADELSERNE
|
|
|
- Clara Henningsen
- 5 år siden
- Visninger:
Transkript
1 BILAG I VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF BETINGELSERNE FOR MARKEDSFØRINGSTILLADELSEN/-TILLADELSERNE 1
2 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport om PSUR'en/PSUR'erne for mycophenolatmofetil, mycophenolsyre er CHMP nået frem til følgende videnskabelige konklusioner: Efter en gennemgang af tilgængelig information om graviditet, efter faderen er blevet eksponeret for mycophenolatmofetil eller mycophenolsyre, herunder en gennemgang af alle ikke-kliniske data og information om overførsel af mycophenolsyre via sædvæske, konkluderede PRAC, at data ikke viser nogen mønstre eller en stigning i medfødte misdannelser eller spontane aborter. PRAC anbefalede derfor at ændre produktinformationen, for at opdatere information om teratogen virkning og graviditet, samt præventionsanbefalingerne til mandlige patienter. Der er foretaget yderligere ændringer vedrørende brug af prævention hos kvinder og graviditetstest, for at præcisere kravene. CHMP tilslutter sig PRAC's videnskabelige konklusioner. Begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne På baggrund af de videnskabelige konklusioner for mycophenolatmofetil, mycophenolsyre er CHMP af den opfattelse, at benefit/risk-forholdet for det lægemiddel/de lægemidler, der indeholder mycophenolatmofetil, mycophenolsyre, forbliver uændret under forudsætning af, at de foreslåede ændringer indføres i produktinformationen. CHMP er nået frem til, at markedsføringstilladelsen/-tilladelserne omfattet af denne PSUR-vurdering bør ændres. 2
3 BILAG II ÆNDRINGER I PRODUKTINFORMATIONEN FOR DET/DE NATIONALT GODKENDTE LÆGEMIDDEL/LÆGEMIDLER 3
4 Ændringer, der skal indføres i de relevante punkter i produktresumeet (ny tekst med fed skrift, slettet tekst med gennemstregning) Punkt 4.4 Teratogen virkning Mycophenolat har en potent teratogen virkning hos mennesker. Spontane aborter (frekvens på 45% til 49%) og medfødte misdannelser (estimeret frekvens på 23% til 27%) er blevet rapporteret efter mycophenolatmofetil eksponering under graviditet. Derfor er CellCept kontraindiceret under graviditet, medmindre der ikke findes en hensigtsmæssig alternativ behandling til at forhindre afstødning af transplantatet. Fertile Kvinder og mænd i den fødedygtige alder skal informeres om risici og følge anbefalingerne angivet under pkt. 4.6 (f.eks. prævention, graviditetstests) før, under og efter behandling med CellCept. Lægen skal sikre, at kvinder og mænd, som tager mycophenolat, forstår risikoen for skader hos barnet, nødvendigheden af sikker prævention og nødvendigheden af at kontakte lægen straks, hvis der er risiko for graviditet. Antikonception (se pkt. 4.6) På grund af robust klinisk evidens, der viser en høj risiko for abort og fosterskader, når mycophenolat mofetil anvendes under graviditet, skal graviditet under behandlingen undgås.cellcepts genotoksiske og teratogene potentiale, Derfor skal fertile kvinder anvende mindst en pålidelig form for antikonception (se pkt. 4.3) to pålidelige former for antikonception samtidig, inden behandling med CellCept påbegyndes, under behandlingen og i seks uger efter behandlingsophør, medmindre seksuel afholdenhed er den valgte form for prævention (se pkt. 4.5). Samtidig brug af to komplementære former for antikonception fortrækkes for at minimere risikoen for svigt i prævention og utilsigtet graviditet. Seksuelt aktive mænd anbefales at bruge kondom under behandlingen og i mindst 90 dage efter behandlings ophør. Både fertile og vasektomerede mænd skal anvende kondom, eftersom risiciene i forbindelse med overførsel af sædvæske også gælder for mænd, som har undergået vasektomi. Derudover anbefales det, at kvindelige partnere til mandlige patienter anvender højeffektiv prævention under behandlingen og i 90 dage efter sidste CellCept-dosis. For antikonceptionelle råd til mænd, se pkt Punkt 4.6 Antikonception hos mænd og kvinder CellCept er kontraindiceret til fertile kvinder, som ikke anvender højeffektiv antikonception. På grund af CellCepts genotoksiske og teratogene potentiale, skal fertile kvinder anvende to pålidelige former for antikonception samtidig, inden behandling med CellCept påbegyndes, under behandlingen og i seks uger efter behandlingsophør, medmindre seksuel afholdenhed er den valgte form for prævention (se pkt. 4.5). Seksuelt aktive mænd anbefales at bruge kondom under behandlingen og i mindst 90 dage efter behandlings ophør. Både fertile og vasektomerede mænd skal anvende kondom, eftersom risiciene i forbindelse med overførsel af sædvæske også gælder for mænd, som har undergået vasektomi. Derudover anbefales det, at kvindelige partnere til mandlige patienter anvender højeffektiv prævention under behandlingen og i 90 dage efter sidste CellCept-dosis. Kvinder i den fødedygtige alder Indtagelse af mycophenolat under graviditet skal undgås. Derfor skal kvinder i den fødedygtige alder anvende mindst en form for pålidelig antikonception (se pkt. 4.3), inden behandling med CellCept påbegyndes, under behandlingen og i seks uger efter behandlingsophør, medmindre 4
5 seksuel afholdenhed er den valgte form for prævention. Samtidigt brug af to komplementære former for prævention er foretrukket. Graviditet CellCept er kontraindiceret under graviditet, medmindre der ikke findes en hensigtsmæssig alternativ behandling, og for at udelukke en uønsket anvendelse under graviditet må behandling ikke initieres, uden at en negativ graviditetstest foreligger. Når behandlingen initieres, skal fertile kvinder og mænd informeres om den øgede risiko for abort og medfødte misdannelser, og de skal vejledes omkring prævention og graviditetsplanlægning. Før CellCept-behandlingen initieres, skal fertile kvinder have lavet en to negative graviditetstests (serum eller urin) med en sensitivitet på mindst 25 mie/ml for at udelukke en uønsket mycophenolat-eksponering til fosteret.to graviditetstests (serum eller urin) med en sensitivitet på mindst 25 mie/ml anbefales.det anbefales, at ttesten nummer 2 skal udføres 8-10 dage senere. efter den første og umiddelbart inden initiering af mycophenolatmofetil-behandling. Ved modtagelse af transplantater fra afdøde donorer, kan det på grund af tidspunktet for tilgængeligheden af transplantationsorganet, ikke altid være muligt at udføre to tests 8-10 dage efter hinanden, inden behandlingen initieres. Derfor skal en graviditetstest udføres umiddelbart før behandlingen initieres og en yderligere test udføres 8-10 dage senere. En ny graviditetstest skal udføres som klinisk indiceret (f.eks. efter rapportering af manglende antikonception). Resultaterne af alle graviditetstests skal diskuteres med patienten. Patienterne skal informeres om straks at kontakte deres læge, hvis graviditet opstår. Mycophenolat har en potent teratogen virkning hos mennesker med en øget risiko for spontane aborter og medfødte misdannelser ved eksponering under graviditet: Spontante aborter er rapporteret hos 45 til 49 % af de gravide kvinder, som var eksponeret for mycophenolatmofetil, sammenlignet med en hyppighed på 12 til 33 % hos patienter, der havde gennemgået en transplantation af solide organer, og som blev behandlet med andre immunsuppressiva end mycophenolatmofetil. Baseret på litteratur rapporter forekom misdannelser hos 23 til 27% af levendefødte børn, hvor moderen var eksponeret for mycophenolatmofetil under graviditet (sammenlignet med 2 til 3% hos levendefødte børn i hele populationen og ca. 4 til 5% hos patienter, der havde gennemgået en transplantation af solide organer, og som blev behandlet med andre immunsuppressiva end mycophenolatmofetil). Efter markedsføring er der observeret medfødte misdannelser, herunder rapporter om multiple misdannelser hos børn af patienter, som under graviditeten var blevet behandlet med CellCept i kombination med andre immunsuppressiva. Følgende misdannelser blev hyppigst rapporteret: abnormiteter i ørerne (f.eks. abnormt formet eller manglende ydre øre/mellemøre), tillukning af øregangen (mellemøre); medfødt hjertesygdom såsom atriale og ventrikulære septum defekter; misdannelser i ansigtet såsom læbespalte, ganespalte, mikrognati og hypertelorisme; abnormiteter i øjnene (f.eks. coloboma); medfødt hjertesygdom såsom atriale og ventrikulære septum defekter; misdannelser af fingre ( f.eks. polydaktyli, syndaktyli); trakeo-øsofageale misdannelser (f.eks. øsofagusatresi); misdannelser i nervesystemet såsom rygmarvsbrok; renale abnormiteter. Derudover har der været enkelte rapporter om følgende misdannelser: mikroftalmi; medfødt plexus choriodeus-cyste; septum pellucidum agenesi; 5
6 nervus olfactorius agenesi. Dyrestudier har vist reproduktionstoksicitet (se pkt. 5.3). Mænd Begrænset klinisk evidens indikerer ikke en øget risiko for misdannelser eller abort efter eksponering for mycophenolat mofetil hos mandelig partner. MPA er et stærkt teratogen. Det vides ikke, om MPA findes i sæd. Beregninger baseret på dyremodeller viser, at den maksimale mængde af MPA, der potentielt kunne overføres til kvinden, er så lav, at det sandsynligvis ikke vil have effekt. Mycophenolat har vist sig at være genotoksisk i dyrestudier ved koncentrationer, der kun overstiger de menneskelige terapeutiske eksponeringer med små marginer, således at risikoen for genotoksiske virkninger på sædceller ikke helt kan udelukkes. Derfor anbefales det som sikkerhedsforanstaltning, at sexuelt aktive mandlige patienter eller deres kvindelige partnere at anvende pålidelig antikonception under behandling af den mandlige patient og i mindst 90 dage efter ophør af mycophenolat mofetil. Mandlige patienter med reproduktivt potentiale bør gøres opmærksom på og diskutere med kvalificeret sundhedspersonele de potentielle risici ved at at blive far til et barn under mycophenolat mofetil behandling. Ændringer, der skal indføres i de relevante punkter i patientinformationen (ny tekst med fed skrift, slettet tekst med gennemstregning) Graviditet, prævention og amning Prævention hos kvinder, som tager CellCept Hvis du er kvinde og kan blive gravid, skal du altid bruge to en effektive præventionsmetoder, mens du tager CellCept, herunder: Før du starter med at tage CellCept Under hele behandlingen med CellCept I 6 uger efter du er stoppet med at tage CellCept. Tal med din læge om den bedst egnede prævention for dig. Det vil afhænge af din situation. Brug af to former for prævention er bedre, da dette vil gøre risikoen for utilsigtet graviditet mindre. Det vil afhænge af din situation. Kontakt lægen så hurtig som muligt, hvis du tror at din prævention har svigtet, eller hvis du har glemt at tage de svangerskabsforebyggende tabletter (f.eks. p-piller). Hvis du er kvinde, kan du ikke blive gravid, hvis et af følgende gælder for dig: Du har passeret overgangsalderen, dvs. er mindst 50 år, og din sidste menstruation var for mere end et år siden (hvis din menstruation er stoppet, fordi du er blevet behandlet for kræft, er der stadigvæk mulighed for, at du kan blive gravid) Dine æggeledere og begge æggestokke er blevet fjernet ved operation (bilateral salpingoooforektomi) Din livmoder (uterus) er blevet fjernet ved operation (hysterektomi) Dine æggestokke er ophørt med at fungere (for tidligt ovariesvigt, som er blevet bekræftet af en speciallæge i gynækologi) Du blev født med en af følgende sjældne tilstande, som gør graviditet umulig: XY-genotype, Turners syndrom eller manglende livmoder Du er barn eller teenager og endnu ikke har fået menstruation. Prævention hos mænd, som tager Cellcept Der ses ikke en øget risiko for misdannelser eller abort hvis faderen tager mycophenolat, ud fra de kendte data. En risiko kan dog ikke udelukkes helt. Som en ekstra sikkerhed anbefales det, at 6
7 du eller din kvindelige partner bruger pålidelig prævention Du skal altid anvende kondom under behandlingen og i 90 dage efter, at du er stoppet med at tage CellCept. Hvis du planlægger at få et barn, vil lægen skal du tale med dig din læge om potentielle risici og alternative behandlinger, som du kan tage for at forhindre afstødning af det transplanterede organ. 7
Myfortic (mycophenolsyre): risiko for medfødte misdannelser VEJLEDNING TIL SUNDHEDSPERSONALE
 Myfortic (mycophenolsyre): risiko for medfødte misdannelser VEJLEDNING TIL SUNDHEDSPERSONALE Indledning Denne vejledning er udarbejdet for at understrege de risici for fostre, der er forbundet med eksponering
Myfortic (mycophenolsyre): risiko for medfødte misdannelser VEJLEDNING TIL SUNDHEDSPERSONALE Indledning Denne vejledning er udarbejdet for at understrege de risici for fostre, der er forbundet med eksponering
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Mycophenolat natrium (Myfortic ) VEJLEDNING OM MYCOPHENOLAT TIL SUNDHEDSPERSONALE Risiko for medfødte misdannelser
 Mycophenolat natrium (Myfortic ) VEJLEDNING OM MYCOPHENOLAT TIL SUNDHEDSPERSONALE Risiko for medfødte misdannelser Indledning Denne vejledning er udarbejdet for at understrege de risici, der er forbundet
Mycophenolat natrium (Myfortic ) VEJLEDNING OM MYCOPHENOLAT TIL SUNDHEDSPERSONALE Risiko for medfødte misdannelser Indledning Denne vejledning er udarbejdet for at understrege de risici, der er forbundet
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Risikominimeringsprogram Patientbrochurer
 Risikominimeringsprogram Patientbrochurer INDHOLDSFORTEGNELSE Information til alle patienter 4-9 Patientbrochure til kvinder i den fødedygtige alder 10 15 Patientbrochure til kvindelige patienter, som
Risikominimeringsprogram Patientbrochurer INDHOLDSFORTEGNELSE Information til alle patienter 4-9 Patientbrochure til kvinder i den fødedygtige alder 10 15 Patientbrochure til kvindelige patienter, som
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Isotretinoin Orion (isotretinoin) Svangerskabsforebyggelsesprogram. Lægens vejledning til ordinering af isotretinoin
 Isotretinoin Orion (isotretinoin) Svangerskabsforebyggelsesprogram Lægens vejledning til ordinering af isotretinoin Introduktion Isotretinoin kapsler indeholder det aktive stof isotretinoin som er stærkt
Isotretinoin Orion (isotretinoin) Svangerskabsforebyggelsesprogram Lægens vejledning til ordinering af isotretinoin Introduktion Isotretinoin kapsler indeholder det aktive stof isotretinoin som er stærkt
Bilag III Ændringer til relevante punkter i produktinformationen
 Bilag III Ændringer til relevante punkter i produktinformationen Bemærk: Disse ændringer til de relevanter punkter i produktinformationen er resultatet af referralproceduren. Produktresuméet kan efterfølgende
Bilag III Ændringer til relevante punkter i produktinformationen Bemærk: Disse ændringer til de relevanter punkter i produktinformationen er resultatet af referralproceduren. Produktresuméet kan efterfølgende
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
9 13 Patientbrochure til fødedygtige kvinder
 Patientbrochure Dette lægemiddel er underlagt supplerende overvågning. Dermed kan der hurtigt tilvejebringes nye oplysninger om sikkerheden. Du kan hjælpe ved at indberette alle de bivirkninger, du får.
Patientbrochure Dette lægemiddel er underlagt supplerende overvågning. Dermed kan der hurtigt tilvejebringes nye oplysninger om sikkerheden. Du kan hjælpe ved at indberette alle de bivirkninger, du får.
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
For alle orale retinoidprodukter, der indeholder acitretin, alitretinoin og isotretinoin, nævnt i tabel 1:
 Uddannelsesmateriale For alle orale retinoidprodukter, der indeholder acitretin, alitretinoin og isotretinoin, nævnt i tabel 1: Materiale til læger Tjekliste til læger/bekræftelsesskema til ordinering
Uddannelsesmateriale For alle orale retinoidprodukter, der indeholder acitretin, alitretinoin og isotretinoin, nævnt i tabel 1: Materiale til læger Tjekliste til læger/bekræftelsesskema til ordinering
BILAG BETINGELSER ELLER BEGRÆNSNINGER SOM SKAL IMPLEMENTERES AF MEDLEMSSTATERNE MED HENSYN TIL SIKKER OG EFFEKTIV BRUG AF LÆGEMIDLET.
 BILAG BETINGELSER ELLER BEGRÆNSNINGER SOM SKAL IMPLEMENTERES AF MEDLEMSSTATERNE MED HENSYN TIL SIKKER OG EFFEKTIV BRUG AF LÆGEMIDLET. 1 Medlemsstaterne skal sikre, at alle betingelser eller begrænsninger
BILAG BETINGELSER ELLER BEGRÆNSNINGER SOM SKAL IMPLEMENTERES AF MEDLEMSSTATERNE MED HENSYN TIL SIKKER OG EFFEKTIV BRUG AF LÆGEMIDLET. 1 Medlemsstaterne skal sikre, at alle betingelser eller begrænsninger
Bilag III. Ændringer i relevante afsnit af produktinformationen
 Bilag III Ændringer i relevante afsnit af produktinformationen Bemærk: Disse ændringer til de relevante afsnit af produktresuméet og indlægssedlen er resultatet af Referralproceduren. Produktinformationen
Bilag III Ændringer i relevante afsnit af produktinformationen Bemærk: Disse ændringer til de relevante afsnit af produktresuméet og indlægssedlen er resultatet af Referralproceduren. Produktinformationen
For alle orale retinoidprodukter, der indeholder acitretin, alitretinoin og isotretinoin, nævnt i tabel 1:
 Uddannelsesmateriale For alle orale retinoidprodukter, der indeholder acitretin, alitretinoin og isotretinoin, nævnt i tabel 1: Materiale til læger Tjekliste til læger/bekræftelsesskema til ordinering
Uddannelsesmateriale For alle orale retinoidprodukter, der indeholder acitretin, alitretinoin og isotretinoin, nævnt i tabel 1: Materiale til læger Tjekliste til læger/bekræftelsesskema til ordinering
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Patientvejledning. Valproat: Delepsine, Delepsine Retard, Deprakine, Deprakine Retard, Orfiril, Orfiril Long eller Orfiril Retard
 Patientvejledning Valproat: Delepsine, Delepsine Retard, Deprakine, Deprakine Retard, Orfiril, Orfiril Long eller Orfiril Retard Prævention og graviditet: Hvad du bør vide Oplysningerne i denne patientvejledning
Patientvejledning Valproat: Delepsine, Delepsine Retard, Deprakine, Deprakine Retard, Orfiril, Orfiril Long eller Orfiril Retard Prævention og graviditet: Hvad du bør vide Oplysningerne i denne patientvejledning
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Vejledning til læger der ordinerer acitretin
 Vejledning til læger der ordinerer acitretin Acitretin Orifarm (acitretin) 10 mg og 25 mg hårde kapsler Forebyggelse af graviditet og fostereksponering Introduktion Acitretin Orifarm indeholder det aktive
Vejledning til læger der ordinerer acitretin Acitretin Orifarm (acitretin) 10 mg og 25 mg hårde kapsler Forebyggelse af graviditet og fostereksponering Introduktion Acitretin Orifarm indeholder det aktive
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. LÆGEMIDLETS NAVN CellCept 250 mg kapsler. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver kapsel indeholder 250 mg mycophenolatmofetil. Alle hjælpestoffer er anført under pkt.
BILAG I PRODUKTRESUME 1 1. LÆGEMIDLETS NAVN CellCept 250 mg kapsler. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver kapsel indeholder 250 mg mycophenolatmofetil. Alle hjælpestoffer er anført under pkt.
Bilag I VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF BETINGELSERNE FOR MARKEDSFØRINGSTILLADELSEN
 Bilag I VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF BETINGELSERNE FOR MARKEDSFØRINGSTILLADELSEN Videnskabelige konklusioner Under hensyntagen til PRAC s vurderingsrapport om PSUR erne for
Bilag I VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF BETINGELSERNE FOR MARKEDSFØRINGSTILLADELSEN Videnskabelige konklusioner Under hensyntagen til PRAC s vurderingsrapport om PSUR erne for
Jaydess (levonorgestrel) minispiral
 Jaydess (levonorgestrel) minispiral Brugervejledning Indhold Hvad er en minispiral? Virkning? Påvirkning? Velkommen Alle har forskellige prioriteringer, og på det her tidspunkt i dit liv er graviditet
Jaydess (levonorgestrel) minispiral Brugervejledning Indhold Hvad er en minispiral? Virkning? Påvirkning? Velkommen Alle har forskellige prioriteringer, og på det her tidspunkt i dit liv er graviditet
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC s vurderingsrapport om PSUR en for
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelserne Videnskabelige konklusioner Under hensyntagen til PRAC s vurderingsrapport om PSUR en for
Indholdsfortegnelse... 2. Forord... 3. Hvem kan hjælpes med ægdonation... 3. Hvordan udføres ægdonationsbehandlingen... 4
 Indholdsfortegnelse Indholdsfortegnelse... 2 Forord... 3 Hvem kan hjælpes med ægdonation... 3 Hvordan udføres ægdonationsbehandlingen... 4 Hvornår udføres ægdonation... 4 Samtale... 4 Venteliste... 5 Aktivliste...
Indholdsfortegnelse Indholdsfortegnelse... 2 Forord... 3 Hvem kan hjælpes med ægdonation... 3 Hvordan udføres ægdonationsbehandlingen... 4 Hvornår udføres ægdonation... 4 Samtale... 4 Venteliste... 5 Aktivliste...
Videnskabelige konklusioner og begrundelse for konklusionerne
 Bilag IV Videnskabelige konklusioner og begrundelse for ændring af betingelserne for markedsføringstilladelserne samt detaljeret redegørelse for afvigelserne fra anbefalingen fra PRAC (Det Europæiske Lægemiddelagenturs
Bilag IV Videnskabelige konklusioner og begrundelse for ændring af betingelserne for markedsføringstilladelserne samt detaljeret redegørelse for afvigelserne fra anbefalingen fra PRAC (Det Europæiske Lægemiddelagenturs
Videnskabelige konklusioner og detaljeret redegørelse for den videnskabelige begrundelse for afvigelserne fra PRAC s anbefaling
 Bilag II Videnskabelige konklusioner og begrundelse for ændring af markedsføringstilladelserne på visse betingelser samt detaljeret redegørelse for den videnskabelige begrundelse for afvigelserne fra anbefalingen
Bilag II Videnskabelige konklusioner og begrundelse for ændring af markedsføringstilladelserne på visse betingelser samt detaljeret redegørelse for den videnskabelige begrundelse for afvigelserne fra anbefalingen
Information til sundhedspersonale
 Information til sundhedspersonale Ordination eller udlevering af Thalidomide Celgene Thalidomide Celgene Svangerskabsforebyggelsesprogram Kontaktoplysninger for Celgene: Celgene ApS Kristianiagade 8, 3.
Information til sundhedspersonale Ordination eller udlevering af Thalidomide Celgene Thalidomide Celgene Svangerskabsforebyggelsesprogram Kontaktoplysninger for Celgene: Celgene ApS Kristianiagade 8, 3.
BILAG III TILLÆG TIL PRODUKTRESUME OG INDLÆGSSEDDEL. Disse ændringer til produktresumé og indlægsseddel er gældende fra Kommissionens beslutning.
 BILAG III TILLÆG TIL PRODUKTRESUME OG INDLÆGSSEDDEL Disse ændringer til produktresumé og indlægsseddel er gældende fra Kommissionens beslutning. Efter Kommissionens beslutning vil myndighederne i de enkelte
BILAG III TILLÆG TIL PRODUKTRESUME OG INDLÆGSSEDDEL Disse ændringer til produktresumé og indlægsseddel er gældende fra Kommissionens beslutning. Efter Kommissionens beslutning vil myndighederne i de enkelte
PRODUKTRESUMÉ. for. Mini-Pe, tabletter
 Produktinformation for Mini-Pe (Norethisteron) Tabletter 0,35 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 17 53 23 Tabletter 0,35 mg 3 x 28 stk. (blister) Dagsaktuel pris
Produktinformation for Mini-Pe (Norethisteron) Tabletter 0,35 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 17 53 23 Tabletter 0,35 mg 3 x 28 stk. (blister) Dagsaktuel pris
Bilag IV. Videnskabelige konklusioner
 Bilag IV Videnskabelige konklusioner 1 Videnskabelige konklusioner Den 7. juni 2017 blev Europa-Kommissionen (herefter "Kommissionen") underrettet om et tilfælde af fulminant leversvigt med dødelig udgang
Bilag IV Videnskabelige konklusioner 1 Videnskabelige konklusioner Den 7. juni 2017 blev Europa-Kommissionen (herefter "Kommissionen") underrettet om et tilfælde af fulminant leversvigt med dødelig udgang
Thalidomide Celgene Svangerskabsforebyggelsesprogram
 Patientbrochure Thalidomide Celgene Svangerskabsforebyggelsesprogram Advarsel: Alvorlige livstruende fødselsdefekter. Hvis Thalidomide Celgene tages under graviditet, kan det forårsage alvorlige fødselsdefekter
Patientbrochure Thalidomide Celgene Svangerskabsforebyggelsesprogram Advarsel: Alvorlige livstruende fødselsdefekter. Hvis Thalidomide Celgene tages under graviditet, kan det forårsage alvorlige fødselsdefekter
BARNLØSHEDSBEHANDLING INSEMINATION IUI-H / IUI-D
 GYNÆKOLOGISK KLINIK Speciallæge Niels Lund Odensevej 25, 1. sal, 5500 Middelfart Tlf. 6440 0046 E-mail: gyn@drlund.dk BARNLØSHEDSBEHANDLING OG INSEMINATION IUI-H / IUI-D 1 Barnløshed Først undersøges årsagen
GYNÆKOLOGISK KLINIK Speciallæge Niels Lund Odensevej 25, 1. sal, 5500 Middelfart Tlf. 6440 0046 E-mail: gyn@drlund.dk BARNLØSHEDSBEHANDLING OG INSEMINATION IUI-H / IUI-D 1 Barnløshed Først undersøges årsagen
Bilag C. (variationer vedrørende nationalt godkendte lægemidler)
 Bilag C (variationer vedrørende nationalt godkendte lægemidler) BILAG I VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRINGEN I BETINGELSERNE FOR MARKEDSFØRINGSTILLADELSEN/MARKEDSFØRINGSTILLADELSERNE
Bilag C (variationer vedrørende nationalt godkendte lægemidler) BILAG I VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRINGEN I BETINGELSERNE FOR MARKEDSFØRINGSTILLADELSEN/MARKEDSFØRINGSTILLADELSERNE
Indlægsseddel: Information til brugeren. Myfortic, 180 mg og 360 mg, enterotabletter. mycophenolsyre (som mycophenolatnatrium)
 Indlægsseddel: Information til brugeren Myfortic, 180 mg og 360 mg, enterotabletter mycophenolsyre (som mycophenolatnatrium) Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel,
Indlægsseddel: Information til brugeren Myfortic, 180 mg og 360 mg, enterotabletter mycophenolsyre (som mycophenolatnatrium) Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel,
De vigtigste risici du bør være opmærksom på når du udskriver Arava omfatter:
 ARAVA leflunomid Praktisk vejledning til læger specifik sikkerhedsinformation Arava (leflunomid) er et sygdomsmodificerende antirheumatisk middel ( Disease Modifying Antirheumatic Drug, DMARD), der er
ARAVA leflunomid Praktisk vejledning til læger specifik sikkerhedsinformation Arava (leflunomid) er et sygdomsmodificerende antirheumatisk middel ( Disease Modifying Antirheumatic Drug, DMARD), der er
Bilag II. Videnskabelige konklusioner
 Bilag II Videnskabelige konklusioner 8 Videnskabelige konklusioner Solu-Medro 40 mg pulver og solvens til injektionsvæske, opløsning, (herefter benævnt "Solu- Medrol") indeholder methylprednisolon og,
Bilag II Videnskabelige konklusioner 8 Videnskabelige konklusioner Solu-Medro 40 mg pulver og solvens til injektionsvæske, opløsning, (herefter benævnt "Solu- Medrol") indeholder methylprednisolon og,
Indlægsseddel: Information til brugeren. CellCept 500 mg pulver til koncentrat til infusionsvæske, opløsning Mycophenolatmofetil
 Indlægsseddel: Information til brugeren CellCept 500 mg pulver til koncentrat til infusionsvæske, opløsning Mycophenolatmofetil Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
Indlægsseddel: Information til brugeren CellCept 500 mg pulver til koncentrat til infusionsvæske, opløsning Mycophenolatmofetil Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
Indlægsseddel: Information til brugeren. Myfenax 250 mg kapsler, hårde Mycophenolatmofetil
 Indlægsseddel: Information til brugeren Myfenax 250 mg kapsler, hårde Mycophenolatmofetil Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Myfenax 250 mg kapsler, hårde Mycophenolatmofetil Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. LÆGEMIDLETS NAVN Myclausen 500 mg filmovertrukne tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver filmovertrukket tablet indeholder 500 mg mycophenolatmofetil. Alle
BILAG I PRODUKTRESUME 1 1. LÆGEMIDLETS NAVN Myclausen 500 mg filmovertrukne tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver filmovertrukket tablet indeholder 500 mg mycophenolatmofetil. Alle
Information om. levonorgestrel. Mirena 1
 Information om levonorgestrel Mirena 1 Hvad er Mirena? Indhold Hvad er Mirena?... 2 Hvordan virker Mirena?... 3 Kan Mirena blive udstødt?... 3 Mirena er et receptpligtigt lægemiddel med høj præventiv sikkerhed
Information om levonorgestrel Mirena 1 Hvad er Mirena? Indhold Hvad er Mirena?... 2 Hvordan virker Mirena?... 3 Kan Mirena blive udstødt?... 3 Mirena er et receptpligtigt lægemiddel med høj præventiv sikkerhed
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1 1. LÆGEMIDLETS NAVN CellCept 250 mg kapsler. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver kapsel indeholder 250 mg mycophenolatmofetil. Alle hjælpestoffer er anført under pkt.
BILAG I PRODUKTRESUME 1 1. LÆGEMIDLETS NAVN CellCept 250 mg kapsler. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver kapsel indeholder 250 mg mycophenolatmofetil. Alle hjælpestoffer er anført under pkt.
BILAG I PRODUKTRESUMÉ
 BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN Myfenax 250 mg kapsler, hårde 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver kapsel indeholder 250 mg mycophenolatmofetil. Alle hjælpestoffer er anført under
BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN Myfenax 250 mg kapsler, hårde 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver kapsel indeholder 250 mg mycophenolatmofetil. Alle hjælpestoffer er anført under
Retningslinjer til sundhedsprofessionelle vedr. håndtering af infektion med Zikavirus pr. 22. november 2016
 Retningslinjer til sundhedsprofessionelle vedr. håndtering af infektion med Zikavirus pr. 22. november 2016 Denne retningslinje erstatter den tidligere version dateret d. 2. august 2016. Væsentligste ændringer
Retningslinjer til sundhedsprofessionelle vedr. håndtering af infektion med Zikavirus pr. 22. november 2016 Denne retningslinje erstatter den tidligere version dateret d. 2. august 2016. Væsentligste ændringer
BILAG I PRODUKTRESUMÉ
 BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN Mycophenolate mofetil Teva 250 mg kapsler, hårde 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver kapsel indeholder 250 mg mycophenolatmofetil. Alle hjælpestoffer
BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN Mycophenolate mofetil Teva 250 mg kapsler, hårde 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver kapsel indeholder 250 mg mycophenolatmofetil. Alle hjælpestoffer
ISOTRETINOIN TEVA til behandling af svær acne
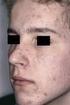 17.07.2015 ISOTRETINOIN TEVA til behandling af svær acne Information til læger Det Europæiske Lægemiddelagenturs (EMAs) komité for lægemidler til mennesker (CHMP) har besluttet, at man skal følge et nøje
17.07.2015 ISOTRETINOIN TEVA til behandling af svær acne Information til læger Det Europæiske Lægemiddelagenturs (EMAs) komité for lægemidler til mennesker (CHMP) har besluttet, at man skal følge et nøje
Patientinformation DBCG 2007- b,t
 information DBCG 2007- b,t Behandling af brystkræft efter operation De har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der alligevel i nogle tilfælde en
information DBCG 2007- b,t Behandling af brystkræft efter operation De har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der alligevel i nogle tilfælde en
Bilag II. Videnskabelige konklusioner
 Bilag II Videnskabelige konklusioner 45 Videnskabelige konklusioner Den 8. marts 2017 indledte Frankrig en procedure i henhold til artikel 31 i direktiv 2001/83/EF og anmodede PRAC om at vurdere betydningen
Bilag II Videnskabelige konklusioner 45 Videnskabelige konklusioner Den 8. marts 2017 indledte Frankrig en procedure i henhold til artikel 31 i direktiv 2001/83/EF og anmodede PRAC om at vurdere betydningen
Information om risikominimerende undervisningsmateriale til voksne med major depressionsperioder i behandling med Agomelatin Glenmark
 Agomelatin Glenmark 25 mg Information om risikominimerende undervisningsmateriale til voksne med major depressionsperioder i behandling med Agomelatin Glenmark Glenmark Pharmaceuticals Nordic AB Skeppsbron
Agomelatin Glenmark 25 mg Information om risikominimerende undervisningsmateriale til voksne med major depressionsperioder i behandling med Agomelatin Glenmark Glenmark Pharmaceuticals Nordic AB Skeppsbron
BILAG I PRODUKTRESUMÉ
 BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN Myfenax 250 mg kapsler, hårde 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver kapsel indeholder 250 mg mycophenolatmofetil. Alle hjælpestoffer er anført under
BILAG I PRODUKTRESUMÉ 1 1. LÆGEMIDLETS NAVN Myfenax 250 mg kapsler, hårde 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver kapsel indeholder 250 mg mycophenolatmofetil. Alle hjælpestoffer er anført under
Bilag IV. Videnskabelige konklusioner
 Bilag IV Videnskabelige konklusioner 59 Videnskabelige konklusioner Den 7. juni 2017 blev Europa-Kommissionen (herefter "Kommissionen") underrettet om et tilfælde af fulminant leversvigt med dødelig udgang
Bilag IV Videnskabelige konklusioner 59 Videnskabelige konklusioner Den 7. juni 2017 blev Europa-Kommissionen (herefter "Kommissionen") underrettet om et tilfælde af fulminant leversvigt med dødelig udgang
Dilemmaer omkring 12 ugers grænsen for legal abort. Oplæg til Folketingets Sundhedsudvalg torsdag d 17. januar 2007
 Dilemmaer omkring 12 ugers grænsen for legal abort Oplæg til Folketingets Sundhedsudvalg torsdag d 17. januar 2007 Birgit Petersson, lektor, speciallæge i psykiatri, medlem af ankenævnet for abort og sterilisation
Dilemmaer omkring 12 ugers grænsen for legal abort Oplæg til Folketingets Sundhedsudvalg torsdag d 17. januar 2007 Birgit Petersson, lektor, speciallæge i psykiatri, medlem af ankenævnet for abort og sterilisation
BILAG III. Ændringer i relevante afsnit af produktresumeet, etiketteringen og indlægssedlen
 BILAG III Ændringer i relevante afsnit af produktresumeet, etiketteringen og indlægssedlen 19 PRODUKTRESUME Dette lægemiddel er underlagt supplerende overvågning. Dermed kan nye sikkerhedsoplysninger hurtigt
BILAG III Ændringer i relevante afsnit af produktresumeet, etiketteringen og indlægssedlen 19 PRODUKTRESUME Dette lægemiddel er underlagt supplerende overvågning. Dermed kan nye sikkerhedsoplysninger hurtigt
- om behandling med CellCept
 Patientinformation - om behandling med CellCept - Mycophenolatmofetil Velkommen til Vejle Sygehus Medicinsk Afdeling Rev. dec. 2008 Information om behandling med CellCept (Mycophenolatmofetil) CellCept
Patientinformation - om behandling med CellCept - Mycophenolatmofetil Velkommen til Vejle Sygehus Medicinsk Afdeling Rev. dec. 2008 Information om behandling med CellCept (Mycophenolatmofetil) CellCept
Leflunomide medac. Information til læger
 DK Leflunomide medac Information til læger Leflunomide medac, information til lægen Til lægen Foruden produktresumeet er denne brochur udviklet af indehaveren af markedsføringstilladelsen for at informere
DK Leflunomide medac Information til læger Leflunomide medac, information til lægen Til lægen Foruden produktresumeet er denne brochur udviklet af indehaveren af markedsføringstilladelsen for at informere
Substance and source of text Lisinopril, fosinopril, trandopril, moexipril, perindopril
 Lisinopril, fosinopril, trandopril, moexipril, perindopril Spirapril, delapril Kontraindikation i andet og tredje trimester (se pkt. og 4.6) section ACE-hæmmerbehandling bør ikke initieres under graviditet.
Lisinopril, fosinopril, trandopril, moexipril, perindopril Spirapril, delapril Kontraindikation i andet og tredje trimester (se pkt. og 4.6) section ACE-hæmmerbehandling bør ikke initieres under graviditet.
Bilag I. Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne
 Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag I Videnskabelige konklusioner og begrundelser for ændring af betingelserne for markedsføringstilladelsen/-tilladelserne 1 Videnskabelige konklusioner Under hensyntagen til PRAC's vurderingsrapport
Bilag II. Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelserne
 Bilag II Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelserne 12 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af lægemidler
Bilag II Videnskabelige konklusioner og begrundelse for ændringen af betingelserne for markedsføringstilladelserne 12 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af lægemidler
P-pille/mini-pille KLAR BESKED
 P-pille/mini-pille K L A R B E S K E D Hvad er p-piller? P-piller er tabletter, der indeholder to hormoner, østrogen og gestagen. Sådan virker p-piller P-piller forhindrer ægløsning ved at blokere for
P-pille/mini-pille K L A R B E S K E D Hvad er p-piller? P-piller er tabletter, der indeholder to hormoner, østrogen og gestagen. Sådan virker p-piller P-piller forhindrer ægløsning ved at blokere for
VÆRD AT VIDE OM. Sterilisation
 VÆRD AT VIDE OM Sterilisation 1 Indhold Sterilisation hvad er det? 3 Inden du beslutter dig 4 Sterilisation af kvinder 7 Sterilisation af mænd 11 Sterilisation hvad er det? En sterilisation er en lille
VÆRD AT VIDE OM Sterilisation 1 Indhold Sterilisation hvad er det? 3 Inden du beslutter dig 4 Sterilisation af kvinder 7 Sterilisation af mænd 11 Sterilisation hvad er det? En sterilisation er en lille
Bilag II. Videnskabelige konklusioner
 Bilag II Videnskabelige konklusioner 14 Videnskabelige konklusioner Haldol, der indeholder det aktive stof haloperidol, er et antipsykotisk lægemiddel, der tilhører butyrophenon-gruppen. Det er en potent,
Bilag II Videnskabelige konklusioner 14 Videnskabelige konklusioner Haldol, der indeholder det aktive stof haloperidol, er et antipsykotisk lægemiddel, der tilhører butyrophenon-gruppen. Det er en potent,
Rollespil til træning af VBA metoden i relation til familieplanlægning i alkohol- og stofbehandlingen
 Rollespil til træning af VBA metoden i relation til familieplanlægning i alkohol- og stofbehandlingen Gå sammen to og to og spil nedenstående scenarier igennem med den aldersgruppe, som er relevant for
Rollespil til træning af VBA metoden i relation til familieplanlægning i alkohol- og stofbehandlingen Gå sammen to og to og spil nedenstående scenarier igennem med den aldersgruppe, som er relevant for
BILAG II FAGLIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉER OG INDLÆGSSEDLER FREMLAGT AF DET EUROPÆISKE LÆGEMIDDELAGENTUR
 BILAG II FAGLIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉER OG INDLÆGSSEDLER FREMLAGT AF DET EUROPÆISKE LÆGEMIDDELAGENTUR 108 FAGLIGE KONKLUSIONER SAMLET RESUMÉ AF DEN VIDENSKABELIGE VURDERING
BILAG II FAGLIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉER OG INDLÆGSSEDLER FREMLAGT AF DET EUROPÆISKE LÆGEMIDDELAGENTUR 108 FAGLIGE KONKLUSIONER SAMLET RESUMÉ AF DEN VIDENSKABELIGE VURDERING
Klar besked om P-PILLER / MINIPILLER
 Klar besked om PPILLER / MINIPILLER PPILLER Ppiller er tabletter, der indeholder to hormoner: Østrogen og gestagen. Ppiller forhindrer ægløsning ved at blokere for dannelsen af de overordnede kønshormoner.
Klar besked om PPILLER / MINIPILLER PPILLER Ppiller er tabletter, der indeholder to hormoner: Østrogen og gestagen. Ppiller forhindrer ægløsning ved at blokere for dannelsen af de overordnede kønshormoner.
dansk Familieplanlægning
 dansk Familieplanlægning P-piller P-piller består af to hormoner, der forhindrer graviditet. Recept på p-piller får man hos lægen eller på en præventionsklinik. Pillerne køber man på apoteket. Læs først
dansk Familieplanlægning P-piller P-piller består af to hormoner, der forhindrer graviditet. Recept på p-piller får man hos lægen eller på en præventionsklinik. Pillerne køber man på apoteket. Læs først
PROJEKT FAMILIEPLANLÆGNING I ALKOHOL- OG STOFBEHANDLINGEN. Familieambulatoriet
 PROJEKT FAMILIEPLANLÆGNING I ALKOHOL- OG STOFBEHANDLINGEN Familieambulatoriet KONTAKTOPLYSNINGER Spørgsmål vedrørende projektet kontakt: E-mail: auh.projekt.familieplanlaegningsindsats@rm.dk Telefon: 2478
PROJEKT FAMILIEPLANLÆGNING I ALKOHOL- OG STOFBEHANDLINGEN Familieambulatoriet KONTAKTOPLYSNINGER Spørgsmål vedrørende projektet kontakt: E-mail: auh.projekt.familieplanlaegningsindsats@rm.dk Telefon: 2478
Informationsbrochure til patienter
 Jinarc (tolvaptan) Informationsbrochure til patienter Dette lægemiddel er underlagt supplerende overvågning. Dermed kan der hurtigt tilvejebringes nye oplysninger om sikkerheden. Du kan hjælpe ved at indberette
Jinarc (tolvaptan) Informationsbrochure til patienter Dette lægemiddel er underlagt supplerende overvågning. Dermed kan der hurtigt tilvejebringes nye oplysninger om sikkerheden. Du kan hjælpe ved at indberette
Bilag I. Navneliste, lægemiddelform, medicinske produkters styrke, indgivelsesvej og ansøgere i medlemslande
 Bilag I Navneliste, lægemiddelform, medicinske produkters styrke, indgivelsesvej og ansøgere i medlemslande 1 Medlemsland EU/EEA Ansøger Firmanavn, adresse (Særnavn) Navn Styrke Lægemiddelform Indgivelsesvej
Bilag I Navneliste, lægemiddelform, medicinske produkters styrke, indgivelsesvej og ansøgere i medlemslande 1 Medlemsland EU/EEA Ansøger Firmanavn, adresse (Særnavn) Navn Styrke Lægemiddelform Indgivelsesvej
PROJEKT FAMILIEPLANLÆGNING I ALKOHOL- OG STOFBEHANDLINGEN. Familieambulatoriet
 PROJEKT FAMILIEPLANLÆGNING I ALKOHOL- OG STOFBEHANDLINGEN Familieambulatoriet KONTAKTOPLYSNINGER Spørgsmål vedrørende projektet kontakt: E-mail: auh.projekt.familieplanlaegningsindsats@rm.dk Telefon: 2478
PROJEKT FAMILIEPLANLÆGNING I ALKOHOL- OG STOFBEHANDLINGEN Familieambulatoriet KONTAKTOPLYSNINGER Spørgsmål vedrørende projektet kontakt: E-mail: auh.projekt.familieplanlaegningsindsats@rm.dk Telefon: 2478
Bilag II. Videnskabelige konklusioner og begrundelse for tilbagetrækning af markedsføringstilladelserne
 Bilag II Videnskabelige konklusioner og begrundelse for tilbagetrækning af markedsføringstilladelserne 4 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Caustinerf arsenical,
Bilag II Videnskabelige konklusioner og begrundelse for tilbagetrækning af markedsføringstilladelserne 4 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering af Caustinerf arsenical,
Insemination med partners sæd
 Insemination med partners sæd Insemination med partnerens sæd, hvor sæden sprøjtes direkte op i livmoderhulen, kan øge chancen for graviditet hos par med uforklarlig, ufrivillig barnløshed, let til moderat
Insemination med partners sæd Insemination med partnerens sæd, hvor sæden sprøjtes direkte op i livmoderhulen, kan øge chancen for graviditet hos par med uforklarlig, ufrivillig barnløshed, let til moderat
Livsstil og frugtbarhed
 Merck Serono is a Livsstil og frugtbarhed Hvad kan jeg selv gøre for at øge min graviditetschance? division of Merck Fertilitet og livsstil A5 0113 FINAL.indd 1 18/01/13 13.14 Er der noget vi selv kan
Merck Serono is a Livsstil og frugtbarhed Hvad kan jeg selv gøre for at øge min graviditetschance? division of Merck Fertilitet og livsstil A5 0113 FINAL.indd 1 18/01/13 13.14 Er der noget vi selv kan
PRODUKTRESUMÉ. for. Mini-Pe, tabletter
 18. januar 2019 PRODUKTRESUMÉ for Mini-Pe, tabletter 0. D.SP.NR. 3235 1. LÆGEMIDLETS NAVN Mini-Pe 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Norethisteron 0,35 mg Hjælpestoffer er anført under pkt. 6.1.
18. januar 2019 PRODUKTRESUMÉ for Mini-Pe, tabletter 0. D.SP.NR. 3235 1. LÆGEMIDLETS NAVN Mini-Pe 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Norethisteron 0,35 mg Hjælpestoffer er anført under pkt. 6.1.
Kvinder med. EPILEPSI hos kvinder EPILEPSI. Overlæge Anne Sabers
 Kvinder med EPILEPSI EPILEPSI hos kvinder Overlæge Anne Sabers Kvinder med epilepsi Indledning Epilepsi optræder stort set på samme måde hos kvinder og mænd, men det er særlige problemstillinger, der
Kvinder med EPILEPSI EPILEPSI hos kvinder Overlæge Anne Sabers Kvinder med epilepsi Indledning Epilepsi optræder stort set på samme måde hos kvinder og mænd, men det er særlige problemstillinger, der
BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉ, ETIKETTERING OG INDLÆGSSEDDEL FREMLAGT AF EMA
 BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉ, ETIKETTERING OG INDLÆGSSEDDEL FREMLAGT AF EMA 11 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering
BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉ, ETIKETTERING OG INDLÆGSSEDDEL FREMLAGT AF EMA 11 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering
Behandling af brystkræft efter operation
 information DBCG 2010-d,t Behandling af brystkræft efter operation Du har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der i nogle tilfælde risiko for, at
information DBCG 2010-d,t Behandling af brystkræft efter operation Du har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der i nogle tilfælde risiko for, at
Høring over bekendtgørelser og vejledninger om væv og celler samt assisteret
 NOTAT 24. oktober 2014 J.nr.: 1406108 Dok. nr.: 1559218 HKJ.DKETIK Høring over bekendtgørelser og vejledninger om væv og celler samt assisteret reproduktion har modtaget bekendtgørelser og vejledninger
NOTAT 24. oktober 2014 J.nr.: 1406108 Dok. nr.: 1559218 HKJ.DKETIK Høring over bekendtgørelser og vejledninger om væv og celler samt assisteret reproduktion har modtaget bekendtgørelser og vejledninger
Patientinformation DBCG 04-b
 information DBCG 04-b Behandling af brystkræft efter operation De har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der alligevel i nogle tilfælde en risiko
information DBCG 04-b Behandling af brystkræft efter operation De har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der alligevel i nogle tilfælde en risiko
Medicinsk abort uge 9+1 til 11+6
 Patientinformation Medicinsk abort uge 9+1 til 11+6 Vælg farve Kvalitet Døgnet Rundt Familiecentret Gynækologisk klinik 2 Medicinsk abort uge 9+1 til 11+6 Forundersøgelse Inden den medicinske abort kan
Patientinformation Medicinsk abort uge 9+1 til 11+6 Vælg farve Kvalitet Døgnet Rundt Familiecentret Gynækologisk klinik 2 Medicinsk abort uge 9+1 til 11+6 Forundersøgelse Inden den medicinske abort kan
Informationsbrochure til patienter
 Jinarc (tolvaptan) Informationsbrochure til patienter Dette lægemiddel er underlagt supplerende overvågning. Dermed kan der hurtigt tilvejebringes nye oplysninger om sikkerheden. Du kan hjælpe ved at indberette
Jinarc (tolvaptan) Informationsbrochure til patienter Dette lægemiddel er underlagt supplerende overvågning. Dermed kan der hurtigt tilvejebringes nye oplysninger om sikkerheden. Du kan hjælpe ved at indberette
Efter2 til 4 Ugers behandling. * Hos patienter med risiko for nedsat nyrefunktion, eren hyppigere monitorering af nyrefunktionen påkrævet.
 ANBEFALINGER VEDRØRENDE NYREBEHANDLING OG DOSISJUSTERING FOR SUNDHEDSPERSONALE, DER BEHANDLER PÆDIATRISKE PATIENTER MED HBV, SOM TAGER TENOFOVIRDISOPROXIL [Dette undervisningsmateriale er obligatorisk
ANBEFALINGER VEDRØRENDE NYREBEHANDLING OG DOSISJUSTERING FOR SUNDHEDSPERSONALE, DER BEHANDLER PÆDIATRISKE PATIENTER MED HBV, SOM TAGER TENOFOVIRDISOPROXIL [Dette undervisningsmateriale er obligatorisk
Samlet resumé af den videnskabelige vurdering af suppositorier indeholdende terpenderivater (se bilag I)
 BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR TILBAGEKALDELSEN ELLER ÆNDRINGERNE AF DE RELEVANTE PUNKTER I PRODUKTRESUMÉET, ETIKETTERINGEN OG INDLÆGSSEDLEN FREMLAGT AF EMA, I BETRAGTNING AF
BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR TILBAGEKALDELSEN ELLER ÆNDRINGERNE AF DE RELEVANTE PUNKTER I PRODUKTRESUMÉET, ETIKETTERINGEN OG INDLÆGSSEDLEN FREMLAGT AF EMA, I BETRAGTNING AF
Behandling af brystkræft
 information DBCG 2010-neo-c (Tamoxifen) Behandling af brystkræft Behandling af brystkræft omfatter i de fleste tilfælde en kombination af lokalbehandling (operation og eventuel strålebehandling) samt medicinsk
information DBCG 2010-neo-c (Tamoxifen) Behandling af brystkræft Behandling af brystkræft omfatter i de fleste tilfælde en kombination af lokalbehandling (operation og eventuel strålebehandling) samt medicinsk
At forberede sig på at se en fertilitetsspecialist. Spørgsmål til den kvindelige partner. Tag endnu et skridt fremad
 At forberede sig på at se en fertilitetsspecialist Tag endnu et skridt fremad Det kræver stor dygtighed at identificere kilden til fertilitetsproblemer og anbefale den rette behandling. En fertilitetsklinik
At forberede sig på at se en fertilitetsspecialist Tag endnu et skridt fremad Det kræver stor dygtighed at identificere kilden til fertilitetsproblemer og anbefale den rette behandling. En fertilitetsklinik
Klar besked om P-STAV / SPIRAL
 Klar besked om PSTAV / SPIRAL PSTAV Pstaven kaldes også hormonstav. Det er en langtidsvirkende præventionsmetode, der kun indeholder ét hormon, gestagen. Det er en tynd stav på størrelse med en tændstik.
Klar besked om PSTAV / SPIRAL PSTAV Pstaven kaldes også hormonstav. Det er en langtidsvirkende præventionsmetode, der kun indeholder ét hormon, gestagen. Det er en tynd stav på størrelse med en tændstik.
Insemination med donorsæd
 Insemination med donorsæd Insemination med donorsæd foregår på samme måde som med partners sæd, blot anvendes optøet donorsæd. Behandlingen anvendes til par, hvor manden har stærkt nedsat sædkvalitet eller
Insemination med donorsæd Insemination med donorsæd foregår på samme måde som med partners sæd, blot anvendes optøet donorsæd. Behandlingen anvendes til par, hvor manden har stærkt nedsat sædkvalitet eller
ANBEFALINGER VEDRØRENDE NYREBEHANDLING OG DOSISJUSTERING FOR SUNDHEDSPERSONALE, DER BEHANDLER VOKSNE PATIENTER, SOM TAGER TENOFOVIRDISOPROXIL 1
 ANBEFALINGER VEDRØRENDE NYREBEHANDLING OG DOSISJUSTERING FOR SUNDHEDSPERSONALE, DER BEHANDLER VOKSNE PATIENTER, SOM TAGER TENOFOVIRDISOPROXIL 1 [Dette undervisningsmateriale er obligatorisk som en betingelse
ANBEFALINGER VEDRØRENDE NYREBEHANDLING OG DOSISJUSTERING FOR SUNDHEDSPERSONALE, DER BEHANDLER VOKSNE PATIENTER, SOM TAGER TENOFOVIRDISOPROXIL 1 [Dette undervisningsmateriale er obligatorisk som en betingelse
Klar besked om KONDOM / FEMIDOM
 Klar besked om KONDOM / FEMIDOM KONDOM Kondom er en nem præventionsmetode, som de fleste mænd og drenge kan bruge. Kondomet er formet som et langt hylster, der som oftest er lavet af latex. Man ruller
Klar besked om KONDOM / FEMIDOM KONDOM Kondom er en nem præventionsmetode, som de fleste mænd og drenge kan bruge. Kondomet er formet som et langt hylster, der som oftest er lavet af latex. Man ruller
Indlægssseddel: Information til brugeren. Cytotec 0,2 mg tabletter misoprostol
 Indlægssseddel: Information til brugeren Cytotec 0,2 mg tabletter misoprostol Læs indlægssedlen grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger - Gem indlægssedlen.
Indlægssseddel: Information til brugeren Cytotec 0,2 mg tabletter misoprostol Læs indlægssedlen grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger - Gem indlægssedlen.
Medicinsk abort uge 8+1 til 9+0
 Patientinformation Medicinsk abort uge 8+1 til 9+0 Vælg farve Kvalitet Døgnet Rundt Familiecentret Gynækologisk klinik Medicinsk abort fra uge 8+1 til 9+0 Forundersøgelse Inden den medicinske abort kan
Patientinformation Medicinsk abort uge 8+1 til 9+0 Vælg farve Kvalitet Døgnet Rundt Familiecentret Gynækologisk klinik Medicinsk abort fra uge 8+1 til 9+0 Forundersøgelse Inden den medicinske abort kan
Valproat: Nye restriktioner vedrørende brug; præventionsprogram skal opstartes.
 11. oktober 2018 Valproat: Nye restriktioner vedrørende brug; præventionsprogram skal opstartes. Direkte sikkerhedsmeddelelse (DHPC) sendt ud til sundhedsprofessionelle Kære sundhedspersonale Dette brev
11. oktober 2018 Valproat: Nye restriktioner vedrørende brug; præventionsprogram skal opstartes. Direkte sikkerhedsmeddelelse (DHPC) sendt ud til sundhedsprofessionelle Kære sundhedspersonale Dette brev
Mifepriston Linepharma. Mifepristone Linepharma. Mifepristone Linepharma 200 mg comprimé. Mifepristone Linepharma 200 mg Tafla
 Bilag I Liste over lægemidlernes navne, lægemiddelformer, styrker, administrationsveje, ansøgere/indehavere af markedsføringstilladelser i medlemsstaterne. 1 Medlemsstat EU/EØS Indehaver af markedsføringstilladelsen
Bilag I Liste over lægemidlernes navne, lægemiddelformer, styrker, administrationsveje, ansøgere/indehavere af markedsføringstilladelser i medlemsstaterne. 1 Medlemsstat EU/EØS Indehaver af markedsføringstilladelsen
Agomelatin Mylan til behandling af svære depressive episoder hos voksne
 Vigtig information Må ikke smides ud! Agomelatin Mylan til behandling af svære depressive episoder hos voksne Ordinationsvejledning Information til læger og sundhedspersonale Anbefalinger vedrørende: Monitorering
Vigtig information Må ikke smides ud! Agomelatin Mylan til behandling af svære depressive episoder hos voksne Ordinationsvejledning Information til læger og sundhedspersonale Anbefalinger vedrørende: Monitorering
