PRODUKTRESUMÉ. for. Xalatan, øjendråber, opløsning. 1 dråbe indeholder ca. 1,5 mikrogram latanoprost
|
|
|
- Gunnar Poulsen
- 8 år siden
- Visninger:
Transkript
1 Produktinformation for Xalatan (Latanoprost) Øjendråber 50 mikg/ml Markedsførte pakninger: Vnr Lægemiddelform og styrke Øjendråber 50 mikg/ml Øjendråber 50 mikg/ml Pakningsstørrelse 2,5 ml 2,5 ml x 3 Dagsaktuel pris findes på Udlevering: B Tilskud: Generelt Godkendt produktresumé: 27. juni 2014 PRODUKTRESUMÉ for Xalatan, øjendråber, opløsning 0. D.SP.NR LÆGEMIDLETS NAVN Xalatan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 100 ml øjendråber indeholder 0,005 g latanoprost 1 dråbe indeholder ca. 1,5 mikrogram latanoprost Hjælpestof som behandleren skal være opmærksom på: Indeholder konserveringsmidlet benzalkoniumchlorid 0,2 mg/ml. Alle hjælpestoffer er anført under pkt KLINISKE OPLYSNINGER Øjendråber, opløsning Opløsningen er en klar, farveløs væske. 4. KLINISKE OPLYSNINGER 4.1 Terapeutiske indikationer
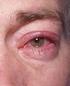
2 Reduktion af forhøjet intraokulært tryk hos patienter med åbenvinkel glaukom og okulær hypertension. Reduktion af forhøjet intraokulært tryk hos børn med forhøjet intraokulært tryk og pædiatrisk glaukom. 4.2 Dosering og indgivelsesmåde Anbefalet dosering til voksne (inklusive ældre): Anbefalet behandling: 1 dråbe i det/de angrebne øje/øjne en gang daglig. Optimal virkning opnås, hvis Xalatan administreres om aftenen. Xalatan bør kun doseres en gang daglig, da det er vist, at hyppigere administration mindsker den intraokulære trykreducerende virkning. Hvis en dosis springes over, bør behandlingen fortsættes med næste dosis som normalt. Ligesom med andre øjendråber anbefales det at sammenpresse tåresækken ved den mediale øjenkrog (punktlig okklusion) i et minut for at mindske muligheden for systemisk absorption. Dette bør gøres umiddelbart efter inddrypningen af hver øjendråbe. Kontaktlinser bør fjernes inden der dryppes med øjendråberne og kan genindsættes 15 minutter efter drypning. Såfremt der anvendes mere end et topikalt øjenmiddel, bør lægemidlerne administreres med mindst 5 minutters mellemrum. Pædiatrisk population Xalatan øjendråber kan bruges til børn i samme dosering som til voksne. Der er ingen tilgængelige data for anvendelse til præmature børn (gestationsalder mindre end 36 uger). Data i aldersgruppen < 1 år er meget begrænsede (4 patienter) (se pkt. 5.1). 4.3 Kontraindikationer Kendt overfølsomhed overfor indholdsstofferne i Xalatan. 4.4 Særlige advarsler og forsigtighedsregler vedrørende brugen Xalatan kan gradvist ændre øjenfarven ved at øge mængden af brunt pigment i iris. Før behandling indledes, bør patienten oplyses om muligheden for permanent ændring af øjenfarven. Unilateral behandling kan resultere i permanent heterochromi. Ændringen i øjenfarven er overvejende set hos patienter med blandet farvning af iris, fx. blåbrun, grå-brun, gul-brun og grøn-brun. I studier med latanoprost ses ændringen sædvanligvis i de første 8 måneder af behandlingen, sjældent ved behandlingen igennem to og tre år og er ikke set efter fjerde behandlingsår. Hastigheden hvormed irispigmenteringen sker aftager med tiden og er stabil efter 5 år. Effekten på øget irispigmentering er ikke evalueret efter mere end 5 års behandling. I et åbent 5-års sikkerhedsstudie med latanoprost udviklede 33 % af patienterne irispigmentering (se pkt. 4.8) Farveændringen af iris er i størstedelen af tilfældene svag, og ofte kan den ikke ses klinisk. Hyppigheden hos patienter med blandet farvning af iris ligger mellem 7 % og 85% med den største hyppighed ved gul-brun iris. Hos patienter med homogene blå øjne er der ikke set ændringer, og hos patienter med homogene grå, grønne eller brune øjne er ændringen kun sjældent set.
3 Farveændringen skyldes øget melaninindhold i stroma melanocytterne i iris, og ikke en stigning i antallet af melanocytter. Den brune pigmentering breder sig typisk koncentrisk omkring pupillen mod periferien af det behandlede øje, men hele iris eller dele af denne kan blive mere brunlig. Der er ikke iagttaget yderligere stigning af brunt pigment i iris efter seponering af behandlingen. I de kliniske afprøvninger har den indtil nu ikke været forbundet med symptomer eller patologiske ændringer. Hverken naevi eller pletter på iris er blevet påvirket af behandling. Akkumulation af pigment i trabekelværket eller andetsteds i forkammeret er ikke iagttaget i kliniske afprøvninger. Øget irispigmentering har efter 5 års klinisk erfaring ikke vist sig at have negative kliniske følger, og behandling med Xalatan kan fortsætte selv om der opstår irispigmentering. Patienterne bør dog undersøges regelmæssigt, og hvis den kliniske situation berettiger det, kan Xalatanbehandlingen seponeres. Der er begrænset klinisk erfaring med Xalatan ved kronisk lukketvinkel glaukom, åbenvinkel glaukom hos pseudophakiske patienter og ved pigmentglaukom. Der er ingen erfaring med Xalatan ved inflammatorisk og neovaskulært glaucom, eller inflammatoriske øjenlidelser. Xalatan har ingen eller kun ringe virkning på pupillen, men der er ingen erfaring ved akutte anfald af lukket vinkel glaukom. Det anbefales derfor, at Xalatan bruges med forsigtighed ved disse tilstande, indtil mere erfaring er opnået. Der er begrænsede forsøgsdata ved brug af Xalatan i den peri-operative periode ved katarakt kirurgi. Xalatan bør anvendes med forsigtighed til disse patienter. Xalatan bør anvendes med forsigtighed til patienter med herpetisk keratitis i anamnesen og bør undgås i tilfælde af aktiv herpes simplex keratitis. Xalatan bør desuden undgås til patienter med tidligere tilbagevendende herpetisk keratitis specifikt forbundet med prostaglandinanaloger. Der er rapporteret makulaødem (se pkt. 4.8) især hos aphakiske patienter, pseudophakiske patienter med iturevet bageste linsekapsel eller med forkammerlinser, samt til patienter med erkendt risiko for cystoidt maculaødem (så som diabetes retinopati og retinalvene okklusion). Xalatan bør anvendes med forsigtighed til aphakiske patienter, til pseudophagiske patienter med iturevet linsekapsel eller forkammerlinse, samt til patienter med erkendt risiko for cystoidt maculaødem. Hos patienter med kendte risikofaktorer, der disponerer for iritis/uveitis kan Xalatan anvendes med forsigtighed. Der er begrænset erfaring med patienter med astma, men der er efter markedsføring rapporteret tilfælde af forværring af astma og/eller dyspnø. Astmapatienter bør derfor behandles med forsigtighed indtil der er opnået tilstrækkelig erfaring, se også pkt Der er set periorbital misfarvning af huden, hvor hovedparten af tilfældene stammer fra japanske patienter. Den hidtidige erfaring viser, at periorbital misfarvning af huden ikke er permanent og har i nogle tilfælde været reversibel ved fortsat behandling med Xalatan.
4 Latanoprost kan gradvis ændre øjenvipper og vellushår ved det behandlede øje og dets omgivelser. Disse ændringer omfatter blandt andet øget længde, tykkelse og pigmentering, øget antal øjenvipper eller hår og øjenvipper, som vokser i forkert retning. Ændringer i øjenvipper forsvinder efter ophør af behandling. Xalatan øjendråber indeholder benzalkoniumchlorid, der almindeligvis bruges som konserveringsmiddel i øjendråber. Benzalkoniumchlorid kan forårsage punctat keratopati og/eller toksisk ulcerøs keratopati, som kan forårsage øjenirritation og misfarve bløde kontaktlinser. Patienter med tørre øjne eller som har problemer med cornea i hyppig eller langvarig behandling med Xalatan bør undersøges hyppigt. Kontaktlinser kan absorbere benzalkoniumchlorid og bør fjernes, inden der dryppes med Xalatan øjendråber. Kontaktlinserne kan genindsættes 15 minutter efter drypning (se pkt. 4.2). Pædiatrisk population Effekt- og sikkerhedsdata i aldersgruppen < 1 år (4 patienter) er meget begrænsede (se pkt. 5.1). Der er ingen tilgængelige data for anvendelse til præmature børn (gestationsalder mindre end 36 uger). Hos børn i alderen 0 til < 3 år, som primært lider af primær kongenit glaukom (PCG), er operation (f.eks. trabekulotomi/goniotomi) stadig førstevalgsbehandling. Sikkerhed ved langtidsbrug hos børn er ikke klarlagt. 4.5 Interaktion med andre lægemidler og andre former for interaktion Definitive data vedrørende lægemiddelinteraktion er ikke tilgængelige. Der er rapporteret paradoksale stigninger i det intraokulære tryk efter samtidig brug af to prostaglandinanaloger. Det anbefales derfor ikke at bruge to eller flere prostaglandiner, prostaglandinanaloger eller prostaglandinderivater samtidigt. Pædiatrisk population Interaktionsforsøg er kun udført hos voksne. 4.6 Graviditet og amning Graviditet: Sikkerheden ved brug af Xalatan under graviditet er ikke fastslået. Xalatan har potentielt skadelige farmakologiske virkninger med hensyn til graviditetsforløb, det ufødte eller det nyfødte barn. Xalatan bør derfor ikke anvendes under graviditet. Amning: Latanoprost og dets metabolitter kan passere over i modermælken og Xalatan bør derfor ikke anvendes af ammende kvinder. Alternativt bør amningen ophøre. Fertilitet: Dyrestudier med latanoprost har ikke vist påvirkning af fertilitet hos hverken mænd eller kvinder (se pkt. 5.3). 4.7 Virkninger på evnen til at føre motorkøretøj eller betjene maskiner Ikke mærkning.
5 Som ved andre øjenpræparater kan inddrypning af øjendråber forårsage forbigående sløring af synet. Patienten bør ikke færdes i trafikken eller betjene maskiner før synet atter er normalt. 4.8 Bivirkninger a. oversigt over sikkerhedsprofilen Størstedelen af latanoprosts bivirkninger er relateret til øjnene. I et åbent 5-års sikkerhedsforsøg med latanoprost udviklede 33% af patienterne irispigmentering (se pkt. 4.4). Øvrige øjenbivirkninger var generelt forbigående og forekom i forbindelse med drypning. b. bivirkningstabel Bivirkningerne er anført efter frekvens: meget almindelig ( 1/10), almindelig ( 1/100 og <1/10), ikke almindelig ( 1/ og <1/1000), sjælden ( 1/ og <1/1.000) og meget sjælden (<1/10.000), ikke kendt (kan ikke estimeres ud fra forhåndenværende data). Infektioner og parasitære sygdomme: Ikke kendt: Herpetisk keratitis Nervesystemer: Ikke kendt: Hovedpine, svimmelhed. Øjne: Meget almindelige: Øget irispigmentering; mild til moderat konjunctival hyperæmi, øjenirritation (inklusiv brændende fornemmelse, stikken og fremmedlegemefornemmelse ); ændring af øjenvipper og vellushår (øget længde, tykkelse, pigmentering og antal) (langt størstedelen er indberetninger fra den japanske population). Almindelige: Forbigående punktformig erosion af epitelet uden symptomer hos de fleste; blepharitis, øjensmerter, fotofobi. Ikke almindelige: Øjenlågsødem., tørre øjne, keratitis, sløret syn og konjunktivitis. Sjældne: Iritis/uveitis (især rapporteret hos patienter med samtidige prædisponerende faktorer); maculaødem; symptomgivende ødemer og erosioner i cornea; periorbitalt ødem; øjenvipper, der vender forkert. Dette kan sommetider give øjenirritation; ekstra række af øjenhår ved de meibomske kirtlers åbning (distichiasis). Meget sjældne: Periorbitale og øjenlågsforandringer, der medfører mere udtalt øjenlågs sulcus. Ikke kendt: Iriscyste.
6 Hjerte: Meget sjælden: Ustabil angina pectoris. Ikke kendt: Palpitationer. Luftveje, thorax og mediastinum: Sjældne: Astma, astma eksacerbation og dyspnø. Hud og subkutane væv: Ikke almindelige: Hududslæt. Sjælden: Lokal hudirritation på øjenlågene, mørkfarvning af øjenlågshuden. Knogler, led, muskler og bindevæv: Ikke kendt: Muskelsmerter, ledsmerter. Almene symptomer og forstyrrelser på administrationsstedet: Meget sjælden): Brystsmerter. Tilfælde af corneal forkalkning er i meget sjældne tilfælde blevet indberettet i forbindelse med brugen af øjendråber der indeholder phosphat. Hos nogle patienter har dette givet signifikante skader på hornhinden. c. beskrivelse af udvalgte bivirkninger Ingen information d. pædiatrisk population I to korttids-kliniske forsøg ( 12 uger) med 93 pædiatriske patienter (henholdsvis 25 og 68) svarede sikkerhedsprofilen til den, der blev set for voksne, og der blev ikke se nogen nye bivirkninger. Desuden var korttids-sikkerhedsprofilerne ens i de pædiatriske undergrupper (se pkt. 5.1). Nasopharyngitis og pyreksi forekom hyppigere hos børn end hos voksne. Indberetning af formodede bivirkninger Når lægemidlet er godkendt, er indberetning af formodede bivirkninger vigtig. Det muliggør løbende overvågning af benefit/risk-forholdet for lægemidlet. Læger og sundhedspersonale anmodes om at indberette alle formodede bivirkninger på eller ved at kontakte Sundhedsstyrelsen via mail på sst@sst.dk eller med brev til Sundhedsstyrelsen, Axel Heides Gade 1, 2300 København S. 4.9 Overdosering Bortset fra okulær irritation og konjunktival hyperæmi kendes ingen andre okulære bivirkninger ved overdosering af Xalatan. Hvis Xalatan indtages ved et uheld kan følgende information være nyttig: 1 flaske indeholder 125 mikrogram latanoprost. Mere end 90 % metaboliseres ved first pass metabolisme i leveren. Intravenøs infusion af 3 mikrogram/kg til raske frivillige gav ingen symptomer, men en dosis på 5,5-10 mikrogram/kg forårsagede kvalme, abdominale smerter, svimmelhed, træthed, hedestigning og svedtendens. Latanoprost er blevet infunderet
7 intravenøst i aber i doser op til 500 mikrogram/kg uden større virkning på det kardiovaskulære system. Intravenøs administration af latanoprost til aber har været forbundet med forbigående bronkokonstriktion. Bronkokonstriktion blev imidlertid ikke induceret af latanoprost hos patienter med moderat bronkial astma, når det er blevet givet topikalt på øjnene i doser 7 gange den kliniske dosis af Xalatan. Skulle det ske overdosering af Xalatan, bør behandlingen være symptomatisk Udlevering B 5. FARMAKOLOGISKE EGENSKABER 5.0 Terapeutisk klassifikation ATC-kode: S 01 EE Farmakodynamiske egenskaber Det aktive lægemiddelstof, latanoprost, en prostagladin F 2α analog, er en selektiv prostanoid FP receptor agonist, som reducerer det intraokulære tryk ved at øge kammervandsafløbet. Reduktion af det intraokulære tryk hos mennesker indsætter ca. 3-4 timer efter administration og maksimal virkning nås efter 8-12 timer. Trykreduktion opretholdes i mindst 24 timer. Studier på dyr og mennesker tyder på, at hovedvirkningsmekanismen er øget uveoscleralt afløb, selvom en vis reduktion i afløbsmodstand er blevet rapporteret hos mennesker. Centrale afprøvninger har vist, at Xalatan er effektiv som monoterapi. Der er endvidere udført kliniske forsøg med kombinationsbehandling. Disse omfatter forsøg som viser, at latanoprost er effektiv i kombination med beta-adrenerge antagonister (timolol). Korttidsstudier (1 eller 2 uger) tyder på, at latanoprosts virkning er additiv ved kombination med adrenerge agonister (dipivalyl epinephrin), orale carboanhydrase hæmmere (acetazolamid) og i hvert fald delvis additiv med cholinerge agonister (pilocarpin). Kliniske afprøvninger har vist, at latanoprost ikke har signifikant virkning på produktionen af kammervand. Latanoprost har ikke vist sig at have nogen virkning på blod-kammervandsbarrieren. Latanoprost har ingen eller kun ubetydelig virkning på den intraokulære blodcirkulation, når det anvendes i kliniske doser på aber. Mild til moderat konjunktival eller episcleral hyperæmi kan imidlertid opstå under topikal behandling. Kronisk latanoprostbehandling af abeøjne, der har gennemgået extrakapsulær linse ekstraktion, påvirkede ikke blodkarrene i retina. Dette blev påvist ved fluorescein angiografi. Latanoprost har ikke induceret fluorescein lækage i det bageste kammer i pseudophakiske humane øjne efter kortidsbehandling. Latanoprost i kliniske doser har ikke nogen signifikant farmakologisk virkning på det kardiovaskulære system eller respirationssystemet. Pædiatrisk population
8 Effekten af latanoprost hos pædiatriske patienter 18 år blev vist i et 12-ugers, dobbeltblindet klinisk forsøg, hvor latanoprost blev sammenlignet med timolol hos 107 patienter diagnosticeret med okulær hypertension og pædiatrisk glaukom. For nyfødte skulle gestationsalderen være mindst 36 uger. Patienterne fik enten latanoprost 50 mikrogram/ml 1 gang dagligt eller timolol 5 mg/ml (eller valgfrit 2,5 mg/ml for patienter yngre end 3 år) to gange dagligt. Det primære effektendepunkt var den gennemsnitlige reduktion i det intraokulære tryk (IOP) fra baseline ved uge 12 af undersøgelsen. Den gennemsnitlige reduktion i IOP i latanoprost- og timolol-grupperne var ens. I alle de undersøgte aldersgrupper (0 - <3 år, 3 - <12 år og år) var den gennemsnitlige reduktion i IOP ved uge 12 i latanoprost- gruppen den samme som i timolol-gruppen. Imidlertid var effektdata for aldersgruppen 0 - <3 år kun baseret på 13 patienter for latanoprost og ingen relvant effekt blev set hos de 4 patienter, som udgjorde aldersgruppen 0- <1 år. Der findes ingen data for præmature børn (gestationsalder under 36 uge). Reduktion i IOP hos patienter i undergruppen med primær kongenit/pædiatrisk glaukom (PCG) var ens i latanoprost- og timolol-gruppen. Ikke-PCG-undergruppen (f.eks. juvenil åbenvinklet glaukom og afakisk glaukom) viste lignende resultater som PCGundergruppen. Der blev set effekt på IOP efter den første uge af behandlingen, og effekten blev opretholdt gennem hele den 12 uger lange forsøgsperiode, som hos voksne, se tabellen. Tabel: Reduktion i IOP (mmhg) ved uge 12 samt behandlings undergrupper og baseline-diagnose Latanoprost N=53 Timolol N=54 Baseline, gennemsnit (SE) 27,3 (0,75) 27,8 (0,84) Gennemsnitlig ændring fra baseline ved uge 12 (SE) -7,18 (0,81) -5,72 (0,81) p-værdi vs. timolol 0,2056 PCG N=28 Non-PCG N=25 PCG N=26 Non-PCG N=28 Baseline, gennemsnit (SE) 26,5 (0,72) 28,2 (1,37) 26,3 (0,95) 29,1 (1,33) Gennemsnitlig ændring fra -5,90 (0,98) -8,66 (1,25) -5,34 (1,02) -6,02 (1,18) baseline ved uge 12 (SE) p-værdi vs. timolol 0,6957 0,1317 SE: standardfejl Justeret estimat baseret på kovarians-analyse (ANCOVA) modellen. 5.2 Farmakokinetiske egenskaber Latanoprost (mw 432,58) er et isopropylester prodrug, som i sig selv er inaktivt, men som efter hydrolyse til latanoprost-syre bliver biologisk aktiv. Prodrug absorberes godt gennem cornea, og alt stof, der passerer over i kammervandet, hydrolyseres ved passagen gennem cornea. Studier på mennesker tyder på, at maksimal koncentration i kammervandet nås ca. 2 timer efter topikal administration. Efter topikal applikation hos aber fordeles latanoprost primært i forreste kammer, bindehinder og øjenlåg. Kun ubetydelige mængder af stoffer når bageste kammer.
9 Der sker praktisk taget ingen metabolisme af latanoprost-syre i øjet. Hovedmetabolismen finder sted i leveren. Plasmahalveringstiden er 17 minutter hos mennesker. Hovedmetabolitterne, 1,2-dinor og 1,2,3,4 tetranor metabolitterne udviser ingen eller kun svag biologisk aktivitet i dyrestudier og udskilles primært i urinen. Pædiatrisk population Plasmakoncentration af latanoprost-syre blev undersøgt i et open-label farmakokinetisk forsøg med 22 voksne og 25 pædiatriske patienter (fra nyfødt til < 18 år) med okulær hypertension og glaukom. Alle aldersgrupper blev behandlet med 1 dråbe latanoprost 50 mikrogram/ml dagligt i hvert øje i minimum 2 uger. Systemisk eksposition for latanoprostsyre var ca. 2 gange højere hos børn i alderen 3 - < 12 år og 6 gange højere hos børn < 3 år sammenlignet med voksne, men en bred sikkerhedsmargin mht. systemiske bivirkninger blev opretholdt (se pkt. 4.9). Median tid til at nå maksimal plasmakoncentration var 5 minutter efter indgivelse af dosis for alle aldersgrupper. Median plasma-halveringstid var kort (< 20 minutter), var den samme for pædiatriske og voksne patienter og resulterede ikke i akkumulering af systemisk latanoprost ved steady-state. 5.3 Prækliniske sikkerhedsdata Latanoprosts okulære såvel som systemiske toksicitet er undersøgt i adskillige dyrestudier. Generelt tåles latanoprost godt med en sikkerhedsmargen mellem klinisk okulær dosis og systemisk toksicitet på mindst 1000 gange. Høje latanoprostdoser, ca. 100 gange klinisk dosis/kg legemsvægt indgivet intravenøst til ikke bedøvede aber øger respirationsfrekvensen, sandsynligvis pga. kortvarig bronkokonstriktion. Latanoprost har ikke vist sig at have allergene egenskaber i dyrestudier. Der er ikke blevet påvist toksiske virkninger i øjet ved doser op til 100 mikrogram/øje/dag hos kaniner eller aber (klinisk dosis er ca. 1,5 mikrogram/øje/dag). Latanoprost forårsager imidlertid øget pigmentering af iris hos aber. Mekanismen for øget pigmentering er tilsyneladende stimulation af melaninproduktionen i melanocytterne i iris, uden at der er iagttaget nogen proliferative ændringer. Farveændringen af iris kan være permanent. Kroniske okulære toksisitetsstudier viser, at administration af latanoprost 6 mikrogram/øje/dag forårsager øget palpebral fissur. Denne virkning er reversibel og opstår ved doser over klinisk niveau. Denne effekt er ikke set hos mennesker. Latanoprost blev fundet negativ i revers mutagen tests på bakterier, genmutation i muselymfomer og muse-micronucleus test. Kromosom ændringer er iagttaget in vitro med human lymfocytter. Lignende virkninger er iagttaget med prostagladin F 2α, et naturligt forekommende prostaglandin, hvilket tyder på at dette er en klasseeffekt. Yderligere mutagenicitetsstudier in vitro/in vivo på ikke planlagt DNA syntese i rotter var negative og tyder på, at latanoprost ikke har mutagent potentiale. Carcinogenicitetsstudier på mus og rotter var negative. Latanoprost har ikke nogen virkning på mandlig eller kvindelig fertilitet i dyrestudier. I embryotoksicitetsstudier på rotter blev der ikke iagttaget nogen embryotoksicitet ved intravenøse doser (5, 50 og 250 mikrogram/kg/dag). Latanoprost forårsagede imidlertid embryoletal virkning hos kaniner ved doser på 5 mikrogram /kg/dag og derover.
10 Dosen på 5 mikrogram/kg/dag (ca. 100 gange klinisk dosis) forårsagede signifikant embryoføtal toksicitet karakteriseret ved øget hyppighed af sen resorption og abort samt nedsat fostervægt. Intet teratogent potentiale er blevet påvist. 6. FARMACEUTISKE OPLYSNINGER 6.1 Hjælpestoffer Natriumchlorid Benzalkoniumclorid (0,2 mg/ml) Natriumdihydrogenphosphatmonohydrat Dinatriumphosphat, vandfrit Vand til injektionsvæsker 6.2 Uforligeligheder In vitro studier har vist, at der sker udfældning, når øjendråber indeholdende thiomersal blandes med Xalatan. Hvis sådanne lægemidler anvendes, bør øjendråberne administreres med mindst 5 minutters mellemrum. 6.3 Opbevaringstid Før første åbning: 2 år. Opbevaringstid efter åbning af dråbebeholder: 4 uger Særlige opbevaringsforhold Opbevares i original emballage. Må ikke opbevares ved temperaturer over 25 o C og bør anvendes inden 4 uger efter anbrud. 6.5 Emballagetyper og pakningsstørrelser Dråbebeholder (5 ml) af polyethylen med enten skruelåg og sikkerhedshætte af polyethylen eller et skruelåg og sikkerhedsring. Hver dråbebeholder indeholder 2,5 ml øjendråber, opløsning svarende til ca. 80 dråber. Pakningsstørrelser: 1 x 2,5 ml, 3 x 2,5 ml, 6 x 2,5 ml. Ikke alle pakningsstørrelser er nødvendigvis markedsført. 6.6 Regler for bortskaffelse og anden håndtering Ingen særlige forholdsregler. 7. INDEHAVER Af MARKEDSFØRINGSTILLADELSEN Pfizer ApS Lautrupvang Ballerup 8. MARKEDSFØRINGSTILLADELSESNUMMER (NUMRE) 18752
11 9. DATO FOR FØRSTE MARKEDSFØRINGSTILLADELSE 10. juli DATO FOR ÆNDRING AF TEKSTEN 27. juni 2014
PRODUKTRESUMÉ. for. Monoprost, øjendråber, opløsning, enkeltdosisbeholder
 10. november 2014 PRODUKTRESUMÉ for Monoprost, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 28012 1. LÆGEMIDLETS NAVN Monoprost 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
10. november 2014 PRODUKTRESUMÉ for Monoprost, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 28012 1. LÆGEMIDLETS NAVN Monoprost 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
PRODUKTRESUMÉ. for. Latanoprost Pfizer, øjendråber, opløsning
 18. januar 2017 PRODUKTRESUMÉ for Latanoprost Pfizer, øjendråber, opløsning 0. D.SP.NR. 27319 1. LÆGEMIDLETS NAVN Latanoprost Pfizer 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
18. januar 2017 PRODUKTRESUMÉ for Latanoprost Pfizer, øjendråber, opløsning 0. D.SP.NR. 27319 1. LÆGEMIDLETS NAVN Latanoprost Pfizer 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
PRODUKTRESUMÉ. for. Xalatan, øjendråber, opløsning
 21. september 2017 PRODUKTRESUMÉ for Xalatan, øjendråber, opløsning 0. D.SP.NR. 09707 1. LÆGEMIDLETS NAVN Xalatan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 100 ml øjendråber indeholder 5 mg latanoprost
21. september 2017 PRODUKTRESUMÉ for Xalatan, øjendråber, opløsning 0. D.SP.NR. 09707 1. LÆGEMIDLETS NAVN Xalatan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 100 ml øjendråber indeholder 5 mg latanoprost
PRODUKTRESUMÉ. for. Latanoprost Pfizer, øjendråber, opløsning
 21. september 2017 PRODUKTRESUMÉ for Latanoprost Pfizer, øjendråber, opløsning 0. D.SP.NR. 27319 1. LÆGEMIDLETS NAVN Latanoprost Pfizer 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
21. september 2017 PRODUKTRESUMÉ for Latanoprost Pfizer, øjendråber, opløsning 0. D.SP.NR. 27319 1. LÆGEMIDLETS NAVN Latanoprost Pfizer 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
PRODUKTRESUMÉ. for. Zaditen, øjendråber, opløsning, enkeltdosisbeholder
 18. februar 2015 PRODUKTRESUMÉ for Zaditen, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 20678 1. LÆGEMIDLETS NAVN Zaditen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 0,4 ml indeholder 0,138 mg
18. februar 2015 PRODUKTRESUMÉ for Zaditen, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 20678 1. LÆGEMIDLETS NAVN Zaditen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 0,4 ml indeholder 0,138 mg
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Xalatan 50 mikrogram/ml, øjendråber, opløsning latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Xalatan 50 mikrogram/ml, øjendråber, opløsning latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Xalcom, øjendråber, opløsning
 Produktinformation for Xalcom (Latanoprost + timolol) Øjendråber 5 mg/ml+50 mikg/ml Markedsførte pakninger: Vnr Lægemiddelform og styrke 00 74 34 Øjendråber 5 mg/ml+50 mikg/ml 00 77 21 Øjendråber 5 mg/ml+50
Produktinformation for Xalcom (Latanoprost + timolol) Øjendråber 5 mg/ml+50 mikg/ml Markedsførte pakninger: Vnr Lægemiddelform og styrke 00 74 34 Øjendråber 5 mg/ml+50 mikg/ml 00 77 21 Øjendråber 5 mg/ml+50
PRODUKTRESUMÉ. for. Terramycin-Polymyxin B, salve
 Produktinformation for Terramycin-Polymyxin B (Oxytetracyclin og Polymyxin B) Salve 30+1 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke Pakningsstørrelse 13 50 46 Salve 30+1 mg/g 15 g Dagsaktuel
Produktinformation for Terramycin-Polymyxin B (Oxytetracyclin og Polymyxin B) Salve 30+1 mg/g Markedsførte pakninger: Vnr Lægemiddelform og styrke Pakningsstørrelse 13 50 46 Salve 30+1 mg/g 15 g Dagsaktuel
PRODUKTRESUMÉ. for. Voltaren Ophtha, øjendråber i enkeltdosisbeholder
 15. april 2013 PRODUKTRESUMÉ for Voltaren Ophtha, øjendråber i enkeltdosisbeholder 0. D.SP.NR. 3588 1. LÆGEMIDLETS NAVN Voltaren Ophtha 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml Voltaren Ophtha indeholder
15. april 2013 PRODUKTRESUMÉ for Voltaren Ophtha, øjendråber i enkeltdosisbeholder 0. D.SP.NR. 3588 1. LÆGEMIDLETS NAVN Voltaren Ophtha 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml Voltaren Ophtha indeholder
PRODUKTRESUMÉ. for. Antistina-Privin, øjendråber, opløsning
 25. marts 2013 PRODUKTRESUMÉ for Antistina-Privin, øjendråber, opløsning 0. D.SP.NR 1222 1. LÆGEMIDLETS NAVN Antistina-Privin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Antazolinsulfat 5 mg/ml + naphazolinnitrat
25. marts 2013 PRODUKTRESUMÉ for Antistina-Privin, øjendråber, opløsning 0. D.SP.NR 1222 1. LÆGEMIDLETS NAVN Antistina-Privin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Antazolinsulfat 5 mg/ml + naphazolinnitrat
PRODUKTRESUMÉ. for. Otrivin ukonserveret, næsespray, opløsning
 13. januar 2014 PRODUKTRESUMÉ for Otrivin ukonserveret, næsespray, opløsning 0. D.SP.NR. 2164 1. LÆGEMIDLETS NAVN Otrivin ukonserveret 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Xylometazolinhydrochlorid
13. januar 2014 PRODUKTRESUMÉ for Otrivin ukonserveret, næsespray, opløsning 0. D.SP.NR. 2164 1. LÆGEMIDLETS NAVN Otrivin ukonserveret 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Xylometazolinhydrochlorid
Indlægsseddel: Information til brugeren. Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder. Latanoprost
 Indlægsseddel: Information til brugeren Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder Latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
Indlægsseddel: Information til brugeren Monoprost 50 mikrogram/ml øjendråber, opløsning i enkeltdosisbeholder Latanoprost Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
PRODUKTRESUMÉ. for. Zovir, creme 5%, 2 g
 15. september 2014 PRODUKTRESUMÉ for Zovir, creme 5%, 2 g 0. D.SP.NR 8902 1. LÆGEMIDLETS NAVN Zovir 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aciclovir 50 mg/g Hjælpestoffer er anført under pkt. 6.1.
15. september 2014 PRODUKTRESUMÉ for Zovir, creme 5%, 2 g 0. D.SP.NR 8902 1. LÆGEMIDLETS NAVN Zovir 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aciclovir 50 mg/g Hjælpestoffer er anført under pkt. 6.1.
PRODUKTRESUMÉ. for. Dulcolax, suppositorier
 10. januar 2011 PRODUKTRESUMÉ for Dulcolax, suppositorier 0. D.SP.NR. 1603 1. LÆGEMIDLETS NAVN Dulcolax 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Bisacodyl 10 mg Hjælpestoffer er anført under pkt. 6.1.
10. januar 2011 PRODUKTRESUMÉ for Dulcolax, suppositorier 0. D.SP.NR. 1603 1. LÆGEMIDLETS NAVN Dulcolax 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Bisacodyl 10 mg Hjælpestoffer er anført under pkt. 6.1.
PRODUKTRESUMÉ. for. Voltabak, øjendråber, opløsning
 22. februar 2013 PRODUKTRESUMÉ for Voltabak, øjendråber, opløsning 0. D.SP.NR. 27464 1. LÆGEMIDLETS NAVN Voltabak 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diclofenacnatrium 1 mg/ml Hjælpestof: Polyoxyleret
22. februar 2013 PRODUKTRESUMÉ for Voltabak, øjendråber, opløsning 0. D.SP.NR. 27464 1. LÆGEMIDLETS NAVN Voltabak 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diclofenacnatrium 1 mg/ml Hjælpestof: Polyoxyleret
PRODUKTRESUMÉ. for. Monopex, øjendråber, opløsning, enkeltdosisbeholder
 10. april 2014 PRODUKTRESUMÉ for Monopex, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 28299 1. LÆGEMIDLETS NAVN Monopex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 1
10. april 2014 PRODUKTRESUMÉ for Monopex, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 28299 1. LÆGEMIDLETS NAVN Monopex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 1
PRODUKTRESUMÉ. for. Strepsils Citrus Sukkerfri, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils Citrus Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Citrus Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4-diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils Citrus Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Citrus Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4-diklorbenzylalkohol
for Olbetam, kapsler, hårde
 Produktinformation for Olbetam (Acipimox) Kapsler 250 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 41 24 00 Kapsler 250 mg 90 stk. Dagsaktuel pris findes på www.medicinpriser.dk
Produktinformation for Olbetam (Acipimox) Kapsler 250 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 41 24 00 Kapsler 250 mg 90 stk. Dagsaktuel pris findes på www.medicinpriser.dk
PRODUKTRESUMÉ. for. Strepsils Jordbær Sukkerfri, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils Jordbær Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Jordbær Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils Jordbær Sukkerfri, sugetabletter 0. D.SP.NR. 01854 1. LÆGEMIDLETS NAVN Strepsils Jordbær Sukkerfri 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
PRODUKTRESUMÉ. for. Regaine Forte, kutanopløsning
 28. juni 2007 PRODUKTRESUMÉ for Regaine Forte, kutanopløsning 0. D.SP.NR. 6550 1. LÆGEMIDLETS NAVN Regaine Forte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Minoxidil 50 mg/ml Hjælpestoffer se pkt. 6.1.
28. juni 2007 PRODUKTRESUMÉ for Regaine Forte, kutanopløsning 0. D.SP.NR. 6550 1. LÆGEMIDLETS NAVN Regaine Forte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Minoxidil 50 mg/ml Hjælpestoffer se pkt. 6.1.
PRODUKTRESUMÉ. for. Galieve Cool Mint, oral suspension
 12. maj 2015 PRODUKTRESUMÉ for Galieve Cool Mint, oral suspension 0. D.SP.NR. 27229 1. LÆGEMIDLETS NAVN Galieve Cool Mint 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én dosis/10 ml indeholder: 500 mg natriumalginat
12. maj 2015 PRODUKTRESUMÉ for Galieve Cool Mint, oral suspension 0. D.SP.NR. 27229 1. LÆGEMIDLETS NAVN Galieve Cool Mint 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Én dosis/10 ml indeholder: 500 mg natriumalginat
PRODUKTRESUMÉ. for. Urilin, syrup
 21. juni 2011 PRODUKTRESUMÉ for Urilin, syrup 0. D.SP.NR 27072 1. VETERINÆRLÆGEMIDLETS NAVN Urilin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Phenylpropanolamin 40,29 mg (svarende
21. juni 2011 PRODUKTRESUMÉ for Urilin, syrup 0. D.SP.NR 27072 1. VETERINÆRLÆGEMIDLETS NAVN Urilin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Aktivt stof: Phenylpropanolamin 40,29 mg (svarende
PRODUKTRESUMÉ. for. Sofradex, øjen- og øredråber, opløsning (2care4)
 28. november 2012 PRODUKTRESUMÉ for Sofradex, øjen- og øredråber, opløsning (2care4) 0. D.SP.NR. 2508 1. LÆGEMIDLETS NAVN Sofradex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dexamethason 0,5 mg/ml som
28. november 2012 PRODUKTRESUMÉ for Sofradex, øjen- og øredråber, opløsning (2care4) 0. D.SP.NR. 2508 1. LÆGEMIDLETS NAVN Sofradex 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dexamethason 0,5 mg/ml som
PRODUKTRESUMÉ. for. Hyobac App 2 Vet., injektionsvæske, emulsion. Actinobacillus pleuropneumoniae, serotype 2, RP > 1*
 10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
10. april 2012 PRODUKTRESUMÉ for Hyobac App 2 Vet., injektionsvæske, emulsion 0. D.SP.NR 27891 1. VETERINÆRLÆGEMIDLETS NAVN Hyobac App 2 Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktive stoffer Pr.
PRODUKTRESUMÉ. for. Terramycin-Polymyxin B, øjensalve
 25. november 2011 PRODUKTRESUMÉ for Terramycin-Polymyxin B, øjensalve 0. D.SP.NR. 0071 1. LÆGEMIDLETS NAVN Terramycin-Polymyxin B 2. KVALITATIV OG KAVNTITATIV SAMMENSÆTNING Oxytetracyclin 5 mg/g som oxytetracyclinhydrochlorid
25. november 2011 PRODUKTRESUMÉ for Terramycin-Polymyxin B, øjensalve 0. D.SP.NR. 0071 1. LÆGEMIDLETS NAVN Terramycin-Polymyxin B 2. KVALITATIV OG KAVNTITATIV SAMMENSÆTNING Oxytetracyclin 5 mg/g som oxytetracyclinhydrochlorid
PRODUKTRESUMÉ. for. Uniferon, injektionsvæske, opløsning, beregnet til pattegrise
 9. april 2015 PRODUKTRESUMÉ for Uniferon, injektionsvæske, opløsning, beregnet til pattegrise 0. D.SP.NR 08324 1. VETERINÆRLÆGEMIDLETS NAVN Uniferon 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
9. april 2015 PRODUKTRESUMÉ for Uniferon, injektionsvæske, opløsning, beregnet til pattegrise 0. D.SP.NR 08324 1. VETERINÆRLÆGEMIDLETS NAVN Uniferon 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
PRODUKTRESUMÉ. for. Mini-Pe, tabletter
 Produktinformation for Mini-Pe (Norethisteron) Tabletter 0,35 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 17 53 23 Tabletter 0,35 mg 3 x 28 stk. (blister) Dagsaktuel pris
Produktinformation for Mini-Pe (Norethisteron) Tabletter 0,35 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 17 53 23 Tabletter 0,35 mg 3 x 28 stk. (blister) Dagsaktuel pris
Indlægsseddel: Information til brugeren. Maxidex 1 mg/ml, øjendråber, suspension. dexamethason
 Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. Benaliv 0,5 mg/ml øjendråber, suspension. Levocabastin
 Indlægsseddel: Information til brugeren Benaliv 0,5 mg/ml øjendråber, suspension Levocabastin Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Benaliv 0,5 mg/ml øjendråber, suspension Levocabastin Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
PRODUKTRESUMÉ. for. Benylan, oral opløsning
 28. juni 2007 PRODUKTRESUMÉ for Benylan, oral opløsning 0. D.SP.NR. 0958 1. LÆGEMIDLETS NAVN Benylan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diphenhydraminhydrochlorid 2,8 mg/ml Hjælpestoffer se pkt.
28. juni 2007 PRODUKTRESUMÉ for Benylan, oral opløsning 0. D.SP.NR. 0958 1. LÆGEMIDLETS NAVN Benylan 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Diphenhydraminhydrochlorid 2,8 mg/ml Hjælpestoffer se pkt.
Indlægsseddel: Information til brugeren. Ciloxan 3 mg/ml, øjendråber, opløsning. ciprofloxacin
 Indlægsseddel: Information til brugeren Ciloxan 3 mg/ml, øjendråber, opløsning ciprofloxacin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Ciloxan 3 mg/ml, øjendråber, opløsning ciprofloxacin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
PRODUKTRESUMÉ. for. Equimucin Vet., oralt pulver
 29. oktober 2009 PRODUKTRESUMÉ for Equimucin Vet., oralt pulver 0. D.SP.NR. 22316 1. VETERINÆRLÆGEMIDLETS NAVN Equimucin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Acetylcystein 2 g Alle
29. oktober 2009 PRODUKTRESUMÉ for Equimucin Vet., oralt pulver 0. D.SP.NR. 22316 1. VETERINÆRLÆGEMIDLETS NAVN Equimucin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Acetylcystein 2 g Alle
PRODUKTRESUMÉ. for. Felden, gel. Hjælpestof, som behandleren skal være opmærksom på: Propylenglycol
 Produktinformation for Felden (Piroxicam) Gel, 0,5% Markedsførte pakninger: Vnr Lægemiddelform og styrke 15 23 48 Gel 0,5% 06 14 65 Gel 0,5% 08 58 16 Gel 0,5% Pakningsstørrelse 25 g 50 g 112 g Dagsaktuel
Produktinformation for Felden (Piroxicam) Gel, 0,5% Markedsførte pakninger: Vnr Lægemiddelform og styrke 15 23 48 Gel 0,5% 06 14 65 Gel 0,5% 08 58 16 Gel 0,5% Pakningsstørrelse 25 g 50 g 112 g Dagsaktuel
PRODUKTRESUMÉ. for. Antepsin, tabletter
 26. oktober 2012 PRODUKTRESUMÉ for Antepsin, tabletter 0. D.SP.NR. 3919 1. LÆGEMIDLETS NAVN Antepsin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Sucralfat 1 g Alle hjælpestoffer er anført under pkt. 6.1.
26. oktober 2012 PRODUKTRESUMÉ for Antepsin, tabletter 0. D.SP.NR. 3919 1. LÆGEMIDLETS NAVN Antepsin 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Sucralfat 1 g Alle hjælpestoffer er anført under pkt. 6.1.
Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning
 Indlægsseddel: Information til brugeren Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning hypromellose Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Viskøse
Indlægsseddel: Information til brugeren Viskøse Øjendråber Ophtha 3,5 mg/ml øjendråber, opløsning hypromellose Læs denne indlægsseddel grundigt. Den indeholder vigtige informationer. Du kan få Viskøse
PRODUKTRESUMÉ. for. Strepsils med Honning & Citron, sugetabletter
 24. april 2013 PRODUKTRESUMÉ for Strepsils med Honning & Citron, sugetabletter 0. D.SP.NR. 1854 1. LÆGEMIDLETS NAVN Strepsils med Honning & Citron 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
24. april 2013 PRODUKTRESUMÉ for Strepsils med Honning & Citron, sugetabletter 0. D.SP.NR. 1854 1. LÆGEMIDLETS NAVN Strepsils med Honning & Citron 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 2,4- diklorbenzylalkohol
PRODUKTRESUMÉ. for. Panodil, filmovertrukne tabletter
 7. januar 2013 PRODUKTRESUMÉ for Panodil, filmovertrukne tabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver tablet indeholder 500 mg eller 1000 mg paracetamol.
7. januar 2013 PRODUKTRESUMÉ for Panodil, filmovertrukne tabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver tablet indeholder 500 mg eller 1000 mg paracetamol.
PRODUKTRESUMÉ. for. Mucolysin Skovbær, brusetabletter
 1. februar 2012 PRODUKTRESUMÉ for Mucolysin Skovbær, brusetabletter 0. D.SP.NR. 22946 1. LÆGEMIDLETS NAVN Mucolysin Skovbær 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En brusetablet indeholder 200 mg acetylcystein.
1. februar 2012 PRODUKTRESUMÉ for Mucolysin Skovbær, brusetabletter 0. D.SP.NR. 22946 1. LÆGEMIDLETS NAVN Mucolysin Skovbær 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En brusetablet indeholder 200 mg acetylcystein.
PRODUKTRESUMÉ. for. Panodil Brus, brusetabletter
 7. januar 2013 PRODUKTRESUMÉ for Panodil Brus, brusetabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Brus 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver brusetablet indeholder 500 mg paracetamol.
7. januar 2013 PRODUKTRESUMÉ for Panodil Brus, brusetabletter 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Brus 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver brusetablet indeholder 500 mg paracetamol.
Indlægsseddel: Information til patienten. Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin
 Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning. Emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
PRODUKTRESUMÉ. for. Xalcom, øjendråber, opløsning
 12. november 2018 PRODUKTRESUMÉ for Xalcom, øjendråber, opløsning 0. D.SP.NR. 20888 1. LÆGEMIDLETS NAVN Xalcom 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder latanoprost 50 mikrogram/ml
12. november 2018 PRODUKTRESUMÉ for Xalcom, øjendråber, opløsning 0. D.SP.NR. 20888 1. LÆGEMIDLETS NAVN Xalcom 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder latanoprost 50 mikrogram/ml
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Allergodil 0,5 mg/ml øjendråber, opløsning. Azelastinhydrochlorid
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Allergodil 0,5 mg/ml øjendråber, opløsning Azelastinhydrochlorid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
PRODUKTRESUMÉ. for. Panodil Hot, pulver til oral opløsning, brev
 7. januar 2013 PRODUKTRESUMÉ for Panodil Hot, pulver til oral opløsning, brev 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Hot 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hvert brev indeholder 500 mg paracetamol.
7. januar 2013 PRODUKTRESUMÉ for Panodil Hot, pulver til oral opløsning, brev 0. D.SP.NR. 3115 1. LÆGEMIDLETS NAVN Panodil Hot 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hvert brev indeholder 500 mg paracetamol.
PRODUKTRESUMÉ. for. Kelactin Vet., oral opløsning
 4. maj 2015 PRODUKTRESUMÉ for Kelactin Vet., oral opløsning 0. D.SP.NR 27896 1. VETERINÆRLÆGEMIDLETS NAVN Kelactin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml af produktet indeholder: Aktivt stof:
4. maj 2015 PRODUKTRESUMÉ for Kelactin Vet., oral opløsning 0. D.SP.NR 27896 1. VETERINÆRLÆGEMIDLETS NAVN Kelactin Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml af produktet indeholder: Aktivt stof:
Indlægsseddel: Information til brugeren. OPATANOL 1 mg/ml øjendråber, opløsning Olopatadin
 Indlægsseddel: Information til brugeren OPATANOL 1 mg/ml øjendråber, opløsning Olopatadin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren OPATANOL 1 mg/ml øjendråber, opløsning Olopatadin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren
 Indlægsseddel: Information til brugeren Hydrocortison med Terramycin og Polymyxin B 15 mg/ml / 5 mg/ml / 1 mg/ml Øjen- og øredråber, suspension hydrocortisonacetat/oxytetracyclinhydrochlorid/polymyxin
Indlægsseddel: Information til brugeren Hydrocortison med Terramycin og Polymyxin B 15 mg/ml / 5 mg/ml / 1 mg/ml Øjen- og øredråber, suspension hydrocortisonacetat/oxytetracyclinhydrochlorid/polymyxin
PRODUKTRESUMÉ. for. Mhyogen, injektionsvæske, emulsion
 17. juni 2015 PRODUKTRESUMÉ for Mhyogen, injektionsvæske, emulsion 0. D.SP.NR. 29159 1. VETERINÆRLÆGEMIDLETS NAVN Mhyogen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis (2 ml) indeholder: Aktive stoffer
17. juni 2015 PRODUKTRESUMÉ for Mhyogen, injektionsvæske, emulsion 0. D.SP.NR. 29159 1. VETERINÆRLÆGEMIDLETS NAVN Mhyogen 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis (2 ml) indeholder: Aktive stoffer
PRODUKTRESUMÉ. for. Softacort, øjendråber, opløsning, enkeltdosisbeholder
 3. april 2017 PRODUKTRESUMÉ for Softacort, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 29514 1. LÆGEMIDLETS NAVN Softacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
3. april 2017 PRODUKTRESUMÉ for Softacort, øjendråber, opløsning, enkeltdosisbeholder 0. D.SP.NR. 29514 1. LÆGEMIDLETS NAVN Softacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml øjendråber, opløsning
PRODUKTRESUMÉ. for. Mega C 1500 "Tolico", depottabletter 1500 mg
 10. november 2010 PRODUKTRESUMÉ for Mega C 1500 "Tolico", depottabletter 1500 mg 0. D.SP.NR. - 1. LÆGEMIDLETS NAVN Mega C 1500 Tolico 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 depottablet indeholder:
10. november 2010 PRODUKTRESUMÉ for Mega C 1500 "Tolico", depottabletter 1500 mg 0. D.SP.NR. - 1. LÆGEMIDLETS NAVN Mega C 1500 Tolico 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 depottablet indeholder:
PRODUKTRESUMÉ. for. Locacorten - Vioform, øredråber, opløsning
 8. juni 2017 PRODUKTRESUMÉ for Locacorten - Vioform, øredråber, opløsning 0. D.SP.NR. 2775 1. LÆGEMIDLETS NAVN Locacorten - Vioform 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Flumetasonpivalat 0,2 mg/g
8. juni 2017 PRODUKTRESUMÉ for Locacorten - Vioform, øredråber, opløsning 0. D.SP.NR. 2775 1. LÆGEMIDLETS NAVN Locacorten - Vioform 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Flumetasonpivalat 0,2 mg/g
PRODUKTRESUMÉ. for. Lestid, oralt pulver, enkeltdosisbeholder
 Produktinformation for Lestid (Colestipol) Pulv. til oral susp., endos. 5 g Markedsførte pakninger: Vnr Lægemiddelform og styrke 52 58 16 Pulv. til oral susp., endos. 5 mg Pakningsstørrelse 50 stk. Dagsaktuel
Produktinformation for Lestid (Colestipol) Pulv. til oral susp., endos. 5 g Markedsførte pakninger: Vnr Lægemiddelform og styrke 52 58 16 Pulv. til oral susp., endos. 5 mg Pakningsstørrelse 50 stk. Dagsaktuel
Indlægsseddel: Information til brugeren. Mydriacyl 5 mg/ml og 10 mg/ml øjendråber, opløsning. tropicamid
 Indlægsseddel: Information til brugeren Mydriacyl 5 mg/ml og 10 mg/ml øjendråber, opløsning tropicamid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Mydriacyl 5 mg/ml og 10 mg/ml øjendråber, opløsning tropicamid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Minprostin, vagitorier. 3. LÆGEMIDDELFORM Vagitorier Hvide vagitorier der er mærket UPJOHN 715 på den ene side.
 Produktinformation for Minprostin (Dinoproston) Vagitorier 3 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 41 09 51 Vagitorier 3 mg 4 stk. Dagsaktuel pris findes på www.medicinpriser.dk
Produktinformation for Minprostin (Dinoproston) Vagitorier 3 mg Markedsførte pakninger: Vnr Lægemiddelform og Pakningsstørrelse styrke 41 09 51 Vagitorier 3 mg 4 stk. Dagsaktuel pris findes på www.medicinpriser.dk
PRODUKTRESUMÉ. for. Creon 25.000, hårde enterokapsler
 24. august 2015 PRODUKTRESUMÉ for Creon 25.000, hårde enterokapsler 0. D.SP.NR 818 1. LÆGEMIDLETS NAVN Creon 25.000 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 kapsel indeholder 300 mg pankreatin svarende
24. august 2015 PRODUKTRESUMÉ for Creon 25.000, hårde enterokapsler 0. D.SP.NR 818 1. LÆGEMIDLETS NAVN Creon 25.000 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 kapsel indeholder 300 mg pankreatin svarende
Hele virion influenzavaccine af pandemisk stamme, inaktiveret, med antigen * svarende til:
 1. LÆGEMIDLETS NAVN Daronrix, injektionsvæske, suspension, i fyldt injektionssprøjte Pandemisk influenzavaccine (hele virion, inaktiveret, adjuveret) 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hele virion
1. LÆGEMIDLETS NAVN Daronrix, injektionsvæske, suspension, i fyldt injektionssprøjte Pandemisk influenzavaccine (hele virion, inaktiveret, adjuveret) 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hele virion
PRODUKTRESUMÉ. for. Aurovet, oralt pulver
 12. januar 2015 PRODUKTRESUMÉ for Aurovet, oralt pulver 0. D.SP.NR 24814 1. VETERINÆRLÆGEMIDLETS NAVN Aurovet 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Chlortetracyclin (som chlortetracyclinhydrochlorid)
12. januar 2015 PRODUKTRESUMÉ for Aurovet, oralt pulver 0. D.SP.NR 24814 1. VETERINÆRLÆGEMIDLETS NAVN Aurovet 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Chlortetracyclin (som chlortetracyclinhydrochlorid)
Indlægsseddel: Information til brugeren. TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension. tobramycin og dexamethason
 Indlægsseddel: Information til brugeren TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension tobramycin og dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
Indlægsseddel: Information til brugeren TOBRADEX 3 mg/ml / 1mg/ml øjendråber, suspension tobramycin og dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den
Indlægsseddel: Information til brugeren. Lodoxamid
 Indlægsseddel: Information til brugeren Alomide 1 mg/ml, øjendråber, opløsning Lodoxamid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Alomide 1 mg/ml, øjendråber, opløsning Lodoxamid Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste.
 1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
1. VETERINÆRLÆGEMIDLETS NAVN Metacam 20 mg/ml injektionsvæske, opløsning til kvæg, grise og heste. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml indeholder: Aktivt stof: Meloxicam Hjælpestof: Ethanol
PRODUKTRESUMÉ. for. Isovorin, injektionsvæske, opløsning
 Produktinformation for Isovorin (Levofolinsyre som calciumlevofolin) Injektionsvæske, opl. 10 Markedsførte pakninger: Vnr Lægemiddelform og styrke 09 12 66 Injektionsvæske, opl. 10 09 12 77 Injektionsvæske,
Produktinformation for Isovorin (Levofolinsyre som calciumlevofolin) Injektionsvæske, opl. 10 Markedsførte pakninger: Vnr Lægemiddelform og styrke 09 12 66 Injektionsvæske, opl. 10 09 12 77 Injektionsvæske,
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Glycerylnitrat SAD, koncentrat til infusionsvæske, opløsning 5 mg/ml. glyceryltrinitrat
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Glycerylnitrat SAD, koncentrat til infusionsvæske, opløsning 5 mg/ml glyceryltrinitrat Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Glycerylnitrat SAD, koncentrat til infusionsvæske, opløsning 5 mg/ml glyceryltrinitrat Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel,
PRODUKTRESUMÉ. for. Metomotyl, injektionsvæske, opløsning
 12. december 2017 PRODUKTRESUMÉ for Metomotyl, injektionsvæske, opløsning 0. D.SP.NR. 28870 1. VETERINÆRLÆGEMIDLETS NAVN Metomotyl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml i 2,5 mg/ml opløsning
12. december 2017 PRODUKTRESUMÉ for Metomotyl, injektionsvæske, opløsning 0. D.SP.NR. 28870 1. VETERINÆRLÆGEMIDLETS NAVN Metomotyl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml i 2,5 mg/ml opløsning
Indlægsseddel: Information til brugeren. Maxidex 1 mg/ml, øjendråber, suspension. dexamethason
 Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Maxidex 1 mg/ml, øjendråber, suspension dexamethason Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
PRODUKTRESUMÉ. for. Prostivas, infusionsvæske, opløsning, koncentrat
 Produktinformation for Prostivas (Alprostadil) Infusionskoncentrat 0,5 mg/ml Markedsførte pakninger: Vnr Lægemiddelform og styrke 04 17 31 Infusionskoncentrat 0,5 mg/ml Pakningsstørrelse 5 x 1 ml Dagsaktuel
Produktinformation for Prostivas (Alprostadil) Infusionskoncentrat 0,5 mg/ml Markedsførte pakninger: Vnr Lægemiddelform og styrke 04 17 31 Infusionskoncentrat 0,5 mg/ml Pakningsstørrelse 5 x 1 ml Dagsaktuel
PRODUKTRESUMÉ. for. Dilaterol Vet. syrup. Aktivt stof 25 mikrogram clenbuterolhydrochlorid (svarende til 22 mikrogram clenbuterol).
 16. marts 2018 PRODUKTRESUMÉ for Dilaterol Vet. syrup 0. D.SP.NR 28075 1. VETERINÆRLÆGEMIDLETS NAVN Dilaterol Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktivt stof 25 mikrogram
16. marts 2018 PRODUKTRESUMÉ for Dilaterol Vet. syrup 0. D.SP.NR 28075 1. VETERINÆRLÆGEMIDLETS NAVN Dilaterol Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktivt stof 25 mikrogram
PRODUKTRESUMÉ. for. Pracetam Vet., opløsning til anvendelse til drikkevand
 12. januar 2015 PRODUKTRESUMÉ for Pracetam Vet., opløsning til anvendelse til drikkevand 0. D.SP.NR 22642 1. VETERINÆRLÆGEMIDLETS NAVN Pracetam Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
12. januar 2015 PRODUKTRESUMÉ for Pracetam Vet., opløsning til anvendelse til drikkevand 0. D.SP.NR 22642 1. VETERINÆRLÆGEMIDLETS NAVN Pracetam Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof
PRODUKTRESUMÉ. for. Brentacort, salve
 26. november 2013 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
26. november 2013 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
BILAG III. Ændringer i relevante afsnit af produktresumeet, etiketteringen og indlægssedlen
 BILAG III Ændringer i relevante afsnit af produktresumeet, etiketteringen og indlægssedlen 19 PRODUKTRESUME Dette lægemiddel er underlagt supplerende overvågning. Dermed kan nye sikkerhedsoplysninger hurtigt
BILAG III Ændringer i relevante afsnit af produktresumeet, etiketteringen og indlægssedlen 19 PRODUKTRESUME Dette lægemiddel er underlagt supplerende overvågning. Dermed kan nye sikkerhedsoplysninger hurtigt
PRODUKTRESUMÉ. for. Malaseb Vet., shampoo
 15. juli 2010 PRODUKTRESUMÉ for Malaseb Vet., shampoo 0. D.SP.NR 25817 1. VETERINÆRLÆGEMIDLETS NAVN Malaseb Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktive stoffer: Chlorhexidindigluconat
15. juli 2010 PRODUKTRESUMÉ for Malaseb Vet., shampoo 0. D.SP.NR 25817 1. VETERINÆRLÆGEMIDLETS NAVN Malaseb Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktive stoffer: Chlorhexidindigluconat
PRODUKTRESUMÉ. for. Mydriasert, øjenlamel
 10. april 2012 PRODUKTRESUMÉ for Mydriasert, øjenlamel 0. D.SP.NR. 23325 1. LÆGEMIDLETS NAVN Mydriasert 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En øjenlamel indeholder 0,28 mg tropicamid og 5,4 mg phenylephrin
10. april 2012 PRODUKTRESUMÉ for Mydriasert, øjenlamel 0. D.SP.NR. 23325 1. LÆGEMIDLETS NAVN Mydriasert 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En øjenlamel indeholder 0,28 mg tropicamid og 5,4 mg phenylephrin
Indlægsseddel: Information til brugeren. Tobrex Depot 3 mg/ml, depotøjendråber, opløsning. tobramycin
 Indlægsseddel: Information til brugeren Tobrex Depot 3 mg/ml, depotøjendråber, opløsning tobramycin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Tobrex Depot 3 mg/ml, depotøjendråber, opløsning tobramycin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Bricanyl, infusionsvæske, opløsning, koncentrat til
 10. januar 2012 PRODUKTRESUMÉ for Bricanyl, infusionsvæske, opløsning, koncentrat til 0. D.SP.NR. 2900 1. LÆGEMIDLETS NAVN Bricanyl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Terbutalinsulfat
10. januar 2012 PRODUKTRESUMÉ for Bricanyl, infusionsvæske, opløsning, koncentrat til 0. D.SP.NR. 2900 1. LÆGEMIDLETS NAVN Bricanyl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml indeholder: Terbutalinsulfat
Indlægsseddel: Information til brugeren. Voltaren Ophtha 1 mg/ml, øjendråber, opløsning diclofenac
 Indlægsseddel: Information til brugeren Voltaren Ophtha 1 mg/ml, øjendråber, opløsning diclofenac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
Indlægsseddel: Information til brugeren Voltaren Ophtha 1 mg/ml, øjendråber, opløsning diclofenac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige
PRODUKTRESUMÉ. for. Brentacort, salve
 22. december 2011 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
22. december 2011 PRODUKTRESUMÉ for Brentacort, salve 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
PRODUKTRESUMÉ. for. Atipam injektionsvæske, opløsning
 27. februar 2013 PRODUKTRESUMÉ for Atipam injektionsvæske, opløsning 0. D.SP.NR 25362 1. VETERINÆRLÆGEMIDLETS NAVN Atipam 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktivt stof: Atipamezolhydrochlorid
27. februar 2013 PRODUKTRESUMÉ for Atipam injektionsvæske, opløsning 0. D.SP.NR 25362 1. VETERINÆRLÆGEMIDLETS NAVN Atipam 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Hver ml indeholder: Aktivt stof: Atipamezolhydrochlorid
PRODUKTRESUMÉ. for. Promon Vet., tabletter
 9. april 2014 PRODUKTRESUMÉ for Promon Vet., tabletter 0. D.SP.NR 3787 1. VETERINÆRLÆGEMIDLETS NAVN Promon Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: 1 tablet indeholder: Medroxyprogesteronacetat
9. april 2014 PRODUKTRESUMÉ for Promon Vet., tabletter 0. D.SP.NR 3787 1. VETERINÆRLÆGEMIDLETS NAVN Promon Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: 1 tablet indeholder: Medroxyprogesteronacetat
PRODUKTRESUMÉ. for. Toltarox, oral suspension
 2. januar 2013 PRODUKTRESUMÉ for Toltarox, oral suspension 0. D.SP.NR 26780 1. VETERINÆRLÆGEMIDLETS NAVN Toltarox 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml oral suspension indeholder: Aktivt stof
2. januar 2013 PRODUKTRESUMÉ for Toltarox, oral suspension 0. D.SP.NR 26780 1. VETERINÆRLÆGEMIDLETS NAVN Toltarox 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml oral suspension indeholder: Aktivt stof
Indlægsseddel: Information til brugeren. Dalacin. 10 mg/ ml kutanopløsning Til udvortes brug clindamycinphosphat
 Indlægsseddel: Information til brugeren Dalacin 10 mg/ ml kutanopløsning Til udvortes brug clindamycinphosphat Læs denne indlægsseddel grundigt, inden De begynder at bruge dette lægemiddel, da den indeholder
Indlægsseddel: Information til brugeren Dalacin 10 mg/ ml kutanopløsning Til udvortes brug clindamycinphosphat Læs denne indlægsseddel grundigt, inden De begynder at bruge dette lægemiddel, da den indeholder
PRODUKTRESUMÉ. for. Canesten, vaginaltabletter (Orifarm)
 27. september 2010 PRODUKTRESUMÉ for Canesten, vaginaltabletter (Orifarm) 0. D.SP.NR. 3105 1. LÆGEMIDLETS NAVN Canesten 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Clotrimazol 100 mg og 500 mg 3. Lægemiddelform
27. september 2010 PRODUKTRESUMÉ for Canesten, vaginaltabletter (Orifarm) 0. D.SP.NR. 3105 1. LÆGEMIDLETS NAVN Canesten 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Clotrimazol 100 mg og 500 mg 3. Lægemiddelform
PRODUKTRESUMÉ. for. Brentacort, creme
 6. juli 2015 PRODUKTRESUMÉ for Brentacort, creme 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
6. juli 2015 PRODUKTRESUMÉ for Brentacort, creme 0. D.SP.NR. 3789 1. LÆGEMIDLETS NAVN Brentacort 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 20 mg/g miconazolnitrat og 10 mg/g hydrocortison. Hjælpestoffer
PRODUKTRESUMÉ. for. Nixema, medicinsk plaster
 10. april 2007 PRODUKTRESUMÉ for Nixema, medicinsk plaster 0. D.SP.NR. 22894 1. LÆGEMIDLETS NAVN Nixema 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Mængde anført på mærkningen Aktivt stof mg/cm 2 mg/brik
10. april 2007 PRODUKTRESUMÉ for Nixema, medicinsk plaster 0. D.SP.NR. 22894 1. LÆGEMIDLETS NAVN Nixema 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Mængde anført på mærkningen Aktivt stof mg/cm 2 mg/brik
PRODUKTRESUMÉ for ALK 780 Rugmel Opløsning til priktest (Soluprick) Korn- og melallergen
 23. januar 2015 PRODUKTRESUMÉ for ALK 780 Rugmel Opløsning til priktest (Soluprick) Korn- og melallergen 0. D.SP.NR. 4821 1. LÆGEMIDLETS NAVN ALK 780 Rugmel 2. KVALITATIV OG KVANTITATIV SAMMENSÆÆTNING
23. januar 2015 PRODUKTRESUMÉ for ALK 780 Rugmel Opløsning til priktest (Soluprick) Korn- og melallergen 0. D.SP.NR. 4821 1. LÆGEMIDLETS NAVN ALK 780 Rugmel 2. KVALITATIV OG KVANTITATIV SAMMENSÆÆTNING
Zovir 5 % creme Aciclovir
 11. november 2016 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
11. november 2016 Zovir 5 % creme Aciclovir Der findes to pakningsstørrelser af Zovir 5 % creme. Den fås med henholdsvis 10 g og 2 g med hver sin indlægsseddel. Se de følgende sider. Første indlægsseddel
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN. Ventoline 0,4 mg/ml oral opløsning Salbutamol
 INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Ventoline 0,4 mg/ml oral opløsning Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN Ventoline 0,4 mg/ml oral opløsning Salbutamol Læs denne indlægsseddel grundigt, inden du begynder at tage dette lægemiddel, da den indeholder vigtige oplysninger.
BILAG I PRODUKTRESUME
 BILAG I PRODUKTRESUME 1. LÆGEMIDLETS NAVN TRAVATAN 40 mikrogram/ml øjendråber, opløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 40 mikrogram travoprost Hjælpestoffer er anført
BILAG I PRODUKTRESUME 1. LÆGEMIDLETS NAVN TRAVATAN 40 mikrogram/ml øjendråber, opløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 ml opløsning indeholder 40 mikrogram travoprost Hjælpestoffer er anført
Indlægsseddel: Information til patienten. Emadine 0,5 mg/ml øjendråber, opløsning i enkeltdosisbeholder. emedastin
 Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning i enkeltdosisbeholder. emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
Indlægsseddel: Information til patienten Emadine 0,5 mg/ml øjendråber, opløsning i enkeltdosisbeholder. emedastin Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder
Metaflumizon (mg) 0,80 ml 160 mg. 1,60 ml 320 mg
 1. VETERINÆRLÆGEMIDLETS NAVN ProMeris 160 mg Spot-on, opløsning til små katte ProMeris 320 mg Spot-on, opløsning til store katte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Én ml indeholder
1. VETERINÆRLÆGEMIDLETS NAVN ProMeris 160 mg Spot-on, opløsning til små katte ProMeris 320 mg Spot-on, opløsning til store katte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof: Én ml indeholder
PRODUKTRESUMÉ. for. Tamoxifen A-Pharma, tabletter (A-Pharma)
 27. september 2012 PRODUKTRESUMÉ for Tamoxifen A-Pharma, tabletter (A-Pharma) 0. D.SP.NR. 6472 1. LÆGEMIDLETS NAVN Tamoxifen A-Pharma. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Tamoxifen 20 mg som tamoxifencitrat.
27. september 2012 PRODUKTRESUMÉ for Tamoxifen A-Pharma, tabletter (A-Pharma) 0. D.SP.NR. 6472 1. LÆGEMIDLETS NAVN Tamoxifen A-Pharma. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Tamoxifen 20 mg som tamoxifencitrat.
PRODUKTRESUMÉ. for. Dapson Scanpharm, tabletter
 PRODUKTRESUMÉ 14. juni 2007 for Dapson Scanpharm, tabletter 0. D.SP.NR. 6766 1. LÆGEMIDLETS NAVN Dapson Scanpharm 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dapson 50 mg og 100 mg Hjælpestoffer, se pkt
PRODUKTRESUMÉ 14. juni 2007 for Dapson Scanpharm, tabletter 0. D.SP.NR. 6766 1. LÆGEMIDLETS NAVN Dapson Scanpharm 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Dapson 50 mg og 100 mg Hjælpestoffer, se pkt
Amning: Vivotif bør kun anvendes på tvingende indikation i ammeperioden.
 8. december 2008 PRODUKTRESUMÉ for Vivotif, hårde enterokapsler 0. D.SP.NR. 6673 1. LÆGEMIDLETS NAVN Vivotif 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis indeholder: Mindst 2 x 10 9 levende organismer
8. december 2008 PRODUKTRESUMÉ for Vivotif, hårde enterokapsler 0. D.SP.NR. 6673 1. LÆGEMIDLETS NAVN Vivotif 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING 1 dosis indeholder: Mindst 2 x 10 9 levende organismer
PRODUKTRESUMÉ. for. Canidryl, tabletter. 50.0 mg/tablet 100.0 mg/tablet Hjælpestoffer Se pkt. 6.1 for en fuldstændig fortegnelse over hjælpestoffer.
 29. oktober 2012 PRODUKTRESUMÉ for Canidryl, tabletter 0. D.SP.NR 23484 1. VETERINÆRLÆGEMIDLETS NAVN Canidryl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof Carprofen 20.0 mg/tablet 50.0 mg/tablet
29. oktober 2012 PRODUKTRESUMÉ for Canidryl, tabletter 0. D.SP.NR 23484 1. VETERINÆRLÆGEMIDLETS NAVN Canidryl 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Aktivt stof Carprofen 20.0 mg/tablet 50.0 mg/tablet
Indlægsseddel: Information til brugeren. Nevanac 3 mg/ml øjendråber, suspension nepafenac
 Indlægsseddel: Information til brugeren Nevanac 3 mg/ml øjendråber, suspension nepafenac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren Nevanac 3 mg/ml øjendråber, suspension nepafenac Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
Indlægsseddel: Information til brugeren. Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning. Dexamethasonnatriumphosphat/chloramphenicol
 Indlægsseddel: Information til brugeren Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning Dexamethasonnatriumphosphat/chloramphenicol Læs denne indlægsseddel grundigt, inden du begynder at bruge
Indlægsseddel: Information til brugeren Spersadex Comp. 1 mg/ml + 5 mg/ml, øjendråber, opløsning Dexamethasonnatriumphosphat/chloramphenicol Læs denne indlægsseddel grundigt, inden du begynder at bruge
Bilag III. Ændringer til relevante afsnit af produktinformationen
 Bilag III Ændringer til relevante afsnit af produktinformationen Bemærk: Disse ændringer til de relevante afsnit i produktresuméet og indlægssedlen er resultatet af referral-proceduren. Produktinformationen
Bilag III Ændringer til relevante afsnit af produktinformationen Bemærk: Disse ændringer til de relevante afsnit i produktresuméet og indlægssedlen er resultatet af referral-proceduren. Produktinformationen
Bilag III. Ændringer til relevante afsnit i produktresuméer og indlægssedler
 Bilag III Ændringer til relevante afsnit i produktresuméer og indlægssedler Note: De pågældende punkter i produktresuméet og indlægssedlen er resultatet af referral proceduren. Produktinformationen kan
Bilag III Ændringer til relevante afsnit i produktresuméer og indlægssedler Note: De pågældende punkter i produktresuméet og indlægssedlen er resultatet af referral proceduren. Produktinformationen kan
BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉ, ETIKETTERING OG INDLÆGSSEDDEL FREMLAGT AF EMA
 BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉ, ETIKETTERING OG INDLÆGSSEDDEL FREMLAGT AF EMA 11 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering
BILAG II VIDENSKABELIGE KONKLUSIONER OG BEGRUNDELSER FOR ÆNDRING AF PRODUKTRESUMÉ, ETIKETTERING OG INDLÆGSSEDDEL FREMLAGT AF EMA 11 Videnskabelige konklusioner Samlet resumé af den videnskabelige vurdering
Hjælpestoffer: Thiomersal maks. 120 µg
 1. VETERINÆRLÆGEMIDLETS NAVN COXEVAC injektionsvæske, opløsning til kvæg og geder. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Sammensætning i 1 ml: Aktivt stof: Inaktiveret Coxiella burnetii, stamme Nine
1. VETERINÆRLÆGEMIDLETS NAVN COXEVAC injektionsvæske, opløsning til kvæg og geder. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Sammensætning i 1 ml: Aktivt stof: Inaktiveret Coxiella burnetii, stamme Nine
PRODUKTRESUMÉ. for. Romefen Vet., tabletter
 29. oktober 2012 PRODUKTRESUMÉ for Romefen Vet., tabletter 0. D.SP.NR 8710 1. VETERINÆRLÆGEMIDLETS NAVN Romefen Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Ketoprofen 10 mg og 20 mg. 3. LÆGEMIDDELFORM
29. oktober 2012 PRODUKTRESUMÉ for Romefen Vet., tabletter 0. D.SP.NR 8710 1. VETERINÆRLÆGEMIDLETS NAVN Romefen Vet. 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING Ketoprofen 10 mg og 20 mg. 3. LÆGEMIDDELFORM
Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat
 Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Tag altid
Indlægsseddel: Information til brugeren Brentan 20 mg/g creme Miconazolnitrat Læs denne indlægsseddel grundigt inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger. Tag altid
4.2 Terapeutiske indikationer med angivelse af dyrearter, som lægemidlet er beregnet til
 1. VETERINÆRLÆGEMIDLETS NAVN MELOXIDYL 0,5 mg/ml oral suspension til katte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml MELOXIDYL 0,5 mg/ml oral suspension til katte indeholder: Aktivt stof: Meloxicam
1. VETERINÆRLÆGEMIDLETS NAVN MELOXIDYL 0,5 mg/ml oral suspension til katte 2. KVALITATIV OG KVANTITATIV SAMMENSÆTNING En ml MELOXIDYL 0,5 mg/ml oral suspension til katte indeholder: Aktivt stof: Meloxicam
