Deltagerinformation og samtykkeerklæring vedr. det videnskabelige forsøg P[R]EBEN
|
|
|
- Poul Søndergaard
- 5 år siden
- Visninger:
Transkript
1 Deltagerinformation og samtykkeerklæring vedr. det videnskabelige forsøg P[R]EBEN Forsøgets titel: Et fase 1/2 studie af kombinationsbehandling med pixantrone, etoposid, bendamustin og, ved CD20-positive tumorer, rituximab til patienter med tilbagefald af aggressiv lymfekræft af B- eller T-celle fænotype P[R]EBEN studiet Officiel titel (engelsk): A Phase 1/2 study of the combination of pixantrone, etoposide, bendamustine and, in CD-20 positive tumors, rituximab in patients with relapsed aggressive non-hodgkin lymphomas of B- or T-cell phenotype The P[R]EBEN study Kære Vi vil gerne spørge dig, om du vil deltage i ovennævnte videnskabelige forsøg. Forsøgets initiativtager er Nordisk Lymfomgruppe (NLG), som er en sammenslutning af de hospitalsafdelinger, der beskæftiger sig med diagnosticering og behandling af lymfekræft i Norden (Danmark, Finland, Norge og Sverige). NLG står for idé, udvikling og gennemførelse af dette videnskabelige forsøg. Forsøget bliver udført på 20 hospitaler i Norden samt enkelte centre udenfor Norden. I alt 84 patienter vil indgå i forsøget. Vi spørger dig om du vil deltage, fordi du har lymfekræft af enten B-celle eller T-celle fænotype, som er behandlet en eller flere gange tidligere, men nu viser sygdomsaktivitet igen. Det er helt op til dig selv, om du vil deltage eller ej. Før du beslutter dig, er det vigtigt at du ved mere om forsøget, så tag dig god tid til at læse denne information. Du har også modtaget pjecen "Før du beslutter dig" om at være forsøgsperson i sundhedsvidenskabelige forsøg. Pjecen indeholder generel information om lægevidenskabelige undersøgelser. Tag dig også god tid til at tale om forsøget med din ægtefælle, partner, familie eller venner. Din deltagelse i forsøget er helt frivillig. Det er vigtigt at du forstår de mulige risici og ulemper, og også de mulige fordele ved deltagelse, så du kan tage din beslutning på et godt og velinformeret grundlag. Hvis du stadig har spørgsmål efter at have læst denne information, kan du kontakte den forsøgsansvarlige læge eller projektsygeplejerske, hvis navne findes på side 8. Formålet med forsøget Der findes ikke en standardbehandling for patienter i din situation. Det kan enten være fordi din læge skønner, at du ikke kan tåle en optrapning af behandlingsstyrken til højdosis kemoterapi med stamcelletransplantation, eller fordi du allerede har fået denne behandling tidligere i dit sygdomsforløb. Man forsøger løbende at teste nye lægemidler/ lægemiddelkombinationer i håb om at etablere nye standardbehandlinger med øget effektivitet og acceptable bivirkninger. Dette forsøg undersøger værdien af det nye Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 1
2 kemoterapistof pixantrone givet i kombination med to andre velkendte kemoterapistoffer: etoposid og bendamustin, samt antistoffet rituximab. Antistoffet kan dog kun bruges hvis lymfekræften besidder målskiven, der gør det muligt for rituximab-antistoffet at virke. Denne målskive er et protein, der sidder på kræftcellernes overflade og hedder CD20. Tilstedeværelse af CD20 på kræftcellerne bliver undersøgt rutinemæssigt i vævsprøver uanset om der er tale om forsøg eller ikke. Tilsammen kalder vi kombinationen af de lægemidler vi vil teste for P[R]EBEN (forbogstaver i de 4 lægemidler). Alle lægemidlerne er allerede godkendte og registrerede til kræftbehandling i EU og Danmark. Det nye i dette forsøg er altså at bruge dem i kombination. Indenfor det sidste år har man på nordiske og andre centre i Europa afprøvet kombinationen hos patienter, hvor behandlingsmulighederne med de kendte standardbehandlinger var udtømte. Resultaterne hos nogle af disse patienter var overraskende gode. Vi ønsker derfor, ved dette forsøg, at teste behandlingen under videnskabeligt kontrollerede forhold. Ved hjælp af blod- og vævsundersøgelser knyttet til P[R]EBEN forsøget vil vi prøve at fastslå om man kan forudsige, hvem der vil have mest gavn af denne behandling. Forsøget har to dele: Fase 1: Eftersom de kræftlægemidler, der indgår i P[R]EBEN kuren tidligere kun er blevet undersøgt i ét bestemt dosisniveau hos patienter med lymfekræft, begynder vi i denne fase af forsøget med at bestemme den optimale dosis for stofferne, når de gives i kombination. Denne del udføres kun med patienter, som lægen på forhånd vurderer at kunne tåle en forøget dosis af stofferne. Det vurderes ud fra alder og generel helbredstilstand. Denne del er gennemført og afsluttet den 12. oktober 2017 med konklusionen at den optimale dosis svarer til det allerede kendte niveau. Som følge af dette vil alle patienter inkluderet efter 12. oktober 2017 blive behandlet på dette dosisniveau (se fase 2 afsnittet nedenfor). Fase 2: Et større antal patienter behandles med kombinationen af kræftlægemidler i ens dosis for at bedømme hvor mange patienter, der bliver hjulpet af behandlingen og hvordan den tåles. Efter afslutning af fase 1 delen (se ovenfor) vil alle patienter blive behandlet med samme dosisniveau. Formålet med forsøget er altså at undersøge effekten af denne nye lægemiddelkombination med henblik på at opnå et bedre og mere holdbart behandlingsresultat i en situation hvor der ikke findes en standardbehandling. Biologisk materiale I forbindelse med forsøget vil vi gerne oprette en forskningsbiobank. Hvad er formålet med forskningsbiobanken og hvad bruges det biologiske materiale til? Formålet er at vurdere omsætningen af de enkelte kemoterapistoffer i kroppen og at undersøge udvalgte proteiner og gener i kræftceller og normale celler, der kan have indflydelse på forekomst og udbredelse af lymfekræften samt effekten af behandling. Med Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 2
3 den metode vi anvender vil vi kun undersøge udvalgte proteiner og gener og ikke hele arvematerialet. Hvilket og hvor meget biologisk materiale? Før, under og efter behandlingen vil der blive taget en blodprøve (10 ml blod). Det vil ske i forbindelse med de øvrige blodprøver, der normalt skal tages. Desuden vil der blive gemt overskydende materiale fra vævsbiopsier (lymfekræftvæv), der udtages i forbindelse med diagnosticering af sygdomstilbagefaldet. Disse prøver tages uanset om du er med i forsøget eller ej og der er således ikke tale om nogen ekstra prøver i denne forbindelse. Håndtering og opbevaring af det biologiske materiale Prøverne i forskningsbiobanken bliver gemt og analyseret samlet når alle patienter har afsluttet forsøgsbehandlingen. Ingen af prøverne kræver ekstra besøg. Prøverne mærkes med det projektnummer du har i forsøget. Det er udelukkende de ansvarlige for forsøget, der har adgang til oplysninger om de persondata, der hører til projektnummeret. Du kan til enhver tid bede om at få prøverne i forskningsbiobanken destrueret og trække dit tilsagn tilbage. Det er frivilligt at afgive prøver til forskningsbiobanken, og du kan deltage i forsøget uden at afgive prøver til det. Evt. overskydende biologisk materiale vil blive overført til en biobank til fremtidig forskning hvis du giver dit samtykke til det. Plan for forsøget Når du har underskrevet samtykkeerklæringen, vil du blive tilbudt en række tests for at undersøge, om du er egnet til at indgå i forsøget. De fleste af disse tests er standardundersøgelser for din sygdom og vil blive udført uanset om du deltager i forsøget eller ej. De udføres for at vi kan få det bedst mulige overblik over din sygdom og øvrige relevante helbredsmæssige forhold. Din læge vil ud fra undersøgelserne vurdere din almene sundhedstilstand og tage stilling til hvor meget kemoterapi du vil kunne tåle. Dette vil afgøre hvilken fase af forsøget du vil blive tilbudt indgang i. Du kan ikke selv afgøre, hvilken fase, du vil deltage i, og heller ikke hvilken dosis af kemoterapi, du bliver tilbudt. Fase 1: Denne del er afsluttet den 12. oktober Fase 2: Efter afslutning af fase 1 delen vil alle patienter, der indgår i fase 2 delen modtage samme dosisniveau. I alt 60 patienter vil indgå i denne fase af forsøget. Behandling (Appendix B viser en oversigt over behandlingsforløbet) Alle patienter i forsøget vil modtage 4-6 runder af kemoterapibehandling med kemoterapistofferne pixantrone, etoposid og bendamustine. Patienter, hvis lymfekræft indeholder målskiven CD20 vil også modtage rituximab. Hver behandlingsrunde varer 21 dage, hvor du modtager behandling på dag 1 og 8. Kemoterapien gives som en indsprøjtning i en blodåre og tager ca. 5 timer. Stoffet rituximab gives i en blodåre første gang du får det, og som en indsprøjtning under huden i de efterfølgende behandlingsrunder. Efter 2 behandlingsrunder bliver du scannet for at vurdere effekten af behandlingen. Hvis den er tilfredsstillende fortsætter du til de næste 4 behandlingsrunder og scannes derefter igen (skanninger under og efter behandling med kemoterapi er standardfremgangsmåden til Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 3
4 vurdering af behandlingseffekt og ville også blive lavet hvis du ikke deltog i forsøget). Hvis der derimod ikke har været nogen virkning på lymfekræften får du ikke flere behandlinger i forsøget, men vil blive fulgt i henhold til standardretningslinier. Follow-up Efter endt behandling overgår du til kontrolforløb, såkaldt follow-up. Her vil vi med regelmæssige mellemrum se på virkninger og bivirkninger af behandlingen på længere sigt. Follow-up perioden varer 5 år. Det første og andet år vil du blive set til kontrol i ambulatoriet hver 3. måned. Fra det tredje til det femte kontrolår vil du blive set til kontrol hver 6. måned. Det svarer til de almindelige kontrolforløb efter behandling for lymfekræft uanset om man er behandlet i et forsøg eller med standardbehandling. Nytte ved forsøget De 4 kræftlægemidler i P[R]EBEN gives allerede som adskilte behandlinger, men denne specifikke kombination er, som tidligere nævnt, ikke videnskabeligt afprøvet. Af denne grund er der endnu ikke viden om alle bivirkninger, der kan være til behandlingen. Der er heller ikke data om effekten og sikkerheden ved behandlingen, så vi ved ikke, om du får gavn af at deltage i forsøget. Det er muligt at behandlingen vil virke godt på din sygdom, og at du som følge heraf vil opleve færre symptomer. Det kan imidlertid ikke garanteres, så det er også muligt, at du ikke får gavn af at deltage i forsøget. Der er også en risiko for, at behandlingen vil medføre bivirkninger. Forsøget vil dog med stor sandsynlighed give vigtig information, som kan have betydning for behandlingen af fremtidige patienter. Bivirkninger, risici, komplikationer og ulemper Denne undersøgelse giver risiko for ubehag og bivirkninger. Du finder et omfattende overblik over mulige bivirkninger i Appendix B. Ikke alle bivirkninger, der er registreret, er anført her, men det omfatter de mest almindelige bivirkninger. Det er ikke således, at alle de nævnte bivirkninger rammer alle deltagere. Du kan risikere bivirkninger, der endnu ikke er kendt. Det er meget vigtigt, at du følger de instruktioner du får af personalet og at du fortæller om alle bivirkninger, anden medicin, behandling eller indlæggelse, som ikke er en del af forsøgsbehandlingen. Hvis du udvikler symptomer, beder vi dig informere din læge, også selv om du ikke mener at der er tale om en bivirkning til behandlingen. I tilfælde af alvorlige symptomer bør du omgående kontakte din forsøgsansvarlige læge. Uden for afdelingens daglige åbningstid bedes du kontakte afdelingens vagthavende læge. Du vil i forbindelse med alle besøg i ambulatoriet blive spurgt om hvorvidt du har oplevet symptomer, og i givet fald, hvor alvorlige de har været. Det er yderst vigtig at undgå graviditet under behandlingen. Derfor skal kvinder i den fødedygtige alder have foretaget en graviditetstest før forsøgsbehandlingen kan starte og de skal bruge effektiv graviditets-forebyggelse (f.eks. spiral, p-piller) under hele forløbet og 12 måneder efter sidste behandling. Ligeledes skal mandlige deltagere anvende prævention under forsøgsbehandlingen og 6 måneder efter sidste behandling hvis deres partner er i den fødedygtige alder. Andre behandlingsmuligheder Din læge vil drøfte mulige alternative behandlingsmuligheder med dig, før du beslutter dig for om du vil deltage i dette forsøg. Til din sygdomssituation findes der dog ingen Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 4
5 behandlinger, der opfattes som standard behandling, hverken her i Danmark eller i udlandet. Afbrydelse af og udelukkelse fra forsøget Forsøget vil blive fulgt så nøje som muligt. Det kan være at de læger, der er ansvarlige for forsøget vælger at justere eller afbryde din behandling af lægelige årsager, herunder bivirkninger. Hvis man vurderer at din sikkerhed eller velbefindende er i fare, vil vi omgående orientere dig og afslutte din behandling i forsøget. Hvis du tillader det, vil vi også informere din praktiserende læge. Hvad sker der hvis du ikke ønsker at deltage i forsøget? Det er op til dig, om du vil deltage i denne undersøgelse. Din deltagelse er således helt frivillig. Hvis du beslutter, at du ikke vil deltage, behøver du ikke at foretage dig yderligere, heller ikke at angive en grund hertil. Hvad du end beslutter, så vil det ikke have indflydelse på den behandling og hjælp, som du og dine pårørende vil modtage. Du vil modtage den samme behandling, som du ellers ville have fået. Hvis du beslutter dig for at deltage, kan du altid ændre mening og trække dig fra forsøget, uden at du behøver give en grund. Hvis du ønsker at stoppe forsøgsbehandlingen før tid, vil vi bede dig informere din læge herom. Din læge vil så på en sikker måde afslutte behandlingen i forsøget. Hvornår ophører forsøget? Forsøget slutter når du har gennemgået hele behandlingen og den efterfølgende follow-up periode. Din læge kan, som nævnt, også vælge at afslutte forsøget tidligere, for eksempel hvis du har for svære bivirkninger. Forsøgets overordnet ansvarlige kan også afslutte forsøget hvis ny information om sygdommen eller om behandlingen bliver tilgængelig. Forsøget vil også blive afsluttet, hvis P[R]EBEN ikke virker tilfredsstillende ved overordnet vurdering af alle behandlede patienter. I så fald vil din læge tale med dig om andre behandlingsmuligheder. Efter afsluttet behandling (uanset om du har modtaget hele den planlagte behandling eller kun en del af den) vil du blive fulgt i 5 år som led i forsøget. Efter de 5 år vil du fortsat blive fulgt i afdelingen, selv om forsøget er afsluttet. Adgang til forsøgsresultater Nordisk Lymfomgruppe ejer forsøgsresultaterne, og en arbejdsgruppe herunder har ansvaret for at forsøgsresultaterne bliver offentliggjort i form af en eller flere videnskabelige artikler i internationale engelsksprogede medicinske tidsskrifter. Den første analyse af forsøgsresultaterne vil blive gjort op og offentliggjort ca. 1 år efter at alle forsøgsdeltagere har afsluttet behandlingen. Forventet tidspunkt vil være i Næste opgørelse af forsøgsresultater vil være 5 år efter alle patienter har afsluttet behandling. Forventet tidspunkt vil her være i Derudover vil der være diverse andre publikationer vedrørende de biologiske undersøgelser gennemført i forbindelse med forsøget. Hvordan håndteres dine fortrolige oplysninger? Et begrænset antal personer vil få videregivet oplysninger fra din patientjournal. Disse personer inkluderer: Forsøgsteamet, Lægemiddelstyrelsen og de myndigheder, der overvåger forsøget. Herudover vil der være monitorer, som har til opgave at overvåge udførelsen af forsøget. De vil også kunne få videregivet fortrolig information for at udføre denne opgave. Alle oplysninger vil blive håndteret i henhold til gældende lovgivning om Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 5
6 datasikkerhed og beskyttelse af patientrettigheder. Alle informationer og biologisk materiale vil blive kodet, dvs. navn og CPR-nummer erstattes af en kode, så dine personlige oplysninger ikke fremgår af dokumentationen. I forbindelse med publikation af resultater vil dine personlige informationer ikke kunne spores. Dine data vil blive gemt i op til 20 år efter afslutningen af forsøget. Data vil, i anonymiseret form, kunne blive sendt til andre lande med henblik på analyse, også til lande der ikke er omfattet af de europæiske retningslinjer for datasikkerhed. I henhold til gældende lovgivning vil såvel sponsor som Lægemiddelstyrelsen kunne få videregivet journaloplysninger med relevans for forsøget. Oplysninger om økonomiske forhold Deltagelse i forsøget er gratis for deltagerne. Gennemførelsen af forsøget støttes økonomisk af lægemiddelvirksomhederne CTI Life Sciences Ltd og Les Laboratoires Servier. Dette muliggør betaling for godkendelse af forsøget, dataindsamling, monitorering, forsikring, opbevaring og analyse af prøver, ekstra undersøgelser og administration i forbindelse med forsøget i alle de lande og hospitaler, der deltager. Det enkelte hospital modtager et beløb per patient på kr i fase 1-delen og kr i fase 2-delen. Herudover leverer CTI Life Sciences Ltd./Les Laboratoires Servier det ene kemoterapistof, pixantrone, uden beregning. Den økonomiske støtte dækker udelukkende de supplerende omkostninger til driften af forsøget. Ingen af de deltagende læger eller sygeplejersker modtager honorar eller anden betaling fra CTI Life Sciences/Les Laboratoires Servier for at medvirke til forsøget. Den overordnet ansvarlige læge har været scientific advisor for CTI Life Sciences/Les Laboratoires Servier ved enkelte rådgivningsmøder (advisory boards), men modtager intet honorar for at medvirke til forsøget, har ingen økonomisk interesse (ejerskab af værdipapirer o.l.) eller nogen form for ansættelsesforhold i de pågældende medicinalvirksomheder. Lægemiddelforsøgets koncept og resultater ejes af Nordisk Lymfomgruppe, repræsenteret ved dette forsøg af Hæmatologisk Afdeling, Aarhus Universitetshospital. Godkendelse Dette forsøg er godkendt af den Videnskabsetiske Komité for Region Midtjylland og af Lægemiddelstyrelsen i Danmark. Er der andet, du gerne vil vide? Du har naturligvis brug for tid til at overveje din deltagelse i forsøget. Du vil formentlig ønske at diskutere dette med andre. Du vil naturligvis få mulighed for dette. Hvis du har spørgsmål, kan du også vende dem med din forsøgsansvarlige læge og sygeplejerske på hospitalet. Hvis du er utilfreds med forsøget eller behandlingen, er der mulighed for at klage. Din læge og/eller hospitalets patientvejleder vil i så fald kunne vejlede dig i, hvordan man klager. Appendix A viser kontaktinformation på de personer, som du kunne få behov for at henvende dig til. Det skriftlige samtykke Hvis du beslutter dig for at deltage i forsøget, beder vi dig om at underskrive samtykkeerklæringen. Ved at underskrive denne erklæring indvilger du i at deltage i forsøget. Du kan trække dig ud af forsøget til enhver tid. Den læge som har informeret dig om forsøget vil også underskrive samtykkeerklæringen, for at bekræfte, at du er blevet informeret om forsøget og at du har modtaget dette informationsbrev. Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 6
7 Appendices Appendix A: Kontaktinformation Appendix B: Oversigt over behandlingsforløb Appendix C: Bivirkninger til forsøgslægemidlerne Appendix D: Samtykkeerklæring (i 2 kopier) Appendix E: Samtykkeerklæring til biobank til fremtidig forskning (i 2 kopier) Appendix F: Fuldmagtserklæring Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 7
8 Appendix A: Kontaktinformation Du kan få mere information om forsøget fra din forsøgsansvarlige læge eller en af de andre læger på Hæmatologisk afdeling R, Aarhus Universitetshospital. Overordnet forsøgsansvarlig: Professor, overlæge Francesco d Amore Hæmatologisk Afdeling R, Aarhus Universitetshospital Tage Hansens Gade Aarhus C Tlf frandamo@rm.dk Forsøgsansvarlig på Aaruhs Universitetshospital: Overlæge Judit M. Jørgensen Hæmatologisk Afdeling R, Aarhus Universitetshospital Tage Hansens Gade Aarhus C Tlf judijoer@rm.dk Projektsygeplejerske: Lise Rønde Nielsen Klinisk Forskningsenhed Hæmatologisk Afdeling R Aarhus Universitetshospital Tage Hansens Gade Aarhus C Tlf ingelnel@rm.dk Forsøgsansvarlig på Rigshospitalet: Overlæge Peter Brown Hæmatologisk Afdeling Rigshospitalet Blegdamsvej 9, 2100 København Ø Tlf Projektsygeplejerske: Stine Hutters Klinisk afprøvningsteam Hæmatologisk klinik Rigshospitalet Blegdamsvej 9, 2100 København Ø Tlf Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 8
9 Appendix B: Oversigt over behandlingsforløb Ca. tidspunkter Behandling Uddybende kommentarer Før start Information og undersøgelser PET/CT skanning, vævs- og blodprøver, hjertefunktionsundersøgelse, lægeundersøgelse mm. Uge 1 Kemoterapi runde 1 (21 dage) Behandling gives dag Uge 4 Kemoterapi runde 2 (21 dage) Behandling gives dag Uge 6 Midtvejs-status PET/CT skanning, blodprøver, lægeundersøgelse. Knoglemarvsundersøgelse hvis der var sygdom i knoglemarven før behandlingsstart Uge 7 Kemoterapi runde 3 (21 dage) Behandling gives dag Uge 10 Kemoterapi runde 4 (21 dage) Behandling gives dag Uge 13 Kemoterapi runde 5 (21 dage) Behandling gives dag Uge 16 Kemoterapi runde 6 (21 dage) Behandling gives dag Uge 18 Slutevaluering PET/CT skanning, blodprøver, lægeundersøgelse. Knoglemarvsundersøgelse hvis der var sygdom i knoglemarven før behandlingsstart År 1-2 efter behandling År 3-5 efter behandling Follow-up Lægeundersøgelse og blodprøver hver 3. måned CT skannning hver 6. måned Follow-up Lægeundersøgelse og blodprøver hver 6. måned CT skannning 1 gang om året Alle tidspunkter er vejledende og der kan forekomme afvigelser pga. helligdage, planlægning af undersøgelser, hensyn til din helbredstilstand mm. Der vil desuden være dage, hvor der f. eks. skal tages blodprøver forud næste behandlingsrunde. Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 9
10 Appendix C: Bivirkninger til forsøgslægemidlerne De mest almindeligt forekommende bivirkninger vil være et midlertidigt nedsat antal røde og hvide blodlegemer, samt blodplader. Dette skyldes at kemoterapien, i al almindelighed, som regel medfører en midlertidig svækkelse af knoglemarvens evne til at danne nye blodlegemer (røde og hvide blodlegemer samt blodplader). Størrelsen af denne svækkelse af knoglemarven og det deraf følgende fald i blodlegemer vil også være afhængig af hvor meget kemoterapi du i forvejen (før starten på forsøgsmedicin) har modtaget. Et lavt antal røde blodlegemer (også kaldt blodmangel ) kan medføre symptomer som træthed og svimmelhed, samt lavt blodtryk. Afhængig af sværhedsgraden af den eventuelle blodmangel vil din læge tage stilling til om du skal tilbydes blodtransfusion. Et lavt antal hvide blodlegemer kan medføre en øget risiko for infektioner. Hvis dette forekommer, vil din læge forsøge at finde årsagen til infektionen og om nødvendigt give dig antibiotisk behandling. Endeligt vil et nedsat antal blodplader medføre en øget risiko for blødningstilbøjelighed som er direkte forbundet med sværhedsgraden af denne blodplademangel. Hvis der forekommer blødninger, eller ved meget lave blodpladetal, selv uden forekomst af blødninger, vil din læge tage stilling til om du skal tilbydes blodpladetransfusion. Under behandling med kemoterapistoffet pixantrone er der mulighed for en forbigående let blåfarvning af hud og urin. Dette skyldes stoffets farve (blå) og forsvinder normalt igen, når pixantrone er udskilt af kroppen i løbet af højest et par uger. Andre mulige bivirkninger er træthed, kvalme, diarré, mavesmerter, feber, hovedpine, forstoppelse, appetitløshed, vægttab og nattesved. Alle disse bivirkninger optræder som regel i meget mild grad, de optræder ikke hos alle patienter, og de er forbigående i langt de fleste tilfælde. Uventede bivirkninger til den nye lægemiddelkombination kan ikke udelukkes, selv om den indledende kliniske erfaring har givet indtryk af en relativt let gennemførlig behandling, som de fleste patienter klarer ambulant. I givet fald vil din læge afgøre hvilke foranstaltninger, det er bedst at iværksætte og hvordan I bedst forholder jer. Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 10
11 Appendix D: Samtykkeerklæring Forsøgets officielle titel: A Phase 1/2 study of the combination of pixantrone, etoposide, bendamustine and, in CD-20 positive tumors, rituximab in patients with relapsed aggressive non-hodgkin lymphomas of B- or T-cell phenotype The P[R]EBEN study Forsøgets danske titel: Et fase I/II studie af kombinationsbehandling med pixantrone, etoposid, bendamustin og, ved CD20-positive tumorer, rituximab til patienter med tilbagefald af aggressiv lymfekræft af B- eller T-celle fænotype P[R]EBEN studiet. Erklæring fra forsøgspersonen: Jeg har fået skriftlig og mundtlig information og jeg ved nok om formål, metode, fordele og ulemper til at sige ja til at deltage. Jeg ved, at det er frivilligt at deltage, og at jeg altid kan trække mit samtykke tilbage uden at miste mine nuværende eller fremtidige rettigheder til behandling. Jeg giver samtykke til, at deltage i forskningsprojektet og til, at mit biologiske materiale udtages med henblik på opbevaring i en forskningsbiobank. Jeg har fået kopi af dette samtykkeark samt en kopi af den skriftlige information om projektet til eget brug. Forsøgspersonens navn: Dato: Underskrift: Ønsker du at blive informeret om forskningsprojektets resultat og eventuelle konsekvenser for dig?: Ja: (sæt x) Nej: (sæt x) Erklæring fra den, der afgiver information: Jeg erklærer, at forsøgspersonen har modtaget mundtlig og skriftlig information om forsøget. Efter min overbevisning er der givet tilstrækkelig information til, at der kan træffes beslutning om deltagelse i forsøget. Navn på den, der har afgivet information: Dato: Underskrift: Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 11
12 Samtykkeerklæring Forsøgets officielle titel: A Phase 1/2 study of the combination of pixantrone, etoposide, bendamustine and, in CD-20 positive tumors, rituximab in patients with relapsed aggressive non-hodgkin lymphomas of B- or T-cell phenotype The P[R]EBEN study Forsøgets danske titel: Et fase I/II studie af kombinationsbehandling med pixantrone, etoposid, bendamustin og, ved CD20-positive tumorer, rituximab til patienter med tilbagefald af aggressiv lymfekræft af B- eller T-celle fænotype P[R]EBEN studiet. Erklæring fra forsøgspersonen: Jeg har fået skriftlig og mundtlig information og jeg ved nok om formål, metode, fordele og ulemper til at sige ja til at deltage. Jeg ved, at det er frivilligt at deltage, og at jeg altid kan trække mit samtykke tilbage uden at miste mine nuværende eller fremtidige rettigheder til behandling. Jeg giver samtykke til, at deltage i forskningsprojektet og til, at mit biologiske materiale udtages med henblik på opbevaring i en forskningsbiobank. Jeg har fået kopi af dette samtykkeark samt en kopi af den skriftlige information om projektet til eget brug. Forsøgspersonens navn: Dato: Underskrift: Ønsker du at blive informeret om forskningsprojektets resultat og eventuelle konsekvenser for dig?: Ja: (sæt x) Nej: (sæt x) Erklæring fra den, der afgiver information: Jeg erklærer, at forsøgspersonen har modtaget mundtlig og skriftlig information om forsøget. Efter min overbevisning er der givet tilstrækkelig information til, at der kan træffes beslutning om deltagelse i forsøget. Navn på den, der har afgivet information: Dato: Underskrift: Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital 12
13 P[R]EBEN protokol - Samtykke til biobank og fuldmagt 27. november 2015 Appendix E: Samtykkeerklæring for overførsel af overskydende biologisk materiale til biobank til fremtidig forskning Forsøgets officielle titel: A Phase 1/2 study of the combination of pixantrone, etoposide, bendamustine and, in CD-20 positive tumors, rituximab in patients with relapsed aggressive non-hodgkin lymphomas of B- or T-cell phenotype The P[R]EBEN study Forsøgets danske titel: Et fase I/II studie af kombinationsbehandling med pixantrone, etoposid, bendamustin og, ved CD20-positive tumorer, rituximab til patienter med tilbagefald af aggressiv lymfekræft af B- eller T-celle fænotype P[R]EBEN studiet. Erklæring fra forsøgspersonen: Jeg har fået skriftlig og mundtlig information og jeg ved nok om formål, fordele og ulemper til at sige ja til at eventuelt overskud af mit biologiske materiale fra ovennævnte forsøg må overføres til en biobank til fremtidig forskning.. Jeg ved, at det er frivilligt at deltage, og at jeg altid kan trække mit samtykke tilbage uden at miste mine nuværende eller fremtidige rettigheder til behandling. Jeg giver samtykke til, at eventuelt overskydende biologisk materiale fra min deltagelse i ovennævnte forsøg må overføres til en biobank til fremtidig forskning. Jeg har fået kopi af dette samtykkeark samt en kopi af den skriftlige information om projektet til eget brug. Forsøgspersonens navn: Dato: Underskrift: Erklæring fra den, der afgiver information: Jeg erklærer, at forsøgspersonen har modtaget mundtlig og skriftlig information om forsøget. Efter min overbevisning er der givet tilstrækkelig information til, at der kan træffes beslutning om deltagelse i forsøget. Navn på den, der har afgivet information: Dato: Underskrift: Samtykke til biobank og fuldmagt P[R]EBEN, ver 1.0, 27. november 2015 Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital
14 P[R]EBEN protokol - Samtykke til biobank og fuldmagt 27. november 2015 Samtykkeerklæring for overførsel af overskydende biologisk materiale til en biobank til fremtidig forskning Forsøgets officielle titel: A Phase 1/2 study of the combination of pixantrone, etoposide, bendamustine and, in CD-20 positive tumors, rituximab in patients with relapsed aggressive non-hodgkin lymphomas of B- or T-cell phenotype The P[R]EBEN study Forsøgets danske titel: Et fase I/II studie af kombinationsbehandling med pixantrone, etoposid, bendamustin og, ved CD20-positive tumorer, rituximab til patienter med tilbagefald af aggressiv lymfekræft af B- eller T-celle fænotype P[R]EBEN studiet. Erklæring fra forsøgspersonen: Jeg har fået skriftlig og mundtlig information og jeg ved nok om formål, fordele og ulemper til at sige ja til at eventuelt overskud af mit biologiske materiale fra ovennævnte forsøg må overføres til en biobank til fremtidig forskning.. Jeg ved, at det er frivilligt at deltage, og at jeg altid kan trække mit samtykke tilbage uden at miste mine nuværende eller fremtidige rettigheder til behandling. Jeg giver samtykke til, at eventuelt overskydende biologisk materiale fra min deltagelse i ovennævnte forsøg må overføres til en biobank til fremtidig forskning. Jeg har fået kopi af dette samtykkeark samt en kopi af den skriftlige information om projektet til eget brug. Forsøgspersonens navn: Dato: Underskrift: Erklæring fra den, der afgiver information: Jeg erklærer, at forsøgspersonen har modtaget mundtlig og skriftlig information om forsøget. Efter min overbevisning er der givet tilstrækkelig information til, at der kan træffes beslutning om deltagelse i forsøget. Navn på den, der har afgivet information: Dato: Underskrift: Samtykke til biobank og fuldmagt P[R]EBEN, ver 1.0, 27. november 2015 Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital
15 P[R]EBEN protokol - Samtykke til biobank og fuldmagt 27. november 2015 Appendix F: Fuldmagtserklæring Forsøgets officielle titel: A Phase 1/2 study of the combination of pixantrone, etoposide, bendamustine and, in CD-20 positive tumors, rituximab in patients with relapsed aggressive non-hodgkin lymphomas of B- or T-cell phenotype The P[R]EBEN study Forsøgets danske titel: Et fase I/II studie af kombinationsbehandling med pixantrone, etoposid, bendamustin og, ved CD20-positive tumorer, rituximab til patienter med tilbagefald af aggressiv lymfekræft af B- eller T-celle fænotype P[R]EBEN studiet. Jeg giver endvidere fuldmagt til, at min patientjournal samt oplysninger i behandlingsskemaerne vil være tilgængelige for repræsentanter for udenlandske myndigheder med samme funktion som Lægemiddelstyrelsen, under forsøget og i op til 15 år efter undersøgelsens afslutning, med det formål at monitorere eller kontrollere oplysningernes rigtighed. Forsøgspersonens navn: (Blokbogstaver) Forsøgspersonens underskrift: Dato: Samtykke til biobank og fuldmagt P[R]EBEN, ver 1.0, 27. november 2015 Hæmatologisk Klinisk Forskningsenhed, Aarhus Universitetshospital
16 Forsøgspersoners rettigheder i et sundhedsvidenskabeligt Forskningsprojekt Som deltager i et sundhedsvidenskabeligt forskningsprojekt skal du vide, at: din deltagelse i forskningsprojektet er helt frivillig og kun kan ske efter, at du har fået både skriftlig og mundtlig information om forskningsprojektet og underskrevet samtykkeerklæringen. du til enhver tid mundtligt, skriftligt eller ved anden klar tilkendegivelse kan trække dit samtykke til deltagelse tilbage og udtræde af forskningsprojektet. Såfremt du trækker dit samtykke tilbage påvirker dette ikke din ret til nuværende eller fremtidig behandling eller andre rettigheder, som du måtte have. du har ret til at tage et familiemedlem, en ven eller en bekendt med til informationssamtalen. du har ret til betænkningstid, før du underskriver samtykkeerklæringen. oplysninger om dine helbredsforhold, øvrige rent private forhold og andre fortrolige oplysninger om dig, som fremkommer i forbindelse med forskningsprojektet, er omfattet af tavshedspligt. opbevaring af oplysninger om dig, herunder oplysninger i dine blodprøver og væv, sker efter reglerne i databeskyttelsesforordningen, databeskyttelsesloven samt sundhedsloven. der er mulighed for at få aktindsigt i forsøgsprotokoller efter offentlighedslovens bestemmelser. Det vil sige, at du kan få adgang til at se alle papirer vedrørende din deltagelse i forsøget, bortset fra de dele, som indeholder forretningshemmeligheder eller fortrolige oplysninger om andre. der er mulighed for at klage og få erstatning efter reglerne i lov om klage- og erstatningsadgang inden for sundhedsvæsenet. Hvis der under forsøget skulle opstå en skade kan du henvende dig til Patienterstatningen, se nærmere på
17 De Videnskabsetiske Komiteer for Region Hovedstaden (6 komiteer) Tlf.: Hjemmeside: De Videnskabsetiske Komiteer for Region Syddanmark (2 komiteer) Tlf.: komite@rsyd.dk Hjemmeside: Den Videnskabsetiske Komité for Region Nordjylland Tlf.: vek@rn.dk Hjemmeside: Den Videnskabsetiske Komité for Region Sjælland Tlf.: RVK-sjaelland@regionsjaelland.dk Hjemmeside: sundhed/forskning/forfagfolk/ videnskabsetisk-komite/sider/default.aspx De Videnskabsetiske Komiteer for Region Midtjylland (2 komiteer) Tlf.: / / komite@rm.dk Hjemmeside: National Videnskabsetisk Komité Tlf.: kontakt@nvk.dk Hjemmeside: Dette tillæg er udarbejdet af det videnskabsetiske komitésystem og kan vedhæftes den skriftlige information om det sundhedsvidenskabelige forskningsprojekt. Spørgsmål til et konkret projekt skal rettes til projektets forsøgsansvarlige. Generelle spørgsmål til forsøgspersoners rettigheder kan rettes til den komité, som har godkendt projektet. Revideret juli /1
Revideret august Før du beslutter dig. Om at være forsøgsperson i sundhedsvidenskabelige forsøg
 Revideret august 2014 Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg HVIS DU OVERVEJER AT DELTAGE I FORSØG For at få ny viden om sygdomme og blive bedre til at behandle dem,
Revideret august 2014 Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg HVIS DU OVERVEJER AT DELTAGE I FORSØG For at få ny viden om sygdomme og blive bedre til at behandle dem,
Deltagerinformation om deltagelse i videnskabeligt forsøg om tape stripping
 Deltagerinformation om deltagelse i videnskabeligt forsøg om tape stripping Forsøgets titel: Hud transkriptomet Vi skriver til dig for at spørge om du vil deltage i et videnskabeligt forsøg, der udføres
Deltagerinformation om deltagelse i videnskabeligt forsøg om tape stripping Forsøgets titel: Hud transkriptomet Vi skriver til dig for at spørge om du vil deltage i et videnskabeligt forsøg, der udføres
Deltager information. Deltagerinformation H-D _v11_ Kære Patient
 Deltagerinformation H-D-2009-003_v11_19-11-2013 Deltager information Kære Patient De hæmatologiske afdelinger i Danmark gennemfører i øjeblikket forskningsprojektet: Fra in vitro til in vivo monitorering
Deltagerinformation H-D-2009-003_v11_19-11-2013 Deltager information Kære Patient De hæmatologiske afdelinger i Danmark gennemfører i øjeblikket forskningsprojektet: Fra in vitro til in vivo monitorering
Vi vil hermed spørge om du vil deltage i et Sundhedsvidenskabeligt forskningsprojekt.
 Deltager information Kære Patient Vi vil hermed spørge om du vil deltage i et Sundhedsvidenskabeligt forskningsprojekt. De hæmatologiske klinikker på Herlev Universitets Hospital og Rigshospitalet gennemfører
Deltager information Kære Patient Vi vil hermed spørge om du vil deltage i et Sundhedsvidenskabeligt forskningsprojekt. De hæmatologiske klinikker på Herlev Universitets Hospital og Rigshospitalet gennemfører
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. PATIENTINFORMATION OM DELTAGELSE I VIDENSKABELIGT FORSØG Videnskabelig undersøgelse af
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. PATIENTINFORMATION OM DELTAGELSE I VIDENSKABELIGT FORSØG Videnskabelig undersøgelse af
Deltagerinformation om deltagelse i et videnskabeligt forsøg
 v2_05-10-2017 Deltagerinformation om deltagelse i et videnskabeligt forsøg Forsøgets titel: Målrettet behandling af patienter med blodsygdomme Vi vil spørge, om du vil deltage i et videnskabeligt forsøg,
v2_05-10-2017 Deltagerinformation om deltagelse i et videnskabeligt forsøg Forsøgets titel: Målrettet behandling af patienter med blodsygdomme Vi vil spørge, om du vil deltage i et videnskabeligt forsøg,
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation i forbindelse med videnskabelig undersøgelse af patienter med lymfeknudekræft.
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation i forbindelse med videnskabelig undersøgelse af patienter med lymfeknudekræft.
Deltagerinformation. I De Nordiske Lande gennemføres i øjeblikket forskningsprojektet:
 Deltagerinformation I De Nordiske Lande gennemføres i øjeblikket forskningsprojektet: Individuel monitorering af minimal restsygdom hos patienter med myelodysplastisk syndrom behandlet med allogen hæmatopoietisk
Deltagerinformation I De Nordiske Lande gennemføres i øjeblikket forskningsprojektet: Individuel monitorering af minimal restsygdom hos patienter med myelodysplastisk syndrom behandlet med allogen hæmatopoietisk
Før du beslutter dig. Om at være forsøgsperson i sundhedsvidenskabelige forsøg
 Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg Revideret september 2018 Hvis du overvejer at deltage i forsøg For at få ny viden om sygdomme og blive bedre til at behandle
Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg Revideret september 2018 Hvis du overvejer at deltage i forsøg For at få ny viden om sygdomme og blive bedre til at behandle
Et studie, som følger personer med hæmofili A og B, med eller uden inhibitorer, når de får deres sædvanlige behandling (explorer 6)
 Voksen/forælder Deltagerinformation og deltagersamtykkeerklæring Et studie, som følger personer med hæmofili A og B, med eller uden inhibitorer, når de får deres sædvanlige behandling (explorer 6) Side
Voksen/forælder Deltagerinformation og deltagersamtykkeerklæring Et studie, som følger personer med hæmofili A og B, med eller uden inhibitorer, når de får deres sædvanlige behandling (explorer 6) Side
Deltagerinformation. Kan ve-stimulerende drop med fordel afbrydes tidligere i fødselsforløbet?
 Deltagerinformation Kan ve-stimulerende drop med fordel afbrydes tidligere i fødselsforløbet? Vil du deltage i et videnskabelig projekt? Projektet I 2016 startede et projekt om varigheden af ve-stimulerende
Deltagerinformation Kan ve-stimulerende drop med fordel afbrydes tidligere i fødselsforløbet? Vil du deltage i et videnskabelig projekt? Projektet I 2016 startede et projekt om varigheden af ve-stimulerende
FØR DU BESLUTTER DIG? Om at være forsøgsperson i sundhedsvidenskabelige forsøg
 FØR DU BESLUTTER DIG? Om at være forsøgsperson i sundhedsvidenskabelige forsøg 1 HVIS DU OVERVEJER AT DELTAGE I FORSØG For at få ny viden om sygdomme og blive bedre til at behandle dem, er det vigtigt
FØR DU BESLUTTER DIG? Om at være forsøgsperson i sundhedsvidenskabelige forsøg 1 HVIS DU OVERVEJER AT DELTAGE I FORSØG For at få ny viden om sygdomme og blive bedre til at behandle dem, er det vigtigt
Deltagerinformation 18-01-2010 INFORMATION TIL DELTAGERE
 INFORMATION TIL DELTAGERE Tilskud af høj-dosis vitamin D under graviditeten med henblik på forebyggelse af astma hos børn: Delstudium i ABC (Asthma Begins in Childhood) kohorten Vi henvender os til dig
INFORMATION TIL DELTAGERE Tilskud af høj-dosis vitamin D under graviditeten med henblik på forebyggelse af astma hos børn: Delstudium i ABC (Asthma Begins in Childhood) kohorten Vi henvender os til dig
DELTAGERINFORMATION 5 & SAMTYKKEERKLÆRING 5. Randomisering DA vs IDAC som 3. serie kemoterapi hos MRD-negative patienter
 NATIONAL CANCER RESEARCH INSTITUT AKUT MYELOID LEUKÆMI OG HØJ RISIKO MYELOID DYSPLASI AML18 NATIONAL CANCER RESEARCH INSTITUTE AML 18 UNDERSØGELSE VED AKUT MYELOID LEUKÆMI OG HØJRISIKO MYELODYSPLASI DELTAGERINFORMATION
NATIONAL CANCER RESEARCH INSTITUT AKUT MYELOID LEUKÆMI OG HØJ RISIKO MYELOID DYSPLASI AML18 NATIONAL CANCER RESEARCH INSTITUTE AML 18 UNDERSØGELSE VED AKUT MYELOID LEUKÆMI OG HØJRISIKO MYELODYSPLASI DELTAGERINFORMATION
Før du beslutter dig. Om at være forsøgsperson i sundhedsvidenskabelige forsøg
 Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg Den Nationale Videnskabsetiske Komité * Finsensvej 15 * 2000 Frederiksberg * Tlf.: +45 72 26 93 70 * E Mail: dnvk@dvvk.dk *
Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg Den Nationale Videnskabsetiske Komité * Finsensvej 15 * 2000 Frederiksberg * Tlf.: +45 72 26 93 70 * E Mail: dnvk@dvvk.dk *
Før du beslutter dig. Om at være forsøgsperson i sundhedsvidenskabelige forsøg
 Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg DEN CENTRALE VIDENSKABSETISKE KOMITÉ * FINSENSVEJ 15 * 2000 FREDERIKSBERG * TLF.: +45 72 26 93 70 * E-MAIL: CVK@SUM.DK * WWW.CVK.SUM.dk
Før du beslutter dig Om at være forsøgsperson i sundhedsvidenskabelige forsøg DEN CENTRALE VIDENSKABSETISKE KOMITÉ * FINSENSVEJ 15 * 2000 FREDERIKSBERG * TLF.: +45 72 26 93 70 * E-MAIL: CVK@SUM.DK * WWW.CVK.SUM.dk
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Patientinformation Fase III randomiseret undersøgelse af lav-dosis helkropsbestråling og
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Patientinformation Fase III randomiseret undersøgelse af lav-dosis helkropsbestråling og
Hvidovre Hospital Gynækologisk-Obstetrisk afdeling. Deltagerinformation
 August 2012 Hvidovre Hospital Gynækologisk-Obstetrisk afdeling Deltagerinformation for det videnskabelige forsøg: Formodning af livmoderhalsen med misoprostol ved graviditet efter terminen Modning af de
August 2012 Hvidovre Hospital Gynækologisk-Obstetrisk afdeling Deltagerinformation for det videnskabelige forsøg: Formodning af livmoderhalsen med misoprostol ved graviditet efter terminen Modning af de
Deltagerinformation og samtykkeerklæring. om deltagelse i et sundhedsvidenskabeligt forsøg
 Protokol PCI-32765DBL3001 Side 1 af 8 Sponsor: Deltagerinformation og samtykkeerklæring om deltagelse i et sundhedsvidenskabeligt forsøg Janssen Research & Development, LLC (Janssen Research & Development,
Protokol PCI-32765DBL3001 Side 1 af 8 Sponsor: Deltagerinformation og samtykkeerklæring om deltagelse i et sundhedsvidenskabeligt forsøg Janssen Research & Development, LLC (Janssen Research & Development,
Patientinformation og samtykkeerklæring vedrørende deltagelse i en videnskabelig undersøgelse
 Patientinformation og samtykkeerklæring vedrørende deltagelse i en videnskabelig undersøgelse Kemoterapi og biologisk behandling til patienter med kræft i tyktarmen eller endetarmen Onkologisk Afdeling
Patientinformation og samtykkeerklæring vedrørende deltagelse i en videnskabelig undersøgelse Kemoterapi og biologisk behandling til patienter med kræft i tyktarmen eller endetarmen Onkologisk Afdeling
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation Klinisk forsøg med rituximab (MabThera ) alene eller i kombination
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation Klinisk forsøg med rituximab (MabThera ) alene eller i kombination
Deltagerinformation 10-5-2010 INFORMATION TIL DELTAGERE
 INFORMATION TIL DELTAGERE H1N1v vaccination af gravide kvinder. Et kohortestudie til karakterisering af den beskyttende effekt af Influenza A H1N1v vaccine hos gravide kvinder: Vi henvender os til dig
INFORMATION TIL DELTAGERE H1N1v vaccination af gravide kvinder. Et kohortestudie til karakterisering af den beskyttende effekt af Influenza A H1N1v vaccine hos gravide kvinder: Vi henvender os til dig
Forespørgsel om at deltage i forskningsprojektet STATICH: Blodfortyndende behandling efter hjerneblødning
 Forespørgsel om at deltage i forskningsprojektet STATICH: Blodfortyndende behandling efter hjerneblødning Vi vil spørge, om du vil deltage i et videnskabeligt forsøg. Det er frivilligt at deltage i forsøget.
Forespørgsel om at deltage i forskningsprojektet STATICH: Blodfortyndende behandling efter hjerneblødning Vi vil spørge, om du vil deltage i et videnskabeligt forsøg. Det er frivilligt at deltage i forsøget.
Deltagerinformation 10-01-2009 INFORMATION TIL DELTAGERE
 INFORMATION TIL DELTAGERE Tilskud af høj-dosis vitamin D under graviditeten med henblik på forebyggelse af astma hos børn: Delstudium i ABC (Asthma Begins in Childhood) kohorten Vi henvender os til dig
INFORMATION TIL DELTAGERE Tilskud af høj-dosis vitamin D under graviditeten med henblik på forebyggelse af astma hos børn: Delstudium i ABC (Asthma Begins in Childhood) kohorten Vi henvender os til dig
Deltagerinformation 06-11-2009 INFORMATION TIL DELTAGERE
 INFORMATION TIL DELTAGERE H1N1v vaccination af gravide kvinder. Et kohortestudie til karakterisering af den beskyttende effekt af Influenza A H1N1v vaccine hos gravide kvinder: Delstudium i ABC (Asthma
INFORMATION TIL DELTAGERE H1N1v vaccination af gravide kvinder. Et kohortestudie til karakterisering af den beskyttende effekt af Influenza A H1N1v vaccine hos gravide kvinder: Delstudium i ABC (Asthma
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Intensiveret
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Intensiveret
Patientinformation. PET ved non-hodgkin lymfom
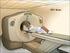 Side 1 af 6 Patientinformation PET ved non-hodgkin lymfom De har for nylig fået konstateret non-hodgkin lymfom (lymfekræft). I den anledning vil vi spørge, om De ønsker at deltage i et videnskabeligt projekt,
Side 1 af 6 Patientinformation PET ved non-hodgkin lymfom De har for nylig fået konstateret non-hodgkin lymfom (lymfekræft). I den anledning vil vi spørge, om De ønsker at deltage i et videnskabeligt projekt,
REGIONERNES FÆLLES TJEKLISTE
 REGIONERNES FÆLLES TJEKLISTE A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne skal være påført
REGIONERNES FÆLLES TJEKLISTE A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne skal være påført
københavns universitet det natur- og biovidenskabelige fakultet DELTAGERINFORMATION OM FORSKNINGSPROJEKTET SKOT III MØDRE
 københavns universitet det natur- og biovidenskabelige fakultet DELTAGERINFORMATION OM FORSKNINGSPROJEKTET SKOT III MØDRE Hvem kan deltage 3 Aktiviteter i forsøget 3 Oversigt over aktiviteter i forsøget
københavns universitet det natur- og biovidenskabelige fakultet DELTAGERINFORMATION OM FORSKNINGSPROJEKTET SKOT III MØDRE Hvem kan deltage 3 Aktiviteter i forsøget 3 Oversigt over aktiviteter i forsøget
Deltagerinformation og samtykkeerklæring ved deltagelse i en videnskabelig undersøgelse. NeoCol
 Deltagerinformation og samtykkeerklæring ved deltagelse i en videnskabelig undersøgelse NeoCol En undersøgelse, der belyser effekten af kombinationskemoterapi før operation hos patienter med tyktarmskræft
Deltagerinformation og samtykkeerklæring ved deltagelse i en videnskabelig undersøgelse NeoCol En undersøgelse, der belyser effekten af kombinationskemoterapi før operation hos patienter med tyktarmskræft
Deltagerinformation og samtykkeerklæring vedrørende deltagelse i et videnskabeligt forsøg
 Deltagerinformation og samtykkeerklæring vedrørende deltagelse i et videnskabeligt forsøg Strålebehandling og medicinsk behandling til patienter med kræft i endetarmen Side 1 af 7 Vi vil hermed spørge,
Deltagerinformation og samtykkeerklæring vedrørende deltagelse i et videnskabeligt forsøg Strålebehandling og medicinsk behandling til patienter med kræft i endetarmen Side 1 af 7 Vi vil hermed spørge,
TIL PATIENT. Information til patienter om deltagelse i et forskningsprojekt (Indeholder samtykkeerklæring/fuldmagt) DAHANCA 30
 TIL PATIENT Information til patienter om deltagelse i et forskningsprojekt (Indeholder samtykkeerklæring/fuldmagt) DAHANCA 30 Et randomiseret non-inferiority studie af hypoxi-profilvejledt nimorazolbehandling
TIL PATIENT Information til patienter om deltagelse i et forskningsprojekt (Indeholder samtykkeerklæring/fuldmagt) DAHANCA 30 Et randomiseret non-inferiority studie af hypoxi-profilvejledt nimorazolbehandling
Videnskabsetisk komite og biobanker. Dansk Selskab for Good Clinical Practice 28. januar 2015 Lone Gundelach
 Videnskabsetisk komite og biobanker Dansk Selskab for Good Clinical Practice 28. januar 2015 De videnskabsetiske komiteer Anmeldelsespligtigt: Forsøg hvor man ønsker at opnå viden om menneskets biologi
Videnskabsetisk komite og biobanker Dansk Selskab for Good Clinical Practice 28. januar 2015 De videnskabsetiske komiteer Anmeldelsespligtigt: Forsøg hvor man ønsker at opnå viden om menneskets biologi
Mammaimplantater og bakteriologi ved brystforstørrende operation.
 Mammaimplantater og bakteriologi ved brystforstørrende operation. Plastikkirurgen vil ved forundersøgelsen spørge, om du vil deltage i et videnskabeligt forskningsprojekt. Projektet har til formål, at
Mammaimplantater og bakteriologi ved brystforstørrende operation. Plastikkirurgen vil ved forundersøgelsen spørge, om du vil deltage i et videnskabeligt forskningsprojekt. Projektet har til formål, at
Aarhus Universitetshospital
 Anmodning om deltagelse i det videnskabelige forsøg: Behandling af patienter med langvarige helbredsproblemer (kroniske funktionelle lidelser) med medicin Originaltitel: Behandling af multi-organ bodily
Anmodning om deltagelse i det videnskabelige forsøg: Behandling af patienter med langvarige helbredsproblemer (kroniske funktionelle lidelser) med medicin Originaltitel: Behandling af multi-organ bodily
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Information til pårørende til patienter med nydiagnosticeret lymfekræft i hjernen om deltagelse
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Information til pårørende til patienter med nydiagnosticeret lymfekræft i hjernen om deltagelse
Første trimester screening for svangerskabsforgiftning
 Første trimester screening for svangerskabsforgiftning Kan vi tidligt i graviditeten finde de kvinder, der har øget risiko for udvikling af svangerskabsforgiftning senere i graviditeten? Tillykke med din
Første trimester screening for svangerskabsforgiftning Kan vi tidligt i graviditeten finde de kvinder, der har øget risiko for udvikling af svangerskabsforgiftning senere i graviditeten? Tillykke med din
Deltagerinformation Projekt EVITA for dig med CCUS eller lav-risiko MDS eller CMML
 Deltagerinformation EVITA_CCUSogMDS_v4_14-02-2018 Deltagerinformation Projekt EVITA for dig med CCUS eller lav-risiko MDS eller CMML De hæmatologiske afdelinger i Danmark gennemfører i øjeblikket forskningsprojektet:
Deltagerinformation EVITA_CCUSogMDS_v4_14-02-2018 Deltagerinformation Projekt EVITA for dig med CCUS eller lav-risiko MDS eller CMML De hæmatologiske afdelinger i Danmark gennemfører i øjeblikket forskningsprojektet:
Deltagerinformation om deltagelse i et videnskabeligt forsøg.
 Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Autoimmunitet ved knoglemarvssvigt Vi vil spørge, om du vil deltage i et videnskabeligt forsøg, der udføres af læge, ph.d.
Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Autoimmunitet ved knoglemarvssvigt Vi vil spørge, om du vil deltage i et videnskabeligt forsøg, der udføres af læge, ph.d.
Deltagerinformation Information om deltagelse i den videnskabelige undersøgelse: Ambulant nefrektomi med
 Deltagerinformation Information om deltagelse i den videnskabelige undersøgelse: Ambulant nefrektomi med kikkertteknik. Er der nogen begrænsende faktorer? Vi spørger hermed, om du vil deltage i en videnskabelig
Deltagerinformation Information om deltagelse i den videnskabelige undersøgelse: Ambulant nefrektomi med kikkertteknik. Er der nogen begrænsende faktorer? Vi spørger hermed, om du vil deltage i en videnskabelig
Deltagerinformation om deltagelse i et videnskabeligt forsøg.
 Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Intensiveret dosering af kemoterapi med tidlig CNS profylakse hos patienter under 65 år med diffust storcellet B cellelymfom
Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Intensiveret dosering af kemoterapi med tidlig CNS profylakse hos patienter under 65 år med diffust storcellet B cellelymfom
BEHANDLING AF KVINDER EFTER FØDSELSRELATERET BLØDNING
 DELTAGERINFORMATION -OM DELTAGELSE I ET VIDENSKABELIGT FORSØG BEHANDLING AF KVINDER EFTER FØDSELSRELATERET BLØDNING Original projekttitel: Et randomiseret, komparativt, åbent forsøg med intravenøs indgift
DELTAGERINFORMATION -OM DELTAGELSE I ET VIDENSKABELIGT FORSØG BEHANDLING AF KVINDER EFTER FØDSELSRELATERET BLØDNING Original projekttitel: Et randomiseret, komparativt, åbent forsøg med intravenøs indgift
Koagulationsprofil hos patienter som opereres for lungekræft - et randomiseret, kontrolleret studie
 Deltagerinformation Forsøgets titel: Koagulationsprofil hos patienter som opereres for lungekræft - et randomiseret, kontrolleret studie Vi vil spørge, om De vil deltage i et videnskabeligt forsøg, der
Deltagerinformation Forsøgets titel: Koagulationsprofil hos patienter som opereres for lungekræft - et randomiseret, kontrolleret studie Vi vil spørge, om De vil deltage i et videnskabeligt forsøg, der
Kort eller lang reagensglasbehandling?
 Officiel titel: Kort versus lang reagensglasbehandling. En prospektiv, konsekutiv og randomiseret sammenlignende undersøgelse. Deltagerinformation om deltagelse i et videnskabeligt forsøg vedrørende reagensglasbehandling
Officiel titel: Kort versus lang reagensglasbehandling. En prospektiv, konsekutiv og randomiseret sammenlignende undersøgelse. Deltagerinformation om deltagelse i et videnskabeligt forsøg vedrørende reagensglasbehandling
REGIONERNES FÆLLES TJEKLISTE
 REGIONERNES FÆLLES TJEKLISTE A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne skal være påført
REGIONERNES FÆLLES TJEKLISTE A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne skal være påført
Forsøgets titel: Startløbemængden og risikoen for løbeskader hos nybegyndere
 Deltagerinformation Forsøgets titel: Startløbemængden og risikoen for løbeskader hos nybegyndere Vi vil spørge, om du vil deltage i et videnskabeligt forsøg, der udføres af Ortopædkirurgien, Region Nordjylland.
Deltagerinformation Forsøgets titel: Startløbemængden og risikoen for løbeskader hos nybegyndere Vi vil spørge, om du vil deltage i et videnskabeligt forsøg, der udføres af Ortopædkirurgien, Region Nordjylland.
Deltagerinformation om deltagelse i et videnskabeligt forsøg
 Deltagerinformation om deltagelse i et videnskabeligt forsøg Treatment Of Chronic Anal fissure (TOCA): a Randomized Clinical trial on Levorag Emulgel versus Diltiazem gel 2% Forsøgets danske titel: Behandling
Deltagerinformation om deltagelse i et videnskabeligt forsøg Treatment Of Chronic Anal fissure (TOCA): a Randomized Clinical trial on Levorag Emulgel versus Diltiazem gel 2% Forsøgets danske titel: Behandling
Behandling. Rituximab (Mabthera ) med. Aarhus Universitetshospital. Indledning. Palle Juul-Jensens Boulevard Aarhus N Tlf.
 Behandling med Rituximab (Mabthera ) Indledning Sidst revideret: 28.08.2019 Side 1 af 6 Palle Juul-Jensens Boulevard 99 8200 Aarhus N Tlf. 7845 5810 Blodsygdomme Denne vejledning skal give dig og dine
Behandling med Rituximab (Mabthera ) Indledning Sidst revideret: 28.08.2019 Side 1 af 6 Palle Juul-Jensens Boulevard 99 8200 Aarhus N Tlf. 7845 5810 Blodsygdomme Denne vejledning skal give dig og dine
Forekomsten af vektorbårne infektioner hos personer med risiko for flåtbid
 Deltagelse i videnskabeligt forsøg om Forekomsten af vektorbårne infektioner hos personer med risiko for flåtbid Vi vil spørge, om du vil deltage i et videnskabeligt forsøg? Det er frivilligt at deltage
Deltagelse i videnskabeligt forsøg om Forekomsten af vektorbårne infektioner hos personer med risiko for flåtbid Vi vil spørge, om du vil deltage i et videnskabeligt forsøg? Det er frivilligt at deltage
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Information til patienter med nydiagnosticeret lymfekræft i hjernen om deltagelse i et
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Information til patienter med nydiagnosticeret lymfekræft i hjernen om deltagelse i et
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. med enten Rituximab eller Peg-Intron hos ældre patienter med Mantelcelle lymfom 1 Patient-Information
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. med enten Rituximab eller Peg-Intron hos ældre patienter med Mantelcelle lymfom 1 Patient-Information
Forsøgskode: CINC424D2301 side 1 af 15. Deltagerinformation
 Forsøgskode: CINC424D2301 side 1 af 15 Deltagernummer: Deltagerinformation Deltagelse i et videnskabeligt forskningsprojekt for patienter med kronisk graft-versus-host sygdom (cgvhd) efter kortikosteroidbehandling.
Forsøgskode: CINC424D2301 side 1 af 15 Deltagernummer: Deltagerinformation Deltagelse i et videnskabeligt forskningsprojekt for patienter med kronisk graft-versus-host sygdom (cgvhd) efter kortikosteroidbehandling.
KOMITÉSYSTEMETS TJEKLISTE INDHOLD KLINISKE LÆGEMIDDELFORSØG
 1 KOMITÉSYSTEMETS TJEKLISTE INDHOLD KLINISKE LÆGEMIDDELFORSØG DOKUMENTER DER SKAL INDSENDES VIA DKMAnet. Se fælles dokumenttjekliste ved ansøgning om lægemiddelforsøg via DKMAnet * markerer komitérelevante
1 KOMITÉSYSTEMETS TJEKLISTE INDHOLD KLINISKE LÆGEMIDDELFORSØG DOKUMENTER DER SKAL INDSENDES VIA DKMAnet. Se fælles dokumenttjekliste ved ansøgning om lægemiddelforsøg via DKMAnet * markerer komitérelevante
Deltagerinformation om deltagelse i et videnskabeligt forsøg.
 Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Biomarker styret og dosisintensiveret kemoimmunoterapi med tidlig CNS profylakse til patienter under 65 år med højrisiko diffust
Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Biomarker styret og dosisintensiveret kemoimmunoterapi med tidlig CNS profylakse til patienter under 65 år med højrisiko diffust
Perfusion skanning af nyretumorer
 Perfusion skanning af nyretumorer Vi vil spørge, om du vil deltage i et videnskabeligt forsøg. Det er frivilligt at deltage i forsøget. Du kan når som helst og uden at give en grund trække dit samtykke
Perfusion skanning af nyretumorer Vi vil spørge, om du vil deltage i et videnskabeligt forsøg. Det er frivilligt at deltage i forsøget. Du kan når som helst og uden at give en grund trække dit samtykke
Strålebehandling med to forskellige doseringer til patienter opereret for brystkræft. hovedprojekt. Aarhus Universitetshospital
 Strålebehandling med to forskellige doseringer til patienter opereret for brystkræft hovedprojekt Version 1.0 23/12/2014 Underskrives i 2 eksemplarer: 1 til KFE og 1 til patienten Onkologisk Afdeling D
Strålebehandling med to forskellige doseringer til patienter opereret for brystkræft hovedprojekt Version 1.0 23/12/2014 Underskrives i 2 eksemplarer: 1 til KFE og 1 til patienten Onkologisk Afdeling D
Strålebehandling vejledt af PETskanning ved hoved-/halskræft
 Patientinformation Information til patienter om deltagelse i et forskningsprojekt Strålebehandling vejledt af PETskanning ved hoved-/halskræft "Dosis-eskaleret strålebehandling vejledt af funktionel billeddannelse
Patientinformation Information til patienter om deltagelse i et forskningsprojekt Strålebehandling vejledt af PETskanning ved hoved-/halskræft "Dosis-eskaleret strålebehandling vejledt af funktionel billeddannelse
Skriftlig deltagerinformation
 Skriftlig deltagerinformation Tak for din interesse for RunSAFE. Tilmelding: Hvis du ikke allerede har udfyldt tilmeldings spørgeskemaet på: http://www.vilober.dk/deltag-klik-her-2/runsafe/sporgeskema-2
Skriftlig deltagerinformation Tak for din interesse for RunSAFE. Tilmelding: Hvis du ikke allerede har udfyldt tilmeldings spørgeskemaet på: http://www.vilober.dk/deltag-klik-her-2/runsafe/sporgeskema-2
Kapitel 1. Anmeldelse af et sundhedsvidenskabeligt forskningsprojekt og indhold i en forsøgsprotokol og en tillægsprotokol
 UDKAST NOVEMBER 2011 Bekendtgørelse om anmeldelse af sundhedsvidenskabelige forskningsprojekter og om information og samtykke til deltagelse i sundhedsvidenskabelige forskningsprojekter I medfør af 7,
UDKAST NOVEMBER 2011 Bekendtgørelse om anmeldelse af sundhedsvidenskabelige forskningsprojekter og om information og samtykke til deltagelse i sundhedsvidenskabelige forskningsprojekter I medfør af 7,
Udvalget for Videnskab og Teknologi UVT alm. del - Bilag 252 Offentligt. Patienten i kliniske lægemiddelforsøg
 Udvalget for Videnskab og Teknologi UVT alm. del - Bilag 252 Offentligt Patienten i kliniske lægemiddelforsøg Patienten i kliniske lægemiddelforsøg Side Forord Formålet med denne pjece er at give dig og
Udvalget for Videnskab og Teknologi UVT alm. del - Bilag 252 Offentligt Patienten i kliniske lægemiddelforsøg Patienten i kliniske lægemiddelforsøg Side Forord Formålet med denne pjece er at give dig og
Deltager information
 READ, Bilag 10 Fortroligt Side 1 af 7 Deltager information Protokol DBCG 07-READ, dateret 15. oktober 2009. Et videnskabeligt forsøg med to forskellige kombinationer af kemoterapi til patienter med brystkræft.
READ, Bilag 10 Fortroligt Side 1 af 7 Deltager information Protokol DBCG 07-READ, dateret 15. oktober 2009. Et videnskabeligt forsøg med to forskellige kombinationer af kemoterapi til patienter med brystkræft.
Deltagerinformation om et videnskabeligt forsøg
 Hæmatologisk Afdeling Odense Universitetshospital Deltagerinformation om et videnskabeligt forsøg Forebyggende antibiotika til patienter med myelomatose Protokoltitel: SUTRICA Et klinisk prospektivt, randomiseret,
Hæmatologisk Afdeling Odense Universitetshospital Deltagerinformation om et videnskabeligt forsøg Forebyggende antibiotika til patienter med myelomatose Protokoltitel: SUTRICA Et klinisk prospektivt, randomiseret,
Blodprøveanalyser og biobank fra navlesnorsblod hos nyfødte
 Deltagerinformation Blodprøveanalyser og biobank fra navlesnorsblod hos nyfødte Tilbud til alle, der fødes på Rigshospitalet og Herlev Hospital Hvis du ønsker at deltage i projektet, kan du finde samtykkearket
Deltagerinformation Blodprøveanalyser og biobank fra navlesnorsblod hos nyfødte Tilbud til alle, der fødes på Rigshospitalet og Herlev Hospital Hvis du ønsker at deltage i projektet, kan du finde samtykkearket
Aarhus Universitetshospital
 Anmodning om deltagelse i det videnskabelige forsøg: Behandling af patienter med langvarige helbredsproblemer (kroniske funktionelle lidelser) med gruppeterapi Originaltitel: Behandling af multi-organ
Anmodning om deltagelse i det videnskabelige forsøg: Behandling af patienter med langvarige helbredsproblemer (kroniske funktionelle lidelser) med gruppeterapi Originaltitel: Behandling af multi-organ
Patientinformation DBCG 2007- d,t
 information DBCG 2007- d,t Behandling af brystkræft efter operation De har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der alligevel i nogle tilfælde en
information DBCG 2007- d,t Behandling af brystkræft efter operation De har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der alligevel i nogle tilfælde en
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Brentuximab
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Brentuximab
Vil du deltage i et forskningsprojektet der handler om psykoedukation til pårørende?
 Vil du deltage i et forskningsprojektet der handler om psykoedukation til pårørende? (Forskningsprojektets titel: Psykoedukation af pårørende til forebyggelse af nye depressive episoder: en lodtrækningsundersøgelse
Vil du deltage i et forskningsprojektet der handler om psykoedukation til pårørende? (Forskningsprojektets titel: Psykoedukation af pårørende til forebyggelse af nye depressive episoder: en lodtrækningsundersøgelse
Forsøgets titel: Startløbemængden og risikoen for løbeskader hos nybegyndere med BMI 30-35
 Deltagerinformation Forsøgets titel: Startløbemængden og risikoen for løbeskader hos nybegyndere med BMI 30-35 Vi vil spørge, om du vil deltage i et videnskabeligt forsøg, der udføres af Ortopædkirurgien,
Deltagerinformation Forsøgets titel: Startløbemængden og risikoen for løbeskader hos nybegyndere med BMI 30-35 Vi vil spørge, om du vil deltage i et videnskabeligt forsøg, der udføres af Ortopædkirurgien,
Behandling af steroidrefraktær kronisk Graft versus Host sygdom med Ekstrakorporal Fotoferese.
 Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Behandling af steroidrefraktær kronisk Graft versus Host sygdom med Ekstrakorporal Fotoferese. Vi vil spørge, om du vil deltage
Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Behandling af steroidrefraktær kronisk Graft versus Host sygdom med Ekstrakorporal Fotoferese. Vi vil spørge, om du vil deltage
Behandling af brystkræft efter operation
 information DBCG 2010-d,t Behandling af brystkræft efter operation Du har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der i nogle tilfælde risiko for, at
information DBCG 2010-d,t Behandling af brystkræft efter operation Du har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der i nogle tilfælde risiko for, at
Videnskabsetisk komite og biobanker. Dansk Selskab for Good Clinical Practice 3. november 2014 Lone Gundelach
 Videnskabsetisk komite og biobanker Dansk Selskab for Good Clinical Practice Forskningsbiobank Samling af personhenførbart biologisk materiale Indgår som integreret del af konkret forskningsprojekt Opbevares
Videnskabsetisk komite og biobanker Dansk Selskab for Good Clinical Practice Forskningsbiobank Samling af personhenførbart biologisk materiale Indgår som integreret del af konkret forskningsprojekt Opbevares
Behandling af brystkræft
 information DBCG 2010-neo-b Behandling af brystkræft Behandling af brystkræft omfatter i de fleste tilfælde en kombination af lokalbehandling (operation og eventuel strålebehandling) samt medicinsk behandling.
information DBCG 2010-neo-b Behandling af brystkræft Behandling af brystkræft omfatter i de fleste tilfælde en kombination af lokalbehandling (operation og eventuel strålebehandling) samt medicinsk behandling.
Drillemave projektet Videnskabelig undersøgelse om behandling af børn med forstoppelse og afføringsinkontinens
 Børneafdelingen Drillemave projektet Videnskabelig undersøgelse om behandling af børn med forstoppelse og afføringsinkontinens Rumle www.koldingsygehus.dk Projekt-ID: S-2012 0016 Deltagerinformation til
Børneafdelingen Drillemave projektet Videnskabelig undersøgelse om behandling af børn med forstoppelse og afføringsinkontinens Rumle www.koldingsygehus.dk Projekt-ID: S-2012 0016 Deltagerinformation til
Nordisk Lymfom Gruppe
 Nordisk Lymfom Gruppe Lokale kontakter Hovedansvarlige læge for den danske del af SAKK 35/14 undersøgelsen:: Overlæge Michael Pedersen Hæmatologisk afdeling L-4034 Rigshospitalet Blegdamsvej 9 2100 København
Nordisk Lymfom Gruppe Lokale kontakter Hovedansvarlige læge for den danske del af SAKK 35/14 undersøgelsen:: Overlæge Michael Pedersen Hæmatologisk afdeling L-4034 Rigshospitalet Blegdamsvej 9 2100 København
9. Dokumentation for den forsøgsansvarliges uddannelse (f.eks. autorisationsid).
 Mødedato: REGIONERNES FÆLLES TJEKLISTE (vs-09_06-13) A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne
Mødedato: REGIONERNES FÆLLES TJEKLISTE (vs-09_06-13) A. DOKUMENTER DER SKAL INDSENDES. Bemærk at alt materiale skal indsendes elektronisk. Hvert dokument skal indsendes som en selvstændig PDF-fil. Dokumenterne
Undersøgelse af det bedøvede hudområde efter nerveblokade med lokalbedøvelse i hofteområdet
 Deltagerinformation om deltagelse i et videnskabeligt forsøg Titel: Regional anaesthesia of the cutaneus nerves of the hip - Undersøgelse af det bedøvede hudområde efter nerveblokade med lokalbedøvelse
Deltagerinformation om deltagelse i et videnskabeligt forsøg Titel: Regional anaesthesia of the cutaneus nerves of the hip - Undersøgelse af det bedøvede hudområde efter nerveblokade med lokalbedøvelse
Deltagerinformation om deltagelse i et videnskabeligt forsøg DALIAH
 Deltagerinformation om deltagelse i et videnskabeligt forsøg DALIAH Forsøgets titel: Dansk Studie af Lav-Dosis Interferon Alpha vs Hydroxyurea i Behandlingen af Ph- Negative Kroniske Myeloide Neoplasier
Deltagerinformation om deltagelse i et videnskabeligt forsøg DALIAH Forsøgets titel: Dansk Studie af Lav-Dosis Interferon Alpha vs Hydroxyurea i Behandlingen af Ph- Negative Kroniske Myeloide Neoplasier
Forsøgskode: CINC424D2301 side 1 af 15. Deltagerinformation
 Forsøgskode: CINC424D2301 side 1 af 15 Deltagerinformation v. 3.0_ 27-jun-2018 23-Jan-2019 Deltagernummer: Deltagerinformation Deltagelse i et videnskabeligt forskningsprojekt for patienter med kronisk
Forsøgskode: CINC424D2301 side 1 af 15 Deltagerinformation v. 3.0_ 27-jun-2018 23-Jan-2019 Deltagernummer: Deltagerinformation Deltagelse i et videnskabeligt forskningsprojekt for patienter med kronisk
Deltagerinformation om deltagelse i et videnskabeligt forsøg
 Deltagerinformation om deltagelse i et videnskabeligt forsøg PANSAID PAracetamol og NSAID i kombinationsbehandling Forsøgsansvarlige: Kasper H. Thybo, læge, ph.d.-studerende, Anæstesiologisk afdeling,
Deltagerinformation om deltagelse i et videnskabeligt forsøg PANSAID PAracetamol og NSAID i kombinationsbehandling Forsøgsansvarlige: Kasper H. Thybo, læge, ph.d.-studerende, Anæstesiologisk afdeling,
Deltagerinformation om deltagelse i et videnskabeligt forsøg.
 Deltagerinformation om deltagelse i et videnskabeligt forsøg. Kort projekttitel: CAT-studiet Forsøgets titel: Dansk: Kompressionsbehandling af ankelbrud. Engelsk: Compression in Anklefracture Treatment,
Deltagerinformation om deltagelse i et videnskabeligt forsøg. Kort projekttitel: CAT-studiet Forsøgets titel: Dansk: Kompressionsbehandling af ankelbrud. Engelsk: Compression in Anklefracture Treatment,
Biologiske signaler i graviditeten - Genetisk information
 Biologiske signaler i graviditeten - Genetisk information 2 Vi vil spørge, om du vil deltage i et videnskabeligt studie, der udføres af Afdeling for Epidemiologisk Forskning, Statens Serum Institut. Før
Biologiske signaler i graviditeten - Genetisk information 2 Vi vil spørge, om du vil deltage i et videnskabeligt studie, der udføres af Afdeling for Epidemiologisk Forskning, Statens Serum Institut. Før
Deltagerinformation og samtykkeerklæring om deltagelse i en videnskabelig undersøgelse
 Deltagerinformation og samtykkeerklæring om deltagelse i en videnskabelig undersøgelse Partnership projektet: Styrket samarbejde mellem kræftpatient, praktiserende læge og onkolog En undersøgelse, der
Deltagerinformation og samtykkeerklæring om deltagelse i en videnskabelig undersøgelse Partnership projektet: Styrket samarbejde mellem kræftpatient, praktiserende læge og onkolog En undersøgelse, der
Deltagerinformation om deltagelse i et videnskabeligt forsøg.
 Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Brentuximab vedotin eller B-CAP til behandling af ældre patienter med nydiagnostiseret klassisk Hodgkin lymfom. Engelsk titel:
Deltagerinformation om deltagelse i et videnskabeligt forsøg. Forsøgets titel: Brentuximab vedotin eller B-CAP til behandling af ældre patienter med nydiagnostiseret klassisk Hodgkin lymfom. Engelsk titel:
Behandling af brystkræft
 Patientinformation DBCG 2015-neo-d (Paclitaxel, 8 serier) Behandling af brystkræft Behandling af brystkræft omfatter i de fleste tilfælde en kombination af lokalbehandling (operation og eventuel strålebehandling)
Patientinformation DBCG 2015-neo-d (Paclitaxel, 8 serier) Behandling af brystkræft Behandling af brystkræft omfatter i de fleste tilfælde en kombination af lokalbehandling (operation og eventuel strålebehandling)
Patientinformation DBCG 2007- b,t
 information DBCG 2007- b,t Behandling af brystkræft efter operation De har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der alligevel i nogle tilfælde en
information DBCG 2007- b,t Behandling af brystkræft efter operation De har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der alligevel i nogle tilfælde en
Den Centrale Videnskabsetiske. Før du beslutter dig. Forsøgspersoner til sundhedsvidenskabelige forsøg. Videnskabsetiske
 Den Centrale Videnskabsetiske Komité Før du beslutter dig Forsøgspersoner til sundhedsvidenskabelige forsøg De Videnskabsetiske Komitéer i Danmark FØR DU BESLUTTER DIG - Forsøgspersoner til sundhedsvidenskabelige
Den Centrale Videnskabsetiske Komité Før du beslutter dig Forsøgspersoner til sundhedsvidenskabelige forsøg De Videnskabsetiske Komitéer i Danmark FØR DU BESLUTTER DIG - Forsøgspersoner til sundhedsvidenskabelige
Bilag B: DAHANCA 35 A national randomized trial of proton versus photon radiotherapy for the treatment of head-neck cancer
 Bilag B: DAHANCA 35 A national randomized trial of proton versus photon radiotherapy for the treatment of head-neck cancer PATIENTINFORMATION Ver 1.11 31.03.19 TIL PATIENTEN Information til patienter om
Bilag B: DAHANCA 35 A national randomized trial of proton versus photon radiotherapy for the treatment of head-neck cancer PATIENTINFORMATION Ver 1.11 31.03.19 TIL PATIENTEN Information til patienter om
Forskningsprojektets titel Lymfeknudefjernelse i forbindelse med nefroureterektomi på baggrund af tumor i nyrebækkenet eller øverste 2/3 af urinleder.
 Deltagerinformation Forskningsprojektets titel Lymfeknudefjernelse i forbindelse med nefroureterektomi på baggrund af tumor i nyrebækkenet eller øverste 2/3 af urinleder. Vi vil spørge, om du vil deltage
Deltagerinformation Forskningsprojektets titel Lymfeknudefjernelse i forbindelse med nefroureterektomi på baggrund af tumor i nyrebækkenet eller øverste 2/3 af urinleder. Vi vil spørge, om du vil deltage
Information til deltagere
 K Ø B E N H A V N S U N I V E R S I T ET D E T S U N D H E D S V I D E N S K A B E L I G E F A K U L T E T Information til deltagere Akupunktur og klimakterielle symptomer: Et randomiseret studie Deltagerinformation
K Ø B E N H A V N S U N I V E R S I T ET D E T S U N D H E D S V I D E N S K A B E L I G E F A K U L T E T Information til deltagere Akupunktur og klimakterielle symptomer: Et randomiseret studie Deltagerinformation
Patientinformation DBCG 04-b
 information DBCG 04-b Behandling af brystkræft efter operation De har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der alligevel i nogle tilfælde en risiko
information DBCG 04-b Behandling af brystkræft efter operation De har nu overstået operationen for brystkræft. Selvom hele svulsten er fjernet ved operationen, er der alligevel i nogle tilfælde en risiko
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation og samtykkkeerklæring om deltagelse i et videnskabeligt forsøg til
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. Deltagerinformation og samtykkkeerklæring om deltagelse i et videnskabeligt forsøg til
Telemedicinsk service til patienter med kronisk obstruktiv lungesygdom
 Telemedicinsk service til patienter med kronisk obstruktiv lungesygdom Et klinisk randomiseret, kontrolleret studie til vurdering af den kliniske effekt og de økonomiske konsekvenser af telemedicinsk service
Telemedicinsk service til patienter med kronisk obstruktiv lungesygdom Et klinisk randomiseret, kontrolleret studie til vurdering af den kliniske effekt og de økonomiske konsekvenser af telemedicinsk service
Deltagerinformation. Undersøgelse af virkningen af et bioaktivt protein (CGMP) - et biprodukt fra ostefremstilling, givet i 3 forskellige dosis
 Deltagerinformation Undersøgelse af virkningen af et bioaktivt protein (CGMP) - et biprodukt fra ostefremstilling, givet i 3 forskellige dosis Originale titel: Dobbelt-blindt cross-over studie af casein
Deltagerinformation Undersøgelse af virkningen af et bioaktivt protein (CGMP) - et biprodukt fra ostefremstilling, givet i 3 forskellige dosis Originale titel: Dobbelt-blindt cross-over studie af casein
At skrive en god deltagerinformation (december 2011)
 At skrive en god deltagerinformation (december 2011) Generelt om deltagerinformationen I forbindelse med videnskabelige forsøg, der inddrager forsøgspersoner, er der fastsat regler for, hvordan man informerer
At skrive en god deltagerinformation (december 2011) Generelt om deltagerinformationen I forbindelse med videnskabelige forsøg, der inddrager forsøgspersoner, er der fastsat regler for, hvordan man informerer
Til patienter og pårørende. Rituximab (MabThera) Information om behandling med antistof. Hæmatologisk Afdeling
 Til patienter og pårørende Rituximab (MabThera) Information om behandling med antistof Hæmatologisk Afdeling Indledning Denne vejledning skal give dig og dine pårørende viden om den medicinske kræftbehandling
Til patienter og pårørende Rituximab (MabThera) Information om behandling med antistof Hæmatologisk Afdeling Indledning Denne vejledning skal give dig og dine pårørende viden om den medicinske kræftbehandling
Deltagelse i et videnskabeligt forsøg i Smertecenter Syd
 Til patienter og pårørende Deltagelse i et videnskabeligt forsøg i Smertecenter Syd Deltagerinformation Vælg farve Smertecenter Syd, OUH Forsøgets titel: Biomarkører ved kroniske smertetilstande. En undersøgelse
Til patienter og pårørende Deltagelse i et videnskabeligt forsøg i Smertecenter Syd Deltagerinformation Vælg farve Smertecenter Syd, OUH Forsøgets titel: Biomarkører ved kroniske smertetilstande. En undersøgelse
Information vedrørende deltagelse i det sundhedsvidenskabelige forskningsprojekt:
 Information vedrørende deltagelse i det sundhedsvidenskabelige forskningsprojekt: Efterbehandling til patienter tidligere Forskningsprojektet udføres af Læge, Ph.d.-studerende Anne Sophie Sølling, Tlf.:
Information vedrørende deltagelse i det sundhedsvidenskabelige forskningsprojekt: Efterbehandling til patienter tidligere Forskningsprojektet udføres af Læge, Ph.d.-studerende Anne Sophie Sølling, Tlf.:
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter.
 Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. BRAVE Til patienter med Hodgkin lymfom, som ikke responderede på 1. linie kemoterapi, eller
Dette er kun til orientering for patienter i opfølgningsfasen. Forsøget er lukket for inklusion af nye patienter. BRAVE Til patienter med Hodgkin lymfom, som ikke responderede på 1. linie kemoterapi, eller
Behandling af brystkræft
 Patientinformation DBCG 2015-neo-bt (Docetaxel, 6 serier) Behandling af brystkræft Behandling af brystkræft omfatter i de fleste tilfælde en kombination af lokalbehandling (operation og eventuel strålebehandling)
Patientinformation DBCG 2015-neo-bt (Docetaxel, 6 serier) Behandling af brystkræft Behandling af brystkræft omfatter i de fleste tilfælde en kombination af lokalbehandling (operation og eventuel strålebehandling)
Deltagerinformation om et videnskabeligt forsøg
 Hæmatologisk Enhed 1. Afdeling 4033/4034 Rigshospitalet Blegdamsvej 9 2100 København Ø Deltagerinformation om et videnskabeligt forsøg Behandling af tilbagefald af myelomatose efter tidligere højdosisbehandling
Hæmatologisk Enhed 1. Afdeling 4033/4034 Rigshospitalet Blegdamsvej 9 2100 København Ø Deltagerinformation om et videnskabeligt forsøg Behandling af tilbagefald af myelomatose efter tidligere højdosisbehandling
