Udvalgte grundstoffers kemi i vandig opløsning
|
|
|
- Johanne Clausen
- 8 år siden
- Visninger:
Transkript
1 Udvalgte grundstoffers kemi i vandig opløsning Fældning Opløsning Syre-baseligevægte Kompleksdannelse Oxidation Reduktion Peter Andersen og Ole Mønsted Kemisk Institut Københavns Universitet 2004
2
3 Denne udgivelse er en introduktion til nogle grundstoffers kemi i vandig opløsning som beskrevet i bogen "Grundlæggende analytisk kemi & Grundstoffernes kemi i vandig opløsning". Udvalget tager udgangspunkt i ønsket om at illustrere en række almenkemiske fænomener så som fældning, opløsning, syre-baseligevægte, kompleksdannelse, oxidation og reduktion. Det drejer sig primært om reaktioner udført i semimikromålestok for oxoanioner fra gruppe i det periodiske system og for halogeniderne Cl -, Br - og I -. INDHOLDSFORTEGNELSE Laboratorieudstyr og -teknik ved semimikroprøver... 3 B; C; N, P; S; Cl, Br, I; (Li, Na,K)... 9 B C N P S Cl, Br, I Li, Na, K Fast stofprøve... 25
4
5 3 Laboratorieudstyr og -teknik ved semimikroprøver Alle reaktioner og analyser i forbindelse med "Udvalgte grundstoffers kemi i vandig opløsning" udføres i semimikromålestok. Dette er ensbetydende med, at forsøg, som i makromålestok udføres med opløsningsvoluminer på ml, her udføres med voluminer på 1-20 dråber (0,05-1 ml). Ud fra et fagligt synspunkt er makro- og semimikrometoderne lige gode, men den sidste er ressourcebesparende med hensyn til tid, plads og kemikalier. Risikoen for alvorligere laboratorieulykker er minimal, og anlæg til at forhindre forurening overbelastes ikke. Dråbeflasker. Prøveopløsninger og reagensopløsninger opbevares på 10 ml dråbeflasker, som ikke fjernes fra reagensreolerne, hvor de har en fast plads efter et i forvejen fastlagt system. De mest anvendte reagenser findes på reoler ude på laboratoriebordene. De mere sjældent anvendte reagenser findes ligesom prøveopløsningerne på reoler i stinkskabene. Dråbepipetterne, som skrues i efter brug, må ikke forurenes ved kontakt med reagensglas. Dråbestørrelsen er omkr. 0,05 ml, men kan være mindre på grund af flasken eller reagenset (NaOH, konc. svovlsyre). Dråbeflaskerne kan om nødvendigt påfyldes fra de store reagensflasker, som findes på laboratoriet. Sprøjteflaske. Flasken holdes normalt fyldt med ionbyttet vand fra hanen mærket IK over vasken. Flasken benyttes f.eks. ved spuling af pipetter, påfyldning af vand på vandbadet, og hvor tilsætning af relativt store mængder vand under forsøgene er påkrævet. I reagenssættet findes en dråbeflaske med ionbyttet vand. Dråbeflasken benyttes normalt til dosering af vanddråber under forsøgene. Kapillarpipette. En kapillarpipette består af et tilspidset glasrør forsynet med en plastichætte. Den benyttes bl.a. til overførsel af væske fra et glas med et nedcentrifugeret bundfald til et andet glas, til overførsel af væske fra en digel til et reagensglas eller omvendt (dråber hældes aldrig) eller til at dosere dråber med. Hver gang en kapillarpipette har været i brug, skylles den udvendigt med ionbyttet vand fra sprøjteflasken (over den firkantede skål). Derpå renses den indvendigt ved 2-3 gange at suge rent vand op fra et bægerglas med ionbyttet vand og sprøjte det ud igen over bakken. Af og til må pipetten renses gennemgribende, ved at hætten fjernes, og pipetten spules under vandhanen.
6 4 Reagensglas. Udstyret indeholder to typer glas: almindelige, kraveløse glas, som benyttes til de fleste reaktioner, og glas med krave, som anvendes, når en reaktion skal foregå under tryk i et tilproppet glas. Kraven gør det lettere at fastgøre en korkprop i glassets hals ved hjælp af en træklemme. Inden proppen fjernes efter endt reaktion, er det hensigtsmæssigt at køle reaktionsblandingen på is. Spatler og omrørerpinde. Ved fældning af et bundfald ved hjælp af et fældningsreagens er det vigtigt at sikre god blanding, enten ved omrøring med en omrørerpind eller spatel eller ved at knipse glasset. Fracentrifugerede bundfald, som skal udvaskes eller opløses, må også bringes i god kontakt med vaskevæsken eller opløsningsmidlet ved omhyggelig omrøring. Centrifuge. Ved alle adskillelser af bundfald og opløsning anvendes en centrifuge. Et glas, hvis indhold skal centrifugeres, afbalanceres altid med et andet glas med næsten samme volumen vand. Den normale centrifugeringstid er 30 sekunder, lidt mindre for grovkrystallinske bundfald, lidt mere for finkrystallinske bundfald. Efter centrifugeringen skilles væsken (centrifugatet) altid fra bundfaldet med kapillarpipette. Hvis et bundfald skal benyttes i et videre forløb, udvaskes det normalt med vand eller en opløsning, som forskriften angiver. Udvaskningen foretages for at fjerne uønskede stoffer, som kan interferere med de efterfølgende reaktioner. Udvaskningen foregår på den måde, at bundfaldet røres omhyggeligt op med vaskevæsken, hvorefter denne fjernes efter centrifugering. Processen gentages 1-2 gange, eller til bundfaldet er rent. Et bundfald skal ofte ekstraheres (udtrækkes) med vand eller en nærmere angivet opløsning. Ved ekstraktionen skal visse af bundfaldets bestanddele bringes i opløsning, hvorefter remanensen, d.v.s. den rest, som bliver uopløst tilbage, skal centrifugeres fra. Vandbad. Mange reaktioner eller opløsningsprocesser foregår bedst ved en højere temperatur end stuetemperatur. Alle nødvendige opvarmninger foregår på et vandbad. Vandbadet består af et højt, relativt smalt bægerglas på 100 ml indeholdende ml ionbyttet vand, som holdes konstant opvarmet til lidt under kogepunktet ved hjælp af en mikrobrænder. Vandbadet påfyldes jævnligt nyt vand fra sprøjteflasken, så tørkogning undgås. Et varmt, tørt glas revner, hvis der tilsættes koldt vand. De reagensglas, som skal holdes neddyppet i badet, holdes på plads ved hjælp af træklemmer, som hviler på bægerglassets kant. Mikrobrænderens flamme kan reguleres ved hjælp af en nåleventil på selve brænderen. Ved laboratorietids ophør lukkes gashanen på væggen, og slangen tages af. Infralampe. Det er undertiden nødvendigt at inddampe en opløsning helt eller næsten til tørhed. Væsken overføres til en lille porcelænsdigel ved hjælp af en kapillarpipette. Porcelænsdiglen anbringes under infralampen i stinkskabet. Efter inddampningen flyttes diglen med en pincet (evt. digeltang) ud på en af stinkskabets fliser, hvor den henstår til nedkøling. Varme, oftest rygende digler fjernes aldrig fra stinkskabet, da der ved inddampningen ofte udvikles giftige dampe. Efter en inddampning næsten til tørhed skal inddampningsresten oftest opløses eller ekstraheres (ved god omrøring) med vand eller en opløsning, som forskriften angiver. Dette foregår stadig i stinkskab. Diglens indhold overføres derefter til et reagensglas ved hjælp af en kapillarpipette.
7 Affaldsbakke. Den firkantede plasticskål fyldes halvt med vand og bruges som samlebakke for brugte reagensglas med indhold. Glas indeholdende pentan-1-ol, eddikesyre og sulfidholdige opløsninger lægges aldrig i bakken, men skylles straks over vaskens afløb med rigeligt vand. Brugt indikatorpapir lægges ikke i bakken, men i en papirkurv. Specielt giftige stoffer som chrom(vi)-, cadmium-, kviksølv-, thallium-, bly- og arsenforbindelser opsamles hver for sig (i f.eks. bægerglas) og derefter i de respektive opsamlingsdunke, som er opstillet i øvelseslaboratoriet. Når det er praktisk eller påkrævet, renses affaldsbakkens indhold af glasudstyr med alm. postevand. Efter rensningen skylles alt udstyr omhyggeligt med ionbyttet vand. Gasanalyseapparat. Apparatets brug er illustreret nedenfor og er nærmere beskrevet under prøver for borat, carbonat og ammoniak. Gennemluftning. Gennemluftning foregår fra tryklufthanerne i stinkskabene. Luftslangen påmonteres et plastrør, og man sørger for, at luftstrømmen ikke er for kraftig. Husk at lukke for luftventilen straks efter brug. Defekt udstyr. Glasudstyr med skår eller revner kasseres straks og lægges i en speciel opsamlingsbeholder. Kapillarpipetter, reagensglas, omrørerpinde og andet standardudstyr kan erstattes fra laboratoriets lager af reserveudstyr. 5 Forslag til opstilling af udstyr ved øvelsespladsen. Fra venstre: Stativ med vandbad, mikrobrænder (må ikke stå på glaspladen), reol med reagenssæt (dråbeflasker), stativ med reagensglas, glasplade, cylinderglas med kapillarpipetter, bægerglas med ionbyttet vand, affaldsbakke.
8 6
9 7
10 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba * Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra ** Rf La Ce Pr Nd Pr Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
11 9 B; C; N, P; S; Cl, Br, I; (Li, Na, K) Udvalget af grundstoffer drejer sig om ikke-metaller fra gruppe 13-17, også benævnt hovedgruppe. Disse grundstoffer danner alle oxoanioner og de korresponderende syrer. I den udleverede faste analyseblanding, Analyse I, vil de findes som borater, B(OH) - 4 (evt. borsyre, H 3 BO 3, eller polyborater), carbonater, CO 2-3 (evt. HCO - 3 ), nitrater, NO - 3, phosphater, PO 3-4 (evt. HPO 2-4 eller H 2 PO - 4 ) og sulfater, SO 2-4 (evt. HSO - 4 ), d.v.s. i højeste oxidationstrin. Halogenerne vil findes som Cl -, Br - og I -, og nitrogen kan også findes som NH + 4, altså i laveste oxidationstrin. Ammoniumionen har omtrent samme størrelse som kaliumionen, og de to kationer danner ofte isostrukturelle salte. De otte grundstoffer tilhører en gruppe, som er karakteriseret ved, at de enkelte komponenter kan påvises stort set direkte uden forudgående separationer. Til gruppen hører også alkalimetallerne Li +, Na + og K +. De påvises ved flammeemission i den udleverede faste stofprøve.
12 10 Bor Borationen, B(OH) 4-1. Vand. Borsyre er en svag syre, som reagerer efter ligningen B(OH) 3 + H 2 O º B(OH) H + altså ved optagelse af OH - og ikke, som det sædvanlige for syrer, ved afgivelse af H +. Syrestyrkekonstanten K a = 10-9,2 M. Til borsyrens salte hører foruden meta- og orthoborater de såkaldte polyborater, hvoraf tetraboraterne er de mest kendte. De hydrolyseres i vand efter ligningen Na 2 [B 4 (OH) 4 O 5 ]A8 H 2 O(s) 6 2 B(OH) B(OH) Na H 2 O Da der dannes lige meget af syren og den korresponderende base, fungerer opløsningen som en pufferopløsning med ph = 9,2. Mål (indikatorpapir) ph i en opløsning af natriumtetraborat (0,1 M). 2. Glycerol. Den svage syre borsyre danner chelate forbindelser med glycoler, som f.eks. glycerol. Disse forbindelser er relativt stærke syrer. >C(OH) >C-O O-C< - 2, + B(OH) 3 º,, B+, + H H 2 O >C(OH) >C-O O-C< I et reagensglas blandes 1 dråbe glycerol med 1 dråbe vand, 1 dråbe natriumhydroxid (0,1 M) og 1 dråbe phenolphtaleinopløsning. Opløsningens ph bliver I et andet reagensglas blandes 1 dråbe natriumtetraborat (0,1 M) og 1 dråbe phenolphtaleinopløsning. Opløsningens ph bliver 9,2. Ved hjælp af en kapillarpipette blandes indholdet af de to glas. Indikatoren er farveløs ved ph mindre end 8. Mål blandingens ph med indikatorpapir.
13 3. Flammefarvning. Flygtige borforbindelser giver grøn flammefarve. Borsyre danner flygtige estere med de letteste alifatiske alkoholer. Trimethylborat koger f.eks. ved 65 C. B(OH) CH 3 OH 6 B(OCH 3 ) H 2 O 11 I et reagensglas blandes 2 dråber natriumtetraborat (0,1 M) og 4 dråber konc. svovlsyre (18 M). Efter køling på is tilsættes et lidt større volumen methanol. Reagensglasset påmonteres et boratrør, d.v.s. et tungtsmelteligt, tilspidset glasrør (se illustrationen i afsnittet om laboratorieudstyr). Der ledes nu en svag luftstrøm gennem systemet samtidig med, at glasset varmes på vandbadet. Næsten øjeblikkeligt herefter kan methanoldampe indeholdende trimethylborat antændes ved boratrørets munding. Den grønne flammefarve iagttages.
14 12 Carbon Carbonationen, CO Syrer. Ved tilsætning af stærke syrer til faste carbonater og koncentrerede opløsninger af carbonater sker en synlig udvikling af carbondioxid (brusning). Hvis den frigjorte carbondioxid, CO 2, ledes ned i en opløsning af bariumhydroxid, fældes et hvidt bundfald af bariumcarbonat, BaCO 3. MeCO 3 (s) + 2 H 6 + Me2+ + CO 2 (g) + H 2 O CO H 6 + CO 2 (g) + H 2 O CO 2 (g) + Ba OH -6 BaCO 3 (s) + H 2 O Det dannede bundfald kan opløses i syre. BaCO 3 (s) + 2 H + 6 Ba2+ + CO 2 (g) + H 2 O I et reagensglas (I) anbringes 3 dråber natriumcarbonat (0,1 M) og 3 dråber vand. Glasset sættes til køling på is. I et andet reagensglas (II) anbringes 5 dråber bariumhydroxid (0,2 M). CO 2 -røret monteres på gasprøveapparatet, som forbindes med lufttilledningen (se afsnittet om laboratorieudstyr). Til reagensglas (I) sættes nu forsigtigt 4-6 dr. fort. saltsyre (4 M). Herefter monteres glasset hurtigt på gasprøveapparatet, og CO 2 -røret dyppes ned i bariumhydroxidopløsningen (glas II). Der ledes nu en svag luftstrøm gennem systemet samtidig med, at reagensglas (I) varmes på vandbadet. Efter nogle minutters forløb afbrydes. Det udfældede bundfald af bariumcarbonat udvaskes med vand, og det konstateres, at det opløses fuldstændigt ved opvarmning med 2-3 dråber fort. saltsyre (4 M). 2. Bariumchlorid. Carbonationer fældes af bariumioner som et hvidt, syreopløseligt bundfald af bariumcarbonat, BaCO 3 (jf. ovenfor). 3. Sølvnitrat. Carbonationer fældes af sølvioner som et hvidgult bundfald af sølvcarbonat, Ag 2 CO 3, som bliver mørkt ved opvarmning på grund af omdannelse til Ag 2 O.
15 13 Nitrogen Ammoniumionen, NH Vand. Selvom ammoniumionen ikke er en metallisk kation, danner den alligevel salte med egenskaber, som minder om alkalimetalsaltenes. De simple salte er letopløselige og reagerer, hvis anionen er neutral, svagt surt på grund af ammoniumionens dissociation. NH 4+ º NH 3 + H + Den korresponderende base, ammoniak, fungerer i vandig opløsning som en svag base. Syrestyrkekonstanten for ammoniumionen er 10-9,25 M. Mål ved hjælp af indikatorpapir ph af en opløsning af ammoniumchlorid (0,1 M) og af ammoniak (0,1 M). Sammenlign værdierne med de beregnede. Sæt en dråbe phenolphtalein til hver af de to opløsninger og til et par dråber vand. 2. Natriumhydroxid. Ved tilsætning af stærk base til en opløsning indeholdende ammoniumioner dannes ammoniak. Denne ammoniak kan i gasform ledes over i rent vand (ved opvarmning og lufttilledning) og påvises ved hjælp af en syre-baseindikator. NH OH -6 NH 3 + H 2 O Reaktionen kan også benyttes til påvisning af komplekst bundet ammoniak. Ved robuste amminkomplekser, specielt af cobalt(iii), tilsættes natriumsulfid for at fælde metalionen som sulfid. 2 [Co(NH 3 ) 6 ] HS OH -6 2 CoS(s) + S(s) + 12 NH H 2 O I et reagensglas (I) blandes 1 dråbe ammoniumchlorid (0,1 M) og 2 dråber natriumhydroxid (2 M). Reagensglasset anbringes i gasprøveapparatet, som i forvejen er forsynet med et CO 2 -rør, som er neddyppet i et andet reagensglas (II) indeholdende 2 dråber vand og 1 dråbe phenolphtaleinopløsning. Der ledes nu en svag luftstrøm igennem systemet samtidig med, at glas(i) holdes opvarmet på vandbadet. Der fortsættes, til indikatoren har skiftet farve.
16 14 Nitrationen, NO 3-1. Jern(II)sulfat. Jern(II)ioner reducerer i stærkt sur væske nitrationen til NO, som med overskud af jern(ii) danner det brune nitrosylkompleks, Fe(NO) 2+. Reaktionen katalyseres af chlorid, men generes af farvede forbindelser, f.eks. iod dannet ved oxidation af iodid. NO Fe H + 6 Fe(NO) Fe H 2 O Til 1 dråbe kaliumnitrat (0,1 M) sættes 1 dråbe saltsyre (0,5 M) og 6 dråber konc. svovlsyre (18 M). Efter køling på is tilsættes forsigtigt langs siden af det skråtstillede reagensglas 2 dråber jern(ii)sulfat (0,5 M), således at de lægger sig oven på svovlsyreblandingen. I grænselaget dannes nu en mørkebrun, smal zone, hvis farve skyldes Fe(NO) Aluminium, zink og jern. Elektropositive metaller reducerer i sur væske nitrationer til ammoniumioner. NO Zn(s) + 10 H + 6 NH Zn H 2 O Til 1 dråbe kaliumnitrat (0,1 M) sættes en lille spatelfuld zink og nogle dråber fort. saltsyre (4 M). Efter køling på is tilsættes overskud af natriumhydroxid (2 M) (til alkalisk reaktion). Opløsningen centrifugeres og overføres til et nyt reagensglas. Ved hjælp af gasprøveapparatet ledes ammoniakken over i et reagensglas med vand og phenolphtaleinopløsning, som beskrevet tidligere under ammoniak.
17 15 Phosphor Phosphationen, PO Sølvnitrat. Phosphationen, PO 4 3- (stærkt basisk væske), eller hydrogenphosphationen, HPO 4 2- (svagt basisk, neutral eller meget svagt sur væske), fælder mange metalioner som tungtopløselige, normale phosphater. Sølvioner fældes f.eks. af hydrogenphosphationer som et gult bundfald af Ag 3 PO 4. Phosphatet opløses i eddikesyre. 3 Ag HPO 4 2- º Ag 3 PO 4 (s) + H 2 PO 4 - Ag 3 PO 4 (s) + 2 CH 3 COOH º 3 Ag + + H 2 PO CH 3 COO - Til 1 dråbe natriumhydrogenphosphat (0,1 M) sættes 1 dråbe sølvnitrat (0,1 M). Det gule bundfald opløses i eddikesyre (4 M). 2. Ammoniummolybdat. Phosphorsyre reagerer i varm salpetersyre med ammoniummolybdat under dannelse af et gult bundfald af ammoniummolybdophosphat. Bundfaldet er opløseligt i overskud af phosphorsyre, i ammoniak og i stærk base. Reaktionen hindres ved tilstedeværelsen af reducerende forbindelser som f.eks. iodid (reducerer Mo VI ). Arsensyre giver en tilsvarende fældning. H 3 PO NH H 2 MoO 4 6 (NH 4 ) 3 [P(Mo 3 O 10 ) 4 ](s) + 3 H H 2 O Til 5 dråber ammoniummolybdat (0,5 M i 4 M salpetersyre), som i forvejen er varmet kortvarigt på vandbadet, sættes med en kapillarpipette nogle få dråber af en blanding af 1 dråbe natriumhydrogenphosphat (0,1 M) og 1 dråbe fort. salpetersyre (4 M).
18 16 Svovl Sulfidionen, S 2-1. Vand. Hydrogensulfid er en yderst giftig gas med en karakteristisk ubehagelig lugt (som rådne æg), over for hvilken lugtesansen sløves efter kort tid. En vandig opløsning af hydrogensulfid reagerer svagt surt (en mættet opløsning af hydrogensulfid i vand er ca. 0,1 M ved 20 C). H 2 S º HS - + H + pk 1 = 7 Sulfidionen er en stærk base, og reaktionen S 2- + H 2 O º HS - + OH - er helt forskudt til højre. I 0,4 M saltsur opløsning fældes en række metalioner som sulfider af hydrogensulfid, selvom sulfidionkoncentrationen under disse omstændigheder er forsvindende (se Afsnit III og IV). Under mindre sure omstændigheder fældes også tungtopløselige sulfider af flere overgangsmetaller (se Afsnit III). Nogle af sulfiderne genopløses i saltsyre, alle undtagen HgS oxideres af salpetersyre (der dannes frit svovl). 2. Saltsyre. Der frigøres hydrogensulfid, hvis man sætter en ikke-oxiderende syre til et letopløseligt sulfid. Den dannede gas kan opsamles i vand og kan påvises her ved hjælp af en metalion, som danner et tungtopløseligt sulfid. HS - + H 6 + H 2 S(g) Cu 2+ + H 2 S 6 CuS(s) + 2 H+ På gasprøveapparatet monteres et carbondioxid-rør, hvis spids holdes neddyppet i en opløsning bestående af 2 dråber kobber(ii)nitrat (0,1 M), 1 dråbe saltsyre (4 M) og 7 dråber vand. I et andet reagensglas blandes 1 dråbe natriumsulfid (1 M) med 1 dråbe fort.saltsyre (4 M), hvorefter glasset hurtigt forbindes med gasprøveapparatet. Det dannede hydrogensulfid ledes ved hjælp af en svag luftstrøm og opvarmning over i det andet glas, hvor der fældes et mørkt bundfald af kobbersulfid.
19 17 Thioacetamid, CH 3 C(S)(NH 2 ) Thioacetamid (TAA), CH 3 C(S)(NH 2 ), er et hvidt, krystallinsk stof, som, opløst i vand, hydrolyseres til hydrogensulfid og ammoniumacetat. Hydrolysen fremmes af syre og ved opvarmning. S // H 3 C-C + 2 H 2 O 6 H 2 S(g) + NH CH 3 COO - \ NH 2 Thioacetamid kan derfor anvendes som fældningsmiddel i stedet for hydrogensulfid. I et reagensglas med krave blandes 1 dråbe kobber(ii)nitrat (0,1 M) med 8 dråber vand og 1 dråbe thioacetamid (1 M). Glasset lukkes med en prop, som fastgøres med en klemme, og der varmes på vandbad, til der sker en udfældning af kobber(ii)sulfid. I et andet tilsvarende glas blandes 1 dråbe kobber(ii)nitrat (0,1 M) med 7 dråber vand, 1 dråbe saltsyre (4 M) og 1 dråbe thioacetamid (1 M). Glasset tilproppes som ovenfor og varmes på vandbad, til kobber(ii)sulfid udfældes. Bemærk forskellen mellem fældningshastighederne i de to forsøg. Begge glas køles på is, før de åbnes i stinkskab.
20 18 Sulfitionen, SO Syrer. Ved tilsætning af stærke syrer til faste sulfiter og koncentrerede opløsninger af sulfiter sker en synlig udvikling af svovldioxid. Hvis den frigjorte svovldioxid ledes ned i en opløsning af bariumhydroxid, fældes et syreopløseligt bundfald af bariumsulfit, BaSO 3. SO H + 6 SO 2 (g) + H 2 O SO 2 (g) + Ba OH -6 BaSO 3 (s) + H 2 O Det udfældede bundfald af bariumsulfit kan oxideres af triiodid, til syreuopløseligt bariumsulfat, BaSO 4. BaSO 3 (s) + I H 2 O 6 BaSO 4 (s) + 2 H+ + 3 I - I et reagensglas (I) anbringes 3 dråber natriumsulfit (0,1 M) og 3 dråber vand. Glasset sættes til køling på is. I et andet reagensglas (II) anbringes 5 dråber bariumhydroxid (0,2 M). Carbondioxid-røret monteres på gasprøveapparatet, som forbindes med lufttilledningen. Til reagensglas (I) sættes nu 4-6 dr. fort. saltsyre (4 M). Herefter monteres glasset hurtigt på gasprøveapparatet, og carbondioxid-røret neddyppes i bariumhydroxidopløsningen (glas II). Der ledes nu en svag luftstrøm gennem systemet samtidigt med, at reagensglas (I) varmes på vandbadet. Efter nogle minutters forløb afbrydes gennemluftningen. Det udfældede bundfald af bariumsulfit vaskes med vand, og der tilsættes dråbevis og under omrystning kaliumtriiodid (0,05 M iod i 0,3 M kaliumiodid), til der fremkommer en blivende brunfarvning. Det nye bundfald af bariumsulfat udvaskes med vand, og det konstateres, at det ikke går i opløsning i 4 M saltsyre. 2. Bariumchlorid. Sulfitioner fældes af bariumioner som et hvidt, syreopløseligt bundfald af BaSO Sølvnitrat. Sulfitioner fældes af sølvioner som et hvidt bundfald af Ag 2 SO Oxiderende reagenser. Sulfitioner oxideres til sulfationer af iod (jf. ovenfor).
21 19 Sulfationen, SO Bariumchlorid. Bariumioner fælder sulfationer som et hvidt, finkrystallinsk bundfald af BaSO 4. Sulfatet er stort set ikke opløseligt i mineralsyrer og adskiller sig herved fra andre tungtopløselige bariumsalte. Ba 2+ + SO 4 2- º BaSO 4 (s) Ba 2+ + HSO 4 - º BaSO 4 (s) + H + Til 1 dråbe natriumsulfat (0,1 M) sættes 1 dråbe fort. saltsyre (4 M) og 2 dråber bariumchlorid (0,1 M). Der varmes på vandbad og centrifugeres. Bundfaldet behandles med nogle dråber konc. saltsyre (12 M). 2. Strontiumchlorid. Strontiumioner fælder sulfationer som et hvidt bundfald af SrSO 4. Sulfatet er opløseligt i mineralsyrer og fældes kun, hvis [H + ] er mindre end 0,1 M. 3. Blynitrat. Blyioner fælder sulfationer som et hvidt, tungt bundfald af PbSO 4. Sulfatet er opløseligt både i salpetersyre og i stærk base, det sidste på grund af kompleksdannelse. Pb 2+ + SO 4 2- º PbSO 4 (s) PbSO 4 (s) + 3 OH - º Pb(OH) SO 4 2-
22 20 Halogenerne. Cl, Br, I Chlor Chloridionen, Cl - 1. Sølvnitrat. Chloridioner fældes i neutral og sur væske som et hvidt bundfald af sølvchlorid, AgCl. Det udfældede bundfald koagulerer ved opvarmning og tilsætning af sølvnitrat i overskud. Sølvchlorid kan opløses i opløsninger indeholdende kompleksdannende ligander som ammoniak, chlorid, cyanid og thiosulfat. Ammoniakkoncentrationen i en 1 M opløsning af ammoniumcarbonat er tilstrækkelig høj til at opløse AgCl, men ikke AgBr eller AgI. Hvis der derfor til en opløsning af sølvchlorid i ammoniumcarbonat sættes én dråbe kaliumbromid, vil der straks ske en udfældning af AgBr. Ag + + Cl - º AgCl(s) NH CO 3 2- º NH 3 + HCO 3 - AgCl(s) + 2 NH 3 º [Ag(NH 3 ) 2 ] + + Cl - [Ag(NH 3 ) 2 ] + + Br - º AgBr(s) + 2 NH 3 Til 1 dråbe kaliumchlorid (0,1 M) sættes 2 dråber fort. salpetersyre (4 M) og 2 dråber sølvnitrat (0,1 M). Der varmes, til bundfaldet har samlet sig fuldstændigt. Efter fracentrifugering af bundfaldet vaskes dette omhyggeligt, først 2 gange med 5-10 dråber fort. salpetersyre (4 M) under opvarmning, derpå 2 gange med koldt vand. Til det udvaskede bundfald sættes derefter 10 dråber ammoniumcarbonat (1 M). Efter omhyggelig omrøring (uden opvarmning) i ca. 5 minutter centrifugeres. Til centrifugatet sættes 1 dråbe kaliumbromid (0,1 M). Væsken bliver nu straks hvid og komplet uigennemsigtig. Gem prøven til sammenligning med den tilsvarende reaktion under brom.
23 2. Oxiderende reagenser. Generelt virker konc. saltsyre ofte reducerende under dannelse af chlor. Chloridioner oxideres kun langsomt til frit chlor af et stærkt oxidationsmiddel som permanganationen i kold, svagt sur opløsning. Derimod sker der en oxidation i varm, stærkt sur opløsning Cl MnO H Cl 2 (g) + 2 Mn H 2 O Til 1 dråbe kaliumchlorid (0,1 M) sættes 2 dråber vand, 1 dråbe fort. svovlsyre (2 M) og, med kapillarpipette, 1 dråbe kaliumpermanganat (0,02 M). Efter henstand et par minutter tilsættes 3-4 dråber fort. svovlsyre (2 M), og der varmes på vandbad, til opløsningen er affarvet. Bromidionen, Br - Brom 1. Sølvnitrat. Bromidioner fældes i neutral og sur væske af sølvioner som et hvidt eller hvidgult bundfald af sølvbromid, AgBr. Det udfældede sølvbromid opløses i konc. ammoniak, i opløsninger af kaliumcyanid og i thiosulfatopløsninger. I ammoniumcarbonat opløses kun en ringe mængde. Ag + + Br - º AgBr(s) AgBr(s) + 2 NH 3 º [Ag(NH 3 ) 2 ] + + Br - AgBr(s) + 2 S 2 O 3 2- º [Ag(S 2 O 3 ) 2 ] 3- + Br - Til 1 dråbe kaliumbromid (0,1 M) sættes 2 dråber fort. salpetersyre (4 M) og 2 dråber sølvnitrat (0,1 M). Der varmes, til bundfaldet har samlet sig fuldstændigt. Derpå udvaskes bundfaldet som beskrevet for AgCl, og det ekstraheres derefter på samme vis med 10 dråber ammoniumcarbonat (1 M). Til centrifugatet sættes 1 dråbe kaliumbromid (0,1 M), og det iagttages, hvorledes der fremkommer en uklarhed, som dog ikke gør opløsningen uigennemsigtig. Sammenlign med den tilsvarende reaktion under chlor. Remanensen fra ekstraktionen behandles med konc. ammoniak (12 M), hvorefter der centrifugeres. Til det fremkomne centrifugat sættes salpetersyre (4 M) til sur reaktion.
24 22 2. Oxiderende reagenser. Bromidioner oxideres let til frit brom af kaliumpermanganat i svovlsur væske. Det dannede brom kan udrystes i trichlorethan med gulbrun farve. 10 Br MnO H Br Mn H 2 O Til 1 dråbe kaliumbromid (0,1 M) sættes 2 dråber vand og 1 dråbe fort. svovlsyre (2 M). Med kapillarpipette tilsættes kaliumpermanganat (0,02 M) dråbevis, til rødfarvningen er blivende. Nu tilsættes 2-3 dråber trichlorethan, og opløsningen omrystes. Der tilsættes derpå en enkelt dråbe hydrogenperoxid (1 M) for at fjerne brunsten og overskud af permanganat. Den organiske fase er farvet tydeligt gulbrun. Bromidioner oxideres ikke til brom af jern(iii), men alle bromider med undtagelse af AgBr oxideres af konc. salpetersyre. 6 Br NO H Br NO(g) + 4 H 2 O Iodidionen, I - Iod 1. Sølvnitrat. Iodidioner fældes i neutral eller sur væske af sølvioner som et gult bundfald af sølviodid, AgI. Det udfældede sølviodid kan hverken opløses i ammoniumcarbonat eller konc. ammoniak, men i opløsninger af kalimcyanid eller natriumthiosulfat. Iodidionerne kan også frigøres ved reduktion af sølv(i) med zink i svovlsyre. Ag + + I - º AgI(s) 2 AgI(s) + Zn(s) 6 2 Ag(s) + Zn I - Til 2 dråber kaliumiodid (0,1 M) sættes 4 dråber fort. salpetersyre (4 M) og 4 dråber sølvnitrat (0,1 M). Der varmes, til det gule bundfald har sat sig. Dette udvaskes som beskrevet for AgCl. Til bundfaldet sættes lidt zink og 2-3 dråber fort. svovlsyre (2 M). Der varmes under god omrystning i ca. 5 minutter, hvorpå der centrifugeres. Væsken, som indeholder iodidioner, overføres til et andet reagensglas og benyttes i det næste forsøg.
25 2. Oxiderende reagenser. De svage og middelstærke oxidationsmidler jern(iii), kobber(ii) og hydrogenperoxid er i fort. svovlsur væske i stand til at oxidere iodid til frit iod uden samtidig at oxidere bromid til frit brom. Det dannede iod kan udrystes i trichlorethan med violet farve. 2 I Fe 3+ 6 I Fe2+ 23 Til opløsningen fra det foregående forsøg sættes 2 dråber jern(iii)sulfat (0,25 M i 0,1 M svovlsyre). Derefter tilsættes 2-3 dråber trichlorethan, og der omrystes. Den organiske fase er farvet violet. Efter forsøget destilleres både iod og trichlorethan af på vandbadet i stinkskabet. De stærke oxidationsmidler som chlor, kaliumpermanganat, konc. salpetersyre og konc. svovlsyre oxiderer både bromider og iodider til henholdsvis brom og iod. Overskud af nogle af disse oxidationsmidler kan oxidere iodid til iodat(v).
26 24 Alkalimetallerne. Li, Na, K Grundstofferne i det periodiske systems gruppe 1, alkalimetallerne (her kun Li, Na og K) påvises lettest ved flammefotometri. Ved denne metode sprøjtes en vandig opløsning af metalionerne (som her kun optræder i oxidationstrinet +1) ind i en flamme, hvorved en del af dem omdannes til gasformige uladede atomer. Ved den høje temperatur anslås nogle af disse atomer og udsender lys (emission) ved tilbagefald til grundtilstanden i form af et for grundstoffet karakteristisk liniespektrum (Li rødt, Na gult og K violet lys). Ved at måle emissionsintensiteten, som er proportional med metalionkoncentrationen i opløsningen, får man derfor både en kvalitativ og en kvantitativ bestemmelse af grundstoffet.
27 25 Fast stofprøve. B; C; N, P; S; Cl, Br, I; Li, Na, K Den udleverede faste stofprøve er en blanding af alkali- og ammoniumsalte, indeholdende et udvalg af forbindelser af B; C; N, P; S; Cl, Br, I; Li, Na, K. De påvises som anvist nedenfor, idet der startes med halogenerne. Bor (i borater/borsyre). Boratrøret, som er et tungtsmelteligt glasrør, som er trukket ud i en spids, anbringes i gasprøveapparatet. I et reagensglas blandes 10 mg analyseblanding med 5 dr. konc. svovlsyre. Efter afkøling tilsættes ca. 20 dr. methanol, hvorefter glasset anbringes i gasprøveapparatet. Hurtigt efter ledes en svag luftstrøm gennem apparatet samtidig med, at en flamme (f.eks. fra en mikrobrænder) holdes foran boratrørets spids. Hvis analysen indeholder bor, vil de antændte dampe, til forskel fra ren methanol, brænde med en grøn flamme: B(OH) CH 3 OH 6 B(OCH 3 ) 3 (g) + 3 H 2 O Carbon (i carbonat/hydrogencarbonat). I et reagensglas (I) anbringes 10 mg stofprøve opløst eller opslemmet i 4-5 dr. vand. Glasset køles på is. I et andet glas (II) anbringes 5 dr. bariumhydroxid (0,2 M). Et CO 2 -rør monteres på det til lufttilledningen tilsluttede gasprøveapparat. Til reagensglas (I) sættes nu 4-6 dr. fort. saltsyre (4 M). Herefter monteres glasset hurtigt på gasprøveapparatet, og carbondioxidrørets spids neddyppes i bariumhydroxidopløsningen. Der pumpes nu en svag luftstrøm gennem systemet samtidig med, at reagensglas (I) varmes på vandbadet. Et hvidt bundfald af kendelig størrelse i reagensglas (II) viser carbonat i prøven. Bundfaldet skal fremkomme allerede efter få minutters gennembobling (der vil fremkomme et svagt bundfald bare fra carbondioxiden i den tilledte luft: Sammenlign med en blindprøve uden carbonat): CO H + 6 CO 2 (g) + H 2 O CO 2 (g) + 2 OH - + Ba 2+ 6 BaCO 3 (s) + H 2 O
28 26 Nitrogen (i ammoniak/ammonium eller nitrat). Ammoniak/ammonium. Til ca. 10 mg analyse sættes 2 dr. natriumhydroxid (2 M). Glasset anbringes i gasprøveapparatet, hvorpå et carbondioxidrør, som holdes neddyppet i et reagensglas med 2 dr. vand og 1 dr. phenolphtaleinopløsning, også er monteret. Ved hjælp af vandbad og lufttilførsel bringes den eventuelle ammoniak over i det rene vand, hvor det vil give sig til kende ved indikatorens farveskift. Nitrat. Hvis reaktionen for ammoniak er positiv, fjernes al ammoniak, som ellers vil give fejlreaktion, således: Til 10 mg stofprøve, opslemmet eller opløst i 1 dr. vand, sættes 2 dr. natriumhydroxid. Den frigivne ammoniak fjernes under luftgennembobling i nogle minutter. Til opløsningen eller opslemningen sættes derpå lidt zink og saltsyre (4 M) til sur reaktion. Der varmes i nogle minutter: NO Zn(s) + 10 H 6 + NH Zn H 2 O Efter afkøling tilsættes overskud af natriumhydroxid (2 M), og ammoniakken påvises som beskrevet ovenfor. Nitrat kan også påvises som Fe(NO) 2+ (denne påvisning generes af farvede ioner og af iodid): Til 10 mg analyse i 1 dr. vand sættes 1 dr. saltsyre (0,5 M) og 6 dr. konc. svovlsyre. Efter afkøling lægges 2 dr. jern(ii)sulfat (0,5 M) forsigtigt oven på overfladen ved at lade det løbe ned langs reagensglassets indvendige side. Nitrat vil da give anledning til dannelsen af en smal brunsort zone i grænselaget: NO Fe H + 6 Fe(NO) Fe H 2 O Phosphor (i phosphat/hydrogenphosphat/dihydrogenphosphat). Ca. 10 mg analyse opløses i 1 dr. salpetersyre (4 M) i stinkskab. Der varmes på vandbad i 2 min under nitrogengennembobling. I et andet reagensglas varmes 5 dr. ammoniummolybdat (0,5 M i 4 M salpetersyre) ved kortvarig neddypning i vandbadet, hvorefter der med en kapillarpipette tilsættes en ringe mængde af den førstnævnte blanding. Et gult bundfald beviser tilstedeværelsen af phosphat: H 3 PO H 2 MoO NH 4 +6 (NH 4 ) 3 [P(Mo 3 O 10 ) 4 ] + 3 H H 2 O Svovl (i sulfat/hydrogensulfat). Ca. 5 mg analyse opløses i 1 dr. saltsyre (4 M) og 1 dr. vand ved opvarmning. 2 dr. bariumchlorid (0,1 M) tilsættes. Fremkomsten af et hvidt bundfald angiver tilstedeværelsen af sulfat: Ba HSO º 4 BaSO 4 (s) + H +
29 27 Halogenerne chlor, brom og iod (som chlorid, bromid og iodid). Ca. 25 mg analyse behandles med 4-5 dr. vand og 2 dr. salpetersyre (4 M). Der centrifugeres, og til centrifugatet sættes sølvnitrat (0,1 M) i overskud, som ikke skal være for stort. Ved tilstedeværelsen af halogener dannes nu et bundfald, som samler sig ved opvarmning. Ved tilsætning af yderligere 1 dr. sølvnitrat prøves for overskud af sølvion (intet nyt bundfald): Ag + + X - º AgX(s) X = Cl,Br,I Når bundfaldet har samlet sig helt, centrifugeres. Bundfaldet udvaskes omhyggeligt i varmen flere gange med salpetersyre (4 M), til det sidste hold vaskevæske viser negativ reaktion for sølvion (dette prøves på vaskecentrifugatet med 1 dr. 4 M saltsyre, og hvis der her kommer bundfald, må udvaskningen fortsættes). Efter udvaskningen med salpetersyre udvaskes bundfaldet 2 gange med koldt vand, hvorefter dette sølvhalogenidbundfald undersøges for chlor, brom og iod som følger: Bundfaldet behandles omhyggeligt i 3-4 min og under god omrøring med 10 dr. ammoniumcarbonat (1 M). Blandingen holdes herunder isafkølet. Ammoniakkoncentrationen i ammoniumcarbonat er tilstrækkelig til at opløse sølvchlorid, men ikke sølvbromid eller det tungest opløselige sølviodid: AgCl(s) + 2 NH 3 º [Ag(NH 3 ) 2 ] + + Cl - Centrifugering. Bundfaldet undersøges for brom og iod (a), og centrifugatet tilsættes 1 dr. kaliumbromid (0,1 M). Hvis opløsningen herved bliver fuldstændig uigennemsigtig mælket, er tilstedeværelsen af chlor påvist: [Ag(NH 3 ) 2 ] + + Br - º AgBr(s) + 2 NH 3 Tilstedeværelsen af brom i analysen eller ufuldstændig udvaskning af sølvhalogenidbundfaldet vil altid fremkalde en uklarhed i opløsningen. a. Til bundfaldet fra behandlingen med ammoniumcarbonat sættes lidt zink og 2 dr. svovlsyre (2 M). Der varmes under omrystning i et par minutter: 2 AgX(s) + Zn(s) 6 2 Ag(s) + 2 X- + Zn 2+ X = (Cl,)Br,I Der centifugeres, og til centrifugatet sættes 4 dr. jern(iii)sulfat (0,25 M i 0,1 M svovlsyre) og 3 dr. trichlorethan. Hvis den organiske fase efter omrystning farves violet, er iod påvist: 2 I Fe 3+ 6 I Fe2+ Inden påvisningen af brom må evt. iod fjernes ved opvarmning under luftgennembobling i stinkskab. Herefter tilsættes opløsningen dråbevis kaliumpermanganat (0,02 M), til opløsningen antager et svagt rødligt skær. Der udrystes derpå med trichlorethan (3 dr.). Overskud af permanganat og et evt. bundfald af brunsten fjernes med 1 dr. hydrogenperoxid (1 M). Hvis brom er til stede, vil den organiske fase være farvet gul - gulbrun: 10 Br MnO H Br Mn H 2 O
30 28 Alkalimetallerne lithium, natrium og kalium. Li +, Na + og K + påvises flammefotometrisk. Ca. 25 mg prøve behandles under opvarmning med 4 dr. vand. Der centrifugeres, og hvis centrifugatet er basisk, indstilles dets ph til ca. 7 ved hjælp af fort. saltsyre. Endelig fyldes reagensglasset helt op med vand. Den homogene (vel omrørte) og klare (centrifugerede) opløsning kan derpå analyseres med flammefotometer for lithium (rød flammefarve), natrium (gul flammefarve) og kalium (violet flammefarve). Kommentarer Påvisninger. Ved påvisningerne bemærkes den grønne flammefarve af det flygtige trimethylborat, B(OCH 3 ) 3, den ofte synlige CO 2 -gasudvikling, når CO 3 2- eller HCO 3 - behandles med syre og dannelsen af BaCO 3 -bundfald, når CO 2 ledes ned i Ba(OH) 2 -opløsning. NH 4 + eller komplekst bundet NH 3 (ikke for robust) frigøres med stærk base som NH 3, og kan som sådan påvises efter afgasning ved sin basiske karakter. NO 3 - kan påvises på samme måde efter reduktion til NH 4 + med metallisk zink eller som Fe(NO) 2+ (brun). Det gule (NH 4 ) 3 [P(Mo 3 O 10 ) 4 ] er et eksempel på et såkaldt heteropolymolybdat, hvor heteroatomet, P, er tetraedrisk omgivet af fire O-atomer (som i PO 4 3- ) i et hulrum dannet af omgivende Mo VI O 6 -oktaedre. SO 4 2- og HSO 4 - påvises i 1 M saltsyre som BaSO 4. Ved påvisningen af Cl -, Br - og I - bemærkes de tungtopløselige sølv(i)halogenider, som har faldende opløselighed og stigende gulfarvning ned gennem gruppen, og som er lysfølsomme (de udskiller frit sølv). Halogenidionerne kan fra disse forbindelser bringes i opløsning ved reduktion af sølv(i) med metallisk zink i syre, og det lettest opløselige sølvhalogenid, AgCl, kan også opløses i (NH 4 ) 2 CO 3, hvorefter Cl - kan påvises ved fældning af AgBr i en sådan opløsning. Den faldende elektronegative karakter ned gennem gruppe 17 udnyttes ved påvisningen af Br - og I -. Således er det kun I -, der af Fe 3+ kan oxideres til frit toatomig halogen, I 2, medens MnO 4 - kan gøre det for dem alle tre (Cl - dog kun varmt). De fri halogener, som har faldende flygtighed ned gennem gruppen, er opløselige i vand og især i upolære organiske solventer, Br 2 og I 2 med gulbrune farver, I 2 dog med sin violette egenfarve i ikke-oxygenholdige svagt bindende solventer (f.eks. CCl 4 eller C 2 H 3 Cl 3 ). For alkalimetallerne Li, Na og K gælder, at selvom der findes enkelte tungtopløselige forbindelser af disse (f.eks. er natriumantimonat, Na[Sb(OH) 6 ], tungtopløseligt), som kan benyttes i analysen, så benyttes her en instrumentel metode (flammfotometri). Disse metaller er blandt de mest følsomme hvad angår emission fra gasformige atomer, specielt natrium, som selv i meget små koncentrationer farver en flamme gul.
31
DET PERIODISKE SYSTEM
 DET PERIODISKE SYSTEM Tilpasset efter Chemistry It s Elemental! Præsentation fra the American Chemical Society, Aug. 2009 http://portal.acs.org/portal/publicwebsite/education/outreach/ncw/studentseducators/cnbp_023211
DET PERIODISKE SYSTEM Tilpasset efter Chemistry It s Elemental! Præsentation fra the American Chemical Society, Aug. 2009 http://portal.acs.org/portal/publicwebsite/education/outreach/ncw/studentseducators/cnbp_023211
Kemirapport 5. Henning hvp@inano.dk 20031325. 13. december 2004
 Kemirapport 5 Henning hvp@inano.dk 20031325 13. december 2004 Vi får fem ukendte stoffer udleveret, og vi skal identificere hvert af dem ved hjælp af metoderne fra øvelserne 1-4. Vi har en liste med mulige
Kemirapport 5 Henning hvp@inano.dk 20031325 13. december 2004 Vi får fem ukendte stoffer udleveret, og vi skal identificere hvert af dem ved hjælp af metoderne fra øvelserne 1-4. Vi har en liste med mulige
Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron. En hydron er en H +
 Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron En hydron er en H + Ved en syrebasereaktion overføres der en hydron fra en syre til en base En syre indeholder
Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron En hydron er en H + Ved en syrebasereaktion overføres der en hydron fra en syre til en base En syre indeholder
Syrer, baser og salte
 Syrer, baser og salte Navn: Indholdsfortegnelse: Ion begrebet... 2 Ætsning af Mg bånd med forskellige opløsninger... 5 Elektrolyse af forskellige opløsninger... 7 Påvisning af ioner i forskellige opløsninger
Syrer, baser og salte Navn: Indholdsfortegnelse: Ion begrebet... 2 Ætsning af Mg bånd med forskellige opløsninger... 5 Elektrolyse af forskellige opløsninger... 7 Påvisning af ioner i forskellige opløsninger
IONER OG SALTE. Et stabilt elektronsystem kan natrium- og chlor-atomerne også få, hvis de reagerer kemisk med hinanden:
 IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
Skriftlig prøve i kursus 26173/F14 Side 1 af 15 UORGANISK KEMI Torsdag den 22. maj 2014
 Skriftlig prøve i kursus 26173/F14 Side 1 af 15 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for He, Se, Cr 3+ og F. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Skriftlig prøve i kursus 26173/F14 Side 1 af 15 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for He, Se, Cr 3+ og F. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Uorganisk kemi - Kemisk ligevægt
 Vejledning til laboratorieøvelser Uorganisk kemi - Kemisk ligevægt Navn: Revision 2011 Kemisk Institut Århus Universitet Rita Hazell & J.-E. Jørgensen 2 Uorganisk kemi - kemisk ligevægt Formålet med dette
Vejledning til laboratorieøvelser Uorganisk kemi - Kemisk ligevægt Navn: Revision 2011 Kemisk Institut Århus Universitet Rita Hazell & J.-E. Jørgensen 2 Uorganisk kemi - kemisk ligevægt Formålet med dette
10. juni 2016 Kemi C 325
 Grundstoffer og Det Periodiske System Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Forklar hvad der forstås med begrebet grundstoffer kontra kemiske forbindelser. Atomer er placeret
Grundstoffer og Det Periodiske System Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Forklar hvad der forstås med begrebet grundstoffer kontra kemiske forbindelser. Atomer er placeret
Syrer, baser og salte
 Molekyler Atomer danner molekyler (kovalente bindinger) ved at dele deres elektroner i yderste elektronskal. Dette sker for at opnå en stabil tilstand. En stabil tilstand er når molekylerne på nogle tidspunkter
Molekyler Atomer danner molekyler (kovalente bindinger) ved at dele deres elektroner i yderste elektronskal. Dette sker for at opnå en stabil tilstand. En stabil tilstand er når molekylerne på nogle tidspunkter
maj 2017 Kemi C 326
 Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Skriftlig prøve i kursus 26173/E14 Side 1 af 14 UORGANISK KEMI Fredag den 19. december 2014
 Skriftlig prøve i kursus 26173/E14 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for O, Al, Fe 3+ og Br. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Skriftlig prøve i kursus 26173/E14 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for O, Al, Fe 3+ og Br. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Skriftlig prøve i kursus 26173/E12 Side 1 af 14 UORGANISK KEMI Tirsdag den 18. december 2012
 Skriftlig prøve i kursus 26173/E12 Side 1 af 14 Opgave 1. 1.1 Angiv elektronkonfigurationer for N, Al 3+, Mn og Zn 2+. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for Ne 2. 4 % b) Angiv
Skriftlig prøve i kursus 26173/E12 Side 1 af 14 Opgave 1. 1.1 Angiv elektronkonfigurationer for N, Al 3+, Mn og Zn 2+. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for Ne 2. 4 % b) Angiv
Skriftlig prøve i kursus 26173/E15 Side 1 af 14 UORGANISK KEMI Fredag den 18. december 2015
 Skriftlig prøve i kursus 26173/E15 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for C, P, Zn 2+ og I. 2% 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Skriftlig prøve i kursus 26173/E15 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for C, P, Zn 2+ og I. 2% 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Bestem en jordprøves surhedsgrad, ph-værdien, med en Rapitest.
 Jordbundsanalyse ph Bestem en jordprøves surhedsgrad, ph-værdien, med en Rapitest 31 21 - Vejledning til Rapitest Læs vejledningen fra Rapitesten: Nu er det let at forbedre sin have med den nye Rapitest
Jordbundsanalyse ph Bestem en jordprøves surhedsgrad, ph-værdien, med en Rapitest 31 21 - Vejledning til Rapitest Læs vejledningen fra Rapitesten: Nu er det let at forbedre sin have med den nye Rapitest
Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold
 Københavns Universitet Saxkøbing, Vintermøde Roedyrkning: Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold Søren Husted, 5 Februar, 2019 Agenda: 9:35 10:15 De essentielle næringsstoffer og roedyrkning
Københavns Universitet Saxkøbing, Vintermøde Roedyrkning: Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold Søren Husted, 5 Februar, 2019 Agenda: 9:35 10:15 De essentielle næringsstoffer og roedyrkning
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler
 Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse:
 Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
Kemiforsøg til teorihæftet Kemisk binding og elektrolyse Forsøg 1.
 Forsøg 1. At undersøge forskellen på rene stoffer og blandinger. 500 ml. bægerglas Magnet Tragt Filterpapir Kniv Stearinlys Sand Jernfilspåner Snit stearinlyset i småstykker med kniven, og bland stearin,
Forsøg 1. At undersøge forskellen på rene stoffer og blandinger. 500 ml. bægerglas Magnet Tragt Filterpapir Kniv Stearinlys Sand Jernfilspåner Snit stearinlyset i småstykker med kniven, og bland stearin,
1. OPVARMNING AF NATRIUMHYDROGENCARBONAT
 1. OPVARMNING AF NATRIUMHYDROGENCARBONAT At undersøge hvilken kemisk reaktion, der finder sted ved opvarmning af natriumhydrogencarbonat. Natriumhydrogencarbonat (natron) har formlen NaHCO 3 og er et fast
1. OPVARMNING AF NATRIUMHYDROGENCARBONAT At undersøge hvilken kemisk reaktion, der finder sted ved opvarmning af natriumhydrogencarbonat. Natriumhydrogencarbonat (natron) har formlen NaHCO 3 og er et fast
Test din viden E-forløb
 OPGAVE E8 Test din viden E-forløb Har du styr på E-forløbets kernestof? Nu har du lært en masse om spændingsrækken og redoxreaktioner. Ved at lave opgaverne nedenfor finder du ud af, om der er nogle områder,
OPGAVE E8 Test din viden E-forløb Har du styr på E-forløbets kernestof? Nu har du lært en masse om spændingsrækken og redoxreaktioner. Ved at lave opgaverne nedenfor finder du ud af, om der er nogle områder,
Uorganisk kemi. HF HCl HBr HI Hydrogenchlorid 10/27/2009. Halogener. H F Cl Br I. Forekomst.87%.07% 1.4% 2.5ppm.3ppm
 Halogener 15.09.09 3 1 Noter 7 H F Cl Br I Forekomst.87%.07% 1.% 2.5ppm.3ppm Ionisationsenergi 1312 1681 125 113 1009 /kjmol 1 (cf.) 517(Li) 93(Na) 16(K) 01(Rb) 373(Cs) Elektronaffinitet 72 333 39 325
Halogener 15.09.09 3 1 Noter 7 H F Cl Br I Forekomst.87%.07% 1.% 2.5ppm.3ppm Ionisationsenergi 1312 1681 125 113 1009 /kjmol 1 (cf.) 517(Li) 93(Na) 16(K) 01(Rb) 373(Cs) Elektronaffinitet 72 333 39 325
Kemiøvelser (til læreren)
 Fra ressourceforbandelse til grøn omstilling Kemiøvelser (til læreren) Udviklet af Kjeld Lundgaard, kemilærer på Ingrid Jespersens Gymasieskole Lærervejledning & kommentarer til forsøgene Nedenstående
Fra ressourceforbandelse til grøn omstilling Kemiøvelser (til læreren) Udviklet af Kjeld Lundgaard, kemilærer på Ingrid Jespersens Gymasieskole Lærervejledning & kommentarer til forsøgene Nedenstående
Kemi Kulhydrater og protein
 Kemi Kulhydrater og protein Formål: Formålet med forsøget er at vise hvordan man kan påvise protein, fedtstof, simple sukkerarter eller stivelse i forskellige fødevarer. Samtidig kan man få en fornemmelse
Kemi Kulhydrater og protein Formål: Formålet med forsøget er at vise hvordan man kan påvise protein, fedtstof, simple sukkerarter eller stivelse i forskellige fødevarer. Samtidig kan man få en fornemmelse
Øvelser 10. KlasseCenter Vesthimmerland
 Indholdsfortegnelse Sådan kan du påvise ilt (O 2 )... 2 Sådan kan du påvise CO 2... 3 Sådan kan du påvise SO 2... 4 Sådan kan røg renses for SO 2... 5 Sammenligning af indåndings- og udåndingsluft....
Indholdsfortegnelse Sådan kan du påvise ilt (O 2 )... 2 Sådan kan du påvise CO 2... 3 Sådan kan du påvise SO 2... 4 Sådan kan røg renses for SO 2... 5 Sammenligning af indåndings- og udåndingsluft....
KVANTITATIV ANALYSE Peter Andersen og Ole Mønsted Kemisk Institut Københavns Universitet 2004
 KVANTITATIV ANALYSE Peter Andersen og Ole Mønsted Kemisk Institut Københavns Universitet 2004 Denne udgivelse er en introduktion til elementær kvantitativ analyse som beskrevet i bogen "Grundlæggende
KVANTITATIV ANALYSE Peter Andersen og Ole Mønsted Kemisk Institut Københavns Universitet 2004 Denne udgivelse er en introduktion til elementær kvantitativ analyse som beskrevet i bogen "Grundlæggende
Er dit reaktionsskema afstemt? Dvs. undersøg for hvert grundstof, om der er lige mange atomer af grundstoffet før reaktionen som efter reaktionen.
 7.12 Bagning med hjortetaksalt I skal undersøge, hvilke egenskaber bagepulveret hjortetaksalt har. Hjortetaksalt bruges i bagværk som kiks, klejner, brunkager m.m. Saltet giver en sprødhed i bagværket.
7.12 Bagning med hjortetaksalt I skal undersøge, hvilke egenskaber bagepulveret hjortetaksalt har. Hjortetaksalt bruges i bagværk som kiks, klejner, brunkager m.m. Saltet giver en sprødhed i bagværket.
Der er noget i luften Ny Prisma Fysik og kemi 9 - kapitel 6 Skole: Navn: Klasse:
 Der er noget i luften Ny Prisma Fysik og kemi 9 - kapitel 6 Skole: Navn: Klasse: Opgave 1 Gasserne nitrogen, oxygen og kuldioxid er de gasser i Jordens atmosfære, der er vigtigst for livet. Angiv hvilke
Der er noget i luften Ny Prisma Fysik og kemi 9 - kapitel 6 Skole: Navn: Klasse: Opgave 1 Gasserne nitrogen, oxygen og kuldioxid er de gasser i Jordens atmosfære, der er vigtigst for livet. Angiv hvilke
Torben Rosenørn. Aalborg Universitet. Campus Esbjerg
 Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
Formål Ud fra en række udvalgte salte, skal man finde ud af om de er let- eller tungtopløselige i vand. Ved at blande saltene sammen med hinanden en f
 Saltes opløselighed i vand. Af: Ulrich Olsen 1e Tirsdag 11/9-2001 Formål Ud fra en række udvalgte salte, skal man finde ud af om de er let- eller tungtopløselige i vand. Ved at blande saltene sammen med
Saltes opløselighed i vand. Af: Ulrich Olsen 1e Tirsdag 11/9-2001 Formål Ud fra en række udvalgte salte, skal man finde ud af om de er let- eller tungtopløselige i vand. Ved at blande saltene sammen med
KORT SUMMARISK GENNEMGANG AF KEMIEN 2013.
 COPYRIGHT NIELS NORDHOLT 2000-2013 S. 1 KORT SUMMARISK GENNEMGANG AF KEMIEN 2013. Sætning, reaktion eller kort forsøgsbeskrivelse Ved en fysisk forandring omdannes stoffer ikke til andre stoffer. Ved en
COPYRIGHT NIELS NORDHOLT 2000-2013 S. 1 KORT SUMMARISK GENNEMGANG AF KEMIEN 2013. Sætning, reaktion eller kort forsøgsbeskrivelse Ved en fysisk forandring omdannes stoffer ikke til andre stoffer. Ved en
Platin komplekser i kampen mod kræft. Koordinationskemi i aktion. cis-ptcl 2 (NH 3 ) 2. Essentiel, nyttig eller toxisk. Hvad der faktisk skete
 Platin komplekser i kampen mod kræft et eksempel på Koordinationskemi i aktion Pt DNA DK 1 Har som den eneste vundet Tour de France syv gange (fra 1999 til 2005) Lance Armstrong blev vist født på en cykel
Platin komplekser i kampen mod kræft et eksempel på Koordinationskemi i aktion Pt DNA DK 1 Har som den eneste vundet Tour de France syv gange (fra 1999 til 2005) Lance Armstrong blev vist født på en cykel
Salte, Syre og Baser
 Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse 1 Stoffers blandbarhed og det periodiske system 2 Stoffers blandbarhed og elektronparbindingen 3 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse 1 Stoffers blandbarhed og det periodiske system 2 Stoffers blandbarhed og elektronparbindingen 3 Redoxreaktioner, spændingsrækken
Anvendt kemi 1 ekstraspørgsmål. Koncentration
 Anvendt kemi 1 ekstraspørgsmål Koncentration Til et kemiforsøg skal der fremstilles en række opløsninger af letopløselige salte. Udregn for hver af de følgende opløsninger, hvor mange gram af det aktuelle
Anvendt kemi 1 ekstraspørgsmål Koncentration Til et kemiforsøg skal der fremstilles en række opløsninger af letopløselige salte. Udregn for hver af de følgende opløsninger, hvor mange gram af det aktuelle
Eksamensspørgsmål til kecu eksamen tirsdag d. 3. juni og onsdag d. 4. juni 2014
 Eksamensspørgsmål til kecu eksamen tirsdag d. 3. juni og onsdag d. 4. juni 2014 Spørgsmål 1. og 15. Ionforbindelser og fældningsreaktioner, herunder øvelsen Saltes opløselighed i vand 2. og 16. Det periodiske
Eksamensspørgsmål til kecu eksamen tirsdag d. 3. juni og onsdag d. 4. juni 2014 Spørgsmål 1. og 15. Ionforbindelser og fældningsreaktioner, herunder øvelsen Saltes opløselighed i vand 2. og 16. Det periodiske
1. BESTEMMELSE AF KRYSTALVAND I KRYSTALSODA
 1. BESTEMMELSE AF KRYSTALVAND I KRYSTALSODA Formålet med denne øvelse er at bestemme indholdet af krystalvand i krystalsoda, som har den kemiske formel Na 2 CO 3 xh 2 O. Teori: En del ionforbindelser (salte)
1. BESTEMMELSE AF KRYSTALVAND I KRYSTALSODA Formålet med denne øvelse er at bestemme indholdet af krystalvand i krystalsoda, som har den kemiske formel Na 2 CO 3 xh 2 O. Teori: En del ionforbindelser (salte)
Aurum KEMI FOR GYMNASIET 2 KIM RONGSTED KRISTIANSEN GUNNAR CEDERBERG
 Aurum KEMI FOR GYMNASIET 2 KIM RONGSTED KRISTIANSEN GUNNAR CEDERBERG Opgave 4.8 Brug tabellen over styrkeeksponenter til at finde pk S og pk B for følgende amfolytter, og afgør i hvert tilfælde, om amfolytten
Aurum KEMI FOR GYMNASIET 2 KIM RONGSTED KRISTIANSEN GUNNAR CEDERBERG Opgave 4.8 Brug tabellen over styrkeeksponenter til at finde pk S og pk B for følgende amfolytter, og afgør i hvert tilfælde, om amfolytten
Sporgrundstof definition:
 Forelæsning Sporgrundstoffer: fordeling, substitution og klassifikation Forelæsning: Hvad er et sporgrundstof? Grundstoffers elektronkonfiguration og radius Det Periodiske System Goldschmidts regler for
Forelæsning Sporgrundstoffer: fordeling, substitution og klassifikation Forelæsning: Hvad er et sporgrundstof? Grundstoffers elektronkonfiguration og radius Det Periodiske System Goldschmidts regler for
Eksamensspørgsmål Kemi C, 2015, Kec124 (NB).
 Eksamensspørgsmål Kemi C, 2015, Kec124 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2015, Kec124 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, spændingsrækken
Emballage- og fyldningsvejledning
 Dunk 2,5 l 2,5 l dunk med rødt eller sort låg Diverse uorganiske Fyldes til kraven. Dunk 5 l 5 l dunk med rødt låg Diverse uorganiske Fyldes til kraven. 60 ml plastflaske PFAS 100 ml plastflaske 100 ml
Dunk 2,5 l 2,5 l dunk med rødt eller sort låg Diverse uorganiske Fyldes til kraven. Dunk 5 l 5 l dunk med rødt låg Diverse uorganiske Fyldes til kraven. 60 ml plastflaske PFAS 100 ml plastflaske 100 ml
Lokalenhed Midtjylland (MJL). Bilagsoversigt.
 Lokalenhed Midtjylland (MJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2
Lokalenhed Midtjylland (MJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2
Lokalenhed Storstrøm (STO). Bilagsoversigt.
 Lokalenhed Storstrøm (STO). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph Hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 )
Lokalenhed Storstrøm (STO). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph Hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 )
Lokalenhed Østjylland (OJL). Bilagsoversigt.
 Lokalenhed Østjylland (OJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2
Lokalenhed Østjylland (OJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2
Lokalenhed Fyn (FYN). Bilagsoversigt.
 Lokalenhed Fyn (FYN). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 ) dybde
Lokalenhed Fyn (FYN). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 ) dybde
Lokalenhed Sjælland (SJL). Bilagsoversigt.
 Lokalenhed Sjælland (SJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 )
Lokalenhed Sjælland (SJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 )
Skriftlig prøve i kursus 26173/E14 Side 1 af 16 UORGANISK KEMI Fredag den 19. december 2014
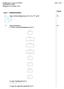 Skriftlig prøve i kursus 26173/E14 Side 1 af 16 pgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for, Al, e 3+ og Br. : [He]2s 2 2p 4 Al: [Ne]3s 2 3p 1 e 3+ : [Ar]3d 5 Br : [Kr] 1.2 Molekylorbitalteori.
Skriftlig prøve i kursus 26173/E14 Side 1 af 16 pgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for, Al, e 3+ og Br. : [He]2s 2 2p 4 Al: [Ne]3s 2 3p 1 e 3+ : [Ar]3d 5 Br : [Kr] 1.2 Molekylorbitalteori.
Miljøeffekter af energiproduktion
 Miljøeffekter af energiproduktion god ide at bruge de kemiske reaktionsligninger under Forbrænding og forsuring. Forud for laboratoriearbejdet er det en stor fordel hvis eleverne allerede ved hvordan el
Miljøeffekter af energiproduktion god ide at bruge de kemiske reaktionsligninger under Forbrænding og forsuring. Forud for laboratoriearbejdet er det en stor fordel hvis eleverne allerede ved hvordan el
Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse:
 Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse: Opgave 1 Et metal er kendetegnet ved, at nogle af metallets elektroner danner en elektrongas. Her er en række udsagn om, hvad et
Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse: Opgave 1 Et metal er kendetegnet ved, at nogle af metallets elektroner danner en elektrongas. Her er en række udsagn om, hvad et
Med forbehold for censors kommentarer. Eksamensspørgsmål Kemi C, 2014, Kec223 (NB).
 Med forbehold for censors kommentarer Eksamensspørgsmål Kemi C, 2014, Kec223 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer
Med forbehold for censors kommentarer Eksamensspørgsmål Kemi C, 2014, Kec223 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer
KOSMOS. 7.1 Spaltning af sukker. Materialer MADENS KEMI KEMISKE STOFFER I MADEN DISACCHARIDER
 KEMISKE STOFFER I MADEN DISACCHARIDER 7.1 Spaltning af sukker I skal undersøge, hvordan sukker spaltes ved kontakt med en syre. Almindelig hvidt sukker er et disaccharid. Det kan spaltes i to monosaccharider:
KEMISKE STOFFER I MADEN DISACCHARIDER 7.1 Spaltning af sukker I skal undersøge, hvordan sukker spaltes ved kontakt med en syre. Almindelig hvidt sukker er et disaccharid. Det kan spaltes i to monosaccharider:
Intro5uktion: I'" Acetylsalicylsyre. Salicylsyre
 Intro5uktion: H'11t frem til omkring 1850 var alle tilgængelige smertestillende midler "naturstoffer", dvs oftest ekstrakter fra planter eller dyr. Det første syntetisk fremstillede smertestillende stof
Intro5uktion: H'11t frem til omkring 1850 var alle tilgængelige smertestillende midler "naturstoffer", dvs oftest ekstrakter fra planter eller dyr. Det første syntetisk fremstillede smertestillende stof
ANALYSE AF FEDTINDHOLD I MADOLIE
 ANALYSE AF FEDTINDOLD I MADOLIE Ved denne øvelse bestemmes det gennemsnitlige antal dobbeltbindinger pr. fedtsyre og fedtstoffets middelmolmasse for en madolie. Supplerende baggrundsinformation om lipider
ANALYSE AF FEDTINDOLD I MADOLIE Ved denne øvelse bestemmes det gennemsnitlige antal dobbeltbindinger pr. fedtsyre og fedtstoffets middelmolmasse for en madolie. Supplerende baggrundsinformation om lipider
KEMISK IN STITUT ENHAVNS UNIVERS ITET KØB. estere. samt. ved GC
 H..C.ØRSTEDS UNGDMSLABRATRIUM KEMISK IN STITUT KØB ENHAVNS UNIVERS ITET Syntese og ekstraktion af naturlige estere samt identifikation ved GC Af Marc Cedenius Indhold Gran... 2 Syntese af Eddikesyre( )bornylester...
H..C.ØRSTEDS UNGDMSLABRATRIUM KEMISK IN STITUT KØB ENHAVNS UNIVERS ITET Syntese og ekstraktion af naturlige estere samt identifikation ved GC Af Marc Cedenius Indhold Gran... 2 Syntese af Eddikesyre( )bornylester...
Et fedtstofs iodtal. Problemstilling. Kapitel 2: Uorganisk kemi (iodometri) R 1 CH 2 O C R 2 O R 3. H + Br Br C C Br Br
 Et fedtstofs iodtal Kapitel 2: Uorganisk kemi (iodometri) Problemstilling Additionsreaktionen til dobbeltbindinger mellem -atomer, 8?7, kan vises ved addition af dibrom til et fedtstof. Reaktionen benyttes
Et fedtstofs iodtal Kapitel 2: Uorganisk kemi (iodometri) Problemstilling Additionsreaktionen til dobbeltbindinger mellem -atomer, 8?7, kan vises ved addition af dibrom til et fedtstof. Reaktionen benyttes
Opgave: Du skal udfylde de manglende felter ud fra den information der er givet
 pgave 1a.01 Brug af det periodiske system pgave: Du skal udfylde de manglende felter ud fra den information der er givet Eks: I rubrik 1 kendte vi grundstof nummeret (nr. 11). Ved brug af det periodiske
pgave 1a.01 Brug af det periodiske system pgave: Du skal udfylde de manglende felter ud fra den information der er givet Eks: I rubrik 1 kendte vi grundstof nummeret (nr. 11). Ved brug af det periodiske
Opgave. Navn Kemi opgaver Klasse Side 1 af 7. Hvad kaldes elementarpartiklerne, angiv deres ladning
 Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Kædens længde kan ligger mellem 10 og 14 carbonatomer; det mest almindelige er 12.
 Kemi laboratorieforsøg 9.2 Anioniske surfaktanter Anioniske surfaktanter er vaskeaktive stoffer, der har en hydrofob ende og en hydrofil ende. Den hydrofile ende er negativt ladet, dvs. en anion. Da der
Kemi laboratorieforsøg 9.2 Anioniske surfaktanter Anioniske surfaktanter er vaskeaktive stoffer, der har en hydrofob ende og en hydrofil ende. Den hydrofile ende er negativt ladet, dvs. en anion. Da der
Naturfag for skov- og gartnerholdet
 Naturfag for skov- og gartnerholdet Grundlæggende kemi -Gennemgang af forskellige stoffers egenskaber og anvendelighed indenfor gartneri, anlægsgartneri og skovbrug 1 www.ucholstebro.dk. Døesvej 70 76.
Naturfag for skov- og gartnerholdet Grundlæggende kemi -Gennemgang af forskellige stoffers egenskaber og anvendelighed indenfor gartneri, anlægsgartneri og skovbrug 1 www.ucholstebro.dk. Døesvej 70 76.
Formål: At undersøge nogle egenskaber ved CO 2 (carbondioxid). 6 CO 2 + 6 H 2 O C 6 H 12 O 6 + 6 O 2
 ØVELSE 2.1 SMÅ FORSØG MED CO 2 At undersøge nogle egenskaber ved CO 2 (carbondioxid). Indledning: CO 2 er en vigtig gas. CO 2 (carbondioxid) er det molekyle, der er grundlaget for opbygningen af alle organiske
ØVELSE 2.1 SMÅ FORSØG MED CO 2 At undersøge nogle egenskaber ved CO 2 (carbondioxid). Indledning: CO 2 er en vigtig gas. CO 2 (carbondioxid) er det molekyle, der er grundlaget for opbygningen af alle organiske
Øvelser 10. KlasseCenter Vesthimmerland Kaj Mikkelsen
 Indholdsfortegnelse Indholdsfortegnelse... 1 Bygning af et glucosemolekyle... 2 Bygning af et poly- sakkarid.... 3 Påvisning af glukose (1)... 4 Påvisning af glucose (2)... 5 Påvisning af disakkarider....
Indholdsfortegnelse Indholdsfortegnelse... 1 Bygning af et glucosemolekyle... 2 Bygning af et poly- sakkarid.... 3 Påvisning af glukose (1)... 4 Påvisning af glucose (2)... 5 Påvisning af disakkarider....
Alkohol Ingrid Jespersens Gymnasieskole 2007
 Alkohol Ingrid Jespersens Gymnasieskole 007 Ethanols fysiske egenskaber Kogepunkt 78,5 o C På side 8 i Alkohol også vises Frysepunkt -114, o C opskriften på et forsøg til bestemmelse af Massefylde 0,789
Alkohol Ingrid Jespersens Gymnasieskole 007 Ethanols fysiske egenskaber Kogepunkt 78,5 o C På side 8 i Alkohol også vises Frysepunkt -114, o C opskriften på et forsøg til bestemmelse af Massefylde 0,789
Rapport over Fældningsreaktioner
 Rapport over Fældningsreaktioner Formål: at undersøge, hvilke salte der dannes ud fra forskellige fældningsreaktioner, og efterfølgende at undersøge hvilke af disse salte, der er tungtopløselige og hvilke,
Rapport over Fældningsreaktioner Formål: at undersøge, hvilke salte der dannes ud fra forskellige fældningsreaktioner, og efterfølgende at undersøge hvilke af disse salte, der er tungtopløselige og hvilke,
reduktion oxidation Reduktion optagelse af elektroner Oxidation afgivelse af elektroner
 8. Redoxreaktioner reduktion oxidation Reduktion optagelse af elektroner Oxidation afgivelse af elektroner (Hel eller delvis) Der er grundlæggende 4 væsentlige kemiske reaktioner: 1. Udfældning af tungtopløselige
8. Redoxreaktioner reduktion oxidation Reduktion optagelse af elektroner Oxidation afgivelse af elektroner (Hel eller delvis) Der er grundlæggende 4 væsentlige kemiske reaktioner: 1. Udfældning af tungtopløselige
Isolering af DNA fra løg
 Isolering af DNA fra løg Formål: At afprøve en metode til isolering af DNA fra et levende væv. At anvende enzymer.. Indledning: Isolering af DNA fra celler er første trin i mange molekylærbiologiske undersøgelser.
Isolering af DNA fra løg Formål: At afprøve en metode til isolering af DNA fra et levende væv. At anvende enzymer.. Indledning: Isolering af DNA fra celler er første trin i mange molekylærbiologiske undersøgelser.
Eksamensspørgsmål 2c ke, juni Fag: Kemi C-niveau. Censor: Andreas Andersen, Skanderborg Gymnasium
 Eksamensspørgsmål 2c ke, juni 2016 Fag: Kemi C-niveau Censor: Andreas Andersen, Skanderborg Gymnasium Eksaminator: Jeanette Olofsson, Ikast-Brande Gymnasium 1. Bindingstyper og tilstandsformer under inddragelse
Eksamensspørgsmål 2c ke, juni 2016 Fag: Kemi C-niveau Censor: Andreas Andersen, Skanderborg Gymnasium Eksaminator: Jeanette Olofsson, Ikast-Brande Gymnasium 1. Bindingstyper og tilstandsformer under inddragelse
Brugsvejledning for 7827.10 dialyseslange
 Brugsvejledning for 7827.10 dialyseslange 14.06.07 Aa 7827.10 1. Præsentation Dialyseslangen er 10 m lang og skal klippes i passende stykker og blødgøres med vand for at udføre forsøgene med osmose og
Brugsvejledning for 7827.10 dialyseslange 14.06.07 Aa 7827.10 1. Præsentation Dialyseslangen er 10 m lang og skal klippes i passende stykker og blødgøres med vand for at udføre forsøgene med osmose og
Anvendt kemi 2 - ekstraopgaver
 1 Anvendt kemi - ekstraopgaver Enthalpiberegninger Stoffet ethan (H6) kan afbrændes. a) Opskriv og afstem reaktionsskemaet for forbrændingen. b) Beregn H for reaktionen. Opgave Betragt følgende redoxreaktionsskema:
1 Anvendt kemi - ekstraopgaver Enthalpiberegninger Stoffet ethan (H6) kan afbrændes. a) Opskriv og afstem reaktionsskemaet for forbrændingen. b) Beregn H for reaktionen. Opgave Betragt følgende redoxreaktionsskema:
4. Kulstofkredsløbet (CO 2
 4. Kulstofkredsløbet (CO 2 82 1. Fakta om kulstofkredsløb 2. Kulstof på jorden 3. Kulstofstrømmene 4. Tidsfaktoren i kulstofstrømmene 5. Forvitring og vulkanisme 6. Temperaturvariationer og klimaforandringer
4. Kulstofkredsløbet (CO 2 82 1. Fakta om kulstofkredsløb 2. Kulstof på jorden 3. Kulstofstrømmene 4. Tidsfaktoren i kulstofstrømmene 5. Forvitring og vulkanisme 6. Temperaturvariationer og klimaforandringer
Biologisk rensning Fjern opløst organisk stof fra vand
 Spildevandscenter Avedøre Biologisk rensning Fjern opløst organisk stof fra vand Øvelse I Formål: På renseanlægget renses et mekanisk, biologisk og kemisk. I den biologiske rensning på renseanlægget benyttes
Spildevandscenter Avedøre Biologisk rensning Fjern opløst organisk stof fra vand Øvelse I Formål: På renseanlægget renses et mekanisk, biologisk og kemisk. I den biologiske rensning på renseanlægget benyttes
Gæringsprocessen ved fremstillingen af alkohol tager udgangspunkt i glukose molekylet (C
 Molekyler af alkohol Byg molekylerne af forskellige alkoholer, og tegn deres stregformler Byg alkoholmolekyler med 1, 2 og 3 C atomer og 1 OH gruppe. Tegn deres stregformler her og skriv navnet ved. Byg
Molekyler af alkohol Byg molekylerne af forskellige alkoholer, og tegn deres stregformler Byg alkoholmolekyler med 1, 2 og 3 C atomer og 1 OH gruppe. Tegn deres stregformler her og skriv navnet ved. Byg
[H 3 O + ] = 10 ph m [OH ] = 10 poh m K s = 10 pks m K b = 10 pk b. m ph + poh = 14 [H 3 O + ][OH ] = m 2 pk s + pk b = 14 K s K b = m 2
![[H 3 O + ] = 10 ph m [OH ] = 10 poh m K s = 10 pks m K b = 10 pk b. m ph + poh = 14 [H 3 O + ][OH ] = m 2 pk s + pk b = 14 K s K b = m 2 [H 3 O + ] = 10 ph m [OH ] = 10 poh m K s = 10 pks m K b = 10 pk b. m ph + poh = 14 [H 3 O + ][OH ] = m 2 pk s + pk b = 14 K s K b = m 2](/thumbs/48/24964855.jpg) ph = -log [H 3 O + ] poh = -log [OH ] pk s = -log K s pk b = -log K b [H 3 O + ] = 10 ph m [OH ] = 10 poh m K s = 10 pks m K b = 10 pk b m ph + poh = 1 [H 3 O + ][OH ] = 10 1 m 2 pk s + pk b = 1 K s K
ph = -log [H 3 O + ] poh = -log [OH ] pk s = -log K s pk b = -log K b [H 3 O + ] = 10 ph m [OH ] = 10 poh m K s = 10 pks m K b = 10 pk b m ph + poh = 1 [H 3 O + ][OH ] = 10 1 m 2 pk s + pk b = 1 K s K
Opgaver til: 6. Syrer og baser
 Opgaver til: 6. Syrer og baser 1. Færdiggør følgende syre-basereaktioner: a) HNO 3 + H 2 O b) H 2 SO 4 + H 2 O c) HNO 3 + NH 3 d) SO 2-3 + H 2O e) PO 3-4 + H 2O f) H 3 PO 4 + H 2 O g) O 2- + H 2 O h) CO
Opgaver til: 6. Syrer og baser 1. Færdiggør følgende syre-basereaktioner: a) HNO 3 + H 2 O b) H 2 SO 4 + H 2 O c) HNO 3 + NH 3 d) SO 2-3 + H 2O e) PO 3-4 + H 2O f) H 3 PO 4 + H 2 O g) O 2- + H 2 O h) CO
Densitet (også kendt som massefylde og vægtfylde) hvor
 Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Fremstilling af enkeltlag på sølv
 Fremstilling af enkeltlag på sølv Formål I dette eksperiment skal du undersøge, hvordan vand hæfter til en overflade af henholdsvis metallisk sølv, et nanometer tykt enkeltlag af hexadekanthiol og et nanometer
Fremstilling af enkeltlag på sølv Formål I dette eksperiment skal du undersøge, hvordan vand hæfter til en overflade af henholdsvis metallisk sølv, et nanometer tykt enkeltlag af hexadekanthiol og et nanometer
Eksamensspørgsmål 2z ke (ikke godkendte) Fag: Kemi C Dato: 7. juni 2013 Lærer: Peter R Nielsen (PN) Censor: Tanja Krüger, VUC Aarhus
 1. Kemisk Binding Gør rede for øvelsen Kovalent- eller Ionbinding? Beskriv ionbinding og kovalent binding og forklar hvordan forskellene på de to typer af kemisk binding udnyttes i for66søget. Stikord
1. Kemisk Binding Gør rede for øvelsen Kovalent- eller Ionbinding? Beskriv ionbinding og kovalent binding og forklar hvordan forskellene på de to typer af kemisk binding udnyttes i for66søget. Stikord
Exoterme og endoterme reaktioner (termometri)
 AKTIVITET 10 (FAG: KEMI) NB! Det er i denne øvelse ikke nødvendigt at udføre alle forsøgene. Vælg selv hvilke du/i vil udføre er du i tvivl så spørg. Hvis du er interesseret i at måle varmen i et af de
AKTIVITET 10 (FAG: KEMI) NB! Det er i denne øvelse ikke nødvendigt at udføre alle forsøgene. Vælg selv hvilke du/i vil udføre er du i tvivl så spørg. Hvis du er interesseret i at måle varmen i et af de
Forord Dette skal du bruge til aktiviteten (findes i aktivitetskassen) Forberedelse Dagens forløb Indledning (læreroplæg) (ca. 15 30 min.
 CO 2 og kulstoffets kredsløb i naturen Lærervejledning Forord Kulstof er en af de væsentligste bestanddele i alt liv, og alle levende væsener indeholder kulstof. Det findes i en masse forskellige sammenhænge
CO 2 og kulstoffets kredsløb i naturen Lærervejledning Forord Kulstof er en af de væsentligste bestanddele i alt liv, og alle levende væsener indeholder kulstof. Det findes i en masse forskellige sammenhænge
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug-dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi C Mohammed
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug-dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi C Mohammed
Øvelse 4.2 1/5 KemiForlaget
 KST G ERNÆRING Benthe Schou ØVELSE 4. Øvelse: Iodtal for fedtstoffer Indledning Et fedtstofs ernæringsmæssige sundhed bestemmes af hvilke fedtsyrer, der indgår i fedtstoffet. Fedtstoffets sundhed er stærkt
KST G ERNÆRING Benthe Schou ØVELSE 4. Øvelse: Iodtal for fedtstoffer Indledning Et fedtstofs ernæringsmæssige sundhed bestemmes af hvilke fedtsyrer, der indgår i fedtstoffet. Fedtstoffets sundhed er stærkt
Kvantitativ bestemmelse af reducerende sukker (glukose)
 Kvantitativ bestemmelse af reducerende sukker (glukose) Baggrund: Det viser sig at en del af de sukkerarter vi indtager med vores mad er hvad man i fagsproget kalder reducerende sukkerarter. Disse vil
Kvantitativ bestemmelse af reducerende sukker (glukose) Baggrund: Det viser sig at en del af de sukkerarter vi indtager med vores mad er hvad man i fagsproget kalder reducerende sukkerarter. Disse vil
OPGAVER OM DANNELSE AF IONER. OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal.
 OPGAVE 3.1 OPGAVER OM DANNELSE AF IONER OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal. b. Angiv derefter hvor mange elektroner atomet skal optage
OPGAVE 3.1 OPGAVER OM DANNELSE AF IONER OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal. b. Angiv derefter hvor mange elektroner atomet skal optage
Grundstoffer og det periodiske system
 Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017
 EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
Elevforsøg i 10. klasse Alkohol
 Fysik/kemi Viborg private Realskole 2016-17 Elevforsøg i 10. klasse Alkohol Model af et alkohol-molekyle Formål At illustrere hvordan forskellige alkohol-molekyler er opbygget At bygge modeller af alkohol
Fysik/kemi Viborg private Realskole 2016-17 Elevforsøg i 10. klasse Alkohol Model af et alkohol-molekyle Formål At illustrere hvordan forskellige alkohol-molekyler er opbygget At bygge modeller af alkohol
1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas
 Eksamensspørgsmål revideret 7/6 NW 1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas Bilag: Det periodisk system. Du skal fortælle om atomets opbygning, om isotoper og naturligvis om begrebet
Eksamensspørgsmål revideret 7/6 NW 1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas Bilag: Det periodisk system. Du skal fortælle om atomets opbygning, om isotoper og naturligvis om begrebet
Jernindhold i fødevarer bestemt ved spektrofotometri
 Bioteknologi 4, Tema 8 Forsøg www.nucleus.dk Linkadresserne fungerer pr. 1.7.2011. Forlaget tager forbehold for evt. ændringer i adresserne. Jernindhold i fødevarer bestemt ved spektrofotometri Formål
Bioteknologi 4, Tema 8 Forsøg www.nucleus.dk Linkadresserne fungerer pr. 1.7.2011. Forlaget tager forbehold for evt. ændringer i adresserne. Jernindhold i fødevarer bestemt ved spektrofotometri Formål
Modul 3-4: Fremstilling af mini-raketter
 Modul 3-4 Modul 3-4: Fremstilling af mini-raketter Det er måske lidt overraskende, men vand (H2O) er faktisk en meget energirig kemisk forbindelse. Teorien bag mini-raketten Vandmolekylerne hænger indbyrdes
Modul 3-4 Modul 3-4: Fremstilling af mini-raketter Det er måske lidt overraskende, men vand (H2O) er faktisk en meget energirig kemisk forbindelse. Teorien bag mini-raketten Vandmolekylerne hænger indbyrdes
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Øvelse 2 Mest mættede olier
 Øvelse 2 Mest mættede olier Formål Formålet med denne øvelse er at foretage en kvalitativ undersøgelse af mængden af dobbeltbindinger i forskellige olier for at undersøge hvilke der er mest mættede. Teori
Øvelse 2 Mest mættede olier Formål Formålet med denne øvelse er at foretage en kvalitativ undersøgelse af mængden af dobbeltbindinger i forskellige olier for at undersøge hvilke der er mest mættede. Teori
Undervisningsbeskrivelse for STX 1m Kemi B
 Undervisningsbeskrivelse for STX 1m Kemi B Termin Afslutning i juni skoleår 15/16 Institution Marie Kruses Skole Uddannelse Fag og niveau Lærer(e) Hold STX Kemi B Hasse Bonde Rasmussen 1mKe Denne undervisningsbeskrivelse
Undervisningsbeskrivelse for STX 1m Kemi B Termin Afslutning i juni skoleår 15/16 Institution Marie Kruses Skole Uddannelse Fag og niveau Lærer(e) Hold STX Kemi B Hasse Bonde Rasmussen 1mKe Denne undervisningsbeskrivelse
E 10: Fremstilling af PEC-solceller
 E 10: Fremstilling af PEC-solceller Formål Formålet med forsøget er at fremstille PEC (Photo Electro Chemical) solceller ud fra vinduesruder, plantesaft, hvid maling og grafit fra en blyant. Apparatur
E 10: Fremstilling af PEC-solceller Formål Formålet med forsøget er at fremstille PEC (Photo Electro Chemical) solceller ud fra vinduesruder, plantesaft, hvid maling og grafit fra en blyant. Apparatur
KEMI HØJT NIVEAU. Tirsdag den 18. maj 2004 kl. 9.00-13.00. (De stillede spørgsmål indgår med lige vægt i vurderingen)
 STUDENTEREKSAMEN MAJ 2004 2004-10-1 MATEMATISK LINJE KEMI ØJT NIVEAU Tirsdag den 18. maj 2004 kl. 9.00-13.00 (De stillede spørgsmål indgår med lige vægt i vurderingen) pgavesættet består af 3 opgaver og
STUDENTEREKSAMEN MAJ 2004 2004-10-1 MATEMATISK LINJE KEMI ØJT NIVEAU Tirsdag den 18. maj 2004 kl. 9.00-13.00 (De stillede spørgsmål indgår med lige vægt i vurderingen) pgavesættet består af 3 opgaver og
Selvsamlende enkeltlag elevvejledning
 Nano ScienceCenter,KøbenhavnsUniversitet Selvsamlende enkeltlag elevvejledning Fremstilling af enkeltlag på sølv Formål I dette forsøg skal du undersøge, hvordan vand hæfter til en overflade af henholdsvis
Nano ScienceCenter,KøbenhavnsUniversitet Selvsamlende enkeltlag elevvejledning Fremstilling af enkeltlag på sølv Formål I dette forsøg skal du undersøge, hvordan vand hæfter til en overflade af henholdsvis
Nedenfor er givet en oversigt over stofdatablade i branchebeskrivelse for metaliseringsvirksomheder.
 Nedenfor er givet en oversigt over stofdatablade i branchebeskrivelse for metaliseringsvirksomheder. For at se detaljer om et stof klik på navnet. For at kommer tilbage til oversigten, klik på Tilbage
Nedenfor er givet en oversigt over stofdatablade i branchebeskrivelse for metaliseringsvirksomheder. For at se detaljer om et stof klik på navnet. For at kommer tilbage til oversigten, klik på Tilbage
Olfaktometrisk titrering
 Side: 1/8 Olfaktometrisk titrering Forfattere: Henrik Parbo Redaktør: Morten Christensen, Thomas Brahe Faglige temaer: Olfaktometri, ph, Titrering, Thioler Kompetenceområder: Introduktion: Titrering med
Side: 1/8 Olfaktometrisk titrering Forfattere: Henrik Parbo Redaktør: Morten Christensen, Thomas Brahe Faglige temaer: Olfaktometri, ph, Titrering, Thioler Kompetenceområder: Introduktion: Titrering med
%2fAfleveringsportal%2fopgaveaflevering.aspx%3felementId%3d476671
 In English Log ud Peter Fristrup CampusNet / 26171 Almen kemi F15 / Opgaver Eksamen F15 Side 1 Navngivning Vis rigtige svar Skjul rigtige svar Spørgsmål 1 Vægtning 1 % Opskriv den kemiske formel for kobber(i)oxid
In English Log ud Peter Fristrup CampusNet / 26171 Almen kemi F15 / Opgaver Eksamen F15 Side 1 Navngivning Vis rigtige svar Skjul rigtige svar Spørgsmål 1 Vægtning 1 % Opskriv den kemiske formel for kobber(i)oxid
BASISKEMI C. Facit HELGE MYGIND OLE VESTERLUND NIEL SEN VIBEKE A XEL SEN HAASE & SØNS FORLAG
 BASISKEMI C ELGE MYGIND OLE VESTERLUND NIEL SEN VIBEKE A XEL SEN Facit AASE & SØNS FORLAG elge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C. Facit forfatterne og aase & Søns Forlag as
BASISKEMI C ELGE MYGIND OLE VESTERLUND NIEL SEN VIBEKE A XEL SEN Facit AASE & SØNS FORLAG elge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C. Facit forfatterne og aase & Søns Forlag as
Mundtlige eksamensopgaver
 Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 10/11 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Flemming Madsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 10/11 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Flemming Madsen
