KEMI i landbruget. Kamilla Hejltegård Nielsen. Land bru gets Rådgivningscenter Lands kon to ret for Uddan nel se
|
|
|
- Christina Søndergaard
- 7 år siden
- Visninger:
Transkript
1 KEMI i landbruget Kamilla ejltegård Nielsen Land bru gets Rådgivningscenter Lands kon to ret for Uddan nel se Landbrugsforlaget 1997
2 Kemi i landbruget Forfatter: Faglig støttegruppe: Redaktør: Dtp: Landbrugslærer Kamilla ejltegård Nielsen, Nordjyllands Landbrugsskole Landbrugslærer Kim Malthe Jensen, Nordjyllands Landbrugsskole Landbrugslærer Jens Nørstad, Kærehave Landbrugsskole Landbrugslærer Benedikte Permin, Borris Landbrugsskole Konsulent Lene Overgaard Bruun, Landskontoret for Uddannelse GRAFIA, Lene Kruse Kessler Illustrationer: Agner Risager Larsen, Lynderup Forside: Tryk: Universets kemi akvarel af Agner Risager Larsen GP-Tryk, Grenå ISBN: Udgiver: Land bru gets Rådgivningscenter Lands kon to ret for Uddannelse Land brugs for la get Udkærsvej 15, 8200 Århus N Tlf , fax Internet adresse: 1. udgave 1997
3 Forord Denne bog indeholder en grundlæggende viden om kemi. Formålet med bogen er at gøre læseren fortrolig med mange af de grundlæggende begreber og udtryk, som er vigtige for forståelsen af landbrugsrelaterede fag som fodringslære, jordbundslære og gødningslære. Bogens kapitler behandler forskellige emner fra kemiens verden med øvelser og eksempler fra hverdagen. Der er et særskilt kapitel (13) med ekstra opgaver, der tager udgangspunkt i et landbrugsfagligt tema. Bogen indeholder også en oversigt over kemiske forbindelser og grundstoffer. Bogen afsluttes med et stikordsregister, som gør det muligt at søge og finde forklaringer på bestemte udtryk.»kemi«er skrevet til elever på landmandsuddannelsens modul I, men kan også være interessant for personer, som ønsker en viden om kemiske processer, der indgår i landbrugsfaglige sammenhænge. Landbrugsforlaget, august 1997
4
5 Indhold 1. Atomernes opbygning Atomkernens opbygning Elektronbaner eller -skaller Det periodiske system Atommasse (atomvægt) Isotoper Elektronparbinding Valens Elektron- og strukturformler Molekyler Molekylevægt Ioner Ion-ladninger Ion-forbindelser Når molekyler bliver til ioner Mineraler Syrer, baser og salte p-værdien Syrer ioner og p Jordens p Analyse af jordprøve Stærke og svage syrer Baser Svage og stærke baser Neutralisation Opløsninger og blandinger.. 49 Opslæmning Kolloid opløsning Blandinger Stoffernes tilstandsform Luftaters massefylde Organisk kemi Kulstof Kulbrinter Isomere stoffer Mættede og umættede kulbrinter.. 62 Aromatiske ringe Molekylestørrelse og tilstandsform. 63 Råolie og olieprodukter Alkoholer Organiske syrer Næringsstoffer Fedtstoffer Kulhydrater Proteiner Ekstra kemiopgaver Når jern omdannes til rust Kalk og kalkning Sæbefremstilling Kulhydrater Oversigt over kemiske forbindelser og grundstoffer Ordliste Facitliste Stikordsregister Indhold
6 Kemi
7 1. Atomernes opbygning Den store naturfilosof Demokrit, der levede cirka 400 år før Kristus, antog at alt måtte være opbygget af nogle små usynlige byggesten, som hver og en var evige og uforanderlige. Demokrit kaldte disse mindste dele for atomer. Ordet atom betyder u-delelig. Legoklodser har omtrent alle de egenskaber, som Demokrit tillagde atomerne, og er netop derfor så gode at bygge med. Først og fremmest er de i sig selv udelelige. De er forskellige i form og størrelse, og de har»kroge«og»modhager«som gør, at de kan trykkes sammen til alle mulige figurer. Disse kan igen skilles, og der kan bygges nye figurer af de samme klodser. Principperne bag Demokrits atomlære var rigtige. Naturen er bygget op af forskellige»atomer«, som binder sig til hinanden mere eller mindre permanent. Man er endda ikke blot sikker på, at de eksisterer, man har også dannet sig nogle forestillinger om, hvordan de enkelte atomer må være opbygget. Atomkernens opbygning For cirka 100 år siden fandt man ud af, at atomerne kan opdeles i nogle mindre»elementarpartikler«. Disse partikler har fået betegnelserne: protoner, neutroner og elektroner. Atomernes opbygning
8 Protonen (p+) har en positiv elementarladning. Neutronen (n) har ingen ladning, men har samme masse som protonen. Elektronen (e-) har en negativ elementarladning. Elektronen er lille i forhold til de to andre; dens masse er 1/2000 del af protonens. Det simpleste atom, vi kender, er brintatomet. Kernen i et normalt brintatom består kun af en enkelt proton (p + ), og derfor har det atomnummer 1. Omkring kernen cirkulerer en elektron (e - ). Figur 1.1 Brintatomet har en proton i kernen, og omkring denne kredser en elektron. elium-atomet har to protoner (2p + ) og har derfor atomnummer 2. Foruden de to protoner (2p + ) indeholder kernen også to neutroner (2n), og omkring kernen kredser to elektroner (2e - ). Et atom indeholder lige så mange elektroner, som der er protoner i kernen. Det er derfor, det er elektrisk neutralt! Figur 1.2 eliumatomet har to protoner i kernen og omkring denne kredser to elektroner. Kemi
9 Elektronbaner eller -skaller Elektronen bevæger sig med enorm fart rundt om kernen ca km i sekundet. Det er ikke muligt at fastslå, hvor elektronen befinder sig på et bestemt tidspunkt. Man siger derfor, at atomkernen er omgivet af en elektronsky. Atomer, som indeholder flere elektroner, er på tilsvarende måde omgivet af flere elektronskyer. Elektronerne kredser i baner langt væk fra atomkernen, derfor virker atomerne meget større, end de faktisk er. Det meste af et atom er tomrum, fordi der er stor afstand fra kernen til den nærmeste elektronskal. vad holder så sammen på atomet? Det er den elektriske tiltrækning mellem den positive kerne og de negative elektroner, som fastholder elektronerne i deres bevægelse omkring kernen lidt ligesom jordens tiltrækning kan fastholde satelitter i deres baner. Elektronerne er ordnet i op til syv»skaller«omkring kernen. ver skal kan kun indeholde et bestemt antal elektroner. Den inderste skal er fuld, når der er to elektroner, den anden kan tage 8, den tredje 18 osv. Figur 1.4 Figuren viser, hvor mange elektroner, der maksimalt kan være i de enkelte skaller. Ingen grundstoffer kan have mere end 8 elektroner i den yderste skal. Figur 1.3 vis du forestiller dig, at kernen på heliumatomet var på størrelse med en kirsebærsten, som blev anbragt ved det ene mål på en fodboldbane, så ville der være størst sandsynlighed for at finde elektronerne i en afstand, der svarer til afstanden til det andet mål på fodboldbanen. Atomernes opbygning
10 Atomer Opgave 1.1 a) De positive partikler (p + ) i atomkernen kaldes: b) De neutrale partikler (n) i atomkernen kaldes: Opgave 1.2 eliumatomet med atomnummer 2 har protoner (p + ) og neutroner (n) i kernen, samt elektroner (e - ), som kredser omkring kernen i en elektronskal. Opgave 1.3 vor mange protoner (p + ) er der i kernen på et atom, som har 88 e -? c) De negative partikler (e - ), som kredser rundt om kernen kaldes: Opgave 1. 4 vor mange elektroner (e - ) kredser omkring kernen i et atom med 20 (p + )? Opgave 1.5 Fyld protoner og elektroner på følgende atomer: 4. Be beryllium 5. B bor 6. - kulstof 10 Kemi
11 Det periodiske system Videnskaben har identificeret 109 forskellige atomer (grundstoffer). Af disse forekommer 90 i naturen, og resten er fremstillet kunstigt i laboratorier. Grundstofferne har hver især et atomtegn, et atomnummer og en atomvægt. Den russiske kemiker Dimitrij Mendelejev opstillede det første periodiske system i På det tidspunkt havde man kun kendskab til 63 grundstoffer. Så for at få systemet til at passe lod Mendelejev en del pladser stå tomme, idet han påstod, at der her skulle anbringes grundstoffer, som man endnu ikke havde opdaget. Mendelejev kunne forudsige, hvilke egenskaber de ukendte grundstoffer måtte have! an kunne for eksempel angive deres proton- og elektronantal. De 109 forskellige grundstoffer i det periodiske system har hver deres specielle kemiske tegn. De er dannet ved forkortelser af grundstoffernes latinske eller græske navne. Græsk Kemisk tegn Dansk navn Oxygen O Ilt ydrogen Brint arbon Kulstof Argentum Ag Sølv Nitrogen N Kvælstof Tabel 1.1 Eksempler på kemiske tegn og navne på forskellige grundstoffer. Atomernes opbygning 11
12 I det periodiske system er grundstofferne ordnet efter tre regler: Efter stigende atomnummer Nummer 1 (brint) har netop en proton i kernen, nummer 2 (helium) har to protoner i kernen osv. Efter antal elektronskaller Grundstoffer med ens antal elektronskaller står efter hinanden på samme linje. Man siger, at de hører til samme periode. Et atom kan have op til syv elektronskaller, derfor er der i alt 7 perioder. Antal elektroner i yderste skal Grundstoffer med samme antal elektroner i yderste skal står i samme gruppe. Da der kan være fra 1 til 8 elektroner i den yderste skal, er der 8 hovedgrupper ovedgruppe = antal e - i yderste skal Periode = antal skaller ydrogen 7 Li 3 Lithium 23 Na 11 Natrium 39 K 19 Kalium 85 Rb 37 Rubidium 133 s 55 æsium 223 Fr 87 Francium 9 Be 4 Beryllium 24 Mg 12 Magnesium 40 a 20 alcium 88 Sr 38 Strontium 137 Ba 56 Barium 226 Ra 88 Radium 45 Sc 21 Scandium 89 Y 39 Yttrium 138 La 57 Lanthan 227 Ac 89 Actinium Undergrupper 48 Ti 22 Titan 91 Zr 40 Zirconium 179 f 72 afnium Ku V 23 Vanadium 93 Nb 41 Niobium 181 Ta 73 Tantal a 105 Kurchatovium ahnium 52 r 24 hrom 96 Mo 55 Mn 25 Mangan 98 Tc Molybdæn Technetium W 74 Wolfram Re 75 Rhenium 56 Fe 26 Jern 101 Ru 44 Ruthenium 190 Os 76 Osmium 59 o 27 obolt 103 Rh 45 Rhodium 192 Ir 77 Iridium Ni 28 Nikkel 106 Pd 46 Palladium 195 Pt 78 Platin 12 Kemi
13 Trappelinjen opdeler det periodiske system i Metaller og ikke-metaller. Metaller Grundstofferne til venstre i det periodiske system under "trappen" er metaller. De har metalglans, og er gode ledere af elektricitet og varme. Ikke-metaller Grundstofferne til højre i det periodiske system over "trappen" kaldes ikke-metaller. De er dårlige ledere af elektricitet og varme. Ædelgasser De grundstoffer, der står i 8. hovedgruppe, er ædelgasser. De kaldes også inaktive luftarter, fordi de normalt ikke vil danne kemiske bindinger med andre stoffer ikke engang med sig selv! u 29 Kobber 108 Ag 47 Sølv 197 Au 79 Guld 65 Zn 30 Zink 112 d 48 admium 201 g 80 Kviksølv 11 B 5 Bor 27 Al 13 Aluminium 70 Ga 31 Gallium 115 In 49 Indium 204 Tl 81 Thallium 12 6 Kulstof 28 Si 14 Silicium 73 Ge 32 Germanium 119 Sn 50 Tin 207 Pb 82 Bly 14 N 7 Kvælstof 31 P 15 Fosfor 75 As 33 Arsen 122 Sb 51 Antimon 209 Bi 83 Bismuth 16 O 8 Ilt 32 S 16 Svovl 79 Se 34 Selen 128 Te 52 Tellum 209 Po 84 Polonium Metaller 19 F 9 Fluor 35 l 17 Klor 80 Br 35 Brom 127 I 53 Jod 210 At 85 Astat 4 e 2 elium 20 Ne 10 Neon 40 Ar 18 Argon 84 Kr 36 Krypton 131 Xe 54 Xenon 222 Rn 86 Radon < > Ikke metaller Figur 1.5 Det periodiske system. Signatur forklaring Kunstigt fremstillet Luftart Væske Fast stof Atomvægt Kemisk tegn Atom nr. Navn 1 1 ydrogen Atomernes opbygning 13
14 Det periodiske system Opgave 1.6 kvælstof a) Kvælstof (N) har atomnummer og atommassen er. b) Kvælstof står i hovedgruppe i periode. c) Kernen indeholder protoner og neutroner. d) Der er elektroner, der kredser omkring kernen i elektronbaner med elektroner i den yderste skal. Opgave 1.7 svovl a) Svovl (S) har atomnummer og atommassen er. b) Svovl står i hovedgruppe, i periode. c) Kernen indeholder protoner og neutroner. d) Der er elektroner, der kredser omkring kernen i elektronbaner med elektroner i den yderste skal. Opgave 1.8 klor a) Klor (l) har atomnummer, og atommassen er. c) Klor har elektronskaller, med elektroner i yderste skal. Opgave 1.9 bor a) Bor (B) har atomnummer og atommassen er. b) Bor står i hovedgruppe, i periode. c) Bor har elektronskaller med elektroner i den yderste skal. Opgave 1.10 a) vilket atom har 12 elektroner? b) vor mange elektronskaller har dette atom? c) vor mange elektroner er der i den yderste elektronskal? Opgave 1.11 vilke to grundstoffers atomer har kun en elektronskal? b) Klor står i hovedgruppe i periode. 14 Kemi
15 Atommasse (atomvægt) Atomerne vejer så lidt, at vi ikke kan lægge dem på en vægt og veje dem. Men man har fundet ud af, at massen af en proton er cirka 1,7 x (en billiontedel af en billiontedel af et gram). Det er besværligt at arbejde med så små tal, derfor angiver man som regel atomernes masse i såkaldte»atommasseenheder«med forkortelsen 1u (unit = enhed). 1u er med tilnærmelse lig massen af en proton. 1u er defineret som 1 af et kulstofsatoms masse. En neutron har 12 samme masse cirka 1u. Til sammenligning er elektronens masse kun omkring u. Figur 1.6 En proton har cirka massen 1 u. Figur 1.7 En elektron har cirka massen u. Et atoms masse vil derfor med tilnærmelse være lig med antallet af protoner og neutroner i kernen. Elektronens masse er så lille, at vi kan se bort fra den i denne sammenhæng. Figur 1.8 eliumatomet, som indeholder 4 kernepartikler, har cirka massen 4u. Atomernes opbygning 15
16 Atommasse Nedenfor er opstillet de første 12 grundstoffer efter stigende atomnummer. Prøv at huske disse grundstoffer. Navn Atomtegn Atomnummer Brint 1 elium e 2 Lithium Li 3 Berylium Be 4 Bor B 5 Kulstof 6 Kvælstof N 7 Ilt O 8 Flour F 9 Neon Ne 10 Natrium Na 11 Magnesium Mg 12 Opgave 1.12 I det periodiske system, som findes på bogens omslag, kan du finde alle grundstoffernes atomnumre, atomtegn, masse og navn. Udfyld de tomme felter i dette skema. Atom- Atom- Atom- Antal Antal Antal Navn nummer tegn masse protoner neutroner elektroner 6 O Klor 16 Kemi
17 Isotoper De fleste grundstofatomer forekommer i flere forskellige»udgaver«hvor antallet af protoner ligger fast, men antallet af neutroner i kernen kan variere lidt. Man siger, at der findes forskellige isotoper af samme grundstof. Isotop af brint () Der findes en sjælden isotop af brint, som foruden en proton også har en neutron i kernen. Den kaldes»tungt brint«, fordi massen er 1u + 1u = 2u i stedet for 1u, som den er hos normal brint. Isotoper er atomer med lige mange protoner, men med forskelligt antal neutroner i kernen. Isotoper Brintatom Tungt brint Figur 1.9 Kernen i et normalt brintatom består kun af en enkelt proton. Kernen i tungt brint indeholder også en neutron i kernen udover protonen. Opgave 1.13 Sæt cirkel omkring det rigtige ord: To forskellige isotoper af et grundstof har ens/forskellig antal protoner, men ens/forskellig antal neutroner. Opgave 1.14 Normalt klor (l) har atomnummer 17 og atommassen er 35. a) vad kaldes l 37? b) vor mange neutroner har l 37 i kernen? c) vor mange neutroner har normal klor i kernen? Opgave 1.15 Normalt fosfor (P) har atomnummer 15 og atommassen er 31. a) vor mange protoner indeholder fosfor i kernen? b) vad kaldes P 32? c) vor mange neutroner har P 32 i kernen? d) vor mange neutroner har normal fosfor i kernen? e) vad vejer den tunge fosfor-isotop? Atomernes opbygning 17
18 Isotoper af uran Det tungeste grundstof i naturen er uran, der består af flere isotoper. Uran skrives ofte med sit kemiske tegn U plus et tal, som angiver atommassen. Tager man en portion naturligt uran, vil 99,3% af atomerne have 146 neutroner i kernen foruden de 92 protoner og atommassen er derfor 238u. 0,7% af atomerne vil kun have 143 neutroner i kernen, og atommassen bliver derfor kun 235u. Nogle af de store atomkerner (f.eks. uran-isotopen U 235 ) er opbygget på en sådan måde, at de er lige på nippet til at gå i stykker. vis man tilfører denne kerne en lille smule energi ved at lade en neutron ramme den, vil kernen ofte spaltes i to dele, og samtidig vil der frigøres to eller tre nye neutroner. Denne reaktion kaldes for en kernespaltning, og blev opdaget af tyskeren Otto ahn i De frigjorte neutroner ville nemlig kunne frembringe nye spaltninger, som så igen kunne frembringe endnu flere spaltninger og så videre. Beregninger viste, at hvis man kunne få denne kædeproces igang, ville man kunne fremstille en bombe med langt større sprængkraft, end man hidtil havde kendt. Mod slutningen af den 2. verdenskrig bragte USA den første atombombe til eksplosion. Den 6. august 1945 og igen den 9. august 1945 kastede amerikanerne to atombomber over de japanske byer iroshima og Nagasaki. Disse to bomber er de eneste eksempler på direkte militær brug af atomvåben. Da resultatet af Otto ahns forsøg blev kendt, indså atomforskere over hele verden, at man nu havde mulighed for at sætte en kædeproces igang. 18 Kemi
19 2. Elektronparbinding Grundstofferne i 8. hovedgruppe kendes som tidligere nævnt under den fælles betegnelse ædelgasser. Disse stoffer ligner hinanden ved, at de normalt ikke kan danne kemiske bindinger med sig selv og andre stoffer. De andre grundstofatomer vil gerne reagere med andre stoffer. vis to eller flere atomer kobles sammen dannes molekyler. Der findes tre forskellige måder, hvorpå stoffer kan binde sig kemisk til hinanden. De kaldes for ion-bindingen, metal-bindingen og elektron-parbindingen. Elektronparbindingen kaldes også for covalent binding. Atomerne vil gerne have fyldt den yderste elektronskal med elektroner. Der kan maksimalt være 8 elektroner i den yderste elektronskal. Figur 2.1 Natrium står i 1. hovedgruppe og har en elektron i den yderste skal, det betyder, at der er lidt over»fuldt hus«. Derfor vil natrium prøve at skille sig af med denne ekstra elektron, så den fyldte skal indenfor vil blive den yderste. Elektronparbinding 19
20 Figur 2.3 To kloratomer bundet sammen af en enkeltbinding. Figur 2.2 Klor står i 7. hovedgruppe og har 7 elektroner i den yderste skal, det betyder, at der er næsten»fuldt hus«, derfor vil klor prøve at optage 1 elektron for at få sin yderste skal fyldt. Når to atomer er bundet sammen af et elektronpar, kalder vi det en enkeltbinding, og hvis atomerne har to fælles elektronpar, hedder det en dobbeltbinding. vordan kan et atom så optage eller afgive elektroner? En måde at optage elektroner på er at koble sig sammen med et naboatom. Forestil dig, at to kloratomer støder sammen, de mangler hver en elektron i deres yderste skal. De to kloratomer vil nu binde sig til hinanden ved at»låne«en elektron af hinanden, så de to elektroner cirkulerer i en bane rundt om begge atomkerner. Kloratomerne deles altså om et elektronpar. Figur 2.4 Når to iltatomer bindes sammen af en dobbeltbinding, bliver de til et iltmolekyle. ver iltatom har seks elektroner i den yderste skal, det vil sige, at der er plads til endnu to elektroner før skallen er fyldt op. De to iltatomer låner derfor to elektroner af hinanden. 20 Kemi
21 Tip 13 rigtige Spørgsmål 1 X 2 1 vor mange elektroner har ilt i sin yderste skal? elektroner elektroner elektroner 2 vor mange elektroner skal ilt optage for at få sin yderste skal elektron elektroner elektroner fyldt op? 3 vad kaldes bindingen, når to Enkel- Type- Dobbeltatomer deles om et elektronpar? binding binding binding 4 vad kaldes den binding vi får, Enkel- Type- Dobbeltnår to atomer deles om to binding binding binding elektronpar? 5 To kvælstofatomer (N) går i for bindelse med hinanden, hvor elektronpar elektronpar elektronpar mange elektronpar deles de om? 6 To svovlatomer (S) går i forbin delse med hinanden, hvor elektronpar elektronpar elektronpar mange elektronpar deles de om? 7 vilke af følgende atomer har Natrium Bor Fluor tre elektroner i sin yderste skal? vilke af følgende atomer mangler tre elektroner for at Kalium Fosfor Klor få sin yderste skal fyldt op? vilke af følgende grundstoffer holdes sammen af en tredobbelt Fosfor Kulstof Bor binding? vilke af følgende grundstoffer findes i 2. hovedgruppe i det Kalium Aluminium Magnesium periodiske system? 11 vor gode er stofferne i 8. Super Dårlige Middel hovedgruppe til at reagere med gode gode andre stoffer? 12 vilket atomtegn har brint? B e 13 vor mange elektroner skal klor afgive for at få sin yderste elektron elektroner elektroner skal fyldt op? Elektronparbinding 21
22 Tre regler for valens Grundstoffer med 1 3 elektroner i den yderste skal, vil lettest kunne få en fyldt yderskal ved at afgive disse overskydende elektroner. Disse grundstoffer vil derfor have valenser 1 3 Grundstoffer med 5 7 elektroner i den yderste skal vil prøve at optage eller»låne«de elektroner, de mangler i at få fyldt den yderste skal. Derfor vil disse grundstoffer også have valenser 1 3. Valens Ordet valens er udtryk for det antal elektroner, som et atom kan optage, afgive eller»låne ud«til andre atomer. Valensen hos et grundstof er enten udtryk for antallet af elektroner i den yderste skal, eller hvordan atomerne lettest får fyldt den yderste skal. Et stofs valens kan fortælle os noget om, hvordan stoffet reagerer med andre stoffer, eller med andre ord, hvilke kemiske egenskaber det har. Grundstoffer med 4 elektroner i den yderste skal kan enten optage eller afgive 4 elektroner. Derfor vil de have valensen 4. Vær opmærksom på, at der vil være undtagelser fra disse regler. Et stof kan have andre valenser udover dem, som reglerne angiver. Figur 2.5 Grundstof nr. 11 natrium (Na) har i alt 11 elektroner. Den inderste skal er fyldt med de 2 elektroner, der kan være der. Skal nr. 2, der højst kan rumme 8 elektroner, er også fyldt ud. Den sidste elektron er alene i 3. skal og afgives derfor let. Derfor får natrium valensen Kemi
23 Ved grundstof nr. 8 ilt (O) er den første skal fyldt ud med 2 elektroner. De sidste 6 elektroner findes i 2. skal. Ved at indfange to elektroner får iltatomet 8 elektroner i yderste skal. Valensen bliver 2. a a, jeg har fanget en elektron valensen er nu 1. Elektron- og strukturformler Du har set via tegninger (figur 2.3 og 2.4), hvordan grundstoffer binder sig til hinanden. Dette kan beskrives mere enkelt ved hjælp af såkaldte elektronformler eller strukturformler. Elektronformel I stedet for at tegne hvert atom med kerne og elektronskal omkring, kan man vise det på denne måde: Na betyder et natriumatom med en elektron i den yderste skal. O betyder et iltatom med seks elektroner i den yderste skal. Ups, jeg har mistet en elektron valensen bliver 1. Strukturformel»Struktur«betyder opbygning og denne formeltype bruges til at vise, hvordan grupper af atomer er bundet sammen. Enkelt binding: - Dobbelt binding: O=O Tredobbelt binding: N=_ N Elektronparbinding 23
24 Valens, elektron- og strukturformler Opgave 2.1 a) vis et atom benytter 2 elektroner i bindingen, har det valensen: c) vilke hovedgrupper af grundstoffer har valensen 3? b) vis et atom benytter 3 elektroner i bindingen har det valensen: d) vilken hovedgruppe af grundstoffer har valensen 4? Opgave 2.2 vilken valens har følgende grundstoffer? a) Brint (): b) Bor (B): c) elium (e): d) Fosfor (P): Opgave 2.3 a) vilke hovedgrupper af grundstoffer har valensen 1? Opgave 2.4 a) I hvilken hovedgruppe står Na og l? Natrium (Na): Klor (l): b) vilken valens har Na og l? Natrium (Na): Klor (l): Opgave 2.5 a) Tegn et aluminiumatom (Al) med elektronformel: b) vilke hovedgrupper af grundstoffer har valensen 2? b) Tegn ved hjælp af en strukturformel bindingen mellem to aluminium atomer: 24 Kemi
25 3. Molekyler Atomer slutter sig ofte sammen til større partikler til molekyler. Atomer kan slutte sig sammen på to forskellige måder: vis identiske atomer slutter sig sammen, kaldes stoffet et grundstof. vis forskellige atomer slutter sig sammen, kaldes stoffet en kemisk forbindelse. Der findes 109 forskellige grundstoffer, men der kan dannes uendeligt mange forskellige kemiske forbindelser. Når to iltatomer kobles sammen via en elektronparbinding, bliver de til et iltmolekyle. Iltmolekylet er et grundstof, fordi det består af ens atomer. Et iltmolekyle har betegnelsen O2, som betyder to sammenbundne iltatomer. På samme måde skriver vi N 2, når to kvælstof-atomer kobles sammen. Kemiske formler Når det drejer sig om kemiske forbindelser, taler man om kemiske formler. 2 O er den kemiske formel for vand. De kemiske tegn og O viser, at molekylet indeholder brintatomer og et iltatom. 2-tallet angiver, at der er to brintatomer i molekylet. Den atmosfæriske luft består af cirka 78% kvælstof, 21% ilt og 0,03% kuldioxid. Kuldioxid har den kemiske formel O 2. De kemiske tegn og O viser, at molekylet indeholder kulstofatomer og iltatomer. 2-tallet angiver to iltatomer i molekylet. vis du vil vise, at der er flere molekyler af et stof, sætter du et tal foran den kemiske formel. 4 2 O fortæller, at der er fire vandmolekyler og 2O 2 fortæller, at der er to kuldioxidmolekyler. Når man angiver antallet af atomer, anvender man de grundlæggende regneregler, der gælder ved brug af parenteser. Formlen for Ammoniumsulfat er (N 4 ) 2 SO4. (N 4 ) 2 fortæller, at der er to kvælstofatomer og otte brintatomer (4x2). Desuden indeholder ammoniumsulfat et svovlatom og fire iltatomer. Molekyler 25
26 Grundstoffer og kemiske forbindelser Opgave 3.1 Er ilt (O 2 ) et grundstof eller en kemisk forbindelse? Opgave 3.5 Køkkensalt har formlen Nal. vilke atomer består et køkkensaltmolekyle af? Opgave 3.2 Er vand ( 2 O) et grundstof eller en kemisk forbindelse? Opgave 3.3 a) Ammoniak består af et kvælstofatom og tre brintatomer. Skriv den kemiske formel: b) Er ammoniak et grundstof eller en kemisk forbindelse? Opgave 3.4 a) ydrogensulfid (svovlbrinte) består af to brintatomer og et svovlatom. Skriv den kemiske formel: Opgave 3.6 Sæt ring omkring de stoffer, som er grundstoffer: 2 2 O N 2 N N 3 e Opgave 3.7 Sæt ring omkring de stoffer, som er molekyler: 2 2 O N 2 N N 3 e Opgave 3.8 Det oplyses, at et ukendt stof indeholder to sølvatomer samt et svovlatom. vilket stof er der tale om? b) Er hydrogensulfid et grundstof eller en kemisk forbindelse? 26 Kemi
27 Molekylevægt Vægten og måleglasset er vigtige redskaber i kemi, men skal kemien bruges i praksis, kommer man ikke uden om blyant, papir og lommeregner. De sikrer nemlig, at man bruger den rigtige mængde af et stof. Når du laver kemiske beregninger, skal du næsten altid begynde med at beregne molekylevægten. Man kan sige, at molekylevægten er et mål for summen af atommasserne i molekylet. Molekyleformel: Viser antallet af atomer af hver slags i molekylet Molekylevægt: Angiver summen af atomvægte i molekylet. Atomvægten er et udtryk for, hvor meget et atom vejer. vis du kender molekyleformlen, er det muligt at beregne molekylevægten for et hvilket som helst stof. Du kan bruge følgende fremgangsmåde som vist her for vand og kalk: 2 O: Vandmolekylet består af to brintatomer og et iltatom. vert brintatom har vægten 1 og iltatomets vægt er 16. Lægger vi disse atomvægte sammen, er molekylevægten for vand 18. : 2 x 1 = 2 O: 1 x 16 = 16 Molekylevægten for et vandmolekyle = 18 ao 3 : Kalkmolekylet består af et calciumatom, et kulstofatom og tre iltatomer. alciumatomets vægt er 40, kulstofatomets vægt er 12, og hver iltatoms vægt er 16. a: 1 x 40 = 40 : 1 x 12 = 12 O: 3 x16 = 48 Molekylevægten for et kalkmolekyle = 100 Når du kan regne molekylevægten ud, kan du beregne, hvor stor en andel et bestemt grundstof udgør af et sammensat stof. vis du f.eks. vil bruge ammoniumnitrat (N 4 NO 3 ) som gødning, så kan du læse indholdet af kvælstof (N) på gødningssækken. Men hvis du vil være helt sikker, kan du selv beregne kvælstofindholdet: Grund- Antal Atom Molekystof atomer vægt levægt N: 2 x 14 = 28 : 4 x 1 = 4 O: 3 x 16 = 48 Ammoniumnitrats molekylevægt = 80 Procent kvælstof indhold = 28 x 100 = 35% 80 Molekyler 27
28 Molekylevægt Opgave 3.9 Skriv i rigtig rækkefølge antallet og navnene på de grundstoffer, der indgår i følgende kemiske forbindelser. Molekyleformel Grundstoffer Stoffets navn As 2 O 3 K 2 O 3 Na 6 P 6 O 18 Arsenik Potaske Grahams salt Opgave 3.10 Beregn molekylevægten på Li 2 SO 4 : Molekyleformel Grundstof Antal atomer Atom vægt Molekylevægt All 3 Aluminium Li 2 SO 4 Klor Li 2 SO 4 I alt = 132 Li 2 SO 4 Li SO 2 4 Li SO 2 4 Li SO I alt = 2 4 Opgave 3.11 Beregn indholdet af kvælstof i procent i følgende handelsgødninger: a: Flydende ammoniak N3 b: hilesalpeter NaNO 3 28 Kemi
29 4. Ioner For bedre at forstå, hvad der sker i jord og planter, er det vigtigt at kende til ionerne. I gødningslæren og jordbundslæren kan du finde frem til ionernes betydning for dyrkning af landbrugsafgrøder. Planterne optager nemlig næringsstoffer fra jorden i form af ioner. Jo bedre jorden er til at fastholde plantenæringsstofferne (ionerne), desto mere frugtbar er jorden. Ion-ladninger Oktet-reglen: Atomer danner bindinger for at få 8 elektroner i den yderste skal. Fra afsnittet om atomkernens opbygning husker du, at atomer er elektrisk neutrale, fordi de har lige så mange protoner (p + ) i kernen, som de har elektroner (e - ) i elektronskallerne. Positive ioner Atomer med få elektroner i den yderste skal vil gerne afgive de yderste elektroner. Afgiver atomet de yderste elektroner, bliver der protonoverskud og atomerne omdannes til positive ioner. Da alle metal-atomerne let afgiver elektroner, vil de altid danne positive ioner ved at afgive én eller flere elektroner. Negative ioner De atomer, som mangler nogle få elektroner i at nå op på 8 elektroner i den yderste skal, vil gerne optage elektroner. De vil indfange de manglende elektroner og derved få elektronoverskud. Disse atomer vil omdannes til negative ioner. Et positivt ladet atom kaldes en positiv ion. Et negativt ladet atom kaldes en negativ ion. Ionernes ladninger kan forklares ud fra oktet-reglen: Atomer eller atomgrupper, der er blevet elektrisk ladet, kaldes for ioner. For at følge oktetreglen kan atomerne lave elektronfællesskaber (elektronparbinding), eller de kan overføre én eller flere elektroner fra det ene atom til det andet derved dannes ioner. Ioner ligner stofferne fra 8. hovedgruppe Molekyler 29
30 Natriumatom til -ion Natrium er et metal og afgiver let en elektron (e - ). Natriumatomet kan blive positivt ved at afgive en elektron (e - ). Natrium-atom Natrium-ion Na + Figur 4.1 Natrium-atomet bliver til den positive natrium-ion ved at afgive en elektron. Natrium-ionen har 8 elektroner i den yderste skal. Ionen ligner altså et stof fra 8. hovedgruppe, og den opfører sig stabilt. Kloratom til -ion Kloratomet har 7 elektroner i den yderste skal. Klor optager derfor gerne en elektron for at udfylde den yderste skal. Klor kan blive til en negativ ion ved at indfange en elektron (e - ). Klor-atom Klor-ion l - Figur 4.2 Klor-atomet bliver til den negative klor-ion ved at indfange en elektron. Som klor-ion er klor nu i en stabil tilstand med 8 elektroner i den yderste skal. Den ekstra elektron kommer fra et andet atom, der afgiver elektroner, f.eks. fra et natrium-atom, der er blevet til en natrium-ion. På denne måde får begge atomer en fyldt yderskal. Men nu er atomerne ikke længere elektrisk neutrale de er blevet til ioner. Figur 4.3 Den elektron, som natriumatomet har for meget, afgives til klor-atomet, som mangler en elektron. Dobbeltladet ioner vis et atom afgiver eller optager to elektroner, kalder vi den dannede ion for dobbeltladet. alcium har to elektroner (e - ), i den yderste skal, og vil skille sig af med de to elektroner for at få fyldt sin yderste skal. alcium får derfor dobbelt så stor en positiv ladning som f.eks. natrium. alcium bliver således til ionen a ++ eller a 2+. For at atomer kan blive ioniseret (omdannet til ioner), skal de flyde frit omkring i en væske eller i luften, så de har chancen for at støde sammen og udveksle elektroner. 30 Kemi
31 Ion-ladninger Opgave 4.1 Sæt ring omkring det rigtige ord: a) vis et brintatom mister sin ene elektron, er der kun protonen tilbage og derfor bliver atomet positivt / negativt ladet. Opgave 4.2 I 2. hovedgruppe har grundstofferne 2 elektroner i den yderste skal. Disse afgives let. vilken ion vil magnesium danne? b) + kaldes en positiv / negativ brintion. Opgave 4.3 a) De nedenstående grundstoffer danner ioner efter oktet-reglen, som er beskrevet i det foregående. Skriv ionernes ladning på det kemiske symbol. Brint Det periodiske system ovedgrupper elium e Lithium Li Berylium Be Bor B Kulstof () Kvælstof N Ilt O Fluor F Neon Ne Natrium Magnesium Aluminium Silicum Na Mg Al (Si) Fosfor P Svovl S Klor l Argon Ar Kalium K alcium a b) vorfor er kulstof og silicium sat i parentes? Opgave 4.4 Prøv om du kan svare på dette spørgsmål, før du går videre i bogen: Saltsyre har formlen l. vilke ioner består stoffet af? Ioner 31
32 Ion-forbindelser Indenfor kemi træffer vi aldrig en positiv ion uden samtidig at møde dens modpol en negativ ion. Nal (køkkensalt) kaldes for en ion-forbindelse, fordi stoffet er opbygget af ioner. er er lige mange Na + -ioner og l - -ioner, fordi natriumionerne ligesom klorid-ionerne er enkeltladede. Ion-gitter Ion-forbindelser er opbygget af et stort antal positive og negative ioner, der fastholdes i et bestemt»mønster«af de elektriske kræfter. Dette»mønster«kaldes for et ion-gitter. Bindingen mellem ionerne er meget stærk, og en ionforbindelse kan ikke lede elektrisk strøm, fordi der ikke er frie elektroner. Figur 4.4 Ion-gitter. På tegningen kan du se, hvorledes ionerne er anbragt i forhold til hinanden i et natriumklorid krystal. 32 Kemi
33 Når ion-forbindelser går i opløsning vis en ion-forbindelse kommer i vand eller smeltes, vil den lidt efter lidt gå i stykker, og ionerne vil bevæge sig rundt mellem hinanden. Dette vil ske, hvis vi kommer Nal i vand. Derved opløses natriumklorid i form af positivt ladede natriumioner og negativt ladede klor-ioner. Disse ioner vil hele tiden støde ind i hinanden og danne ion-forbindelsen Nal. Men ion-forbindelserne vil også hele tiden blive revet fra hinanden og danne frie ioner, som igen støder sammen og danner ion-forbindelser og så videre. Når ioner kombineres De fleste stoffer, vi finder i kemilokalet, er opbygget af ioner. Man kalder alle de stoffer, som består af ioner, og som holdes sammen af ionbindinger, for salte. I fagsproget kaldes negativt ladede ioner for anioner, og positivt ladede ioner kaldes for kationer. Du kan f.eks. i faget jordbundslære støde på udtrykket kationskapacitet, hvilket er et mål for jordens evne til at binde positivt ladede ioner (f.eks. plantenæringsstoffer). Jo bedre jorden er til at holde fast i plantenæringsstofferne, jo mere frugtbar er jorden. I en ionforbindelse vil der altid være lige mange positive og negative ladninger Nogle af de ioner, du hyppigt støder på, er samlet i tabel 4.1, så du let kan danne navne og formler for et stort antal salte. Positive ioner kaldes kationer Brint + Natrium Na + Kalium K + Kobber u + eller u ++ alcium a ++ Magnesium Mg ++ Zink Zn ++ Aluminium Al +++ Negative ioner kaldes anioner Klorid l - Fluorid F - Oxid O -- Sulfid S -- Tabel 4.1 I tabellen kan du selv finde frem til formlen for forskellige ion-forbindelser. Du skal blot huske, at i salte er der ladningsligevægt, dvs. balance mellem de positive og negative ladninger. Ioner 33
34 Ion-forbindelser Eksempler på ion-forbindelser: 1. eksempel: Natriumklorid Natrium kan reagere med klor og danne stoffet natriumklorid, der er en ion-forbindelse af Na + og l -. Da begge ioner er enkeltladede, indeholder natriumklorid lige mange natrium-ioner og klor-ioner. 2. eksempel: alciumklorid Når calcium reagerer med klor dannes calciumklorid. Da calcium er dobbeltladet og klor enkeltladet, kræves her 2 klor-ioner for få lige mange positive og negative ladninger i ion-forbindelsen. 3. eksempel: Aluminiumoxid Når aluminium reagerer med ilt (oxygen), dannes aluminiumoxid. vis vi skal skrive formlen for denne ion-forbindelse, skal vi have 2 Al +++ -ioner og 3 O -- -ioner for netop at få lige mange positive og negative ladninger. Na + + l - A Nal Figur 4.5 En natrium-ion passer sammen med en klorid-ion. a l - A al 2 + Figur 4.6 En calcium-ion passer sammen med to klorid-ioner. 2 Al O -- A Al 2 O 3 Figur 4.7 To aluminium-ioner passer sammen med tre oxid-ioner. Opgave 4.5 Atomer Ioner Formlen for det nye stof Navnet på det nye stof Zn og S Zn ++ + S -- A ZnS Zinksulfid Na og O A K og S A Al og l A a og F A 34 Kemi
35 Når molekyler bliver til ioner Du har nu set, hvordan simple ioner kan dannes, men ioner kan også bestå af flere atomer. Der er altid ladningsligevægt i ionforbindelser. vis du husker ovenstående læresætning, kan du nemt finde ud af, om de sammensatte ioner er positive eller negative. MgSO 4 er magnesiumsulfat. Iontabellen (tabel 4.1) viser, at magnesium-ionen hedder Mg ++, men hvilken ladning har SO 4 -gruppen? Da ionforbindelser er neutrale, må der være lige mange positive og negative ladninger. Mg ++ må altså modsvares af SO vis du kender ladningen på en af de ioner, som er bundet til hinanden, kender du også ladningen på den anden. vis den ene er positiv, må den anden være negativ. Mineraler Mineraler består af grundstoffer, og kan deles op i to grupper: Makromineraler og spormineraler. Makromineraler Af makromineraler kan nævnes calcium, natrium, fosfor, kalium og magnesium. alcium-ionen udgør en væsentlig bestanddel af vore knogler. Skelettet hos et voksent menneske vejer cirka 10 kg, og en stor del heraf består af den kemiske forbindelse calciumfosfat. Mælk er en vigtig calcium-ion kilde, men man optager også calcium-ioner, når man drikker vand, fordi grundvandet i Danmark indeholder meget calcium-carbonat. I det periodiske system kan man læse følgende om kulstof: findes i salt Nal. Legemets væsker indeholder et stort antal Na + -ioner og l - -ioner, hos et voksent menneske findes opløst omkring et 1 4 kg salt. Ved hårdt fysisk arbejde eller hård motionstræning, sveder man ofte meget. Man kan blive dårlig af for megen fysisk aktivitet, fordi sveden, der forlader kroppen, indeholder salt og derved ødelægges væske/salt balancen. Ioner 35
36 Spormineraler Af spormineraler kan nævnes jern, selen, zink og iod. Mange har svært ved at få tilstrækkeligt af disse mineraler gennem den daglige kost. Det gælder specielt, hvis man ikke spiser ret meget, eller hvis man spiser en meget ensidig kost. For eksempel kan for lidt jern i kosten give jernmangel, hvilket kan medføre blodmangel. Jern-ioner er nemlig en vigtig del af blodet. Typiske symptomer på jernmangel er træthed, hovedpine og svimmelhed. Jernmangel kan oftest afhjælpes ved at indtage et kosttilskud. Så længe du spiser en alsidig og varieret kost, bliver dit daglige behov for metal-ioner dækket gennem din daglige kost. 36 Kemi
37 5. Syrer, baser og salte I daglig tale opfattes sød som det modsatte af sur. Indenfor kemi gælder imidlertid, at basisk er det modsatte af sur. Der findes også måleapparater (p-metre), hvor p-værdien kan aflæses efter samme skala blot mere nøjagtigt. Det er ikke altid en god ide at smage på stoffer for at afgøre, hvor sure eller basiske de er. Det kan endda være farligt. Eddikesyre og myresyre er i koncentreret form så stærke, at de ætser. Derfor må man aldrig smage på et stof, medmindre man med sikkerhed ved, at det ikke er giftigt eller ætsende. Du kan i stedet bruge et stykke indikator-papir til at»smage«for dig. Indikator-papir fortæller dig, hvor sur eller basisk den væske er, som papiret dyppes ned i. p-værdien Når du køber indikator-papir, medfølger der en farveskala forsynet med tal kaldet p-værdien. En sur opløsning farver indikator-papiret rødt, en basisk opløsning farver det blåt. Indikator-papiret bliver gult eller svagt grønligt, hvis opløsningen er neutral. p-værdien er et mål for, hvor sur eller basisk en væske er. Figur 5.1 p-skalaen går fra 0 til 14. En neutral væske har p-værdien 7. Er p-værdien mindre end 7, er væsken sur og hvis p-værdien er større end 7, er væsken basisk. Syrer, baser og salte 37
38 Forsøg med indikator-papir Du kan selv måle p-værdier i forskellige dagligdags produkter med indikatorpapir. Udfyld skemaet: Produkt Farve p-værdi Mælk Kaffe The Øl Sodavand Vand Tykmælk Opvaskemiddel Toiletrens Ajax Mineralvand, sodavand og øl tilsættes luftarten kuldioxid (O2). Det er derfor det bruser, når man åbner flasken. Smagen er frisk og syrlig, og det skyldes, at kuldioxid i vandet danner en syre, der kaldes kulsyre. Syrer Du kender allerede nogle syrer. De smager surt. Når vi spiser forskellige slags frugt, kan vi smage, at nogle er mere sure end andre. Mange frugter indeholder frugtsyrer. En citron smager meget surt fordi saften, som mest består af vand, også indeholder citronsyre. I mange grøntsager og frugter findes der et vigtigt vitamin, -vitamin. vis du har prøvet at spise -vitamintabletter, så ved du, at de smager surt. -vitamin kaldes også askorbinsyre. Når mælk bliver sur, er det fordi, der er blevet dannet mælkesyre. En del mælkeprodukter fremstilles, så de bliver sure som for eksempel A-38, ymer og kærnemælk. Figur 5.2 Mange fødevarer indeholder syrer. 38 Kemi
39 + -ioner og p Når alle syrer farver indikator-papir rødt, skyldes det, at alle syrer indeholder + -ioner. Det er koncentrationen af + -ioner, som bestemmer surhedsgraden, og p er netop et mål for for + -ioner pr. liter i en opløsning. Des større + -koncentration, des mere sur bliver opløsningen og dermed lavere p-tal. Saltsyre er en opløsning af lige mange + og l - -ioner i vand. Det er + -ionerne, der gør saltsyre sur. ver gang man fortynder saltsyre 10 gange, stiger p med 1 p-enhed. p er et udtryk for + - ion koncentrationen. Jo større koncentration, jo lavere er p-værdien. Figur 5.3 Tegneserien viser, hvorledes 1 ml saltsyre med p = 0 fortyndes 10, 100, 1000, 10000, 10000, , og gange. Læg mærke til, at p ændrer sig ved fortynding! Syrer, baser og salte 39
40 Syrer når noget er surt Opgave 5.1 vad er p i en væske, som indeholder 0,0001 gram + - ioner pr. liter? vis p-værdien i en væske stiger, vil surhedsgraden så falde eller stige? Opgave 5.2 vad er p i en væske, som indeholder 0,01 gram + - ioner pr. liter? Opgave 5.4 vor mange gram + -ioner er der pr. liter i en væske ved: a) p 0 b) p 2 Opgave 5.3 c) p 6 Jordens p Landbrugsjorden har en tendens til at blive sur. Når jorden bliver sur, skyldes det, at både planterødderne, mikroorganismerne og større organismer ånder. Ved ånding er disse organismer medvirkende til, at der dannes brint-ioner, der sænker jordens reaktionstal og gør jorden sur. I jordbruget anvender man reaktionstallet (Rt) til at beskrive jordens surhed (p-værdi). Det er vigtigt for landmænd og gartnere, at jorden har den rette p-værdi, for mange planter trives bedst i neutral jord, andre afgrøder kræver lidt sur jord og atter andre lidt basisk jord. Kartofler vokser bedst i sur jord. vis p er for højt, kan kartoflerne blive angrebet af svampesygdommem skurv. Byg og bederoer er eksempler på afgrøder, der bedst trives i jorder med forholdsvist højt p. 40 Kemi
41 Planterøddernes og mikroorganismernes aktivitet er med til at gøre jorden sur. Planterødderne udskiller O 2, som i jordvæsken går i forbindelse med vand og danner den svage syre, kulsyre ( 2 O 3 ). O 2 + O O (kulsyre) Dobbeltpilen fortæller, at reaktionen går begge veje, og at noget af stoffet findes i den form, som er vist på venstre side af pilen, mens andet findes som stoffet på højre side af pilen. Dette kaldes en kemisk ligevægtsligning. En ligevægt, hvor kulsyre indgår, danner en brintion ( + ) og en hydrogen karbonation (O 3 -), som ligningen viser. 2O3 A + + O3 - På grund af kulde og tørke er O2-produktionen lav i vinter- og sommerperioden. Om foråret og efteråret, hvor O2-produktionen er størst vil p i jorden derfor være lavere. Det meste af den dyrkede jord i Danmark har et p fra 6,5 til 7,5. Visse jordtyper er dog meget sure. I mosejord kan man måle p helt ned til 4,5. Analyse af jordprøve vis din skole har et p-meter kan du medbringe en jordprøve og måle surhedsgraden ved at gøre følgende: 2,5 gram jord afvejes i et bægerglas Tilsæt 25 ml al 2 og rør godt rundt p måles næste dag Der skal lægges 0,5 til resultatet Når man måler jordens p, tilsætter man en opløsning af calciumklorid al2 for at udligne variationer i indholdet af + -ioner. Den tilsatte al2 sænker p, derfor lægger man 0,5 til resultatet. Syrer, baser og salte 41
42 Jordbundsundesøgelser 1996 (udsnit af et markkort) Reaktionstal (Rt.) Fosfortal (Pt.) Kaliumtal (Kt.) Magnesiumtal (Mgt.) Kobbertal (ut.) Figur 5.4 Figuren viser i udsnit resultatet af en jordbundsanalyse. For hver mark er der angivet jordens reaktionstal. Planteavlskonsulenten kan udfra reaktionstallet og sædskiftet beregne, hvor meget kalk, der skal tilføres jorden for at hæve jordens surhedsgrad. Signatur: t. Kalk/ha Stærk kalktrang Kalktrang (3t. kalk/ha) Svag kalktrang (2t. kalk/ha) Ingen kalktrang 42 Kemi
43 Stærke og svage syrer Syrer er stoffer, som kan fraspalte + -ioner. Alle syrer indeholder foruden + - ioner også negative ioner i vandig opløsning. De negative ioner kaldes syrerest-ioner. I saltsyre hedder den negative syrerest-ion en klorid-ion l -. Saltsyre er i vandig opløsning helt omdannet til + og l - ioner. Man siger, at saltsyre er fuldstændig ioniseret (spaltet fuldstændigt i ioner). En opløsnings surhedsgrad bestemmes af + -ion koncentrationen. Stærke syrer Syrer der er fuldstændig ioniserede, kaldes for stærke syrer. Til de stærke syres familie hører saltsyre l, svovlsyre 2 SO 4 samt salpetersyre NO 3. Svage syrer De svage syrer spaltes kun delvis, hvilket medfører, at svage syrer ikke danner så mange + -ioner pr. ml. Derfor får de ikke så lave pværdier som de stærke syrer. Det gælder f.eks. for eddikesyre, som kun er delvis ioniseret. I en opløsning af eddikesyre er kun én ud af hver hundrede eddikesyremolekyler omdannet til + - og syrerest-ioner, som her hedder acetat-ioner. Syrens Formel Spaltning i ioner Syrerest- Spaltning Syrens styrke navn ionens navn Saltsyre l + + l - Klorid fuldstændig stærk Svovlsyre 2SO SO 4 -- Salpetersyre NO3 + + NO 3 - Fosforsyre 3PO PO Sulfat Nitrat fuldstændig stærk fuldstændig stærk Fosfat delvis middel stærk Eddikesyre 3 OO OO - Acetat delvis middel stærk Svovlbrinte 2 S S -- Sulfid delvis ret svag Kulsyre 2O O 3 -- arbonat meget lidt meget svag Tabel 5.1 Tabellen viser, hvilke ioner forskellige syrer spaltes i og navnet på syrerest-ionen. Syrer, baser og salte 43
44 Stærke og svage syrer Opgave 5.6 a) Skriv den kemiske formel for saltsyre: Opgave 5.7 Angiv hvilke ioner salpetersyre kan spaltes i: NO 3 + b) Skriv den kemiske formel for svovlsyre: Opgave 5.8 Angiv hvilke ioner kulsyre kan spaltes i: 2 O 3 + c) vis der i en flaske fortyndet svovlsyre og en flaske saltsyre er nøjagtig lige mange molekyler. vilken af syrene har så det laveste p? Opgave 5.9 Sæt ladninger på ionerne: a) 2 SO SO 4 b) 3 OO + 3 OO c) 2 S 2 + S Baser Syrer og baser kan være farlige at omgås. Syreopløsninger med lavt p er ætsende, og baseopløsninger med højt p kan også være ætsende. Jo stærkere en base er, desto højere p-værdi har den. Mange rengøringsmidler er baser, f.eks. ammoniakvand, Ajax, salmiakspiritus, sæbepulver til opvaskemaskiner og afløbsrens. Den udbredte brug af baser i den daglige husholdning skyldes deres fortræffelige evne til at opløse fedt. 44 Kemi
45 Baser er det modsatte af syrer: * Syrer er stoffer, som kan fraspalte + -ioner. * Baser er stoffer, som kan optage + -ioner. Stærke og svage baser Natriumhydroxid Natriumhydroxid (NaO) er en stærk base, der blandt andet bruges til»afsyring«af gamle malede møbler. Andre navne for natriumhydroxid er kautisk soda, ætsnatron eller natronlud. I daglig tale bruges ofte ordet lud om baser. Vi taler for eksempel om at lude halm, når vi behandler halmen med en stærk base for at øge foderværdien. Natriumhydroxid er letopløseligt i vand, men vær forsigtig, når du opløser stoffet, for opløsningen bliver meget varm. En opløsning af NaO leder den elektriske strøm godt. Vi kan netop påvise, at et stof må indeholde ioner, hvis det opløst i vand kan lede den elektriske strøm, og kan deraf slutte, at fortyndet NaO indeholder ioner. Opløst i vand indeholder NaO ionerne: NaO Na + + O - alciumhydroxid alciumhydroxid a(o) 2 ( i daglig tale læsket kalk) er også en stærk base. Opløst i vand indeholder a(o) 2 ionerne: a(o) 2 a O - Ammoniak Ammoniak (N 3 ) er en svag base, der reagerer lidt anderledes. I følge definitionen på en base skal stoffet være i stand til at optage + -ioner. Dette sker, når ammoniak opløses i vand, så dannes O - ioner på følgende måde: N O N O - Baser er stoffer, som danner O - ioner. Eksempel I fortyndet natriumhydroxid er der hovedsagelig Na + -ioner og O - ioner. Natriumhydroxid siges derfor at være en stærk base. I ammoniakopløsningen findes der også O - -ioner, idet opløsningen reagerer basisk. I fortyndet NaO samt fortyndet N 3 af samme koncentration, finder vi forskellig p. I natriumhydroxid er der en 100 gange større koncentration af O - -ioner. Dvs. en forskel i p på 2 enheder. Syrer, baser og salte 45
46 Repetition af syrer og baser Opgave 5.10 a) Sæt ring omkring syrerne: l Nal NO 3 KO 2 S b) vorfor er de øvrige stoffer ikke syrer? Opgave 5.11 vor findes der flest + -ioner, i en liter svag syre eller i en liter svag base? Opgave 5.15 I en Pepsi ola er p 3,2 og i en oca ola er p 2,6. I hvilken cola er der flest + -ioner? Opgave 5.16 I en shampoo til fedtet hår er p 8,2 og i en shampoo til normalt/fint hår er p 6,5. I hvilken shampooflaske er der flest O - -ioner? Opgave 5.17 Sæt ladninger på ionerne: Opgave 5.12 a) vis der er overskud af O - ioner i en væske, siger man, at den er: 3 sur 3 basisk 3 neutral b) Destilleret vand er: 3 surt 3 basisk 3 neutralt Opgave 5.13 vad er p i en væske, som indeholder 1 gram + -ioner/liter? a) NO 3 + NO 3 b) NaO Na + O c) N 4 O N 4 + O d) 3 PO PO 4 Opgave 5.18 Gør reaktionerne færdige: a) 2 O + Opgave 5.14 vad er p i en væske, som indeholder 0, gram + -ioner/liter? b) KO + c) l + d) Fe(O) Kemi
47 Neutralisation En syre og en base kan neutralisere hinanden. Man kan uskadeliggøre en syre ved at tilsætte en base. ydrogen-ionerne + fra syren vil reagere med hydroxid-ionerne O - fra basen og danne almindeligt vand: + + O - 2 O Det gælder om at tilsætte lige så mange O - -ioner, som der er + - ioner i opløsningen, så den bliver neutral og får en p-værdi tæt ved 7. Ved de fleste neutralisationer vil du kun se det faste stof, hvis du fjerner vandet, hvori saltet ellers vil være opløst. Det dannede salt består af ioner, altid en metal-ion (eller ammonium N 4 +) og en syrerest-ion. Ionerne holdes sammen i et ion-gitter, ligesom det var tilfældet med natriumklorid (se fig. 4.4). Salt er en kemisk forbindelse af metal-ioner og syrerest-ioner. Syre + base salt + vand Når du blander en syre og en base sammen, vil der være andre ioner end + - ioner og O - -ioner i væsken, og derfor kan der samtidig forekomme andre kemiske reaktioner. Det kan du se, hvis du blander saltsyre (stærk syre) og natriumhydroxid (stærk base) sammen. l + NaO Nal + 2 O saltsyre natrium- natrium- vand hydroxyd klorid I dette eksempel dannes foruden vand også et fast stof. Stoffet, der dannes, er salt ved navn natriumklorid også kendt som køkkensalt. vis du kommer natriumklorid i vand, vil du ikke kunne måle en ændring i p. Man siger, at saltet natriumklorid er neutralt. vis du blander kulsyre (svag syre) med calciumhydroxid (stærk base), får du calciumkarbonat (kalk) og vand som resultat: 2 O 3 + a(o) 2 ao O kulsyre calcium- calcium- vand hydroxyd carbonat Det viser sig, at kalk ikke er et neutralt salt. Kalk kan nemlig optage + -ioner, og derfor er kalk en base. Man siger også, at kalk er et basisk salt. Regler for, hvornår et salt bliver neutralt, surt eller basisk: stærk syre + stærk base neutralt salt svag syre + svag base neutralt salt stærk syre + svag base surt salt svag syre + stærk base basisk salt Syrer, baser og salte 47
48 Fremstilling af brint Du skal nu fremstille salte og danne brint ved at opløse metaller i syrer. Det kan derfor være en god hjælp at kikke tilbage på, hvordan du kombinerede ioner i kapitel 4. Eksempel: Zinkklorid Man kan lave hydrogen (brint) ved at hælde fortyndet saltsyre over nogle stykker zink. Når zink reagerer med saltsyre, afgiver hvert zink-atom 2 elektroner, hvorved zink-atomet omdannes til en Zn ++ -ion. De to elektroner optages af to + -ioner fra syren. Disse bliver neutrale og kobler sig sammen til et 2 -molekyle og 2 bobler op fra zinkstykkerne. Når alle hydrogen-ionerne på denne måde er erstattet af zink-ioner, har vi en opløsning, som indeholder positive Zn ++ -ioner og negative l - -ioner. Reaktionsligningen for metal-ionen og syren viser, hvad der er sket: Zn + 2l Zn l Znl zink saltsyre zinkklorid hydrogen Opgave 5.19 Du kan fremstille brint, ved at komme magnesium i saltsyre. Prøv at skrive reaktionsligningen op: magnesium + saltsyre magnesiumklorid + hydrogen Opgave 5.20 Du skal fremstille brint, ved at opløse zink i svovlsyre. Prøv at skrive reaktionsligningen op: zink + svovlsyre zinksulfat + hydrogen Opgave 5.21 a) vilke ioner indeholder salpetersyre NO 3? og b) vilke ioner indeholder natriumhydroxid NaO? og c) Gør følgende reaktion færdig! NO 3 + NaO 48 Kemi
49 6. Opløsninger og blandinger vis man rører lidt kogsalt op i vand, vil det blive helt opløst. Man kan således ikke se, at væsken er blevet salt, og vandet vil være lige så klart, som før saltet blev opløst. Når et stof opløses i molekyler eller ioner, kaldes det for en ægte opløsning. I saltvand er det natriumioner og klorid-ioner, som svæver frit omkring, jævnt fordelt mellem vandmolekylerne. En opløsning kan være mættet eller umættet. Opløsningen er mættet, når der f.eks. ikke kan opløses mere salt i vandet. Kogsaltet forbliver synligt og synker til bunds. vis der kan opløses meget af et stof i vand, før opløsningen er mættet, siger man, at stoffet er letopløseligt i vand. Kogsalt er letopløseligt i vand. K + Na + a ++ o ++ u ++ Fe ++ Mg ++ Mn ++ Zn ++ l - NO 3 - SO 4 -- O 3 -- PO Tabel 6.1 Tabellen viser opløseligheden i vand for forskellige salte. De lyse felter viser, at saltet er letopløseligt i vand. Et mørkt felt betyder, at saltet er tungtopløseligt i vand, f.eks. ao 3. Når man kalker eller gøder, har det stor betydning, om de stoffer, man bruger, er letopløselige i vand. Stofferne skal jo opløses i jordvæsken for at trænge ned i jorden, så planterødderne kan optage næringsstofferne. Opgave 6.1 a) vad hedder den farlige luftart, som findes i gylle? b) vornår frigøres denne luftart fra gylle? Syrer, baser og salte 49
50 Sammenhæng mellem temperatur og opløsning Forsøg med mættet saltopløsning Vigtigt: usk ingen prop på kolben under opvarmning! a) Afmål nøjagtig 75 ml fra den kolde hane og hæld det i et bægerglas. b) Vej glas + vand og skriv resultatet i skemaet. c) Lav en mættet salt-opløsning. Begynd med at tilsætte 24 gram salt. Tilsæt derefter små skefulde. usk omrøring mellem hver skefuld. Når der ikke kan opløses mere salt vejes opløsningen, og temperaturen måles. d) Kolben med indhold opvarmes nu til 50 grader. Undersøg om der kan opløses mere salt. Derefter vejes kolben med indhold. e) Kolben med indhold opvarmes nu til 80 grader. Undersøg om der kan opløses mere salt. Derefter vejes kolben med indhold for sidste gang. Vægt af: Vandets temperatur Opløsning + glas Glas + vand Salt koldt f) Marker med krydser i koordinatsystemet resultaterne fra skemaet og tegn en linje mellem punkterne. 50 Kemi
51 Opslæmning Du har i det foregående set, hvordan et stof kan opløses helt eller delvist i en væske. vad sker der med et stof, som ikke kan opløses? vis man forsøger at opløse et uopløseligt stof i en væske, får man en opslæmning. En opslæmning er en mekanisk blanding, det vil sige, at der ikke sker noget med stofferne hverken fysisk eller kemisk. I en opslæmning vil man kunne se partiklerne svæve rundt i væsken. Væsken vil være grumset og uklar. vis man lader opslæmningen stå, vil partiklerne synke til bunds eller stige op til overfladen (hvis stoffet er lettere end vand). Eksempler på opslæmninger kan være en salatdressing (olie i eddike) samt visse typer maling. vis man vil undersøge forholdet imellem grus, sand, ler og humus kan man lave en opslæming af jord i vand. I en køletank med mælk vil der dannes et lag fløde efter et stykke tid uden omrøring. For at undgå, at fløden ligger øverst i mælkekartonen, homogeniserer (findeler) man fedtkuglerne i mælken. Denne type opslæmning kaldes for en emulsion. Kolloid opløsning Nogle stoffer har den egenskab, at de hverken bundfældes eller opløses, når man kommer dem i en væske. Man kan ikke umiddelbart se partiklerne i væsken, som man kunne med opslæmningen. Denne type opløsning kaldes for en kolloid opløsning. Eksempler på kolloide opløsninger er æggehvide i vand, kaffe og tusch. Når kolloiderne kan holde sig flydende i en væske, så skyldes det, at kolloiderne er elektrisk ladede partikler. Normalt er de negativt elektrisk ladede. På grund af deres elektriske ladning frastøder de enkelte kolloider hinanden, hvorved partiklerne holdes svævende i væsken. vis man tilsætter en syre til en opløsning indeholdende kolloider, så vil + - ionerne neutralisere kolloidernes ladning. De klumper derefter sammen og synker til bunds. Figur 6.1 Ægte opløsning Figur 6.2 Opslæmning Figur 6.3 Kolloid opløsning Opløsninger og blandinger 51
52 Blandinger I praktisk landbrug kan du komme ud for, at du ønsker at blande to eller flere stoffer. Tabel 6.2 Blandingstabellen viser bl.a., at det er muligt at blande sprøjtemidlet Pirimor mod lus og sprøjtemidlet Solubor mod bormangel. Lad os tage et eksempel fra roemarken. For at give det optimale udbytte kræves der flere sprøjtninger mod forskellige skadevoldere i løbet af vækstsæsonen. I praksis vil man ofte lave blandinger af sprøjtemidler og næringsstoffer for at spare antallet af kørsler i marken. Forestil dig, at du ønsker at sprøjte din roemark mod bladlus. Samtidig tyder noget på, at roerne mangler bor, idet store dele af de yderste blade er gulbrune og ligger fladt på jorden. Nu vil det være praktisk, hvis man kan sprøjte med en blanding af bor og et sprøjtemiddel mod lus kan man det? Når man blander to sprøjtemidler, er det svært at forudsige, hvordan de vil reagere. Man kan risikere, at de reagerer kemisk med hinanden, og resultatet vil blive en øget eller nedsat effekt. De kan også udfældes (kolloid opløsning) og stoppe dyserne, eller svide afgrøden. vor vidt du kan blande forskellige sprøjtemidler og næringsstoffer, kan du finde oplysninger om i en kemikalie-håndbog. 52 Kemi Kilde: DLG Planteværn 1997
53 7. Stoffernes tilstandsform De kemiske stoffer forekommer i forskellige tilstandsformer i fast form, flydende eller luftformige. Vand kan forekomme som is, vand og damp. Vandets tilstandsform er først og fremmest afhængig af temperaturen. Vand fryser til is ved 0 og bliver til damp over 100. Dette gælder når lufttrykket er 1 atmosfære (omtrent = 1 Bar). Man siger, at vand optræder i tre tilstandsformer: Fast stof, væske og luftform. Når vi siger, at vand er en væske, er det fordi, det er i flydende form ved almindelig temperatur (cirka 20 ). Når man opløser et stof i vand, ændres frysepunktet. avvand fryser først ved -2, fordi der er cirka 3,5% salt opløst i havvandet. Strør man salt på sne, smelter den, idet der dannes en væske med stort saltindhold, og denne væske fryser først ved cirka -20. Ved temperaturer under -218 er ilt et fast stof. Ved højere temperaturer overgår det i første omgang til væskeformig tilstand. Ved temperaturer over -182 overgår ilt til luftform og findes altså i de samme tre tilstandsformer som de fleste andre stoffer. Guld er et fast stof indtil 1064, og det fordamper ved Figur 7.1 Vand har tre tilstandsformer Stoffernes tilstandsform 53
54 Luftarters massefylde Molekylerne i en luftart vil konstant være i fri bevægelse. Der er sammenhæng mellem varme og molekylernes bevægelse. Jo højere temperatur, desto hurtigere bevæger molekylerne sig. Jo hurtigere molekylerne bevæger sig, desto kraftigere bliver sammenstødene. Indeslutter man luft i en beholder og måler trykket, er det under normale forhold cirka 1 bar til at begynde med. Varmer man beholderen op, vil molekylerne bevæge sig hurtigere og dermed støde ind i beholderens vægge med større kraft trykket bliver måleligt højere. vis man i stedet for gør beholderen mindre, bliver der mindre plads til luftmolekylerne, og de vil oftere ramme beholderens vægge. Dette vil igen medføre et højere tryk og en stigende temperatur på grund af de hyppigere sammenstød mellem molekylerne. Tryk og temperatur følges ad. Når rumfanget øges, bliver massefylden mindre fordi massefylde = vægt/rumfang. Når beholderen opvarmes stiger temperaturen og luftarten udvider sig. Et bildæk får højere lufttryk, når det varmes op af solen eller ved kørsel på grund af dækkets gnidning mod vejen. Derfor anbefales det at måle dæktrykket, når luften i dækket er kold. Når stemplet presses ind, bliver rumfanget mindre og massefylden forøges. Figur 7.2- Massefylde 54 Kemi
55 Massefylden for en luftart er afhængig af tryk og temperatur. Massefylde = massen af et stof i forhold til rumfang Når du skal sammenligne massefylde for forskellige luftarter, må du forudsætte, at de har samme tryk og temperatur. I det følgende vil vi udregne massefylde ved såkaldt normaltryk og temperatur (1 atmosfæres tryk og 20 ). Lige store rumfang af en luftart indeholder altid lige mange molekyler ved samme tryk og temperatur. Det betyder, at massefylden for en luftart er direkte afhængig af vægten af hvert molekyle. Jo større molekylevægt en luftart har, jo større er luftartens massefylde. Man kan finde massefylden for en luftart, hvis man kender molekylevægten: Molvægten er det antal gram af stoffet, som angives af stoffets molekylevægt. 1 mol = Det antal molekyler, der skal til, for at molvægten i gram nummerisk svarer til molekylevægten i units. 1 mol af en luftart fylder altid 24 liter (ved normal tryk og temperatur). Massefylde for brint 1 mol 2 vejer: 2 x 1 = 2 gram 1 mol brint fylder: 24 liter Massefylden for brint: 2 = 0,09 g/l 24 Brint vejer kun 1 af atmosfærisk luft 16 og er den letteste luft, der eksisterer. Massefylde for ilt 1 mol O 2 vejer: 2 x 16 = 32 gram 1 mol ilt fylder: 24 liter Massefylden for ilt: = 1,33 g/l Figur 7.3 En luftart vil stige opad, hvis massefylden er mindre end massefylden for atmosfærisk luft. Vægt af 48 liter kulilte Molekylevægt for O: = 28 gram 24 liter O vejer altså 28 gram. 48 liter svarer til to mol O og vejer dermed: 2 x 28 = 56 gram Stoffernes tilstandsform 55
56 Tilstandsformer og massefylde Opgave 7.1 Angiv tilstandsformen for følgende stoffer: Ammoniak -78 Smelte- Koge punkt punkt -34 Kvælstof Ilt Opgave 7.2 Kender du nogle stoffer, som ikke har et fast smeltepunkt? b) vor meget fylder 1 mol ammoniak? Opgave 7.3 a) vor meget vejer 1 mol helium (e)? c) Massefylden for ammoniak er: Opgave 7.5 a) vor meget vejer 24 liter kulilte (O)? b) vor meget fylder 1 mol helium? c) Massefylden for helium er: b) vor meget vejer 60 liter kvælstof (N 2 )? Opgave 7.4 a) vor meget vejer 1 mol Ammoniak (N 3 )? Opgave 7.6 Atmosfærisk luft består (anslået) af 1 5 ilt (O 2 ) og 4 5 kvælstof (N 2 ). Prøv om du kan regne massefylden ud på egen hånd. 56 Kemi
57 8. Organisk kemi Man inddeler gerne kemien i to hoveddele: uorganisk og organisk kemi. Den uorganiske kemi omhandler stoffer, der relaterer til jordbundslæren og gødningslæren. Den organiske kemi henviser til levende organismer (mennesker, dyr og planter) og relaterer således til fag som fodringslære. Opdelingen har historisk baggrund, og går tilbage til en tid, hvor det var kemikernes overbevisning, at visse stoffer kun kunne dannes i levende organismer ved hjælp af en mystisk livskraft. Men i 1828 lykkedes det den tyske kemiker Friedrich Wöhler at fremstille det organiske stof urinstof (urea) i laboratoriet. Med denne videnskabelige udvikling forsvandt den oprindelige begrundelse for at skelne mellem uorganiske og organiske stoffer. Siden er det lykkedes at fremstille stadigt flere syntetiske stoffer, som også findes i levende organismer. De organiske stoffer består af grundstoffer - af molekyler, som dannes og nedbrydes efter de samme regler som gælder for den uorganiske kemi. Kulstof En eksakt definition på organisk stof kan ikke opstilles. Fra et kemisk synspunkt kan man sige, at organisk kemi omfatter de stoffer eller forbindelser, som indeholder grundstoffet kulstof (). Dog er der visse undtagelser: karbonater (O 3 --), kuldioxyd (O 2 ) og kulilte (O) henregnes til den uorganiske kemi. Figur 8.1 Det er nemt at vise, at organiske stoffer indeholder kulstof, idet de fleste kan brænde, når de er tørre. vis der ikke sker en fuldstændig forbrænding, forkuller de. Det vil sige, at de bliver til kulstof. I nogle tilfælde brænder de organiske stoffer med en sodende flamme. Organisk kemi 57
58 Diamant er rent kulstof. Diamant er det hårdeste af de kendte naturligt forekommende stoffer. Netop derfor er diamanter særdeles anvendelige. Tænk bare på glarmesteren, der skærer glas med ægte diamanter. I det periodiske system kan man læse følgende om kulstof: Kemisk tegn: Atomnummer: 6 Atommasse: 12 Antal elektroner: 6 Elektronbaner: 2 Antal elektroner i yderste bane: 4 Figur 8.3 -atomet har en særlig evne til at danne kæder. Kæderne kan blive lange og have mange forgreninger. Kæderne kan indeholde mange hundrede -atomer. Kulstof-atomet vil gerne gå i forbindelse med brint (), ilt (O) og i proteinmolekyler også kvælstof (N). Derudover kan de forbinde sig med atomer fra andre grundstoffer i et utal af kombinationer. Det er faktisk imponerende og foruroligende hvad den kemiske forskning kan lave af nye stoffer. Tænk bare på alle de forskellige vaskemidler, sprøjtemidler, medicin, konserveringsmidler og plasttyper, der i dag kan fremstilles. Figur 8.2 er er kulstof-atomet skrevet i strukturformel. De fire streger ud fra -atomet viser de fire elektroner i yderskallen. 58 Kemi
59 9. Kulbrinter Kulbrinter består af kulstof (carbon) og brint (hydrogen). Der findes adskillige millioner forskellige kulbrinter, f.eks. naturgas, benzin og olie. Kulbrinterne er bygget efter bestemte mønstre: Methan -atomet har fire elektroner i den yderste skal det har fire»fangarme«eller valensen 4. Brint er»enarmet«valensen er 1, og derfor kan fire brint-atomer binde sig til et kulstofatom på følgende måde: gas består næsten udelukkende af kulbrinten methan. Methan dannes også i gylle. Methan antændes let og har været årsag til store eksplosionsulykker i kulminer. Ethan vis to -atomer er kædet sammen, og de frie valenser er besat med hvert sit -atom, får man en anden kulbrinte, nemlig ethan. Ethan 2 6 Propan En tredje kulbrinte er propan: Methan 4 Stoffet hedder methan og har formlen 4. Methan kaldes også for sumpgas, fordi den blandt andet dannes, når planter rådner op i sumpe og moser. Da både stenkul og olie er dannet på denne måde, findes der som regel også methan i miner og oliekilder. Danmarks natur- Propan 3 8 Organisk kemi 59
60 Og sådan kan man fortsætte. ver gang der sættes et nyt 2 på, dannes en ny kulbrinte. Nu kender du princippet, og du kan selv regne formlen ud for den nye kulbrinte, når blot antallet af kulstof-atomer er kendt. Du finder antallet af brintatomer ved at gange kulstof-atomernes antal med 2 og lægge 2 til. Kulbrinter Opgave 9.1 vilken valens har brint, ilt og kvælstof (normalt)? b) Tegn metan med en strukturformel. a) har valensen b) O har valensen c) N har valensen Opgave 9.2 vad er det, der kendetegner en kulbrinte? Opgave 9.4 Kulbrinten pentan har fem - atomer i kæden. Tegn strukturformlen. Opgave 9.3 a) Formlen for methan er: Opgave 9.5 Kulbrinten heptan har formlen Tegn strukturformlen. 60 Kemi
61 Isomere stoffer Stoffer med samme kemiske formel, men med forskellig struktur, vil have forskellige kemiske egenskaber. Sådanne stoffer kaldes isomere stoffer. Kulstofkæderne kan have forskellig struktur (udseende), selv om de indeholder ens antal atomer og dermed har samme formel. Stoffer med samme formel kan således have forskellige kemiske egenskaber. Indtil nu har du set opbygninger af kulbrinter som lange kæder, men kulbrinter, kan også dannes som»forgreninger«. Lad os tage luftarten butan som eksempel. Butan har formlen 4 10, og -atomerne er forbundet som en lang kæde på denne måde: ---. Prøv at forestille dig, at de var sat sammen på denne måde altså med en forgrening i stedet for som en kæde: Isobutan Dette stof kaldes isobutan. Du kan se, at butan og isobutan har samme formel, de har nemlig samme antal -og -atomer i molekylet. Men molekylerne er forskellige i opbygningen (struktur). Figur 9.1 Når det samme antal atomer kan hægte sig sammen på forskellige måder i isomere stoffer, giver det mulighed for dannelse af mange forskellige organiske stoffer. Man fremstiller for eksempel plastiktyper med samme kemiske formel, men med forskellig styrke og bøjelighed, smeltepunkt og brændbarhed. Organisk kemi 61
62 Mættede og umættede kulbrinter De kulbrinter, der er nævnt indtil nu, kaldes for mættede kulbrinter, fordi de er»mættet«med brintatomer. Mættede kulbrinter er kendetegnet ved, at kulstofatomerne er bundet til hinanden med enkeltbindinger, så det størst mulige antal valenser er optaget af -atomer. Umættede kulbrinter Når der også forekommer umættede kulbrinter, skyldes det, at kulstofatomer har den egenskab også at kunne gribe hinanden med to eller tre valensarme. erved opstår dobbelteller tredobbelte-bindinger, og der bliver ikke plads til så mange brintatomer i molekylerne. I både ethen og ethyn er alle fire valenser til -atomerne optaget, og der findes flere bindinger mellem -atomerne indbyrdes, derfor er der ikke plads til så mange -atomer som i de mættede kulbrinter. = = Ethen Ethyn Ethyn bruges til svejsning. Svejserne kalder ethyn for acetylen og blander den med rent ilt. Svejseflammen er over 2000 grader varm og bruges til skærebrænding. Ethen bruges til fremstilling af plastikstoffet olyethen. Aromatiske ringe Kulbrinter kan andet end blot danne lange kæder. Mange kulbrinter er sammensat af en ring bestående af seks -atomer. Denne opbygning kaldes for en aromatisk ring. Aroma betyder duft, og stoffer, der indeholder en aromatisk ring, betegnes som aromatiske molekyler, fordi mange af dem har en stærk duft. De aromatiske ringe består af 6 kulstofatomer, der er bundet sammen ved hjælp af tre enkeltbindinger og tre dobbeltbindinger. Det specielle ved de aromatiske ringe er, at dobbeltbindingerne ikke er stabile. De skifter hele tiden plads, således at seks kulstofatomer deles om de frie elektroner, der svæver i en»fælles elektronsky«. Denne specielle struktur symboliseres med en cirkel som vist på figur 9.2. Aromatiske ringe er meget stabile og derfor oftest tungt nedbrydelige i naturen. Mange af de aromatiske forbindelser er særdeles sundhedsskadelige. 62 Kemi
63 Figur 9.2 Benzen-ringen. Benzen 6 6, som er vist på figuren er den simpleste forbindelse, som indeholder en aromatisk ring.»benzen-ringen«er byggesten for mange andre kulbrinter, flere ringe kan hægtes sammen og danne større molekyler. Figur 9.3 Lindan. Den aromatiske ring indgår i sprøjtemidlet Lindan, der måtte anvendes som bejdsemiddel frem til juni Kombinationen af en aromatisk kulstofring og klor giver særdeles giftige og bioresistente molekyler. Det vil sige, at stoffet ophobes i naturen. Molekylestørrelse og tilstandsform I afsnittet om stoffernes tilstandsform, er det beskrevet, at smeltepunkt og kogepunkt markerer skillelinjen mellem de tre tilstandsformer: Fast form, flydende og luftformig. Gasser Methan, ethan, propan og butan er gasser, fordi de alle har et kogepunkt, som er lavere end almindelig rumtemperatur. Methan og ethan anvendes primært til opvarmning af boliger. Den danske naturgas består hovedsageligt af methan samt få procent ethan. Propan og butan bruges til flaskegas. I de store gasflasker er der propan og i de små gasflasker til f.eks. lightere findes der butan. Man bør håndtere de fire gasser (methan, ethan, propan og butan) med omtanke, idet de er særdeles brændbare og dermed meget farlige. De brænder så hurtigt, at de betegnes som eksplosionsfarlige. En gaseksplosion er en kemisk kædereaktion. Forestil dig, at en gnist antænder de nærmeste gasmolekyler og varmen fra denne reaktion giver antændelsestemperatur for det næste Organisk kemi 63
64 lag gasmolekyler... og sådan vil reaktionen fortsætte. For at kædereaktionen kan ske, skal gaskoncentrationen i luften være over en vis grænse. vis der er for langt mellem gasmolekylerne, kan reaktionen ikke»springe«fra gasmolekyle til gasmolekyle. Kulbrinter med 5 til 16 -atomer i molekylerne er i flydende form ved normalt tryk og temperatur. Benzin og dieselolie hører til i denne gruppe. Benzin er en blanding af kulbrinter med 6 til 10 -atomer i molekylerne, og har et kogepunkt på alt efter molekylestørrelse. Kulbrinter med mere end 16 -atomer i molekylerne er i fast form ved normal tryk og temperatur, eksempelvis asfalt. Jo større molekylerne er (jo flere -atomer i kæden), jo højere er smelte- og kogepunktet for en kulbrinte. Molekylestørrelser og tilstandsform Opgave 9.6 Massefylden for luft er cirka 1,20 gram/ liter. Når du kender formlen for en given luftart, kan du regne ud, om den vil stige op eller synke ned, når den slippes ud i atmosfærisk luft. Molvægten er det antal gram af stoffet, som angives af stoffets molekylevægt. 1 mol af en luftart fylder altid 24 liter (ved normalt tryk og temperatur). a) Udregn massefylden for butan 4 10 Molekylevægt: Massefylde g/liter: b) Vil butan stige op eller synke ned i atmosfærisk luft? 64 Kemi
65 Råolie og olieprodukter Råolie stammer fra havets organismer mest alger, der er sunket til bunds på steder med iltmangel og derfor kun er delvist forrådnede. De organiske stoffer i algerne er blevet omdannet til kulbrinter under indflydelse af tryk og varme gennem millioner af år. Råolien samt gasserne samler sig i bestemte lag. Der er mere end 500 forskellige kulbrinter i olien sammen med svovlforbindelser og visse andre stoffer. Når man fra en boreplatform henter råolien op af borehullerne, er den en blanding af kulbrinter med forskellig molekylestørrelse. På et olieraffinaderi omdannes råolien ved fysiske og kemiske processer til en række brugbare produkter. For at få skilt de forskellige kulbrinter fra hinanden benytter man sig af, at kogepunktet varierer med molekyle-størrelsen (antal -atomer i kæden). Shell-Raffinaderiet i Fredericia. Kilde: A/S Dansk Shell Figur 9.4 Et olieraffinaderi er kendetegnet ved en mængde tanke, tårne og rør. Organisk kemi 65
66 Figur 9.5 Skitse af produktionsforløbet. Råolien bliver forarbejdet til forskellige komponenter, som er udgangspunkt for de endelige produkter. Destillation Råolien opvarmes til cirka 500, så det meste af den bliver luftformig. Oliedampen ledes op gennem et ca. 45 meter højt destillationstårn, hvor den gradvist afkøles, og nogle kulbrinter begynder at fortættes til flydende form. Køletårnet er udformet sådan, at de enkelte kulbrinter kan opsamles og aftappes hver for sig. De dele af råolien med de største og tungeste molekyler bliver ikke luftformige ved opvarmningen, men flyder ned i bunden af tårnet, hvor de aftappes og anvendes til asfalt. Krakning Kulbrinter med mange -atomer i kæden udgør en stor del af råolien. Det passer ikke særligt godt med vores forbrugsmønster, idet der kun udvindes cirka 20% benzin, mens man får mere diesel og smøreolie. Så for at få et større udbytte af benzin ved raffineringen spalter man de lange kæder ved en proces, som kaldes krakning. Når lange kulbrinter som smøreolie og paraffin (tunge olier) udsættes for en høj temperatur i et vist tidsinterval nedbrydes eller krakkes de lange molekyler til mindre og lettere molekyler, svarende til dem, der findes i gasolier og benziner. Ved krakning kan man få op til 50% af råolien lavet om til benzin. Isomerisering Benzin er en blanding af mættede kulbrinter indeholdende 6 til 10 - atomer pr. molekyle. I blandingen findes både uforgrenede og forgrenede (isomere) kulbrinter. De to slags benzinmolekyler brænder forskelligt i en motor. De uforgrenede kulbrinter brænder i stød, ved små eksplosioner, som får motoren til at banke, hvorimod de forgrenede kulbrinter brænder jævnt uden at fremkalde bankning. Oktantallet er et mål for den enkelte benzinsorts evne til at fremkalde bankning. Oktantal 0 står for benzin, der banker, hvor 100 står for benzin, der ikke banker. Ved at blande benzinsorter med forskelligt oktantal, kan man fremstille benzin med et ønsket oktantal. 66 Kemi
67 10. Alkoholer Når du hører ordet alkohol, tænker du sikkert straks på den væske, der ved indtagelse gør folk berusede. Alkohol kan laves ved gæring af sukker, f.eks. fra byg, druer eller æbler, som det findes i øl, vin og spiritus. Men alkohol kan også fremstilles kemisk. Alkohol brænder med en flamme, der ikke soder og kun udsender lidt lys den såkaldte spritflamme. Alkohol indeholder O-grupper. O-gruppen, der kendetegner alkoholer kaldes også hydroxyl. Pas på ikke at forveksle den med hydroxid eller baseionen O -. Alkoholers navne ender på -ol. Methanol Ved fremstilling af methanol tager man et metanmolekyle: Bytter man et af -atomerne ud med en hydroxylgruppe O, fremstilles molekylet metanol: Methanol 3 O O Læg mærke til, at for stoffer som har fået hægtet denne hydroxylgruppe (O) på, skrives O særskilt og til sidst i formlen Methanol anvendes meget i industrien, dels som opløsningsmiddel, dels som udgangspunkt for andre stoffer. Det kan endvidere bruges som brændstof til motorer, eventuelt i blanding med benzin Methan 4 Organisk kemi 67
68 Figur 10.1 Metanol kaldes også træsprit. Men tro ikke, at alle typer alkohol kan indtages. Advarsel: Det er livsfarligt, at drikke træsprit. Ethanol Ethanol er den type alkohol, som findes i øl, vin og spiritus. Det anvendes også til rengøringsmidler og kan bruges som brændsel i spritmotorer. Ved fremstilling af alkohol tager man et ethanmolekyle: Ethan O Så bytter man en af -atomerne ud med en hydroxylgruppe O: Ethanol 2 5 O Og sådan kan man lave hele serien af alkoholer: Propanol, butanol og så videre. Det er bare at hægte en hydroxylgruppe (O) på i stedet for et -atom. 68 Kemi
69 11. Organiske syrer ar du spist syltede agurker, rødbeder, ymer eller A-38? vis ja så kender du de to mest almindelige organiske syrer, eddikesyre og mælkesyre. Myresyre Flere af de organiske syrer har betydning i landbruget. Myresyre er den simpleste af dem. I landbruget bruger man syren som tilsætning ved ensilering for at sikre en lav p. Kvæget kan godt fordøje myresyre, fordi det er en af de syrer, der naturligt dannes i vommen. Figur 11.1 Myresye er den syre, som den store røde skovmyre sprøjter ud af sine giftkirtler, når den forsvarer sig. Syren virker ætsende og kan nok skræmme en fjende bort. Myresyremolekylet tager udgangspunkt i methan-molekylet: I methanol er et af -atomerne erstattet med en O (hyddroxylgruppe): O Methan 4 Methanol 3 O I myresyremolekylet er yderligere to Organisk kemi 69
70 -atomer erstattet med et O-atom, så strukturformlen for myresyre er: ---- O Myresyre OO O Dobbeltbindinger til O-atomer optager to af kulstoffets fire valenser (husk ilt har valensen 2), O-gruppen 1. Der bliver således kun plads til et -atom. Formlen for myresyre skrives OO, fordi man ønsker at fremhæve gruppen OO i formlen. Man kan kende en organisk syre på, at formlen ender med: OO. Propionsyre Den næste syre i serien hedder propionsyre og har tre -atomer i kæden. Propionsyre bruges til fremstilling af forskellige slags oste, hvor man ønsker store huller. Udgangspunktet for processen er, at mælkesukker i mælken omdannes til mælkesyre via mælkesyrebakterier. Ved tilsætning af propionsyrebakterier vil mælkesyren omdannes videre til eddikesyre og propionsyre. Smørsyre Den fjerde organiske syre, der er grund til at nævne, er smørsyre. Denne syre indeholder fire -atomer i kæden og gør mere skade end gavn. I en dårlig ensilage med for høj p vil du finde smørsyre, der har en karakteristisk dårlig lugt, der kan minde om lugten af»sure tæer«det er den samme syre og den samme lugt. Eddikesyre Ligesom ved serien af kulbrinter kan vi få en ny organisk syre ved at sammenkæde flere -atomer. To - atomer i kæden giver en anden kendt syre, nemlig eddikesyre. Eddike kan fremstilles af alkohol, der risler ned over træspåner, hvorpå der lever eddikesyrebakterier. Når rødvin står for længe, bliver den til eddike, fordi eddikesyrebakterierne går i gang med at ilte vinen til eddike. 70 Kemi
71 12. Næringsstoffer For at holde stofskiftet og forbrændingen i gang, skal din krop have næringsstoffer. Forbrændingen af næringsstoffer frigør energi. Energien udnytter din krop til alle de livsvigtige funktioner, f.eks. til hjertets konstante arbejde. Energi findes i fedt, kulhydrater og proteiner. De forskellige næringsstoffer indeholder forskellige mængder energi. Fedt lagres især i depoter i fedtvævet, mens kulhydrat lagres i muskelvævet og leveren. vis du får mere energi tilført gennem maden end kroppen har brug for, vil der blive noget energi i overskud, som kroppen ikke forbrænder. Denne»overskydende energi«vil lagre sig som depoter i dit fedtvæv. Kulhydrater kan omdannes til og oplagres som fedt. Energi måles i enhederne kalorier og joule: 1 kalorie = 4,18 joule. kj (kilojoule) består af 1000 joule kcal (kilokalorie) består af kalorier 1 g kulhydrat = 17 kj 1 g fedt = 38 kj 1 g protein = 17 kj Figur 12.1 Figuren angiver energien ved at forbrænde eller fordøje 1 g af henholdsvis kulhydrat og fedt. Der er meget mere energi i et gram fedt end i et gram kulhydrat! Foderenheder I fodringslæren måles energien i foderenheder, og du vil støde på forkortelsen (FE) eller (FEs). De forskellige dyrearter udnytter foderet forskelligt, derfor skelner man mellem FEs (foderenheder til svin) og FE (foderenheder til øvrige dyr). 1 FE svarer til indholdet af energi i 1 kg byg. Næringsstoffer 71
72 Foderenheder et vigtigt redsskab i forbindelse med fastlæggelse af en foderplan til kvæg, svin, heste og får med videre. vis du kikker i en tabel over forskellige foderstoffers foderværdi, vil du netop få oplyst hvor mange FE/hkg dit foder indeholder. Når antal FE/hkg foder er kendt for den enkelte fodertype, kan man ved valg af supppleringsfoder sammensætte en afbalanceret foderration. Foderstoffers foderværdi til kvæg, heste, får mv. Foderstof Indhold pr. FE Korn FE/ hkg foder kg foder g ford. protein g fedtsyre Byg 96 1, avre 79 1, vede 104 0, Rug 101 0, Uddrag fra tabel, åndbog for driftsplanlægning 1996/97, side 35 Tabel 12.1 I tabellen kan du få oplysninger om kornafgrødernes foderværdi. Fedtstoffer Fedtstoffer og olier fra dyr og planter er kemisk nært beslægtede. Fedtstoffer og olier består af de tre grundstoffer, kulstof (carbon), brint (hydrogen) og ilt (oxygen). Fedtstoffer findes blandt andet som oplagret næring hos mennesker, dyr og planter. Ved hjælp af fedtdepoter i kroppen kan mennesket overleve flere uger uden føde, fordi kroppen kan omdanne det oplagrede fedt til energi. os planter oplagres fedt i frøene som en madpakke for kimen, når den skal spire frem. os dyr findes fedtstoffer også som uldvoks på hår og hos planter som isolerende lag på blade for at hæmme fordampningen. Glycerol Fedt dannes når glycerol (glycerin) reagerer med fedtsyrer. Glycerol er som endelsen -ol antyder en alkohol med tre O-grupper. Den dannes i vores celler som mellemprodukt ved nogle af livsprocesserne. Glycerol bruges ydermere til to meget forskellige produkter: kosmetik (creme) og sprængstof (nitroglycerin). 72 Kemi
73 Figur 12.2 Glycerol molekylet har følgende strukturformel: O O Glycerol Læg mærke til, at glycerol har tre hydroxylgrupper (O) i formlen. Derfor siger man, at glycerol er en trivalent alkohol. De alkoholer, der blev beskrevet i kapitel 8, havde kun én O-gruppe, og de kaldes for monovalente alkoholer. O ROO ROO ROO O fedtsyrer O + O Glycerol _ > ROO ROO ROO Figur 12.3 Figuren viser en reaktionsligning, hvor et glycerinmolekyle reagerer med tre fedtsyremolekyler (ROO). Fedtsyrerne fraspalter hver sin + ion, og glycering fraspalter de tre O - grupper som O- -ioner. De tre + og tre O - forbinder sig og danner tre molekyler 2 O (vand). De tre syrerester (ROO - ) binder sig til de tre valenser på glycerin-molekylet (som blev ledige efter O - ionerne). Dermed er der dannet et fedtmolekyle. For at kunne danne bindinger mellem glycerol og syre, må der fraspaltes vand. De tre fedtsyremolekyler (ROO) behøver ikke at være den samme slags fedtsyre. ermed bliver der mange forskellige kombinationsmuligheder, og dermed mange forskellige slags fedt. Fedt O O O Vand Næringsstoffer 73
74 Fedtsyrer Fedt og olie består ikke kun af glycerol men også af organiske syrer (fede syrer). Fedtsyrerne tilhører samme serie som myresyre, eddikesyre, propionsyre og smørsyre, men de har normalt 12 til 20 -atomer i kæden. Palmitinsyre har for eksempel 15 -atomer, og stearinsyre har 17 - atomer i kæden. Vær opmærksom på, at -atomet i betegnelsen OO ikke skal regnes med til kæden. Med så lange molekylekæder bliver det lidt af et arbejde at skrive strukturformler. For lethedens skyld skriver man derfor formlen for fedtsyre på denne måde: ROO. R er altså en forkortelse for den lange kæde af -atomer med tilhørende -atomer. Mættet og umættet fedt Fedt og olie kan ikke opløses i vand, og vand kan ikke opløses i fedtstoffer. Men fedt kan opløses i benzin og andre organiske opløsningsmidler. Fedtstoffer kan være faste eller flydende ved stuetemperatur. De flydende fedtstoffer kaldes også for fede olier. Syrerne i fedtstof kan være enten mættede (uden dobbeltbindinger) eller umættede (med dobbeltbindinger). vis syreresten er umættet bliver fedtstoffet i reglen flydende, altså olie. De umættede fede syrer, linolsyre og linolensyre, indgår i en del olier som for eksempel fiskeolie og planteolier. ( OO ) Figur 12.4 Linolsyre med 2 dobbeltbindinger En fedtsyre er mættet, hvis det størst mulige antal af -atomernes valenser er bundet til -atomer Du har sikkert hørt om»sundt«(umættet) og»usundt«(mættet) fedtstof. Om et fedtstof er sundt afhænger blandt andet af, om det er umættede fedtsyrer som sammen med glycerol danner fedtet. Fedtsyrerne har betydning for, hvordan fedtaflejringen i blodårerne foregår. Et stort forbrug af mættede fedtsyrer forhøjer fedtindholdet (kolesterol) i blodet. Umættede fedtsyrer sænker fedtindholdet i blodet Kemi
75 Fedtstoffer Opgave 12.1 Nævn nogle af hovedkilderne til fedt i vores kost: Opgave 12.5 exansyre har 5 -atomer i kæden. Tegn strukturformlen for hexansyre. Opgave 12.2 vad er forskellen mellem de fedtstoffer, vi kalder fedt, og dem vi kalder olie? Opgave 12.3 vilke stoffer skal reagere, hvis du skal danne fedt? Opgave 12.6 vilken slags binding skal der være mellem -atomerne for at en fedtsyre kaldes for mættet? (sæt kryds) 3 Enkeltbinding 3 Dobbeltbinding 3 Tredobbeltbinding Opgave 12.7 vilke fedtsyrer sænker blodets fedtindhold? Opgave 12.4 Kan du fuldføre strukturformlen for glycerol? O O O Næringsstoffer 75
76 Kulhydrater Kulhydrater omfatter stoffer som sukker, stivelse og cellulose. Kulhydrat består af kulstof, brint og ilt i mange forskellige kombinationer. Altså nøjagtig de samme grundstoffer som i fedt. Udgangspunktet for produktionen af kulhydrater i naturen er fotosyntesen. Fotosyntese er betegnelsen for den proces, hvor planterne opbygger organiske stoffer af uorganiske. Ligningen for fotosyntese er: sollys 6O O -> 6 12O 6 + 6O 2 kuldioxid vand druesukker ilt Figur 12.5 Udgangspunktet for alle organiske molekyler er sukker, der er dannet ved fotosyntese. Kulhydrater kan opdeles i simple og komplekse kulhydrater. SIMPLE KULYDRATER består af monosakkarider og disakkarider. MONOSAKKARIDER består af sukkerkomponent. Almindelige typer er glukose og fruktose. Ved fordøjelse omdannes alle kulhudrater til monosakkarider. GLUKOSE (druesukker) er også den sukkerform, der findes i blodet. FRUKTOSE (frugtsukker) findes i alle frugter, samt i honning. Figur 12.6 Kulhydrater er en betegnelse for mange forskellige næringstoffer, som har forskellig kemisk sammensætning. KOMPLEKSE KULYDRATER består af en lang sammenkædning af monosakkarider. DISAKKARIDER består af to sukkerkomponenter. Almindelige typer er sakkarose og laktose. To monosakkarider giver tilsammen et disakkarid. POLYSAKKARIDER deles op i to typer, nemlig de fordøjelige og de ufordøjelige. SAKKAROSE (roe- og rørsukker) bedst kendt som alm. husholdningssukker. LAKTOSE (mælkesukker) findes kun i mælk fra pattedyr. FORDØJELIGE findes i lyst brød, kartofler, ris, pasta, grøntsager og havregryn. UFORDØJELIGE findes i klid, groft brød og grove grøntsager. 76 Kemi
77 En af grundene til at monosakkarider og disakkarider kaldes for simple kulhydrater er, at de hurtigt optages i organismen i modsætning til de komplekse kulhydrater. Monosakkarider De simplest byggede kulhydrater er glukose (druesukker), fruktose (frugtsukker) og galaktose (et nedbrydningsprodukt af laktose mælkesukker). De tre nævnte kulhydrater har samme formel 6 12 O 6, men atomerne sidder forskelligt i forhold til hinanden. Dvs. at de er isomere stoffer: stoffer, som har samme formel, men forskellig struktur. er simple kulhydrater, de kaldes også for monosakkarider (mono = enkel, sakkarid = sukker). De er alle opbygget omkring en enkelt ring. Monosakkarider smager sødt og er letopløselige i vand. Disakkarider Disakkarider (di = to) er ligeledes simple kulhydrater. Det er sukkerarter bestående af to ringe, dvs. en binding mellem to monosakkarider.ved denne binding mellem to monosakkarider frigives samtidig et molekyle vand. Formlen for et disakkarid er O 11. O O O O O O Figur 12.8 Et disakkarid er en binding mellem to monosakkarider. Eksempler på disakkarider er laktose (mælkesukker) og sakkarose (rørsukker). Figur 12.7 Druesukker-molekyle med formlen 6 12 O 6. Som du kan se på figuren, er molekylet i druesukker opbygget omkring en 6-kantet ring, som består af 5 -atomer og 1 O-atom. Det 6. -atom er hægtet på det ene af -atomerne i ringen. De sukkerarter, der hidtil er nævnt Rørsukker (sakkarose) er almindeligt husholdningssukker, der primært udvindes af sukkerroer og sukkerrør. Rørsukker dannes ved fotosyntesen og findes i alle grønne planter. os mange planter kan man direkte smage sukkeret i saften. Dyr vil gerne have foder, der indeholder sakkarose. Ved afgræsning foretræk- Næringsstoffer 77
78 ker køerne arter med et højt sukkerindhold. Et højt sukkerindhold i græs gør ensileringen lettere. Disakkarider, der er sammensat af monosakkarider. Sakkarose Laktose = glukose + fruktose = glukose + galaktose Maltose = glukose + glukose Figur 12.9 Rørsukker er et disakkarid, som er sammensat af glukose og fruktose. Polysakkarider De komplekse kulhydrater består af en lang sammenkædning af monosakkarider (druesukker). Disse kulhydrater kaldes for polysakkarider (poly = mange). Mange hundrede molekyler kan bindes sammen til lange kæder, der danner spiraler eller grenede kæder. ver gang et nyt molekyle druesukker bindes til kæden fraspaltes et vandmolekyle. Formlen for polysakkarider skrives på denne måde: ( 6 10 O 5 )n. vor det efterfølgende»n«betyder et stort tal. Figur Når vi hægter glukosemolekyler sammen i lange kæder, får vi stivelse. Polysakkariderne kan opdeles i to undergrupper, alt efter om de er fordøjelige eller ufordøjelige. 78 Kemi
79 Stivelse De fordøjelige kulhydrater kaldes stivelse. Stivelse kan opløses i varmt vand. Ved afkøling forklistrer opløsningen, og det er den egenskab, vi eksempelvis udnytter i køkkenet til jævning af maden med hvedemel, kartoffelmel eller lignende. Stivelse er opbygget af lange kæder af sukkermolekyler. Disse kæder af molekyler kan igen nedbrydes til sukkermolekyler. Sukker kan omdannes til stivelse, og stivelse kan omdannes til sukker. ellulose Et andet vigtigt polysakkarid er cellulose, der er et ufordøjeligt kulhydrat. Dette molekyle består ligeledes af druesukker-molekyler, men de er kædet sammen på en lidt anden måde end i stivelse. ellulose er ufordøjeligt for mennesker, fordi vi ikke har bakterier i fordøjelses-systemet, som kan spalte cellulose-molekylerne. Drøvtyggere kan fordøje cellulosen fordi de har disse bakterier i vommen. este har dem også, men i blindtarmen. Blindtarmen er særlig stor hos heste, og en del af fordøjelsen foregår der. Køer, får, geder, heste og kaniner kan leve på celluloserigt foder, men svin vil ikke kunne fedes op på cellulose. Ubehandlet halm er tungtfordøjeligt selv for drøvtyggere. Det skyldes, at cellulosemolekylerne er indkapslet i lignin, som findes i cellevæggen i træ og halm, og som vombakteriernes enzymer ikke kan spalte. Når halm ludbehandles med ammoniak, løsnes bindingerne mellem lignin og cellulosen, og cellulosen bliver tilgængelig for bakteriernes enzymer, og dermed bliver halmen fordøjeligt for dyrene. ellulose betyder også cellestof. Planterne opbygger cellevæggene af cellulose. ellulosen hjælper planterne til at holde sig stive. Stivelse- og cellulosemolekylerne er opbygget forskelligt. Stivelse kan fordøjes af både mennesker og dyr dvs. at stivelsen bliver omdannet til energi. Næringsstoffer 79
80 Kulhydrater Opgave 12.8 vilke tre grundstoffer består kulhydrater af? Opgave To monosakkarider kan binde sig sammen og danne et: Opgave 12.9 vad kaldes de sukkerarter, der alle er opbygget omkring en enkelt ring? Opgave vad kendetegner molekylerne i polysakkariderne? Opgave Fruktose har samme formel som glukose, nemlig: Opgave vad hedder den polysakkarid, som planterne har inde i cellevæggene? Proteiner Protein er opbygget af lange kæder af aminosyrer, der består af grundstofferne kul (), ilt (O), brint (), kvælstof (N) og oftest noget svovl. Proteiner udfører arbejdet i cellerne med opbygning og nedbrydning af molekyler. os mennesker og dyr indgår proteinerne i skelettet, bindevævet, musklerne, blodet, huden og håret/pelsen. I planternes frø, knolde og rødder er der ofte ophobet store mængder af lagerproteiner. Lagerpeoteinerne er forskellige proteiner, der anvendes som enzymer og som en del af planternes cellevægge (strukturproteiner). Proteinernes funktion i de levende celler er mangeartede, og alle levende celler indeholder et meget stort antal forskellige proteiner. Proteinerne kendes også under betegnelsen æggehvidestoffer. 80 Kemi
81 Aminosyrer En aminosyre består af en organisk syre og en aminogruppe -N 2. Formlen for den simplest byggede aminosyre glycin, kan skrives som N 2 2 OO N Glycin Eller lidt forenklet: N 2 OO O O for eddikesyre og glycin den første er en organisk syre, den anden er en aminosyre Eddikesyre O O Forskellen på de to strukturformler for glycin og eddikesyre er at brintatomet () i eddikesyre er ombyttet med en aminogruppe (N 2 ). Alle aminosyrer indeholder de to grupper, vi lige har nævnt: Basegruppen (N 2 ) og syregruppen OO. Glycin Til slut ser vi på den midterste af de tre atomgrupper i glycinmolekylet, nemlig gruppen 2 eller: Du kan se på strukturformlen, at glycinmolekylet består af de tre atomgrupper: N 2 2 OO N 2 kaldes for aminogruppen, og det er den, som har givet stofferne navnet aminosyrer. Aminogruppen er en basegruppe. Du kan se, at den ligner en anden base ammoniak N 3. OO er en syregruppe, og aminosyrerne er også syrer. Du kan forestille dig dem som afledte af de organiske syrer. Sammenlign strukturformlen Den ene af de to -atomer i 2 kan have andre atomgrupper eller kæder i stedet. Dette giver andre aminosyrer. På næste side kan du se et par eksempler. For at det skal være lettere at sammenligne, er glycin også vist. Næringsstoffer 81
82 Figur Alle aminosyrer har de tre atomgrupper tilfælles, som du kan se over stregen. Det, som varierer, er formlen under stregen på figuren. I alt kender man cirka 100 forskellige aminosyrer. Peptider To molekyler glycin kan forbindes under fraspaltning af vand. Det er syregruppen i et molekyle, som binder sig til aminogruppen i det næste molekyle. Lidt forenklet kan man vise denne binding som på figur På lignende måde kan flere aminosyrer bindes sammen under fraspaltning af vand. Derved opstår lange proteinmolekyler af flere hundrede eller tusinde aminosyrer. Man kan tydeligt fornemme de lange molekyler, når man vil dele en æggehvide i to lige store portioner. Det er umuligt, fordi de lange molekyler klæber sammen som spaghetti og trækker hinanden ned. En binding mellem aminosyre-molekyler kaldes for en peptidbinding, og stoffer som består af kæder af aminosyrer kaldes for peptider. vis det er to molekyler, som hægtes sammen, får man et dipeptid. vis mange aminosyrer er lænket sammen får man et polypeptid. Et protein er derfor et polypeptid, idet et proteinmolekyle består af lange kæder af aminosyrer. Figur Peptidbindingen mellem to molekyler glycin. 82 Kemi
83 N N N... Figur Eksempel på en peptidkæde. Peptidbindingerne har alle en»rygrad«af kulstof- og kvælstofatomer. Rygraden kaldes en peptidkæde. Proteiner kan denatureres, hvorved den naturlige tilstand ødelægges. Det ser man i et spejlæg, hvor den flydende hvide bliver stiv. Det er ikke muligt at gøre hviden flydende igen, fordi man ved kogning og stegning denaturerer proteinerne i kød og grøntsager. Varme over en vis grænse er skadeligt for levende organismer. For eksempel er feber på 43 dræbende for mennesker, fordi proteinerne ved denne temperatur begynder at koagulere (størkne). Proteiner kan også denatureres af syrer og baser. Derfor er det vigtigt, at cellerne ligger i en væske med en bestemt p. os mennesker opretholdes en p på 7,34 i blodet. Proteiner som næringsstof for mennesker og dyr Fordøjelsesprocessen nedbryder proteinerne til aminosyrer. Aminosyrerne optages gennem tarmvæggen og transporteres rundt til kroppens celler, hvor aminosyrerne så igen opbygges til nye proteiner. Disse proteiner er forskellige alt efter om der laves muskler, nerver, hår/ pels eller knogler. Alt i alt bruger vores krop cirka 20 forskellige aminosyrer til opbygning af alle de nødvendige proteiner. Nogle af aminosyrerne kan kroppen selv lave ved at omdanne andre aminosyrer. Der er dog 8 aminosyrer, som voksne mennesker ikke selv kan danne, og som vi skal have tilført gennem maden. Disse betegner vi som livsvigtige eller essentielle aminosyrer. En del planteproteiner har høj biologisk værdi, for eksempel protein fra sojabønner. Når sojabønner siges at have høj biologisk værdi, er det fordi sojabønner indeholder flere af de essentielle aminosyrer. Mange planteproteiner indeholder ikke ret mange essentielle aminosyrer, hvorimod dyreproteiner (kød, fisk, mælk og æg) som regel indeholder flere essentielle aminosyrer. Svin skal have tilført en række aminosyrer gennem foderet. Gennem forsøg har man fundet ud af behovet for de forskellige aminosyrer. Det er specielt de fire essentielle aminosyrer lysin, methionin, cystin og treonin, som man fokuserer på i foder til svin. Næringsstoffer 83
84 Proteiner Opgave vilke grundstoffer indeholder alle proteiner? a) Opgave Aminosyrer kan forbindes under fraspaltning af? b) c) d) Opgave vilken betegnelse bruger man også om proteinerne? Opgave vad kaldes den binding der opstår, når to aminosyremolekyler kobles sammen? Opgave Alle aminosyrer indeholder to grupper (N 2 ) og OO. vad hedder de? Opgave vor mange forskellige aminosyrer findes der? N 2 : OO: Opgave Prøv at tegne strukturformlen for glycin, formlen er: N 2 2 OO Opgave vad vil det sige, at aminosyrer er essentielle? 84 Kemi
85 13. Ekstra kemiopgaver Dette kapitel indeholder fire temaopgaver: - Når jern omdannes til rust - Kalk og kalkning - Sæbefremstilling - Kulhydrater Når jern omdannes til rust Sombaggrundsviden for denne temaopgave, kan du bruge kapitel 4»Ioner«, hvor forskellige metaller og deres kendetegn bliver præsenteret. Den følgende opgave sætter fokus på, hvad der sker når jern ruster. Du vil finde frem til, hvilke faktorer, der har indflydelse på hvor, hvornår og hvor hurtigt jern ruster, samt hvad man kan gøre for at forebygge rustdannelse. Figur 13.1 Grubetæring. Spalter og tildækkede områder er særligt udsatte, fordi her samles snavs og fugt. Nedbrydning af metaller Nedbrydning af metaller (korrosion) er et velkendt fænomen: Uanset hvor godt du passer på din cykel, kan du være sikker på, at den en dag vil ende som»et gammel rustent lig«. Rust kan optræde på to forskellige måder: Din cykel, kan enten ruste over det hele (det kaldes fladerust), eller den kan ruste enkelte steder, for eksempel ved kranken (det kaldes for grubetæring). Figur 13.2 Fladerust. Et rustlag hindrer ikke ny rustdannelse. Tværtimod. Når en rustdannelse først har taget fat, fremmes rustdannelsen i de lag, der ligger under rusten æder sig ned i jernet! Ekstra kemiopgaver 85
86 Jern går villigt i forbindelse med luftens ilt, når der er fugtighed til stede. Jern tæres eller ruster meget hurtigere i saltvand end i forbindelse med almindeligt vand. Det vejsalt, der bliver strøet om vinteren er hårdt ved biler og cykler. Salt (Nal) får jern til at ruste hurtigere. Rust er en kemisk forbindelse af jern (Fe), ilt (O 2 ) og vand ( 2 O). Rust er således ikke et rent stof, men en blanding af forskellige vandholdige jernoxider (forbindelser af jern og oxygen). Disse jernoxider indeholder følgende ioner: Fe ++, Fe +++, O -- og O -. Det betyder, at man kan hindre rustdannelse, hvis man kan hindre ilt og/eller vand i at komme i kontakt med jernet. Figur 13.3 Metallernes fjende: Luft og vand. Redskaber af jern bør smøres med olie, når de skal opbevares. Olie skyer vand og hindrer fugtighed. Der findes også rustbeskyttende maling, der hindrer både ilt og vand i at nå jernet. Galvanisering, hvor jernet overtrækkes med et tyndt lag af et andet metal, er også en meget anvendt rustbeskyttelse. Når man varmegalvaniserer jern, overtrækker man jern med et lag zink. En metalhinde kan også opnås ved hjælp af elektrisk strøm (elektrogalvanisering). Jo tykkere et lag zink jo bedre rustbeskyttelse. 86 Kemi
87 Når jern omdannes til rust Du skal nu undersøge, hvad der har indflydelse på, hvor hurtigt jern ruster. Du skal anbringe 6 jernsøm i hver sit reagensglas, som tegningen viser. Lad forsøget vare mindst en uge. Opgave 13.2 vilke stoffer fremmer rustdannelse? Opgave 13.3 vad er rust? Opgave 13.1 vad kunne du konstatere ud fra forsøget? Opgave 13.4 vad gør man i praksis, for at jern ikke skal ruste? Figur 13.4 Lav samme opstilling som tegningen viser. På den måde undersøger du, hvilke faktorer der har indflydelse på, hvor hurtigt jern ruster. Ekstra kemiopgaver 87
88 Kalk og kalkning Du har allerede erhvervet lidt kendskab til kalk og kalkning fra kapitel 5. Du har måske arbejdet med en jordprøve og målt dens surhedsgrad for at undersøge, om der var behov for kalkning. De følgende opgaver handler om kalk. I den følgende opgave, hvor du skal undersøge kalk, skal du kombinere din viden om ioner, syrer, baser, salte og opløsninger. Når du har studeret forskellige reaktioner med kalk, kan du til sidst udfylde cirklen»fra kalk til kalk«. Kalk et dansk råstof Et vigtigt råstof i den danske undergrund er calciumkarbonat også kaldet kalk eller kridt. Der findes kalkaflejringer i det meste af den danske undergrund i et ca. 400 m tykt lag. Laget er dannet via aflejringer af milliarder af kalkholdige smådyr for cirka 200 millioner af år siden. Denne kalktype kaldes kridt, og den er fin og hvid. Den findes bl.a. ved Møns Klint, hvor kridtet er så tæt på overfladen, at man kan hugge stykker af den. Kalken fra Faxe kalkbrud er dannet af koraler og kaldes koralkalk. Mange steder i Europa findes en anden type kalk kaldet marmor. Anvendelse af kalk For lavt reaktionstal (p) i jorden medfører, at dyrkningsegenskaberne forringes. For at undgå dette tilfører man jordbunden kalk. I 1996 blev der tilført omkring 1,2 millioner tons kalk på de danske marker. Når kalken reagerer Kalk er både et salt og en base. Det indeholder carbonat (O 3 -- ) som er en svag base. Når kalken reagerer, gør den det ved at optage brint-ioner fra jordvæsken. Derved bliver jorden mindre sur. Reaktionen kan skrives sådan: + + ao 3 a ++ + O 3 - Ved reaktionen omdannes kalk til opløste ioner i form af saltet calciumhydrogen carbonat a(o 3 ) 2. Reaktionen kan også skrives sådan: aO 3 a ++ + a(o 3 ) 2 Kalk gør vandet»hårdt«når vi kalker ender noget af kalken i grundvandet, og bidrager til at gøre vandet»hårdt«. Det er den letopløselige forbindelse calciumhydrogencarbonat a(o 3 ) 2, der opløses i jordvæsken og udvaskes. Alle former for kalk har den samme formel: Kalk = ao 3 88 Kemi
89 Er kalk en syre, base eller et neutralt stof? Opgave 13.5 I et reagensglas hælder du et par milliliter destileret vand. a) vad er destilleret vands p? Tilsæt et par teskefulde kalk; ryst godt for at opløse kalken. b) Er kalk letopløseligt, tungtopløseligt eller uopløseligt i destilleret vand? e) vad er opløsningens p? Tilsæt et par teskefulde kalk til saltsyreopløsningen. f) vad sker der med opløsningen, når du tilsætter kalk? g) Beskriv forsøget kemisk: æld et par dråber Fenolftalin i opløsningen. vis farven bliver grålig er opløsningen neutral. vis farven bliver pink, er den basisk. c) vilken farve blev din opløsning? alciumkarbonat + 2 Saltsyre alciumklorid + Vand + Kuldioxid h) vilket stof bruser kraftigt op? d) vad fortæller farven om opløsningen? Mål opløsningens p med indikator papir. I et andet reagensglas med destilleret vand tilsætter du et par dråber fortyndet saltsyre. Gem reagensglasset til næste kemitime og mål opløsningens p. i) Opløsningens p ved den efterfølgende kemitime? Ekstra kemiopgaver 89
90 Brændt kalk, læsket kalk og mørtel Opgave 13.6 Knus noget kalk. Fyld en porcelænsdigel halvt op med det fint formalede kalk. Kalken varmes over en gasflamme i cirka 10 minutter. Rør i kalken en gang imellem. Ser den færdigbrændte kalk anderledes ud? Opgave 13.7 Lav en koncentreret opløsning med den brændte kalk. æld et par dråber Fenolftalin i. vad fortæller farven? Murstenene i en mur bindes sammen med mørtel. Når man skal lave mørtel, begynder processen med kalk fra et kalkbrud. Kalken opvarmes i store ovne, den brændes, siger man. erved dannes det stof, man kalder for brændt kalk. Processen for brændt kalk: varme ao 3 ao + O 2 Kommer der vand på calciumilte ao,»suges«vandet ind i stoffet. Den brændte kalk (calciumilte)»vandes«og ændres dermed til læsket kalk: Tidligere blandede man den hvide læskede kalk med sand, og fik mørtel. Til at begynde med er den blød, men i løbet af nogle uger stivner den og bliver hård. Den læskede kalk vil optage kuldioxid fra luften og blive til kalk. Fra læsket kalk til kalk: O 2 + a(o) 2 ao O Når man i dag får leveret mørtel til byggepladser, er den iblandet cement. Derved øges styrken på mørtlen og tørretiden forkortes. Opgave 13.8 Ufyld cirklen»fra kalk til kalk«processen for læsket kalk: ao + 2 O a(o) 2 Det kemiske navn for læsket kalk er calciumhydroxid, der er ætsende. 90 Kemi
Vikar-Guide. Den elektriske ladning af en elektron er -1 elementarladning, og den elektriske ladning af protonen er +1 elementarladning.
 Vikar-Guide Fag: Klasse: OpgaveSæt: Fysik/Kemi 9. klasse Atomernes opbygning 1. Fælles gennemgang: Eleverne skal løse opgaverne i små grupper på 2-3 personer. De skal bruge deres grundbog, og alternativt
Vikar-Guide Fag: Klasse: OpgaveSæt: Fysik/Kemi 9. klasse Atomernes opbygning 1. Fælles gennemgang: Eleverne skal løse opgaverne i små grupper på 2-3 personer. De skal bruge deres grundbog, og alternativt
Opgave: Du skal udfylde de manglende felter ud fra den information der er givet
 pgave 1a.01 Brug af det periodiske system pgave: Du skal udfylde de manglende felter ud fra den information der er givet Eks: I rubrik 1 kendte vi grundstof nummeret (nr. 11). Ved brug af det periodiske
pgave 1a.01 Brug af det periodiske system pgave: Du skal udfylde de manglende felter ud fra den information der er givet Eks: I rubrik 1 kendte vi grundstof nummeret (nr. 11). Ved brug af det periodiske
IONER OG SALTE. Et stabilt elektronsystem kan natrium- og chlor-atomerne også få, hvis de reagerer kemisk med hinanden:
 IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
Atomets bestanddele. Indledning. Atomer. Atomets bestanddele
 Atomets bestanddele Indledning Mennesket har i tusinder af år interesseret sig for, hvordan forskellige stoffer er sammensat I oldtiden mente man, at alle stoffer kunne deles i blot fire elementer eller
Atomets bestanddele Indledning Mennesket har i tusinder af år interesseret sig for, hvordan forskellige stoffer er sammensat I oldtiden mente man, at alle stoffer kunne deles i blot fire elementer eller
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler
 Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
Atomer er betegnelsen for de kemisk mindste dele af grundstofferne.
 Atomets opbygning Atomer er betegnelsen for de kemisk mindste dele af grundstofferne. Guldatomet (kemiske betegnelse: Au) er f.eks. det mindst stykke metal, der stadig bærer navnet guld, det kan ikke yderlige
Atomets opbygning Atomer er betegnelsen for de kemisk mindste dele af grundstofferne. Guldatomet (kemiske betegnelse: Au) er f.eks. det mindst stykke metal, der stadig bærer navnet guld, det kan ikke yderlige
Naturfag for skov- og gartnerholdet
 Naturfag for skov- og gartnerholdet Grundlæggende kemi -Gennemgang af forskellige stoffers egenskaber og anvendelighed indenfor gartneri, anlægsgartneri og skovbrug 1 www.ucholstebro.dk. Døesvej 70 76.
Naturfag for skov- og gartnerholdet Grundlæggende kemi -Gennemgang af forskellige stoffers egenskaber og anvendelighed indenfor gartneri, anlægsgartneri og skovbrug 1 www.ucholstebro.dk. Døesvej 70 76.
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse:
 Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
Opgaver i atomer. c) Aflæs atommassen for Mg i det periodiske system eller på de udskrevne ark, og skriv det ned.
 Opgaver i atomer Opgave 1 Tegn atomerne af nedenstående grundstoffer på samme måde, som det er vist for andre atomer i timen. Angiv protoner med plusser. Vedrørende elektroner: Husk, at der maksimalt kan
Opgaver i atomer Opgave 1 Tegn atomerne af nedenstående grundstoffer på samme måde, som det er vist for andre atomer i timen. Angiv protoner med plusser. Vedrørende elektroner: Husk, at der maksimalt kan
Torben Rosenørn. Aalborg Universitet. Campus Esbjerg
 Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
DET PERIODISKE SYSTEM
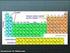 DET PERIODISKE SYSTEM Tilpasset efter Chemistry It s Elemental! Præsentation fra the American Chemical Society, Aug. 2009 http://portal.acs.org/portal/publicwebsite/education/outreach/ncw/studentseducators/cnbp_023211
DET PERIODISKE SYSTEM Tilpasset efter Chemistry It s Elemental! Præsentation fra the American Chemical Society, Aug. 2009 http://portal.acs.org/portal/publicwebsite/education/outreach/ncw/studentseducators/cnbp_023211
Lim mellem atomerne Ny Prisma Fysik og kemi 8. Skole: Navn: Klasse:
 Lim mellem atomerne Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: Opgave 1 Her ser du en modeltegning af et atom. Hvilket atom forestiller modellen? Der er 5 svarmuligheder. Sæt et kryds. Et oxygenatom
Lim mellem atomerne Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: Opgave 1 Her ser du en modeltegning af et atom. Hvilket atom forestiller modellen? Der er 5 svarmuligheder. Sæt et kryds. Et oxygenatom
Salte, Syre og Baser
 Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron. En hydron er en H +
 Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron En hydron er en H + Ved en syrebasereaktion overføres der en hydron fra en syre til en base En syre indeholder
Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron En hydron er en H + Ved en syrebasereaktion overføres der en hydron fra en syre til en base En syre indeholder
Nr. 6-2007 Grundstoffernes historie Fag: Fysik A/B/C Udarbejdet af: Michael Bjerring Christiansen, Århus Statsgymnasium, november 2008
 Nr. 6-007 Grundstoffernes historie Fag: Fysik A/B/C Udarbejdet af: Michael Bjerring Christiansen, Århus Statsgymnasium, november 008 Spørgsmål til artiklen. Hvilket grundstof, mente Hans Bethe, var det
Nr. 6-007 Grundstoffernes historie Fag: Fysik A/B/C Udarbejdet af: Michael Bjerring Christiansen, Århus Statsgymnasium, november 008 Spørgsmål til artiklen. Hvilket grundstof, mente Hans Bethe, var det
Opgave. Navn Kemi opgaver Klasse Side 1 af 7. Hvad kaldes elementarpartiklerne, angiv deres ladning
 Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Fysik og kemi i 8. klasse
 Fysik og kemi i 8. klasse Teori til fysik- og kemiøvelserne ligger på nettet: fysik8.dk Udgivet af: Beskrivelser af elevforsøg Undervisningsforløb om atomfysik, mål & vægt, hverdagskemi, sæbe, metaller,
Fysik og kemi i 8. klasse Teori til fysik- og kemiøvelserne ligger på nettet: fysik8.dk Udgivet af: Beskrivelser af elevforsøg Undervisningsforløb om atomfysik, mål & vægt, hverdagskemi, sæbe, metaller,
Oversigt med forklaring over forskellige begreber
 Oversigt med forklaring over forskellige begreber fra www.michaelfynsk.dk Til dette dokument tilhører en mappe med filer bl.a..exe-,.pdf- og.jpg-filer. Side 1 af 19 Indholdsfortegnelse Brintbinding (hydrogenbinding)
Oversigt med forklaring over forskellige begreber fra www.michaelfynsk.dk Til dette dokument tilhører en mappe med filer bl.a..exe-,.pdf- og.jpg-filer. Side 1 af 19 Indholdsfortegnelse Brintbinding (hydrogenbinding)
Naturfag. Supplerende materiale. 5. udgave
 Naturfag Supplerende materiale 5. udgave Uorganisk kemi Uorganisk kemi Atomets opbygning - en teori Alle ting omkring os, uanset form, farve og størrelse, er opbygget af bittesmå partikler. De kan ikke
Naturfag Supplerende materiale 5. udgave Uorganisk kemi Uorganisk kemi Atomets opbygning - en teori Alle ting omkring os, uanset form, farve og størrelse, er opbygget af bittesmå partikler. De kan ikke
Medicin Fra ide til tablet
 KØBENHAVNS UNIVERSITET DET NATUR- OG BIOVIDENSKABELIGE FAKULTET Medicin Fra ide til tablet Til mellemtrinnet Skoletjenesten, SCIENCE 2017 Grundstoffer og molekyler Grundstoffer Grundsto Kemisk f symbol
KØBENHAVNS UNIVERSITET DET NATUR- OG BIOVIDENSKABELIGE FAKULTET Medicin Fra ide til tablet Til mellemtrinnet Skoletjenesten, SCIENCE 2017 Grundstoffer og molekyler Grundstoffer Grundsto Kemisk f symbol
NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10
 NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10 Elevens navn: CPR-nr.: Skole: Klasse: Tilsynsførendes navn: 1 Tilstandsformer Tilstandsformer Opgave 1.1 Alle stoffer har 3 tilstandsformer.
NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10 Elevens navn: CPR-nr.: Skole: Klasse: Tilsynsførendes navn: 1 Tilstandsformer Tilstandsformer Opgave 1.1 Alle stoffer har 3 tilstandsformer.
Jordens salte Ny Prisma Fysik og kemi 9 - kapitel 2 Skole: Navn: Klasse:
 Jordens salte Ny Prisma Fysik og kemi 9 kapitel 2 Skole: Navn: Klasse: Opgave 1 I planternes blade foregår fotosyntesen, hvor planter forbruger vand og kuldioxid for bl.a. at danne oxygen. 6 H 2 O C 6
Jordens salte Ny Prisma Fysik og kemi 9 kapitel 2 Skole: Navn: Klasse: Opgave 1 I planternes blade foregår fotosyntesen, hvor planter forbruger vand og kuldioxid for bl.a. at danne oxygen. 6 H 2 O C 6
Folkeskolens afgangsprøve Maj-juni 2006 Fysik / kemi - Facitliste
 Folkeskolens afgangsprøve Maj-juni 2006 1/25 Fk5 Opgave 1 / 20 (Opgaven tæller 5 %) I den atommodel, vi anvender i skolen, er et atom normalt opbygget af 3 forskellige partikler: elektroner, neutroner
Folkeskolens afgangsprøve Maj-juni 2006 1/25 Fk5 Opgave 1 / 20 (Opgaven tæller 5 %) I den atommodel, vi anvender i skolen, er et atom normalt opbygget af 3 forskellige partikler: elektroner, neutroner
maj 2017 Kemi C 326
 Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Gødningslære B. Find hjemmesiden: Vælg student login øverst til højre. Skriv koden: WXMITP5PS. og derefter dit navn
 En lille quiz.for de nye og de gamle Find hjemmesiden: www.socrative.com Vælg student login øverst til højre Skriv koden: WXMITP5PS og derefter dit navn Gødningstyper: Grundgødning Højt indhold af et eller
En lille quiz.for de nye og de gamle Find hjemmesiden: www.socrative.com Vælg student login øverst til højre Skriv koden: WXMITP5PS og derefter dit navn Gødningstyper: Grundgødning Højt indhold af et eller
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017
 EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
Navn Kemi opgaver Klasse 9. b Side 1 af 9. Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen sammen?
 Klasse 9. b Side 1 af 9 Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Klasse 9. b Side 1 af 9 Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Gødningslære A. Faglærer Karin Juul Hesselsøe
 Faglærer Karin Juul Hesselsøe Gødningslære er enkelt Gødningslære er enkelt For lidt Gødningslære er enkelt Alt for meget Det kan være svært at finde balancen Planter består mest af sukkerstoffer Kulhydrater
Faglærer Karin Juul Hesselsøe Gødningslære er enkelt Gødningslære er enkelt For lidt Gødningslære er enkelt Alt for meget Det kan være svært at finde balancen Planter består mest af sukkerstoffer Kulhydrater
Opgave 1.1 1 KemiForlaget
 Opgave 1.1 Byg et monosaccharid Kulhydrat-molekylerne består af tre forskellige atomer : arbon, (sorte); ydrogen, (hvide), og Oxygen,O (røde). 1. Lav en ring af 5 -atomer og et O-atom. 2. Byg en gruppe
Opgave 1.1 Byg et monosaccharid Kulhydrat-molekylerne består af tre forskellige atomer : arbon, (sorte); ydrogen, (hvide), og Oxygen,O (røde). 1. Lav en ring af 5 -atomer og et O-atom. 2. Byg en gruppe
Partikler med fart på Ny Prisma Fysik og kemi 9 Skole: Navn: Klasse:
 Partikler med fart på Ny Prisma Fysik og kemi 9 Skole: Navn: Klasse: Opgave 1 Et atom har oftest to slags partikler i atomkernen. Hvad hedder partiklerne? Der er 6 linjer. Sæt et kryds ud for hver linje.
Partikler med fart på Ny Prisma Fysik og kemi 9 Skole: Navn: Klasse: Opgave 1 Et atom har oftest to slags partikler i atomkernen. Hvad hedder partiklerne? Der er 6 linjer. Sæt et kryds ud for hver linje.
Syrer, baser og salte:
 Syrer, baser og salte: Salte: Salte er en stor gruppe af kemiske stoffer med en række fælles egenskaber I tør, fast form er de krystaller. Opløst i vand danner de frie ioner som giver vandet elektrisk
Syrer, baser og salte: Salte: Salte er en stor gruppe af kemiske stoffer med en række fælles egenskaber I tør, fast form er de krystaller. Opløst i vand danner de frie ioner som giver vandet elektrisk
1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation
 Overskrifter til kemispørgsmål, Kemi C 2012 1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation 2. Grundstoffer i mennesket
Overskrifter til kemispørgsmål, Kemi C 2012 1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation 2. Grundstoffer i mennesket
10. juni 2016 Kemi C 325
 Grundstoffer og Det Periodiske System Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Forklar hvad der forstås med begrebet grundstoffer kontra kemiske forbindelser. Atomer er placeret
Grundstoffer og Det Periodiske System Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Forklar hvad der forstås med begrebet grundstoffer kontra kemiske forbindelser. Atomer er placeret
Mundtlige eksamensopgaver
 Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
Guldbog Kemi C Copyright 2016 af Mira Backes og Christian Bøgelund.
 Guldbog Kemi C Copyright 2016 af Mira Backes og Christian Bøgelund. Alle rettigheder forbeholdes. Mekanisk, fotografisk eller elektronisk gengivelse af denne bog eller dele heraf er uden forfatternes skriftlige
Guldbog Kemi C Copyright 2016 af Mira Backes og Christian Bøgelund. Alle rettigheder forbeholdes. Mekanisk, fotografisk eller elektronisk gengivelse af denne bog eller dele heraf er uden forfatternes skriftlige
Der er noget i luften Ny Prisma Fysik og kemi 9 - kapitel 6 Skole: Navn: Klasse:
 Der er noget i luften Ny Prisma Fysik og kemi 9 - kapitel 6 Skole: Navn: Klasse: Opgave 1 Gasserne nitrogen, oxygen og kuldioxid er de gasser i Jordens atmosfære, der er vigtigst for livet. Angiv hvilke
Der er noget i luften Ny Prisma Fysik og kemi 9 - kapitel 6 Skole: Navn: Klasse: Opgave 1 Gasserne nitrogen, oxygen og kuldioxid er de gasser i Jordens atmosfære, der er vigtigst for livet. Angiv hvilke
Syrer, baser og salte
 Molekyler Atomer danner molekyler (kovalente bindinger) ved at dele deres elektroner i yderste elektronskal. Dette sker for at opnå en stabil tilstand. En stabil tilstand er når molekylerne på nogle tidspunkter
Molekyler Atomer danner molekyler (kovalente bindinger) ved at dele deres elektroner i yderste elektronskal. Dette sker for at opnå en stabil tilstand. En stabil tilstand er når molekylerne på nogle tidspunkter
Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse:
 Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse: Opgave 1 Et metal er kendetegnet ved, at nogle af metallets elektroner danner en elektrongas. Her er en række udsagn om, hvad et
Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse: Opgave 1 Et metal er kendetegnet ved, at nogle af metallets elektroner danner en elektrongas. Her er en række udsagn om, hvad et
EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør. Spørgsmål 1. Grundstoffer og det periodiske system
 EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør Øvelse: Opløsningsmidlers egenskaber Spørgsmål 1 Grundstoffer og det periodiske system Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne
EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør Øvelse: Opløsningsmidlers egenskaber Spørgsmål 1 Grundstoffer og det periodiske system Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne
En lille verden Ny Prisma Fysik og kemi 8. Skole: Navn: Klasse:
 En lille verden Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: For at løse nogle af opgaverne skal du benytte Nuklidtabel A og B på kopiark 6.4 og 6.5 i Kopimappe B, Ny Prisma 8. Opgave 1 Et atom består
En lille verden Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: For at løse nogle af opgaverne skal du benytte Nuklidtabel A og B på kopiark 6.4 og 6.5 i Kopimappe B, Ny Prisma 8. Opgave 1 Et atom består
I forløbet Atomet arbejdes med atomets opbygning. Forløbet består af 5 fagtekster, 31 opgaver og 8 aktiviteter. Derudover er der Videnstjek.
 Atomet Niveau: 8. klasse Varighed: 5 lektioner Præsentation: I forløbet Atomet arbejdes med atomets opbygning. Forløbet består af 5 fagtekster, 31 opgaver og 8 aktiviteter. Derudover er der Videnstjek.
Atomet Niveau: 8. klasse Varighed: 5 lektioner Præsentation: I forløbet Atomet arbejdes med atomets opbygning. Forløbet består af 5 fagtekster, 31 opgaver og 8 aktiviteter. Derudover er der Videnstjek.
Med forbehold for censors kommentarer. Eksamensspørgsmål Kemi C, 2014, Kec223 (NB).
 Med forbehold for censors kommentarer Eksamensspørgsmål Kemi C, 2014, Kec223 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer
Med forbehold for censors kommentarer Eksamensspørgsmål Kemi C, 2014, Kec223 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer
Eksamensspørgsmål Kemi C, 2015, Kec124 (NB).
 Eksamensspørgsmål Kemi C, 2015, Kec124 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2015, Kec124 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, spændingsrækken
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold
 Københavns Universitet Saxkøbing, Vintermøde Roedyrkning: Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold Søren Husted, 5 Februar, 2019 Agenda: 9:35 10:15 De essentielle næringsstoffer og roedyrkning
Københavns Universitet Saxkøbing, Vintermøde Roedyrkning: Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold Søren Husted, 5 Februar, 2019 Agenda: 9:35 10:15 De essentielle næringsstoffer og roedyrkning
Fysikforløb nr. 6. Atomfysik
 Fysikforløb nr. 6. Atomfysik I uge 8 begynder vi på atomfysik. Derfor får du dette kompendie, så du i god tid, kan begynde, at forberede dig på emnet. Ideen med dette kompendie er også, at du her får en
Fysikforløb nr. 6. Atomfysik I uge 8 begynder vi på atomfysik. Derfor får du dette kompendie, så du i god tid, kan begynde, at forberede dig på emnet. Ideen med dette kompendie er også, at du her får en
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Intra- og intermolekylære bindinger.
 Intra- og intermolekylære bindinger. Dipol-Dipol bindinger Londonbindinger ydrogen bindinger ydrofil ydrofob 1. Tilstandsformer... 1 2. Dipol-dipolbindinger... 2 3. Londonbindinger... 2 4. ydrogenbindinger....
Intra- og intermolekylære bindinger. Dipol-Dipol bindinger Londonbindinger ydrogen bindinger ydrofil ydrofob 1. Tilstandsformer... 1 2. Dipol-dipolbindinger... 2 3. Londonbindinger... 2 4. ydrogenbindinger....
Rådgivning ved revision af Bekendtgørelse nr. 637 Sammenstilling af analysekvalitet fra intern kvalitetskontrol
 Rådgivning ved revision af Bekendtgørelse nr. 637 Sammenstilling af analysekvalitet fra intern kvalitetskontrol Miljøstyrelsen Teknisk Notat Juni 2003 Sammenstilling af analysekvalitet fra intern kvalitetskontrol
Rådgivning ved revision af Bekendtgørelse nr. 637 Sammenstilling af analysekvalitet fra intern kvalitetskontrol Miljøstyrelsen Teknisk Notat Juni 2003 Sammenstilling af analysekvalitet fra intern kvalitetskontrol
3HCl + Al AlCl3 + 3H
 For at du kan løse denne opgave, og få helt styr på det med reaktionsligninger, er du nødt til at lave forløbet om Ion-bindinger først. Hvis du er færdig med det forløb, så kan du bare fortsætte. Har du
For at du kan løse denne opgave, og få helt styr på det med reaktionsligninger, er du nødt til at lave forløbet om Ion-bindinger først. Hvis du er færdig med det forløb, så kan du bare fortsætte. Har du
Forord. Undervisere kan bruge arket ved først at kontakte pierre@naae.dk og få et skriftligt tilsagn.
 Forord Dette hjælpeark til mol og molberegninger er lavet af til brug på Nørre Åby Efterskole. Man er som studerende/elev meget velkommen til at hente og bruge arket. Undervisere kan bruge arket ved først
Forord Dette hjælpeark til mol og molberegninger er lavet af til brug på Nørre Åby Efterskole. Man er som studerende/elev meget velkommen til at hente og bruge arket. Undervisere kan bruge arket ved først
Læringsmål i fysik - 9. Klasse
 Læringsmål i fysik - 9. Klasse Salte, syrer og baser Jeg ved salt er et stof der er opbygget af ioner. Jeg ved at Ioner i salt sidder i et fast mønster, et iongitter Jeg kan vise og forklare at salt, der
Læringsmål i fysik - 9. Klasse Salte, syrer og baser Jeg ved salt er et stof der er opbygget af ioner. Jeg ved at Ioner i salt sidder i et fast mønster, et iongitter Jeg kan vise og forklare at salt, der
Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse 1 Stoffers blandbarhed og det periodiske system 2 Stoffers blandbarhed og elektronparbindingen 3 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse 1 Stoffers blandbarhed og det periodiske system 2 Stoffers blandbarhed og elektronparbindingen 3 Redoxreaktioner, spændingsrækken
Grundstoffer og det periodiske system
 Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Atomets opbygning. Keminote 2010
 Atomets opbygning Oprindelig forestillede man sig, at atomet var en lille kugle, som ikke kunne deles i mindre dele. Ordet atom kommer af det græske ord atomos, som betyder udelelig. Fra slutningen af
Atomets opbygning Oprindelig forestillede man sig, at atomet var en lille kugle, som ikke kunne deles i mindre dele. Ordet atom kommer af det græske ord atomos, som betyder udelelig. Fra slutningen af
Eksamensopgaverne offentliggøres selvfølgelig med det forbehold, at censor kan komme med ændringsforslag.
 VUC Århus, 17. maj. 2011 Kære alle kursister på holdene ke02da1c (kemi C flex, helårsholdet) og ke05da1c (kemi C flex, halvårsholdet) På de næste mange sider vil I kunne se Jeres kommende eksamensopgaver
VUC Århus, 17. maj. 2011 Kære alle kursister på holdene ke02da1c (kemi C flex, helårsholdet) og ke05da1c (kemi C flex, halvårsholdet) På de næste mange sider vil I kunne se Jeres kommende eksamensopgaver
Kemiske bindinger. Præsentation: Niveau: 8. klasse. Varighed: 7 lektioner
 Kemiske bindinger Niveau: 8. klasse Varighed: 7 lektioner Præsentation: Forløbet Kemiske bindinger omhandler ionbindinger, kovalente bindinger, metalbindinger, polære kovalente bindinger, hydrogenbindinger
Kemiske bindinger Niveau: 8. klasse Varighed: 7 lektioner Præsentation: Forløbet Kemiske bindinger omhandler ionbindinger, kovalente bindinger, metalbindinger, polære kovalente bindinger, hydrogenbindinger
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Fredericia HF og VUC Uddannelse Fag og niveau Lærer(e) Hold HF Kemi C Thomas Nielsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Fredericia HF og VUC Uddannelse Fag og niveau Lærer(e) Hold HF Kemi C Thomas Nielsen
Eksamensopgaver. NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL
 Eksamensopgaver NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL Liste over eksamensøvelser 1. Opløsningsmidlers egenskaber 2. Fældningsreaktioner 3. Påvisning af proteiner 4. Fremstilling af
Eksamensopgaver NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL Liste over eksamensøvelser 1. Opløsningsmidlers egenskaber 2. Fældningsreaktioner 3. Påvisning af proteiner 4. Fremstilling af
Oxidationstal og elektronparbindinger December 2015
 idationstal og elektronparbindinger December 2015 idationstal og elektronparbindinger I redokemi findes en række simple regler, som gør det muligt at bestemme oidationstal for et atom i en kemisk forbindelse,
idationstal og elektronparbindinger December 2015 idationstal og elektronparbindinger I redokemi findes en række simple regler, som gør det muligt at bestemme oidationstal for et atom i en kemisk forbindelse,
m: masse i masseprocent : indhold i volumenprocent : indhold
 Kemisk formelsamling (C-niveau s kernestof samt en del formler, der hører hjemme på Kemi B ) Mængdeberegninger m: masse M: molar masse n : stofmængde : volumen ρ : densitet (massetæthed) c : koncentration
Kemisk formelsamling (C-niveau s kernestof samt en del formler, der hører hjemme på Kemi B ) Mængdeberegninger m: masse M: molar masse n : stofmængde : volumen ρ : densitet (massetæthed) c : koncentration
Syrer, baser og salte
 Syrer, baser og salte Navn: Indholdsfortegnelse: Ion begrebet... 2 Ætsning af Mg bånd med forskellige opløsninger... 5 Elektrolyse af forskellige opløsninger... 7 Påvisning af ioner i forskellige opløsninger
Syrer, baser og salte Navn: Indholdsfortegnelse: Ion begrebet... 2 Ætsning af Mg bånd med forskellige opløsninger... 5 Elektrolyse af forskellige opløsninger... 7 Påvisning af ioner i forskellige opløsninger
Fysik/kemi. Fagets overordnede rammer. Formål. Fagplan
 Fysik/kemi Fagplan Fagets overordnede rammer Der undervises i fysik/kemi på 6.- 9. klassetrin. Undervisningen i fysik/kemi skal bygge på de naturvidenskabelige grundelementer som eleverne har tilegnet
Fysik/kemi Fagplan Fagets overordnede rammer Der undervises i fysik/kemi på 6.- 9. klassetrin. Undervisningen i fysik/kemi skal bygge på de naturvidenskabelige grundelementer som eleverne har tilegnet
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Lærer(e) Hold Sommereksamen 2013 VUF - Voksenuddannelsescenter Frederiksberg
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Lærer(e) Hold Sommereksamen 2013 VUF - Voksenuddannelsescenter Frederiksberg
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2013 Institution Fredericia VUC Uddannelse Fag og niveau Lærer(e) Hold Hf Kemi C Thomas Nielsen 1kec13e
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2013 Institution Fredericia VUC Uddannelse Fag og niveau Lærer(e) Hold Hf Kemi C Thomas Nielsen 1kec13e
Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på:
 1. Molekyler Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på: Elektronparbinding (= kovalent binding) Oktetreglen/ædelgasreglen Polaritet Hydrofile og hydrofobe grupper Navngivning af
1. Molekyler Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på: Elektronparbinding (= kovalent binding) Oktetreglen/ædelgasreglen Polaritet Hydrofile og hydrofobe grupper Navngivning af
Spørgsmål 1 Den kemiske reaktion
 Spørgsmål 1 Den kemiske reaktion Du skal gennemgå eksperimentet Fyrfadslys inddrag gerne dine forsøgsresultater og vurder om de understøtter modellen reaktionskemaet. Du skal endvidere give eksempler på
Spørgsmål 1 Den kemiske reaktion Du skal gennemgå eksperimentet Fyrfadslys inddrag gerne dine forsøgsresultater og vurder om de understøtter modellen reaktionskemaet. Du skal endvidere give eksempler på
Big Bang og universets skabelse (af Jeanette Hansen, Toftlund Skole)
 Big Bang og universets skabelse (af Jeanette Hansen, Toftlund Skole) Har du nogensinde tænkt på, hvordan jorden, solen og hele universet er skabt? Det er måske et af de vigtigste spørgsmål, man forsøger
Big Bang og universets skabelse (af Jeanette Hansen, Toftlund Skole) Har du nogensinde tænkt på, hvordan jorden, solen og hele universet er skabt? Det er måske et af de vigtigste spørgsmål, man forsøger
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
KEMI C. Videooversigt
 KEMI C Videooversigt Afstemning og mængdeberegning... 2 Atomer og det periodiske system... 2 Forsøgsfilm... 2 Ioner og salte... 3 Molekyler... 3 Opløsninger og tilstandsformer... 3 Organisk kemi... 3 Redoxreaktioner...
KEMI C Videooversigt Afstemning og mængdeberegning... 2 Atomer og det periodiske system... 2 Forsøgsfilm... 2 Ioner og salte... 3 Molekyler... 3 Opløsninger og tilstandsformer... 3 Organisk kemi... 3 Redoxreaktioner...
Forløbet består af 7 fagtekster, 12 opgaver, tip en 12 er, 5 praktiske aktiviteter, flere kemi-sudokuer og en mindre skriftlig elevopgave.
 Atomer og molekyler Niveau: 7. klasse Varighed: 7 lektioner Præsentation: I forløbet Atomer og molekyler arbejdes der med helt grundlæggende kemiske begreber omkring stofopbygning, derfor bør temaet placeres
Atomer og molekyler Niveau: 7. klasse Varighed: 7 lektioner Præsentation: I forløbet Atomer og molekyler arbejdes der med helt grundlæggende kemiske begreber omkring stofopbygning, derfor bør temaet placeres
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Flammefarver Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen af et atom
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Flammefarver Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen af et atom
KORT SUMMARISK GENNEMGANG AF KEMIEN 2013.
 COPYRIGHT NIELS NORDHOLT 2000-2013 S. 1 KORT SUMMARISK GENNEMGANG AF KEMIEN 2013. Sætning, reaktion eller kort forsøgsbeskrivelse Ved en fysisk forandring omdannes stoffer ikke til andre stoffer. Ved en
COPYRIGHT NIELS NORDHOLT 2000-2013 S. 1 KORT SUMMARISK GENNEMGANG AF KEMIEN 2013. Sætning, reaktion eller kort forsøgsbeskrivelse Ved en fysisk forandring omdannes stoffer ikke til andre stoffer. Ved en
Densitet (også kendt som massefylde og vægtfylde) hvor
 Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Alkohol Ingrid Jespersens Gymnasieskole 2007
 Alkohol Ingrid Jespersens Gymnasieskole 007 Ethanols fysiske egenskaber Kogepunkt 78,5 o C På side 8 i Alkohol også vises Frysepunkt -114, o C opskriften på et forsøg til bestemmelse af Massefylde 0,789
Alkohol Ingrid Jespersens Gymnasieskole 007 Ethanols fysiske egenskaber Kogepunkt 78,5 o C På side 8 i Alkohol også vises Frysepunkt -114, o C opskriften på et forsøg til bestemmelse af Massefylde 0,789
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug 2014- dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold Flex-kemi C Kemi C Mohammed
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug 2014- dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold Flex-kemi C Kemi C Mohammed
1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas
 Eksamensspørgsmål revideret 7/6 NW 1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas Bilag: Det periodisk system. Du skal fortælle om atomets opbygning, om isotoper og naturligvis om begrebet
Eksamensspørgsmål revideret 7/6 NW 1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas Bilag: Det periodisk system. Du skal fortælle om atomets opbygning, om isotoper og naturligvis om begrebet
Spørgsmål 1. Øvelse: Kobber plus dibrom. Teori: Atomers opbygning.
 Spørgsmål 1. Øvelse: Kobber plus dibrom. Atomers opbygning. Atomets struktur. Det periodiske system. Betydning af hovedgrupperne. Ædelgassernes elektronstruktur i den yderste skal. Dannelse af ioner og
Spørgsmål 1. Øvelse: Kobber plus dibrom. Atomers opbygning. Atomets struktur. Det periodiske system. Betydning af hovedgrupperne. Ædelgassernes elektronstruktur i den yderste skal. Dannelse af ioner og
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug-dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi C Mohammed
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug-dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi C Mohammed
Forløbet Syrer og baser ligger i fysik-kemifokus.dk 7. klasse, og det er muligt at arbejde med forløbet både i 7. og 8. klasse.
 Syrer og baser Niveau: 7. klasse Varighed: 7 lektioner Præsentation: Forløbet Syrer og baser ligger i fysik-kemifokus.dk 7. klasse, og det er muligt at arbejde med forløbet både i 7. og 8. klasse. Forløbet
Syrer og baser Niveau: 7. klasse Varighed: 7 lektioner Præsentation: Forløbet Syrer og baser ligger i fysik-kemifokus.dk 7. klasse, og det er muligt at arbejde med forløbet både i 7. og 8. klasse. Forløbet
TEORETISKE MÅL FOR EMNET:
 TEORETISKE MÅL FOR EMNET: Kendskab til organiske forbindelser Kende alkoholen ethanol samt enkelte andre simple alkoholer Vide, hvad der kendetegner en alkohol Vide, hvordan alkoholprocenter beregnes;
TEORETISKE MÅL FOR EMNET: Kendskab til organiske forbindelser Kende alkoholen ethanol samt enkelte andre simple alkoholer Vide, hvad der kendetegner en alkohol Vide, hvordan alkoholprocenter beregnes;
Kernereaktioner. 1 Energi og masse
 Kernereaktioner 7 1 Energi og masse Ifølge relativitetsteorien gælder det, at når der tilføres energi til et system, vil systemets masse altid vokse. Sammenhængen mellem energitilvæksten og massetilvækstener
Kernereaktioner 7 1 Energi og masse Ifølge relativitetsteorien gælder det, at når der tilføres energi til et system, vil systemets masse altid vokse. Sammenhængen mellem energitilvæksten og massetilvækstener
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Termin hvori undervisningen afsluttes: maj-juni 2011 Københavns Tekniske
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Termin hvori undervisningen afsluttes: maj-juni 2011 Københavns Tekniske
Polære og ikke polære væsker
 Viborg Private Realskole 10. årgang Polære og ikke polære væsker Side -1- En model af et vandmolekyle SIDE 2 1021 At forstå et vandmolekyles opbygning Blyant/kuglepen Molekylesæt Teori Vi ser på en tegning
Viborg Private Realskole 10. årgang Polære og ikke polære væsker Side -1- En model af et vandmolekyle SIDE 2 1021 At forstå et vandmolekyles opbygning Blyant/kuglepen Molekylesæt Teori Vi ser på en tegning
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Atomers opbygning og øvelsen: Spændingsrækken. Atomer og øvelsen: Spændingsrækken
 Kristiansen og Cederberg Aurum Kemi for gymnasiet 1 1. udgave - 2006 pensum sider # Kemi C 2 gange 16 spørgsmål Atomers opbygning og øvelsen: Spændingsrækken Kapitel 1 5-38 1 Det periodiske system, hvilke
Kristiansen og Cederberg Aurum Kemi for gymnasiet 1 1. udgave - 2006 pensum sider # Kemi C 2 gange 16 spørgsmål Atomers opbygning og øvelsen: Spændingsrækken Kapitel 1 5-38 1 Det periodiske system, hvilke
Røntgenstråling. Baggrund. Atomers struktur og Røntgenstråling
 Røntgenstråling Baggrund Bølgelængden af synligt lys ligger i området 400-750 nm. Ting med en mindre rumlig udstrækning kan vi ikke se med vores blotte øje. Det betyder, at hvis vi vil se på hvilke atomer
Røntgenstråling Baggrund Bølgelængden af synligt lys ligger i området 400-750 nm. Ting med en mindre rumlig udstrækning kan vi ikke se med vores blotte øje. Det betyder, at hvis vi vil se på hvilke atomer
1 Ioner og ionforbindelser
 1 Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes, så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
1 Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes, så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
Brombærsolcellen - introduktion
 #0 Brombærsolcellen - introduktion Solceller i lommeregneren, solceller på hustagene, solceller til mobiltelefonen eller solceller til den bærbare computer midt ude i regnskoven- Solcellen har i mange
#0 Brombærsolcellen - introduktion Solceller i lommeregneren, solceller på hustagene, solceller til mobiltelefonen eller solceller til den bærbare computer midt ude i regnskoven- Solcellen har i mange
Folkeskolens afgangsprøve Maj 2006 Fysik / kemi - Facitliste
 Folkeskolens afgangsprøve Maj 2006 1/26 Fk4 Opgave 1 / 20 (Opgaven tæller 5 %) I sin kemibog ser Per denne tegning, som er en model. Hvad forestiller tegningen? Der er 6 svarmuligheder. Sæt 1 kryds Et
Folkeskolens afgangsprøve Maj 2006 1/26 Fk4 Opgave 1 / 20 (Opgaven tæller 5 %) I sin kemibog ser Per denne tegning, som er en model. Hvad forestiller tegningen? Der er 6 svarmuligheder. Sæt 1 kryds Et
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj/ Juni 2016 Institution HF & VUC Nordsjælland Uddannelse Fag og niveau Lærer(e) Hold HF Kemi enkeltfag
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj/ Juni 2016 Institution HF & VUC Nordsjælland Uddannelse Fag og niveau Lærer(e) Hold HF Kemi enkeltfag
Lokalenhed Midtjylland (MJL). Bilagsoversigt.
 Lokalenhed Midtjylland (MJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2
Lokalenhed Midtjylland (MJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2
Lokalenhed Storstrøm (STO). Bilagsoversigt.
 Lokalenhed Storstrøm (STO). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph Hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 )
Lokalenhed Storstrøm (STO). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph Hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 )
Lokalenhed Østjylland (OJL). Bilagsoversigt.
 Lokalenhed Østjylland (OJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2
Lokalenhed Østjylland (OJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2016 Institution HF & VUC Nordsjælland Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi enkeltfag
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2016 Institution HF & VUC Nordsjælland Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi enkeltfag
Afleveringsopgaver i fysik
 Afleveringsopgaver i fysik Opgavesættet skal regnes i grupper på 2-3 personer, helst i par. Hver gruppe afleverer et sæt. Du kan finde noget af stoffet i Orbit C side 165-175. Opgave 1 Tegn atomerne af
Afleveringsopgaver i fysik Opgavesættet skal regnes i grupper på 2-3 personer, helst i par. Hver gruppe afleverer et sæt. Du kan finde noget af stoffet i Orbit C side 165-175. Opgave 1 Tegn atomerne af
Lokalenhed Fyn (FYN). Bilagsoversigt.
 Lokalenhed Fyn (FYN). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 ) dybde
Lokalenhed Fyn (FYN). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 ) dybde
Lokalenhed Sjælland (SJL). Bilagsoversigt.
 Lokalenhed Sjælland (SJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 )
Lokalenhed Sjælland (SJL). Bilagsoversigt. ph-forhold ph dybde Bilag 1 Hydrogencarbonat (HCO 3 ) dybde Ca dybde ph hydrogencarbonat (HCO 3 ) ph Ca Redoxforhold Redoxpotentiale dybde Bilag 2 Ilt (O 2 )
Teori 10. KlasseCenter Vesthimmerland
 TEORETISKE MÅL FOR EMNET: Kendskab til organiske forbindelser Kende alkoholen ethanol samt enkelte andre simple alkoholer Vide, hvad der kendetegner en alkohol Vide, hvordan alkoholprocenter beregnes;
TEORETISKE MÅL FOR EMNET: Kendskab til organiske forbindelser Kende alkoholen ethanol samt enkelte andre simple alkoholer Vide, hvad der kendetegner en alkohol Vide, hvordan alkoholprocenter beregnes;
