1. ATOMET. Elementarpartikel Ladning Masse (u) Antalsbetegnelse PROTON +1 1,0073 Z NEUTRON 0 1,0087 N ELEKTRON -1 0, u = ét C-12 atoms masse
|
|
|
- Bente Lorentzen
- 8 år siden
- Visninger:
Transkript
1 1. ATOMET Elementarpartikel Ladning Masse (u) Antalsbetegnelse PROTON +1 1,0073 Z NEUTRON 0 1,0087 N ELEKTRON -1 0,00055 A = antal nukleoner (nukleontallet, massetallet). Z = antal protoner (protontallet, atomnummeret). N = antal neutroner (neutrontallet). A = Z + N Definitionen af atommasseenheden unit, u, er følgende: 1u = 1 12 ét C-12 atoms masse (1u = 1, g) Isotoper: Atomer med samme antal protoner (Z), men med forskelligt antal neutroner (N) i kernen. (Man kan sige at det er forskellige udgaver af et bestemt grundstof). Symboler for Isotoperne af et bestemt grundstof betegnes ved grundstofsymbolet og nukleontallet A og eventuelt atomnummeret Z således (X er et vilkårligt grundstofsymbol):
2 3. KEMISKE BINDINGSTYPER. Den fede linie i det nedenforstående Periodiske System kaldes for trappelinien. Den adskiller metallerne fra ikke-metallerne. Metallerne står under trappelinien og ikke-metallerne står over den. H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Kovalent binding (elektronparbinding): En kovalent binding er en binding mellem to atomer med et (eller flere) fælles elektronpar. Denne binding optræder mellem to ikke-metaller i molekyler og sammensatte ioner. Eksempler: HCl, NH 3, CO 2, HCN, SO 2-4, NO- 3. Ion: Et atom eller en atomgruppe, der har en positiv eller negativ ladning. Eksempler: Br -, O 2-, N 3-, Na +, Ba 2+, Fe 3+, SO 2-4, PO3-4, NH+ 4, MnO- 4, HSO- 4. Ionbinding: En binding der skyldes den elektriske tiltrækning mellem en henholdsvis positiv og negativ ion. Ionbindingen optræder i forbindelser, der indeholder et metal og et ikke-metal. Forbindelser der indeholder ionbindinger kaldes ionforbindelser eller salte. Eksempler: NaCl [Na + og Cl - ], CaBr 2 [Ca 2+ og 2 Br - ], Li 2 O [2 Li + og O 2- ], Na 2 SO 4 [2 Na + og SO 2-4 ], NH 4Cl [NH + 4 og Cl- ], Ca 3 (PO 4 ) 2 [3 Ca 2+ og 2 PO 3-4 ]. Formelenhed: En formelenhed er den mindste neutrale enhed man kan skrive for en ionforbindelse. De 6 ovenforstående eksempler på ionforbindelser er alle eksempler på en formelenhed af det pågældende stof.
3 4. REAKTIONER Når man afstemmer et reaktionsskema skal der være det samme antal atomer på begge sider af reaktionspilen, fordi der skal være grundstofbevarelse. Hvis der optræder ladninger (i form af ioner) skal de også være ens. Stofferne på den venstre side af reaktionspilen kaldes reaktanter og stofferne på højresiden kaldes produkter. Reaktionskemaets grundelementer: REAKTANTER PRODUKTER C 13 H 28 (l) + O 2 (g) CO 2 (g) + H 2 O (g) I et reaktionsskema kan man også angive hvilken tilstandsform de enkelte stoffer har. Dette gøres i en parentes efter formlen for stoffet. (s) betyder fast stof, (l) betyder væske, (g) betyder gas og (aq) betyder at en vandig opløsning af stoffet. C 13 H 28 (l) + O 2 (g) CO 2 (g) + H 2 O (g) På reaktantsiden er der 13 C og på produktsiden er der 1 C, det vil sige at koefficienten foran CO 2 skal være 13, så der er lige mange carbon på begge sider af reaktionspilen. C 13 H 28 (l) + O 2 (g) 13 CO 2 (g) + H 2 O (g) På reaktantsiden er der 28 H og på produktsiden er der 2 H, det vil sige at koefficienten foran H 2 O skal være 14, så der er lige mange hydrogen på begge sider af reaktionspilen. C 13 H 28 (l) + O 2 (g) 13 CO 2 (g) + 14 H 2 O (g) På produktsiden er der nu ( ) O = 40 O og på reaktantsiden er der 2 O. Det vil sige at koefficienten foran O 2 bliver 20, så der er lige mange oxygen på begge sider af reaktionspilen. C 13 H 28 (l) + 20 O 2 (g) 13 CO 2 (g) + 14 H 2 O (g) Det korrekt afstemte reaktionsskema ser derfor ud som følgende: C 13 H 28 (l) + 20 O 2 (g) 13 CO 2 (g) + 14 H 2 O (g)
4 5. MÆNGDEBEREGNINGER Mol er en antalsbetegnelse (som for eksempel snes (20 stk.) og dusin (12 stk.) også er det): 1 mol = 6, stk. Avogadrokonstanten: N A = 6, mol -1 Den molare masse (molarmasse), M: Angiver massen af 1 mol af stoffet (det antal gram som 1 mol af stoffet vejer). Der eksisterer følgende sammenhæng mellem massen, stofmængden og den molare masse: m = n M Hvor m=massen med enheden g, n=stofmængden med enheden mol og M=den molare masse med enheden g/mol. Hvis du gerne vil vide, hvor mange formelenheder, der er i en given stofmængde, kan det beregnes ved hjælp af følgende sammenhæng: N = n N A Hvor N=antal formelenheder, n=stofmængden med enheden mol og N A er Avogadrokonstanten. C 13 H 28 (l) + 20 O 2 (g) 13 CO 2 (g) + 14 H 2 O (g) Stofmængdeforholdet (molforholdet, MF) er forholdet mellem de stofmængder der indgår i det afstemte reaktionsskema. Stofmængdeforholdet svarer også til forholdet mellem koefficienterne i det afstemte reaktionsskema. Det vil sige i det ovenforstående eksempel er stofmængdeforholdet mellem der fire forbindelser, der indgår i reaktionen, 1:20:13:14. Nu følger der et regneeksempel i brugen af afstemte reaktionsskemaer: Du har 20,52 g C 13 H 28. Hvor stor en masse vand dannes der ved en fuldstændig forbrænding heraf? Du har følgende oplysninger: m(c 13 H 28 ) = 20,52 g og M(C 13 H 28 ) = 184,3642 g/mol. Først beregnes stofmængden af C 13 H 28 : n(c 13 H 28 ) = m/m = 20,52 g / 184,3642 g/mol = 0,1114 mol. Dernæst findes stofmængden af vand. Da det ses af det afstemte reaktionsskema at stofmængdeforholdet mellem C 13 H 28 og H 2 O er 1:14 må det gælde at: n(h 2 O) = 14 n(c 13 H 28 ) = 14 0,1114 mol = 1,5596 mol Til sidst findes massen af vandet: m(h 2 O) = n M = 1,5596 mol 18,0152 g/mol = 28,10 g
5 KONCENTRATION Hvis man har sit stof i en opløsning, ser beregningen af stofmængden lidt anderledes ud, fordi man i denne situation nu kender koncentrationen af stoffet. Koncentration = Opløst stofmængde (med enheden mol) Opløsningens totale volumen (med enheden L) Dette giver følgende sammenhæng: c = n V Hvor n=stofmængden med enhenden mol, V=volumen med enheden L og c=koncentrationen med enheden mol/l=m (udtales: molær). Da koncentrationen angives i mol/l=m (molær) kaldes den også undertiden for molaritet. Nu følger der et regneeksempel i brugen af koncentrationsbegrebet: Du betragter reaktionen mellem fast magnesium og saltsyre, der forløber efter følgende reaktionsskema: Mg (s) + 2 HCl (aq) MgCl 2 (aq) + H 2 (g) Hvor stor en masse dihydrogen kan der maksimalt dannes ud fra 225 ml 0,5 M HCl? Du har følgende oplysninger: c(hcl) = 0,5 M og V(HCl) = 225 ml = 0,225 L. Først beregnes stofmængden af HCl: n(hcl) = c V = 0,5 mol/l 0,225 L = 0,1125 mol Det ses i det afstemte reaktionsskema at stofmængdeforholdet mellem HCl og H 2 er 2:1, det vil sige at stofmængden af H 2 bliver: n(h 2 ) = 0,5 n(hcl) = 0,5 0,1125 mol = 0,05625 mol Til sidst beregnes massen af det dannede dihydrogen, H 2 : m(h 2 ) = n M = 0,05625 mol 2,0158 g/mol = 0,113 g Når man snakker om koncentration, så skelner man mellem formel koncentration og aktuel koncentration. Den formelle koncentration er den tidligere her ovenfor nævnte og man benytter symbolet c herfor. Den aktuelle koncentration kan beskrives som følgende: Aktuel koncentration = Stofmængden af de pågældende partikler (mol) Opløsningens totale volumen (L) For at skelne aktuel koncentration fra formel koncentration, benytter man [ ] som symbol for den aktuelle koncentration.
6 Nu følger der et regneeksempel i brugen af koncentrationsbegrebet med inddragelse af den aktuelle koncentration: 7,41 g AlCl 3 opløses i vand til et totalt slutvolumen på 300 ml. Beregn de aktuelle koncentrationer af aluminiumioner og chloridioner. AlCl 3 (s) Al 3+ (aq) + 3 Cl - (aq) Du har følgende oplysninger: m(alcl 3 ) = 7,41 g, M(AlCl 3 ) = 133,3405 g/mol og V = 300 ml = 0,3 L. Først beregnes stofmængden af AlCl 3 : n(alcl 3 ) = m / M = 7,41 g / 133,3405 g/mol = 0,05557 mol Nu kan den formelle koncentration af AlCl 3 i opløsningen beregnes: c() = n / V = 0,05557 mol / 0,3 L = 0,185 mol/l = 0,185 M Men en vandig opløsning af AlCl 3 indeholder jo egentlig Al 3+ og Cl - (og selvfølgelig en masse vand) og ikke AlCl 3 -formelenheder (se afsnit 3 for forklaring af formelenhed). Det er her den aktuelle koncentration kommer ind. Den aktuelle koncentration af Al 3+ og Cl - bliver: [ Al 3+ ] = 0,185 mol/l = 0,185 M [ Cl - ] = 3 0,185 mol/l = 0,555 mol/l = 0,555 M Fordi der i opløsningen jo er én Al 3+ og tre Cl - for hver AlCl 3 -formelenhed, der er blevet opløst.
7 6. SYRER OG BASER Definitionerne på syrer og baser er som følgende: SYRER: en syre er et stof der kan afgive H + -ioner (protoner) BASER: en base er et stof der kan optage H + -ioner (protoner) Kommes en syre (HA) i vand dannes der altid oxoniumioner, H 3 O + : HA + H 2 O A - + H 3 O + A - kaldes syrens korresponderende base (eller syreresten). Kommes en base (B) i vand dannes der altid hydroxidioner, OH - : B + H 2 O BH + + OH - BH + kaldes basens korresponderende syre. ph-værdien er et udtryk for surhedsgraden i en vandig opløsning af en syre eller en base. Definitionen på ph er som følgende: ph = -log [H 3 O + ] Desuden ved man at ved stuetemperatur er produktet af den aktuelle koncentration af H 3 O + og den aktuelle koncentration af OH - altid konstant. Denne sammenhæng kaldes for vands ionprodukt: [H 3 O + ] [OH - ] = M 2 Man taler også om begreber som: sur opløsning, neutral opløsning og basisk opløsning. De er bestemt ved at følgende gælder: Sur opløsning : [H 3 O + ] > [OH - ] Neutral opløsning : [H 3 O + ] = [OH - ] Basisk opløsning : [H 3 O + ] < [OH - ] Sur Neutral Basisk ph [H 3 O + ] (M) [OH - ] (M)
8 7. ENERGI Et system besidder energi, hvis det kan udføre et stykke arbejde på omgivelserne eller hvis det kan overføre varme til omgivelserne. Den grundlæggende enhed på energi er Joule (J). Effekt er et udtryk for at systems energiforbrug pr. tid. Der eksisterer følgende sammenhæng mellem energi, effekt og tid: E = P t Hvor E=energien med enheden Joule (J), P=effekten med enheden watt (W), 1W=1J/s, og t=tiden med enheden sekund (s). Kinetisk energi (bevægelsesenergi): E kin = ½ m v 2 Hvor E kin =kinetisk energi med enheden J, m=massen med enheden kg og v=hastigheden med enheden meter/sekund (m/s). Potentiel energi (beliggenhedsenergi): E pot = m g h Hvor E pot =potentiel energi med enheden J, m=massen med enheden kg, g=tyngdeaccelerationen som i Danmark er g=9,82 m/s 2 og h=højden (over det valgte nulpunkt) med enheden meter (m). I fysik-kemi opererer man med to temperaturskalaer: Celcius-skalaen: t( C) Kelvin-skalaen: T(K) Det absolutte nulpunkt. På Kelvin-skalaen måles temperaturen i Kelvin (K). Inddelingen på de to temperaturskalaer er den samme, det vil sige at en forskel på 1 C er det samme som en forskel på 1 K. Omregning af temperaturer fra den ene skala til den anden kan gøres ved hjælp af følgende sammenhænge: T(K) = t( C) t( C) = T(K) -273
9 T s er smeltepunktet for det pågældende stof og T k er kogepunktet. De tre tilstandsformer som stoffer kan findes i er fast (s), væske (l) og gas (g). Følgende sammenhæng gælder i en bestemt fase (et af de tre skrå liniestykker i figuren øverst på denne side): E = m c T Hvor E=tilført eller afgivet energi med enheden Joule (J), m=massen med enheden kg, c=specifikke varmekapacitet med enheden kj/(kg K). Specifikke varmekapacitet, c: Den energimængde der skal tilføres stoffet, for at opvarme 1 kg med 1 K. C = m c Hvor C=varmekapaciteten med enheden kj/kg, m=massen med enheden kg og c=specifikke varmekapacitet med enheden kj/(kg K). Varmekapacitet, C: Den energimængde som stoffet skal tilføres, for at blive opvarmet med 1 K. Følgende sammenhæng gælder ved en faseovergang (et af de vandrette liniestykker i figuren øverst på denne side): E = m L Hvor E=tilført eller afgivet energi med enheden Joule (J), m=massen med enheden kg, L=specifikke smeltevarme (L s ) eller specifikke fordampningsvarme (L f ) med enheden kj/kg. Specifikke smeltevarme, L s : Den energimængde der skal tilføres for at smelte 1 kg af stoffet ved smeltepunktet. Specifikke fordampningsvarme, L f : Den energimængde der skal tilføres for at fordampe 1 kg af stoffet ved kogepunktet.
10 8. ELEKTROMAGNETISK STRÅLING I lufttomt rum og i atmosfærisk luft (ved normalt tryk) bevæger al elektromagnetisk stråling sig med lysets hastighed, c = 3, m/s. Man kan opfatte elektromagnetisk stråling på to forskellige måder, som bølger eller partikler. Bølgemodellen: Her opfattes al elektromagnetisk stråling som værende bølger, der kan karakteriseres ved en bølgelængde og frekvens. λ Bølgelængden, λ, er afstanden mellem to bølgetoppe eller bølgedale på bølgen. Frekvensen, f, er antallet af svingninger pr. sekund. Der eksisterer følgende sammenhæng mellem lysets hastighed, bølgelængde og frekvens for elektromagnetisk stråling. Denne sammenhæng kaldes for bølgeformlen: c = λ f Hvor c = lysets hastighed = 3, m/s, λ = bølgelængden med enheden meter (m) og f = frekvensen med enheden 1/s = Hz (Hertz). Partikelmodellen: I denne model opfattes den elektromagnetiske stråling som værende partikler (energiklumper). Disse partikler kaldes fotoner. For at beregne fotonernes energi i den elektromagnetiske stråling kan følgende sammenhæng anvendes: E foton = h f Hvor E foton = fotonens energi med enheden Joule (J), h = Plancks konstant = 6, J s og f = frekvensen med enheden 1/s = Hz (Hertz).
11 9. RADIOAKTIVITET Ved et radioaktivt henfald ændres atomkernen. Den oprindelige kerne som henfalder kaldes moderkernen. Efter henfaldet er den omdannet til datterkernen. α-henfald: Ved et α-henfald udsendes der en 4 2 He-kerne fra moderkernen, X. En α-partikel en en 4 2 He-kerne. α-stråling er partikelstråling. Partikelstråling er stråling, som består af partikler (som for eksempel α-, β- og neutron-stråling) til forskel fra elektromagnetisk stråling (f.eks γ- og røntgen-stråling). Y kaldes for datterkernen. Generelt henfaldsskema: A Z X A-4 Z-2 Y He Eksempel: U Th He β - -henfald: Ved et β - -henfald sker der det, at en neutron i moderkernen bliver omdannet til en proton, hvorved der fra kernen samtidigt udsendes en elektron (e - ) og en antineutrino ( ν ). Det er e - der er den radioaktive β - -stråling. β - -stråling er patikelstråling. 1 0 n 1 1 p e + ν Generelt henfaldsskema: Eksempel: A Z X A Z+1 Y e + ν Th Pa e + ν β + -henfald: Ved et β + -henfald sker der det, at en proton i moderkernen bliver omdannet til en neutron, hvorved der fra kernen samtidigt udsendes en positron (e +, en positiv elektron) og en neutrino (ν). Det er e + der er den radioaktive β + -stråling. β + -stråling er patikelstråling. 1 1 p 1 0 n e + ν Generelt henfaldsskema: Eksempel: A Z X A Z-1 Y e + ν Na Ne e + ν
12 γ-henfald: Ved et γ-henfald slipper en exciteret kerne (en kerne, hvis energitilstand er for høj) af med sin overskudsenergi. Efter henfaldet er kernen i sin grundtilstand. γ-stråling er elektromagnetisk stråling. En stjerne (*)efter symbolet for en radioaktiv kerne betyder at kernen er i en exciteret tilstand. Generelt henfaldsskema: A Z X* A Z Y + γ Eksempel: Ba* Ba + γ Halveringstid, T ½ : den tid det tager for at halvere antallet af kerner i et radioaktivt stof. Aktiviteten, A: antal henfald pr. sekund i en given radioaktiv kilde. Enheden på aktivitet er 1/s=Bq (Bequerel). Aktiviteten, A, fra en radioaktiv kilde er proportional med antallet af radioaktive kerner, N. Jo flere kerner der er des større er aktiviteten. Dette kan samles i følgende sammenhæng: A = k N Hvor A = aktiviteten med enheden Bequerel (Bq=1/s), k = henfaldskonstanten med enheden 1/s og N = antallet af radioaktive kerner. Henfaldskonstanten, k, er forskellig for hver enkelt radioaktiv kerne. Der eksisterer følgende sammenhæng mellem henfaldskonstanten og halveringstiden, T ½, for en given radioaktiv kerne: k = 0,693 T ½ Hvor k har enheden 1/s og halveringstiden, T ½, har enheden sekund (s). 0,693 er i virkeligheden ln2. Henfaldsloven: N = (½) t/t½ N 0 Hvor N = antallet af radioaktive kerner til tiden t, N 0 = antallet af radioaktive kerner til tiden t=0 (altså til begyndelsestidspunktet), t = tiden og T ½ = halveringstiden. A = (½) t/t½ A 0 Hvor A = aktiviteten til tiden t, A 0 = aktiviteten til tiden t=0 (altså til begyndelsestidspunktet), t = tiden og T ½ = halveringstiden. I de to ovenforstående formler skal man huske at tiden og halveringstiden skal have samme enhed.
13 Strålingsdosis: Vi betragter et organ med massen m, der udsættes for noget ioniserende stråling. Energien E afsættes derved i organet. D = E m Hvor D = strålingsdosis med enheden J/kg = Gy (Gray), E = den afsatte energi med enheden J (Joule) og m = massen med enheden kg. H = Q D Hvor H = dosisækvivalent med enheden J/kg = Sv (sievert), Q = kvalitetsfaktoren for den pågældende ioniserende stråling og D = strålingsdosis med enheden J/kg = Gy (Gray).
14 10. TABELLER Fysiske størrelser: STØRRELSE SYMBOL ENHED Evt. SYNONYM Stofmængde n mol Masse m g (gram) vægt Den molare masse M g molarmasse mol Antal formelenheder N stk. Koncentration c mol molaritet L = M (molær) Volumen V L (Liter) rumfang Massefylde ρ g densitet ml Energi E J (Joule) Tid t s (sekunder) Effekt P J s = W (watt) Specifikke c kj varmefylde varmekapacitet kg K Varmekapacitet C kj K Specifikke L s kj smeltevarme kg Specifikke L f kj fordampningsvarme kg Temperatur t C Absolut temperatur T K Hastighed v m s Højden h m (meter) Bølgelængde λ m Frekvens f 1 s = Hz (Hertz) Aktivitet A 1 s = Bq (Bequerel) Halveringstid T ½ (en tidsangivelse) Henfaldskonstant k 1 s = s-1 Strålingsdosis D J kg = Gy (Gray) Dosisækvivalent H J kg = Sv (Sievert) Kvalitetsfaktor Q fart
15 10-tals potenser: Talstørrelse Symbol Navn P peta T tera 10 9 G giga 10 6 M mega 10 3 k kilo 10 2 h hekto 10 1 da deca 10-1 d deci 10-2 c centi 10-3 m milli 10-6 µ mikro 10-9 n nano p pico f femto a atto Talforstavelser (kemiske præfikser): Tal Præfiks Tal Præfiks Tal Præfiks 1 mono 6 hexa 11 undeca 2 di 7 hepta 12 dodeca 3 tri 8 octa 13 trideca 4 tetra 9 nona 14 tetradeca 5 penta 10 deca 15 pentadeca Det græske alfabet: Alfa Α α Iota Ι ι Rho Ρ ρ Beta Β β Kappa Κ κ Sigma Σ σ Gamma Γ γ Lambda Λ λ Tau Τ τ Delta δ My Μ µ Ypsilon Υ υ Epsilon Ε ε Ny Ν ν Phi Φ ϕ Zeta Ζ ζ Ksi Ξ ξ Khi Χ χ Eta Η η Omikron Ο ο Psi Ψ ψ Theta Θ θ Pi Π π Omega Ω ω
16 Konstanter: Konstant Symbol Talstørrelse Avogadrokonstanten N A 6, mol -1 Protonens masse m p 1, u Neutronens masse m n 1, u Elektronens masse m e 5, u Lysets hastighed c 3, m/s Plancks konstant h 6, J s Tyngdeaccelerationen (i DK) g 9,82 m/s 2 Elementarladningen e 1, C Gaskonstanten R 0,0831 L atm mol K Omregninger mellem forskellige enheder: Den atomare masseenhed, unit: 1 u = 1, g = 1, kg Kilowatt-timer (energi): Elektronvolt (energi): 1 kwh = 3, J = 3,6 MJ 1 ev = 1, J Kalorie (energi): Hestekraft (effekt): 1 kalorie = 4,1855 J 1 hk = 735,5 W Bar (tryk): 1 bar = 10 5 Pa Atmosfære (tryk): 1 atm = 760 mmhg = 101,325 kpa Kvalitetsfaktor, Q, for de forskellige strålingstyper: Strålingstype Q β-stråling, γ-stråling og røntgenstråling 1 neutroner, protoner 10 tunge partikler med én ladning 15 α-partikler og tunge partikler med mere end én ladning 20
DET PERIODISKE SYSTEM
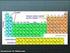 DET PERIODISKE SYSTEM Tilpasset efter Chemistry It s Elemental! Præsentation fra the American Chemical Society, Aug. 2009 http://portal.acs.org/portal/publicwebsite/education/outreach/ncw/studentseducators/cnbp_023211
DET PERIODISKE SYSTEM Tilpasset efter Chemistry It s Elemental! Præsentation fra the American Chemical Society, Aug. 2009 http://portal.acs.org/portal/publicwebsite/education/outreach/ncw/studentseducators/cnbp_023211
m: masse i masseprocent : indhold i volumenprocent : indhold
 Kemisk formelsamling (C-niveau s kernestof samt en del formler, der hører hjemme på Kemi B ) Mængdeberegninger m: masse M: molar masse n : stofmængde : volumen ρ : densitet (massetæthed) c : koncentration
Kemisk formelsamling (C-niveau s kernestof samt en del formler, der hører hjemme på Kemi B ) Mængdeberegninger m: masse M: molar masse n : stofmængde : volumen ρ : densitet (massetæthed) c : koncentration
maj 2017 Kemi C 326
 Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler
 Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
10. juni 2016 Kemi C 325
 Grundstoffer og Det Periodiske System Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Forklar hvad der forstås med begrebet grundstoffer kontra kemiske forbindelser. Atomer er placeret
Grundstoffer og Det Periodiske System Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Forklar hvad der forstås med begrebet grundstoffer kontra kemiske forbindelser. Atomer er placeret
Torben Rosenørn. Aalborg Universitet. Campus Esbjerg
 Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation
 Overskrifter til kemispørgsmål, Kemi C 2012 1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation 2. Grundstoffer i mennesket
Overskrifter til kemispørgsmål, Kemi C 2012 1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation 2. Grundstoffer i mennesket
Skriftlig prøve i kursus 26173/F14 Side 1 af 15 UORGANISK KEMI Torsdag den 22. maj 2014
 Skriftlig prøve i kursus 26173/F14 Side 1 af 15 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for He, Se, Cr 3+ og F. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Skriftlig prøve i kursus 26173/F14 Side 1 af 15 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for He, Se, Cr 3+ og F. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
IONER OG SALTE. Et stabilt elektronsystem kan natrium- og chlor-atomerne også få, hvis de reagerer kemisk med hinanden:
 IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse 1 Stoffers blandbarhed og det periodiske system 2 Stoffers blandbarhed og elektronparbindingen 3 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse 1 Stoffers blandbarhed og det periodiske system 2 Stoffers blandbarhed og elektronparbindingen 3 Redoxreaktioner, spændingsrækken
Densitet (også kendt som massefylde og vægtfylde) hvor
 Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Folkeskolens afgangsprøve Maj-juni 2006 Fysik / kemi - Facitliste
 Folkeskolens afgangsprøve Maj-juni 2006 1/25 Fk5 Opgave 1 / 20 (Opgaven tæller 5 %) I den atommodel, vi anvender i skolen, er et atom normalt opbygget af 3 forskellige partikler: elektroner, neutroner
Folkeskolens afgangsprøve Maj-juni 2006 1/25 Fk5 Opgave 1 / 20 (Opgaven tæller 5 %) I den atommodel, vi anvender i skolen, er et atom normalt opbygget af 3 forskellige partikler: elektroner, neutroner
Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron. En hydron er en H +
 Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron En hydron er en H + Ved en syrebasereaktion overføres der en hydron fra en syre til en base En syre indeholder
Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron En hydron er en H + Ved en syrebasereaktion overføres der en hydron fra en syre til en base En syre indeholder
Skriftlig prøve i kursus 26173/E15 Side 1 af 14 UORGANISK KEMI Fredag den 18. december 2015
 Skriftlig prøve i kursus 26173/E15 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for C, P, Zn 2+ og I. 2% 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Skriftlig prøve i kursus 26173/E15 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for C, P, Zn 2+ og I. 2% 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Opgaver til: 6. Syrer og baser
 Opgaver til: 6. Syrer og baser 1. Færdiggør følgende syre-basereaktioner: a) HNO 3 + H 2 O b) H 2 SO 4 + H 2 O c) HNO 3 + NH 3 d) SO 2-3 + H 2O e) PO 3-4 + H 2O f) H 3 PO 4 + H 2 O g) O 2- + H 2 O h) CO
Opgaver til: 6. Syrer og baser 1. Færdiggør følgende syre-basereaktioner: a) HNO 3 + H 2 O b) H 2 SO 4 + H 2 O c) HNO 3 + NH 3 d) SO 2-3 + H 2O e) PO 3-4 + H 2O f) H 3 PO 4 + H 2 O g) O 2- + H 2 O h) CO
Grundstoffer og det periodiske system
 Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Atomer er betegnelsen for de kemisk mindste dele af grundstofferne.
 Atomets opbygning Atomer er betegnelsen for de kemisk mindste dele af grundstofferne. Guldatomet (kemiske betegnelse: Au) er f.eks. det mindst stykke metal, der stadig bærer navnet guld, det kan ikke yderlige
Atomets opbygning Atomer er betegnelsen for de kemisk mindste dele af grundstofferne. Guldatomet (kemiske betegnelse: Au) er f.eks. det mindst stykke metal, der stadig bærer navnet guld, det kan ikke yderlige
Eksamensspørgsmål Kemi C, 2015, Kec124 (NB).
 Eksamensspørgsmål Kemi C, 2015, Kec124 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2015, Kec124 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, spændingsrækken
Mundtlige eksamensopgaver
 Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas
 Eksamensspørgsmål revideret 7/6 NW 1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas Bilag: Det periodisk system. Du skal fortælle om atomets opbygning, om isotoper og naturligvis om begrebet
Eksamensspørgsmål revideret 7/6 NW 1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas Bilag: Det periodisk system. Du skal fortælle om atomets opbygning, om isotoper og naturligvis om begrebet
Opgave. Navn Kemi opgaver Klasse Side 1 af 7. Hvad kaldes elementarpartiklerne, angiv deres ladning
 Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Opgaver til: 5. Mængdeberegninger
 Opgaver til: 5. Mængdeberegninger 1. Beregn molarmassen for følgende forbindelser: a) SO 3 b) N 2 O 3 c) Na 2 CO 3 d) Fe 3 (PO 4 ) 2 e) Cl 2 O 7 f) (N 4 ) 2 CO 3 g) C 3 C 2 O 2. Beregn stofmængden, n,
Opgaver til: 5. Mængdeberegninger 1. Beregn molarmassen for følgende forbindelser: a) SO 3 b) N 2 O 3 c) Na 2 CO 3 d) Fe 3 (PO 4 ) 2 e) Cl 2 O 7 f) (N 4 ) 2 CO 3 g) C 3 C 2 O 2. Beregn stofmængden, n,
Navn Kemi opgaver Klasse 9. b Side 1 af 9. Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen sammen?
 Klasse 9. b Side 1 af 9 Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Klasse 9. b Side 1 af 9 Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Med forbehold for censors kommentarer. Eksamensspørgsmål Kemi C, 2014, Kec223 (NB).
 Med forbehold for censors kommentarer Eksamensspørgsmål Kemi C, 2014, Kec223 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer
Med forbehold for censors kommentarer Eksamensspørgsmål Kemi C, 2014, Kec223 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer
Oversigt med forklaring over forskellige begreber
 Oversigt med forklaring over forskellige begreber fra www.michaelfynsk.dk Til dette dokument tilhører en mappe med filer bl.a..exe-,.pdf- og.jpg-filer. Side 1 af 19 Indholdsfortegnelse Brintbinding (hydrogenbinding)
Oversigt med forklaring over forskellige begreber fra www.michaelfynsk.dk Til dette dokument tilhører en mappe med filer bl.a..exe-,.pdf- og.jpg-filer. Side 1 af 19 Indholdsfortegnelse Brintbinding (hydrogenbinding)
Eksamensspørgsmål 2c ke, juni Fag: Kemi C-niveau. Censor: Andreas Andersen, Skanderborg Gymnasium
 Eksamensspørgsmål 2c ke, juni 2016 Fag: Kemi C-niveau Censor: Andreas Andersen, Skanderborg Gymnasium Eksaminator: Jeanette Olofsson, Ikast-Brande Gymnasium 1. Bindingstyper og tilstandsformer under inddragelse
Eksamensspørgsmål 2c ke, juni 2016 Fag: Kemi C-niveau Censor: Andreas Andersen, Skanderborg Gymnasium Eksaminator: Jeanette Olofsson, Ikast-Brande Gymnasium 1. Bindingstyper og tilstandsformer under inddragelse
Skriftlig prøve i kursus 26173/E14 Side 1 af 14 UORGANISK KEMI Fredag den 19. december 2014
 Skriftlig prøve i kursus 26173/E14 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for O, Al, Fe 3+ og Br. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Skriftlig prøve i kursus 26173/E14 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for O, Al, Fe 3+ og Br. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold
 Københavns Universitet Saxkøbing, Vintermøde Roedyrkning: Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold Søren Husted, 5 Februar, 2019 Agenda: 9:35 10:15 De essentielle næringsstoffer og roedyrkning
Københavns Universitet Saxkøbing, Vintermøde Roedyrkning: Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold Søren Husted, 5 Februar, 2019 Agenda: 9:35 10:15 De essentielle næringsstoffer og roedyrkning
MODUL 1-2: ELEKTROMAGNETISK STRÅLING
 MODUL 1-2: ELEKTROMAGNETISK STRÅLING MODUL 1 - ELEKTROMAGNETISKE BØLGER I 1. modul skal I lære noget omkring elektromagnetisk stråling (EM- stråling). I skal lære noget om synligt lys, IR- stråling, UV-
MODUL 1-2: ELEKTROMAGNETISK STRÅLING MODUL 1 - ELEKTROMAGNETISKE BØLGER I 1. modul skal I lære noget omkring elektromagnetisk stråling (EM- stråling). I skal lære noget om synligt lys, IR- stråling, UV-
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017
 EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
Test din viden A-forløb
 Test din viden A-forløb Har du styr på A-forløbets kernestof? Nu har du lært en masse om ionforbindelser, molekylforbindelser og mængdeberegninger. Ved at lave opgaverne nedenfor finder du ud af, om der
Test din viden A-forløb Har du styr på A-forløbets kernestof? Nu har du lært en masse om ionforbindelser, molekylforbindelser og mængdeberegninger. Ved at lave opgaverne nedenfor finder du ud af, om der
Skriftlig prøve i kursus 26173/E12 Side 1 af 14 UORGANISK KEMI Tirsdag den 18. december 2012
 Skriftlig prøve i kursus 26173/E12 Side 1 af 14 Opgave 1. 1.1 Angiv elektronkonfigurationer for N, Al 3+, Mn og Zn 2+. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for Ne 2. 4 % b) Angiv
Skriftlig prøve i kursus 26173/E12 Side 1 af 14 Opgave 1. 1.1 Angiv elektronkonfigurationer for N, Al 3+, Mn og Zn 2+. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for Ne 2. 4 % b) Angiv
Eksamensopgaverne offentliggøres selvfølgelig med det forbehold, at censor kan komme med ændringsforslag.
 VUC Århus, 17. maj. 2011 Kære alle kursister på holdene ke02da1c (kemi C flex, helårsholdet) og ke05da1c (kemi C flex, halvårsholdet) På de næste mange sider vil I kunne se Jeres kommende eksamensopgaver
VUC Århus, 17. maj. 2011 Kære alle kursister på holdene ke02da1c (kemi C flex, helårsholdet) og ke05da1c (kemi C flex, halvårsholdet) På de næste mange sider vil I kunne se Jeres kommende eksamensopgaver
Opgaver til: 9. Radioaktivitet
 Opgaver til: 9. Radioaktivitet 1. Opskriv henfaldskemaet for α-henfaldet af: 229 90 Th 92 U 86 Rn 2. Opskriv henfaldskemaet for β - -henfaldet af: 209 82 Pb 10 4 Be 79 Au 3. Opskriv henfaldskemaet for
Opgaver til: 9. Radioaktivitet 1. Opskriv henfaldskemaet for α-henfaldet af: 229 90 Th 92 U 86 Rn 2. Opskriv henfaldskemaet for β - -henfaldet af: 209 82 Pb 10 4 Be 79 Au 3. Opskriv henfaldskemaet for
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug-dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi C Mohammed
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug-dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi C Mohammed
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Eksamensspørgsmål til kecu eksamen tirsdag d. 3. juni og onsdag d. 4. juni 2014
 Eksamensspørgsmål til kecu eksamen tirsdag d. 3. juni og onsdag d. 4. juni 2014 Spørgsmål 1. og 15. Ionforbindelser og fældningsreaktioner, herunder øvelsen Saltes opløselighed i vand 2. og 16. Det periodiske
Eksamensspørgsmål til kecu eksamen tirsdag d. 3. juni og onsdag d. 4. juni 2014 Spørgsmål 1. og 15. Ionforbindelser og fældningsreaktioner, herunder øvelsen Saltes opløselighed i vand 2. og 16. Det periodiske
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse:
 Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
Atomets bestanddele. Indledning. Atomer. Atomets bestanddele
 Atomets bestanddele Indledning Mennesket har i tusinder af år interesseret sig for, hvordan forskellige stoffer er sammensat I oldtiden mente man, at alle stoffer kunne deles i blot fire elementer eller
Atomets bestanddele Indledning Mennesket har i tusinder af år interesseret sig for, hvordan forskellige stoffer er sammensat I oldtiden mente man, at alle stoffer kunne deles i blot fire elementer eller
Platin komplekser i kampen mod kræft. Koordinationskemi i aktion. cis-ptcl 2 (NH 3 ) 2. Essentiel, nyttig eller toxisk. Hvad der faktisk skete
 Platin komplekser i kampen mod kræft et eksempel på Koordinationskemi i aktion Pt DNA DK 1 Har som den eneste vundet Tour de France syv gange (fra 1999 til 2005) Lance Armstrong blev vist født på en cykel
Platin komplekser i kampen mod kræft et eksempel på Koordinationskemi i aktion Pt DNA DK 1 Har som den eneste vundet Tour de France syv gange (fra 1999 til 2005) Lance Armstrong blev vist født på en cykel
Helge Mygind Ole Vesterlund Niel sen Vibeke A xelsen. Notatark
 BASISKEMI C Helge Mygind Ole Vesterlund Niel sen Vibeke A xelsen Notatark HAAse & Søns forlag Helge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C. Notatark forfatterne og Haase & Søns Forlag
BASISKEMI C Helge Mygind Ole Vesterlund Niel sen Vibeke A xelsen Notatark HAAse & Søns forlag Helge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C. Notatark forfatterne og Haase & Søns Forlag
Spørgsmål 1 Den kemiske reaktion
 Spørgsmål 1 Den kemiske reaktion Du skal gennemgå eksperimentet Fyrfadslys inddrag gerne dine forsøgsresultater og vurder om de understøtter modellen reaktionskemaet. Du skal endvidere give eksempler på
Spørgsmål 1 Den kemiske reaktion Du skal gennemgå eksperimentet Fyrfadslys inddrag gerne dine forsøgsresultater og vurder om de understøtter modellen reaktionskemaet. Du skal endvidere give eksempler på
Eksamensopgaver. NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL
 Eksamensopgaver NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL Liste over eksamensøvelser 1. Opløsningsmidlers egenskaber 2. Fældningsreaktioner 3. Påvisning af proteiner 4. Fremstilling af
Eksamensopgaver NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL Liste over eksamensøvelser 1. Opløsningsmidlers egenskaber 2. Fældningsreaktioner 3. Påvisning af proteiner 4. Fremstilling af
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Diana Christensen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Diana Christensen
1 Ioner og ionforbindelser
 1 Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes, så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
1 Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes, så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør. Spørgsmål 1. Grundstoffer og det periodiske system
 EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør Øvelse: Opløsningsmidlers egenskaber Spørgsmål 1 Grundstoffer og det periodiske system Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne
EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør Øvelse: Opløsningsmidlers egenskaber Spørgsmål 1 Grundstoffer og det periodiske system Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne
1 Atomets opbygning. Du skal fortælle om det periodiske system og atomets opbygning. Inddrag eksperimentet Reaktionen mellem kobber og dibrom.
 1 Atomets opbygning Du skal fortælle om det periodiske system og atomets opbygning. Inddrag eksperimentet Reaktionen mellem kobber og dibrom. Kernepartikler og elektronstruktur Periodisk system - hovedgrupper
1 Atomets opbygning Du skal fortælle om det periodiske system og atomets opbygning. Inddrag eksperimentet Reaktionen mellem kobber og dibrom. Kernepartikler og elektronstruktur Periodisk system - hovedgrupper
NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10
 NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10 Elevens navn: CPR-nr.: Skole: Klasse: Tilsynsførendes navn: 1 Tilstandsformer Tilstandsformer Opgave 1.1 Alle stoffer har 3 tilstandsformer.
NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10 Elevens navn: CPR-nr.: Skole: Klasse: Tilsynsførendes navn: 1 Tilstandsformer Tilstandsformer Opgave 1.1 Alle stoffer har 3 tilstandsformer.
Test din viden E-forløb
 OPGAVE E8 Test din viden E-forløb Har du styr på E-forløbets kernestof? Nu har du lært en masse om spændingsrækken og redoxreaktioner. Ved at lave opgaverne nedenfor finder du ud af, om der er nogle områder,
OPGAVE E8 Test din viden E-forløb Har du styr på E-forløbets kernestof? Nu har du lært en masse om spændingsrækken og redoxreaktioner. Ved at lave opgaverne nedenfor finder du ud af, om der er nogle områder,
1. Kovalent binding herunder eksperimentet Undersøgelse af stoffers opløselighed.
 Indhold 1. Kovalent binding herunder eksperimentet Undersøgelse af stoffers opløselighed.... 2 2. Fældningsreaktioner herunder eksperimentet Saltes opløselighed i vand.... 3 3. Stofmængdekoncentration
Indhold 1. Kovalent binding herunder eksperimentet Undersøgelse af stoffers opløselighed.... 2 2. Fældningsreaktioner herunder eksperimentet Saltes opløselighed i vand.... 3 3. Stofmængdekoncentration
Atomets opbygning. Keminote 2010
 Atomets opbygning Oprindelig forestillede man sig, at atomet var en lille kugle, som ikke kunne deles i mindre dele. Ordet atom kommer af det græske ord atomos, som betyder udelelig. Fra slutningen af
Atomets opbygning Oprindelig forestillede man sig, at atomet var en lille kugle, som ikke kunne deles i mindre dele. Ordet atom kommer af det græske ord atomos, som betyder udelelig. Fra slutningen af
Eksamensspørgsmål. Spørgsmål : Atomer og bindinger (Hvilken type stof?) Spørgsmål : Ionforbindelser (Saltes opløselighed i vand
 Eksamensspørgsmål KemiC (17KeC80) Med forbehold for censors godkendelse Oversigt Spørgsmål 1 + 14: Atomer og bindinger (Hvilken type stof?) Spørgsmål 2 + 15: Ionforbindelser (Saltes opløselighed i vand
Eksamensspørgsmål KemiC (17KeC80) Med forbehold for censors godkendelse Oversigt Spørgsmål 1 + 14: Atomer og bindinger (Hvilken type stof?) Spørgsmål 2 + 15: Ionforbindelser (Saltes opløselighed i vand
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
reduktion oxidation Reduktion optagelse af elektroner Oxidation afgivelse af elektroner
 8. Redoxreaktioner reduktion oxidation Reduktion optagelse af elektroner Oxidation afgivelse af elektroner (Hel eller delvis) Der er grundlæggende 4 væsentlige kemiske reaktioner: 1. Udfældning af tungtopløselige
8. Redoxreaktioner reduktion oxidation Reduktion optagelse af elektroner Oxidation afgivelse af elektroner (Hel eller delvis) Der er grundlæggende 4 væsentlige kemiske reaktioner: 1. Udfældning af tungtopløselige
Syrer, baser og salte:
 Syrer, baser og salte: Salte: Salte er en stor gruppe af kemiske stoffer med en række fælles egenskaber I tør, fast form er de krystaller. Opløst i vand danner de frie ioner som giver vandet elektrisk
Syrer, baser og salte: Salte: Salte er en stor gruppe af kemiske stoffer med en række fælles egenskaber I tør, fast form er de krystaller. Opløst i vand danner de frie ioner som giver vandet elektrisk
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2018 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2018 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Forelæsning 8. Stabile isotoper. Iltisotoper anvendt i paleoklimastudier, magmadannelse, termometri, vand-bjergart reaktion.
 Forelæsning: Hvad er stabile isotoper? Forelæsning 8 Stabile isotoper Fraktionering af stabile isotoper Iltisotoper Termometri Vand-bjergart reaktion Øvelse: Iltisotoper anvendt i paleoklimastudier, magmadannelse,
Forelæsning: Hvad er stabile isotoper? Forelæsning 8 Stabile isotoper Fraktionering af stabile isotoper Iltisotoper Termometri Vand-bjergart reaktion Øvelse: Iltisotoper anvendt i paleoklimastudier, magmadannelse,
Mol og molarmasse. Mol. Molarmassen. Molarmassen for atomer
 Mol og molarmasse Mol 1 u = 1,66. 10-24 g og dermed også 1 g = 6,02. 10 23 u. Da massen af én nukleon er meget tæt på 1 u er der 6,02. 10 23 nukleoner i en stofmængde på 1 g. Dette tal kaldes 1 mol 1 mol
Mol og molarmasse Mol 1 u = 1,66. 10-24 g og dermed også 1 g = 6,02. 10 23 u. Da massen af én nukleon er meget tæt på 1 u er der 6,02. 10 23 nukleoner i en stofmængde på 1 g. Dette tal kaldes 1 mol 1 mol
OPGAVER OM DANNELSE AF IONER. OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal.
 OPGAVE 3.1 OPGAVER OM DANNELSE AF IONER OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal. b. Angiv derefter hvor mange elektroner atomet skal optage
OPGAVE 3.1 OPGAVER OM DANNELSE AF IONER OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal. b. Angiv derefter hvor mange elektroner atomet skal optage
Salte, Syre og Baser
 Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
Læringsmål i fysik - 9. Klasse
 Læringsmål i fysik - 9. Klasse Salte, syrer og baser Jeg ved salt er et stof der er opbygget af ioner. Jeg ved at Ioner i salt sidder i et fast mønster, et iongitter Jeg kan vise og forklare at salt, der
Læringsmål i fysik - 9. Klasse Salte, syrer og baser Jeg ved salt er et stof der er opbygget af ioner. Jeg ved at Ioner i salt sidder i et fast mønster, et iongitter Jeg kan vise og forklare at salt, der
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Løsningsforslag til fysik A eksamenssæt, 23. maj 2008
 Løsningsforslag til fysik A eksamenssæt, 23. maj 2008 Kristian Jerslev 22. marts 2009 Geotermisk anlæg Det geotermiske anlæg Nesjavellir leverer varme til forbrugerne med effekten 300MW og elektrisk energi
Løsningsforslag til fysik A eksamenssæt, 23. maj 2008 Kristian Jerslev 22. marts 2009 Geotermisk anlæg Det geotermiske anlæg Nesjavellir leverer varme til forbrugerne med effekten 300MW og elektrisk energi
Du skal også komme ind på øvelsen Saltes opløselighed i vand.
 1. Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
1. Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 10/11 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Flemming Madsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 10/11 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Flemming Madsen
Sporgrundstof definition:
 Forelæsning Sporgrundstoffer: fordeling, substitution og klassifikation Forelæsning: Hvad er et sporgrundstof? Grundstoffers elektronkonfiguration og radius Det Periodiske System Goldschmidts regler for
Forelæsning Sporgrundstoffer: fordeling, substitution og klassifikation Forelæsning: Hvad er et sporgrundstof? Grundstoffers elektronkonfiguration og radius Det Periodiske System Goldschmidts regler for
Formelsamling til Fysik B
 Formelsamling til Fysik B Af Dann Olesen og Søren Andersen Hastighed(velocity) Densitet Tryk Arbejde Definitioner og lignende Hastighed, [ ] Strækning, [ ] Volumen(rumfang), [ ] Tryk, [ ] : Pascal Kraft,
Formelsamling til Fysik B Af Dann Olesen og Søren Andersen Hastighed(velocity) Densitet Tryk Arbejde Definitioner og lignende Hastighed, [ ] Strækning, [ ] Volumen(rumfang), [ ] Tryk, [ ] : Pascal Kraft,
Naturfag for skov- og gartnerholdet
 Naturfag for skov- og gartnerholdet Grundlæggende kemi -Gennemgang af forskellige stoffers egenskaber og anvendelighed indenfor gartneri, anlægsgartneri og skovbrug 1 www.ucholstebro.dk. Døesvej 70 76.
Naturfag for skov- og gartnerholdet Grundlæggende kemi -Gennemgang af forskellige stoffers egenskaber og anvendelighed indenfor gartneri, anlægsgartneri og skovbrug 1 www.ucholstebro.dk. Døesvej 70 76.
Spørgsmål 1 Den kemiske reaktion
 Spørgsmål 1 Den kemiske reaktion Med udgangspunkt i eksperimentet Fyrfadslys ønskes der en gennemgang af modellen reaktionskemaet. Du skal endvidere inddrage forskellige typer af kemiske reaktioner i din
Spørgsmål 1 Den kemiske reaktion Med udgangspunkt i eksperimentet Fyrfadslys ønskes der en gennemgang af modellen reaktionskemaet. Du skal endvidere inddrage forskellige typer af kemiske reaktioner i din
Eksamensspørgsma l kemi C, 2015, kec324 (CHT)
 Oversigt Sp. 1 og 2 Ioner og Ionforbindelser Sp. 3, 4 og 5 Molekylforbindelser Sp. 6 Kemisk mængdeberegning Sp. 7 Koncentration i en opløsning Sp. 8 og 9 Organisk kemi Sp. 10 og 11 Syrer og baser Sp. 12
Oversigt Sp. 1 og 2 Ioner og Ionforbindelser Sp. 3, 4 og 5 Molekylforbindelser Sp. 6 Kemisk mængdeberegning Sp. 7 Koncentration i en opløsning Sp. 8 og 9 Organisk kemi Sp. 10 og 11 Syrer og baser Sp. 12
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Thy-Mors HF & VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi-C Gunnsteinn Agnar
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Thy-Mors HF & VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi-C Gunnsteinn Agnar
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug 2014- dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold Flex-kemi C Kemi C Mohammed
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug 2014- dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold Flex-kemi C Kemi C Mohammed
Exoterme og endoterme reaktioner (termometri)
 AKTIVITET 10 (FAG: KEMI) NB! Det er i denne øvelse ikke nødvendigt at udføre alle forsøgene. Vælg selv hvilke du/i vil udføre er du i tvivl så spørg. Hvis du er interesseret i at måle varmen i et af de
AKTIVITET 10 (FAG: KEMI) NB! Det er i denne øvelse ikke nødvendigt at udføre alle forsøgene. Vælg selv hvilke du/i vil udføre er du i tvivl så spørg. Hvis du er interesseret i at måle varmen i et af de
Eksaminationsgrundlag for selvstuderende
 Eksaminationsgrundlag for selvstuderende Skolens eksaminationsgrundlag: Jeg ønsker at gå til eksamen i nedennævnte eksaminationsgrundlag (pensum), som skolen har lavet. Du skal ikke foretage dig yderligere
Eksaminationsgrundlag for selvstuderende Skolens eksaminationsgrundlag: Jeg ønsker at gå til eksamen i nedennævnte eksaminationsgrundlag (pensum), som skolen har lavet. Du skal ikke foretage dig yderligere
Eksamensspørgsmål 2z ke (ikke godkendte) Fag: Kemi C Dato: 7. juni 2013 Lærer: Peter R Nielsen (PN) Censor: Tanja Krüger, VUC Aarhus
 1. Kemisk Binding Gør rede for øvelsen Kovalent- eller Ionbinding? Beskriv ionbinding og kovalent binding og forklar hvordan forskellene på de to typer af kemisk binding udnyttes i for66søget. Stikord
1. Kemisk Binding Gør rede for øvelsen Kovalent- eller Ionbinding? Beskriv ionbinding og kovalent binding og forklar hvordan forskellene på de to typer af kemisk binding udnyttes i for66søget. Stikord
Spørgsmål 1. Øvelse: Kobber plus dibrom. Teori: Atomers opbygning.
 Spørgsmål 1. Øvelse: Kobber plus dibrom. Atomers opbygning. Atomets struktur. Det periodiske system. Betydning af hovedgrupperne. Ædelgassernes elektronstruktur i den yderste skal. Dannelse af ioner og
Spørgsmål 1. Øvelse: Kobber plus dibrom. Atomers opbygning. Atomets struktur. Det periodiske system. Betydning af hovedgrupperne. Ædelgassernes elektronstruktur i den yderste skal. Dannelse af ioner og
Dansk Fysikolympiade 2007 Landsprøve. Prøven afholdes en af dagene tirsdag den 9. fredag den 12. januar. Prøvetid: 3 timer
 Dansk Fysikolympiade 2007 Landsprøve Prøven afholdes en af dagene tirsdag den 9. fredag den 12. januar Prøvetid: 3 timer Opgavesættet består af 6 opgaver med tilsammen 17 spørgsmål. Svarene på de stillede
Dansk Fysikolympiade 2007 Landsprøve Prøven afholdes en af dagene tirsdag den 9. fredag den 12. januar Prøvetid: 3 timer Opgavesættet består af 6 opgaver med tilsammen 17 spørgsmål. Svarene på de stillede
Marie og Pierre Curie
 N Kernefysik 1. Radioaktivitet Marie og Pierre Curie Atomer består af en kerne med en elektronsky udenom. Kernen er ganske lille i forhold til elektronskyen. Kernens størrelse i sammenligning med hele
N Kernefysik 1. Radioaktivitet Marie og Pierre Curie Atomer består af en kerne med en elektronsky udenom. Kernen er ganske lille i forhold til elektronskyen. Kernens størrelse i sammenligning med hele
Eksamensspørgsmål Kemi C, 2016, Kec225 (KSD).
 Eksamensspørgsmål Kemi C, 2016, Kec225 (KSD). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, ph 5 Redoxreaktioner,
Eksamensspørgsmål Kemi C, 2016, Kec225 (KSD). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, ph 5 Redoxreaktioner,
Eksamen i fysik 2016
 Eksamen i fysik 2016 NB: Jeg gør brug af DATABOG fysik kemi, 11. udgave, 4. oplag & Fysik i overblik, 1. oplag. Opgave 1 Proptrækker Vi kender vinens volumen og masse. Enheden liter omregnes til kubikmeter.
Eksamen i fysik 2016 NB: Jeg gør brug af DATABOG fysik kemi, 11. udgave, 4. oplag & Fysik i overblik, 1. oplag. Opgave 1 Proptrækker Vi kender vinens volumen og masse. Enheden liter omregnes til kubikmeter.
Spørgsmål 1 Carbonhydrider
 Nedenstående spørgsmål er med forbehold for censors godkendelse Spørgsmål 1 Carbonhydrider Der ønskes en gennemgang af udvalgte carbonhydriders opbygning og kemiske egenskaber. Du skal inddrage øvelsen:
Nedenstående spørgsmål er med forbehold for censors godkendelse Spørgsmål 1 Carbonhydrider Der ønskes en gennemgang af udvalgte carbonhydriders opbygning og kemiske egenskaber. Du skal inddrage øvelsen:
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2019 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2019 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2019, eksamen maj/juni 2019 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2019, eksamen maj/juni 2019 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Flammefarver Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen af et atom
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Flammefarver Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen af et atom
Opgaver i atomer. c) Aflæs atommassen for Mg i det periodiske system eller på de udskrevne ark, og skriv det ned.
 Opgaver i atomer Opgave 1 Tegn atomerne af nedenstående grundstoffer på samme måde, som det er vist for andre atomer i timen. Angiv protoner med plusser. Vedrørende elektroner: Husk, at der maksimalt kan
Opgaver i atomer Opgave 1 Tegn atomerne af nedenstående grundstoffer på samme måde, som det er vist for andre atomer i timen. Angiv protoner med plusser. Vedrørende elektroner: Husk, at der maksimalt kan
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Til at beregne varmelegemets resistans. Kan ohms lov bruges. Hvor R er modstanden/resistansen, U er spændingsfaldet og I er strømstyrken.
 I alle opgaver er der afrundet til det antal betydende cifre, som oplysningen med mindst mulige cifre i opgaven har. Opgave 1 Færdig Spændingsfaldet over varmelegemet er 3.2 V, og varmelegemet omsætter
I alle opgaver er der afrundet til det antal betydende cifre, som oplysningen med mindst mulige cifre i opgaven har. Opgave 1 Færdig Spændingsfaldet over varmelegemet er 3.2 V, og varmelegemet omsætter
Kernefysik og dannelse af grundstoffer. Fysik A - Note. Kerneprocesser. Gunnar Gunnarsson, april 2012 Side 1 af 14
 Kerneprocesser Side 1 af 14 1. Kerneprocesser Radioaktivitet Fission Kerneproces Fusion Kollisioner Radioaktivitet: Spontant henfald ( af en ustabil kerne. Fission: Sønderdeling af en meget tung kerne.
Kerneprocesser Side 1 af 14 1. Kerneprocesser Radioaktivitet Fission Kerneproces Fusion Kollisioner Radioaktivitet: Spontant henfald ( af en ustabil kerne. Fission: Sønderdeling af en meget tung kerne.
Partikler med fart på Ny Prisma Fysik og kemi 9 Skole: Navn: Klasse:
 Partikler med fart på Ny Prisma Fysik og kemi 9 Skole: Navn: Klasse: Opgave 1 Et atom har oftest to slags partikler i atomkernen. Hvad hedder partiklerne? Der er 6 linjer. Sæt et kryds ud for hver linje.
Partikler med fart på Ny Prisma Fysik og kemi 9 Skole: Navn: Klasse: Opgave 1 Et atom har oftest to slags partikler i atomkernen. Hvad hedder partiklerne? Der er 6 linjer. Sæt et kryds ud for hver linje.
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin januar 2017 Institution HF & VUC København Syd Uddannelse Fag og niveau Lærer(e) Hold e-learningskemi C Kemi
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin januar 2017 Institution HF & VUC København Syd Uddannelse Fag og niveau Lærer(e) Hold e-learningskemi C Kemi
4 Formelsamling i KEMI FORLAGET
 4 Formelsamling i KEMI FORLAGET Indhold Forord... 5 Elektromagnetisk stråling... 7 Kemiske maengdeberegninger... 9 Termodynamik... 13 Kemisk ligevægt... 19 Syrer og baser... 22 Reaktionskinetik... 27 Elektrokemi...
4 Formelsamling i KEMI FORLAGET Indhold Forord... 5 Elektromagnetisk stråling... 7 Kemiske maengdeberegninger... 9 Termodynamik... 13 Kemisk ligevægt... 19 Syrer og baser... 22 Reaktionskinetik... 27 Elektrokemi...
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2019 Institution Den Jydske Haandværkerskole Uddannelse Fag og niveau Lærer(e) Hold EUX Kemi C Katya
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2019 Institution Den Jydske Haandværkerskole Uddannelse Fag og niveau Lærer(e) Hold EUX Kemi C Katya
Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på:
 1. Molekyler Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på: Elektronparbinding (= kovalent binding) Oktetreglen/ædelgasreglen Polaritet Hydrofile og hydrofobe grupper Navngivning af
1. Molekyler Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på: Elektronparbinding (= kovalent binding) Oktetreglen/ædelgasreglen Polaritet Hydrofile og hydrofobe grupper Navngivning af
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Vinter 2016 Institution VUC Lyngby Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C COL 16kemc21 Oversigt
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Vinter 2016 Institution VUC Lyngby Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C COL 16kemc21 Oversigt
Eksamensspørgsmål. 1.p
 0 1.p - 2018 Kemi Eksamensspørgsmål Oversigt 1. Ioner og ionforbindelser (Fældningsreaktioner Udvaskning af næringsstoffer) 2. Molekyler (Stoffers blandbarhed) 3. Opløselighed (Stoffers blandbarhed) 4.
0 1.p - 2018 Kemi Eksamensspørgsmål Oversigt 1. Ioner og ionforbindelser (Fældningsreaktioner Udvaskning af næringsstoffer) 2. Molekyler (Stoffers blandbarhed) 3. Opløselighed (Stoffers blandbarhed) 4.
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2016 Institution Thy Mors HF & VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi-C Gunnsteinn Agnar
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2016 Institution Thy Mors HF & VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi-C Gunnsteinn Agnar
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2019 Institution Den Jydske Haandværkerskole Uddannelse Fag og niveau Lærer(e) Hold EUX Kemi C Katya
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2019 Institution Den Jydske Haandværkerskole Uddannelse Fag og niveau Lærer(e) Hold EUX Kemi C Katya
