Naturfag - naturligvis. 2. Kemi
|
|
|
- Else Clausen
- 8 år siden
- Visninger:
Transkript
1 Naturfag - naturligvis af Kenneth ansen 2. Kemi C C O C C O C C C C C O O Acetylsalicylsyre (bedre kendt som aspirin)
2 2. Kemi Indhold 1. Grundstoffer og kemiske forbindelser 2 2. Atomets opbygning 5 3. Det periodiske system 7 4. Oktetreglen Covalente forbindelser Ionforbindelser Reaktionsskemaer Fældningsreaktioner Stofmængde og molmasse Kemisk mængdeberegning Opløsningers koncentration Syrer og baser p og syrestyrke Redox-reaktioner 36 Facitliste 38 Øvelsesvejledninger A. Identifikation af negative ioner 40 B. Soda og bagepulver 41 C. Titrering af eddikesyre og ascorbinsyre 43 D. p i vandige opløsninger af salte 44 E. Spændingsrækken 46 Tabeller Grundstoffernes navne 47 Nogle ioner 48 Opløselighed af salte 49 Det periodiske system 50 1
3 1. Grundstoffer og kemiske forbindelser Alt stof er sammensat af molekyler, som igen er sammensat af atomer. vad menes der egentligt med det? Tager man et stykke sukker, så kan man dele det op i to mindre stykker. Begge mindre stykker består stadigvæk af sukker; det kan man konstatere ved f.eks. at smage på det. Denne proces kan man fortsætte og fortsætte og fortsætte - man får til stadighed mindre og mindre stykker sukker. Men processen stopper på et tidspunkt - pludselig står man med et meget, meget lille stykke sukker, som ikke kan opdeles i to mindre stykker sukker - man taler om et molekyle. Man kan ganske vist opdele sukkermolekylet i mindre dele, men disse mindre dele er ikke længere sukker! Faktisk viser det sig, at vi kan opdele sukkermolekylet i 48 mindre dele. Disse dele kaldes atomer, og de kan ikke opdeles yderligere. Undersøger man de 48 atomer nøjere, ser man, at 12 af dem faktisk er kul-atomer, 24 er hydrogen-atomer og 12 oxygen-atomer. Det er lidt underligt, fordi sukker umiddelbart ikke rigtigt har noget at gøre med stofferne kul, hydrogen eller oxygen: Kul er et sort, fast stof, som kan brænde, og hydrogen og oxygen er farveløse gasser. Tager vi nu et andet stof - f.eks. gassen svovlbrinte (der lugter som rådne æg!), og opdeler og opdeler, så ender vi igen med et svovlbrinte-molekyle, som kan opdeles i et svovl-atom og to hydrogen-atomer. Dette kan man gøre med alle mulige stoffer., og det viser sig, de alle er sammensat af atomer. eldigvis findes der kun omkring 100 slags atomer, så i princippet er det til at overskue, hvad der sker. Disse ca. 100 slags atomer er atomer af stoffer, som kaldes grundstoffer. Nogle eksempler er kul, oxygen (ilt), hydrogen (brint), nitrogen (kvælstof), svovl, jern, guld, sølv og kobber. I stedet for at skrive, at sukker indeholder 12 kulatomer, 24 hydrogenatomer og 12 oxygenatomer, har man indført nogle grundstofsymboler. Kul forkortes C, hydrogen og oxygen O, og den kemiske formel for sukker bliver derfor C 1224O12. Tilsvarende forkortes svovl S, så formlen for svovlbrinte (eller hydrogensulfid) bliver 2 S. De forskellige kemiske symboler for de mange grundstoffer findes i det periodiske system sidst i hæftet. Bemærk, at de kemiske symboler består af ét eller to bogstaver. Anvender man to bogstaver, så skal det første bogstav være stort og det sidste lille. Følger man ikke denne regel, så kan man komme ud i problemer. F.eks. er Co symbolet for grundstoffet kobolt, mens CO er symbolet for den kemiske forbindelse kulmonoxid (eller kulilte). 2
4 Somme tider anvender man parenteser i de kemiske formler, f.eks. Ca (NO 3 ) 2. er indeholder et molekyle et Ca-atom, 2 N-atomer og hele 6 O-atomer. Nu lyder over 100 grundstoffer som mange stoffer, man skal holde rede på, men heldigvis skal vi kun beskæftige os med de vigtigste, og dem er der kun ca. 25 af. Der kommer en liste senere i dette kapitel. Man kan opdele grundstofferne på forskellige måde. Den første inddeling er i metaller og i ikke-metaller. Metaller er velkendte fra dagligdagen, f.eks. jern, kobber, sølv, guld, aluminium og platin, samt legeringerne messing og bronze. (En legering er en blanding af et eller flere metaller. Legeringer er altså ikke grundstoffer). Alle metaller har en række fælles egenskaber. De har metalglans, dvs. blanke, spejlende overflader, og de er gode til at lede elektrisk strøm og varme. Mange metaller har et højt smeltepunkt, men der findes undtagelser. Den mest markante undtagelse er kviksølv, som smelter ved -39 C, og som derfor er en væske ved stuetemperatur. De fleste metaller er 'hvide' som jern eller sølv, undtagelser er det røde kobber og det gule guld. Endvidere opfører metallerne sig stort set på samme måde kemisk set. Ikke-metallerne er en meget mere blandet gruppe, men de fælles træk er, at de ikke har metalglans, og de er dårlige til at lede elektrisk strøm og varme. Nogle ikke-metaller er gasser ved stuetemperatur - det gælder nitrogen, oxygen, chlor, flour, helium, neon, argon m.fl. Brom er en brunlig væske, mens svovl og kul er faste stoffer. Endelig findes der nogle grundstoffer - halvmetallerne - der både kan opfattes som metaller og ikke-metaller. ermed menes, at de af udseende ligner metaller, men at de kemisk set kan reagere som ikke-metaller. eldigvis er der ingen af disse halvmetaller blandt de vigtigste grundstoffer. Læg mærke til, at de fleste grundstoffer faktisk er metaller, men at de vigtigste er ikke-metaller. Derfor kan man regne med, at hvis man støder på et grundstof, som man stort set intet ved om, så er det nok et metal. Endvidere er alle grundstoffer, hvis navn ender på -ium, metaller. De eneste undtagelser er helium, som ikke optræder i nogle kemiske forbindelser, og halvmetallet silicium. Mange grundstoffer har både det almindeligt anvendte kemiske navn og et trivialnavn. I tabellen nedenfor over de vigtigste stoffer er begge navne og grundstofsymbolet anført. Man bør undgå at bruge trivialnavne, især de tre 'slemme', ilt, brint og kvælstof. 3
5 De vigtigste grundstoffer symbol kemisk trivialnavn symbol kemisk trivialnavn navn navn hydrogen brint Cl chlor - C kul - K kalium - N nitrogen kvælstof Ca calcium - O oxygen ilt Fe jern - F flour - Cu kobber - Na natrium - Br brom - Mg magnesium - Ag sølv - Al aluminium - I iod - P phosphor - Ba barium - S svovl - Au guld - Opgaver 1.1 vilke af de vigtigste grundstoffer er metaller? 1.2 Følgende grundstoffer er du sikkert stødt på i ren tilstand et eller andet sted. vor, og hvad hedder grundstofferne egentligt? N, O, Ar, C, Al, Fe, Cu, Ag, Au, Pt, Ni, Sn, g 1.3 Angiv antallet af hver slags atom i hvert af følgende molekyler: a) C 3 COO (eddikesyre) b) Na 2CO 3 (soda) c) Na 2SO 4 d) Al 2O3 e) Al 2 (SO 4 ) 3 f) (OOCC 2 ) 2 C(O)(COO) (citronsyre) 4
6 2. Atomets opbygning For at kunne forstå kemi skal man kunne forstå atomets opbygning: Et atom er opbygget af tre forskellige mindre partikler: Protoner, som har en positiv elektrisk ladning, neutroner, som er elektrisk neutrale og elektroner, som er negativt ladede. Protonerne og neutronerne sidder inde i kernen, mens elektronerne svæver rundt om kernen i de såkaldte elektronskyer eller orbitaler. Protonens positive og elektronens negative ladning er lige store, så et atom, som indeholder lige mange protoner og elektroner, er elektrisk neutralt. Protonen og neutronen vejer (næsten) lige meget, nemlig omkring 1, kg, mens elektronen vejer meget mindre, protonens masse. 9, kg. Dette er ca. 1/1820-del af Et atom kan opfattes som en lille kugle med en radius på omkring m. Dette er i virkeligheden elektronskyernes størrelse, for kernen er meget mindre, ca m. Dette er bemærkelsesværdigt: Kernen fylder kun en tusindedel af atomet, men indeholder næsten hele atomets masse. Antallet af protoner i et atom kaldes atomets atomnummer, og man bruger normalt symbolet Z for atomnummeret. Det er atomnummeret, der bestemmer, hvilket slags grundstof atomet er. Antallet af neutroner kan variere indenfor atomer af det samme stof. F.eks. findes der oxygen-atomer (ilt-atomer), som indeholder 8, 9 eller 10 neutroner. Alle oxygen-atomer indeholder 8 protoner. Atomer af det samme stof, men med forskelligt neutrontal, kaldes isotoper. Isotoper spiller stort set ingen rolle indenfor kemien, men er meget vigtige i kernefysikken. Atomer er normalt elektrisk neutrale, dvs. antallet af protoner og elektroner er det samme. vis atomet af en eller anden grund indeholder flere eller færre elektroner end antallet af protoner, så er atomet elektrisk ladet, og man taler om en ion. Ioner optræder meget hyppigt indenfor kemien. Ioner symboliseres ved det oprindelige atoms symbol samt et antal plusser eller minusser, som angiver ionens ladning. F.eks. indeholder et nitrogenatom normalt 7 elektroner (og 7 protoner), og symbolet er N. Fjerner vi en elektron, får vi en ion med en enkelt positiv ladning (husk, at elektronen er negativt ladet), og vi får ionen N. Fjerner vi to elektroner, fås ionen N, og fjerner vi tre ioner, fås N 3 (eller N ). 5
7 Tilfører vi derimod en elektron, bliver atomet negativt ladet, og vi får ionen 3 Tilføres endnu en elektron, fås N, og efter endnu en elektron N. - N. Et atoms kemiske egenskaber bestemmes udelukkende af dets elektroner og hele elektronsystemets opbygning. Dette er i virkeligheden et meget kompliceret emne, så vi vil nøjes med at skitsere et par hovedtræk. Elektronerne sidder i skaller. ver skal har kun plads til et fast antal elektroner - således kan den første skal indeholde maksimalt 2 elektroner, den 2. skal 8 elektroner, den 3. skal 18 elektroner osv. (Generelt gælder, at den n'te skal 2 indeholder højst 2n elektroner.) Atomet placerer sine elektroner så tæt på kernen som muligt, dvs. i de laveste skaller. Betragter vi f.eks. et svovl-atom, med atomnummeret 16, så vil den inderste skal indeholde 2 elektroner, den næstinderste 8 elektroner og den 3. skal de resterende 6 elektroner. Opgaver 2.1 Grundstoffet magnesium (Mg) har atomnummeret 12. vorledes sidder magnesiums elektroner i skallerne? 2.2 Solen består næsten udelukkende af hydrogen (brint). Et hydrogenatom vejer 30 ca. det samme som en proton. Solen vejer ca. 2,0 10 kg. vor mange atomer indeholder Solen? 2.3 Vand består af 2 O-molekyler med en masse på ca. 20 protonmasser. vor mange vandmolekyler er der i en liter vand (som vejer 1 kg)? 6
8 3. Det periodiske system Man kender 108 grundstoffer, og det er mange at holde rede på. eldigvis kan man sætte alle grundstofferne ind i et system - det periodiske system. Det viser sig, at grundstofferne kan opdeles i grupper af stoffer, der ligner hinanden meget. Nogle eksempler er: Ædelgasserne (eller de inaktive gasser). Dette er e, Ne, Ar, Kr, Xe og Rn. Fælles for disse er, at de er gasformige og at de ikke vil reagere kemisk med andre stoffer. alogenerne, som består af F, Cl, Br, I og At. Dette er grundstoffer, som meget gerne vil reagere med andre grundstoffer. Disse grundstoffer forekommer altid som to-atomige molekyler, dvs. som F 2, Cl 2, Br2, I2 ogat 2. De danner enkeltladede negative ioner: F,Cl,Br,I,At. Alkalimetallerne, som er Li, Na, K, Rb, Cs, Fr. Dette er bløde metaller med meget lave smeltepunkter, og der dannes altid enkeltladede positive ioner, f.eks. Na. Alle metallerne reagerer kraftigt med vand. Jordalkalimetallerne, som er Be, Mg, Ca, Sr, Ba og Ra. Dette er meget hårde metaller med højt smeltepunkter, og der dannes altid dobbeltladede positive ioner, f.eks. Ca. Man kan pusle alle grundstofferne ind i et system, således at grundstofferne kommer i rækkefølge (efter atomnummer), og således at grundstoffer, som er i familie, står under hinanden. Dette er det periodiske system, som man kan se i detaljer bag i hæftet. Man kan inddele det periodiske system i vandrette rækker og lodrette søjler. De vandrette rækker kaldes perioder: 1. periode 2. periode 3. periode 4. periode 5. periode 6. periode 7. periode (6. periode) (7. periode) 7
9 1. periode består altså kun af og e; 2. periode af Li, Be, B, C, N, O, F og Ne. Bemærk, at man af praktiske grund har fraspaltet dele af 6. og 7. periode. erved undgår man, at det periodiske system bliver alt for bredt. Den lodrette inddeling er mere interessant. Man har inddelt grundstofferne i hovedgrupperne, undergrupperne og to 'under-undergrupper' G G under-grupperne G G G G G G lanthaniderne actiniderne er betyder G naturligvis hovedgruppe. ydrogen står lidt for sig selv over 1. hovedgruppe, som er alkalimetallerne - det er jo lidt mystisk at kalde gasse hydrogen for et (alkali-)metal! 2. hovedgrupppe er jordalkalimetallerne, 7. hovedgruppe er halogenerne og 8. hovedgruppe er ædelgasserne. Nogle gange inddeler man også undergrupperne i 8 undergrupper; men dels er der ikke enighed om navnene på eller opdelingen af disse undergrupper, dels er denne inddeling ikke synderlig nyttig, så det gør vi ikke her. Endelig har man lanthaniderne (eller de sjældne jordarter) og aktiniderne, som er en slags 'under-undergrupper'. Grunden til, at stofferne i samme hovedgruppe ligner hinanden, er den ganske simple, at alle grundstoffer i samme hovedgruppe har det samme antal atomer i yderste skal! Ser vi f.eks. på alkalimetallerne, så har Li 3 elektroner, som fordeler sig 2, 1; Na har 11 elektroner, som fordeler sig 2, 8, 1; K har 19 elektroner, som fordeler sig 2, 8, 8, 1 etc. Idet det er elektronsystemets struktur, og især den yderste skal, der bestemmer et stofs kemiske egenskaber, må man forvente, at alle alkalimetallerne opfører sig nogenlunde ens. Faktisk er der mening i nummereringen af hovedgrupperne. Alle stoffer i 1. hovedgruppe har en elektron i yderste skal, alle stoffer i 2. hovedgruppe har 2 elektroner i yderste skal, etc. Specielt har alle ædelgasserne i 8. hovedgruppe 8 elektroner i den yderste skal (pånær helium, der kun har to elektroner i 1. skal). 8
10 Ydermere kan man se, at metallerne befinder sig til venstre i det periodiske system, mens ikke-metallerne er i øverste højre hjørne. På nedenstående figur er metallerne mørkegrå, halvmetallerne lysegrå og ikke-metallerne hvide. Endelig har vi markeret de 20 vigtigste grundstoffer fra sektion 2.1 med gråt nedenfor. Bemærk, at næsten alle vigtige grundstoffer er hovedgruppestoffer. Opgaver 3.1 For nedenstående grundstoffer skal du finde deres navn, deres periode, og undersøge, om de står i en hovedgruppe, en sidegruppe eller er lanthanider/actinider. a) Rb b) e c) Se d) Fr e) Sm f) Pu g) Br h) g i) As 9
11 4. Oktetreglen Som tidligere nævnt har ædelgasserne 8 elektroner i den yderste skal. Dette viser sig at være en ganske attraktiv tilstand. ermed menes, at alle atomer tilstræber at komme til at ligne en ædelgas - eller sagt på en anden måde alle atomer vil gerne have 8 elektroner i den yderste skal. Dette kaldes oktetreglen. Lad os f.eks. betragte alkalimetallet natrium, som har atomnummeret 11. Natrium har 2 elektroner i 1. skal, 8. elektroner i 2, skal og 1 elektron i 3. skal. vordan kan natrium komme til at ligne en ædelgas? En mulighed er at blive en ion. Mister natrium-atomet sin elektron i yderste skal, så får resten samme elektronstruktur som ædelgassen Ne, og det er jo i overensstemmelse med oktetreglen. Altså, natrium vil gerne blive til ionen Na. I teorien kunne man forestille sig en anden mulighed, nemlig at vi fyldte 3. skal op 7 med 7 ekstra elektroner, således at vi fik ionen Na med samme elektronstruktur 7 som ædelgassen Ar. Dette sker ikke i praksis. Når man skal lave Na -ionen, så er 6 man først nødt til at lave en Na -ion og derefter sætte en ekstra elektron på. Men den negativt ladede elektron vil blive frastødt meget kraftigt af den meget negativt 6 7 ladede Na -ion, og derfor er det meget svært at lave Na -ionen. Af samme grund optræder ioner med mere end 3 plus- eller minus-ladninger faktisk aldrig i kemien. Det samme gælder for de andre stoffer i 1. hovedgruppe - den nemmeste måde at komme til at ligne ædelgasserne på er ved at danne positive enkeltladede ioner. I anden hovedgruppe har atomerne 2 elektroner i den yderste skal, og den nemmeste måde at opfylde oktetreglen på er at afgive to elektroner og danne dobbeltladede positive ioner, f.eks. Ca. Endelig vil stofferne i 3. hovedgruppe danne tripelladede positive ioner, f.eks. 3 Al. I fjerde hovedgruppe skulle man forvente, at stofferne dannede ioner med enten 4 plusladninger eller 4 minusladninger, men som nævnt før kan ioner ikke have så stor en ladning. Stofferne i 4. hovedgruppe er derfor nødt til at finde på en anden udvej - de danner covalente forbindelser, som vi skal høre mere om senere. I 5. hovedgruppe har atomerne 5 elektroner i yderste skal. Det er for bøvlet at afgive alle disse 5 elektroner, så disse stoffer danner ikke positive ioner. I stedet kan atomerne optage tre elektroner for at opnå ædelgasstruktur,. F.eks. vil nitrogen 3 danne ionen N, som har samme elektrostruktur som argon. 10
12 I 6. hovedgruppe optager atomerne to elektroner og danner ioner med ædelgasstruktur. Eksempler er O og S. Endelig vil stofferne i 7. hovedgruppe optage en elektron og danne ioner som og Cl. F ydrogen kan gå begge veje. ydrogen kan optage en elektron og blive til, som har samme struktur som helium, eller det kan afgive en elektron og blive til, som i virkeligheden er en nøgen atomkerne. ( -ionen optræder imidlertid aldrig frit, da den binder sig lynhurtigt til andre molekyler.) I nedenstående skema er vist nogle af de ioner af hovedgruppestoffer, der dannes ifølge oktetreglen. Li Na K Rb Cs Be Mg 3 Al N 3 3 P O 2 2 S Ca... 2 Se 2 Sr... Te Ba... F Cl Br I Disse ioner har specielle navne. Positive ioner kaldes grundstoffets navn efterfulgt af -ion. F.eks. hedder 3 'natrium-ion', mens Al er en aluminium-ion. Na en Negative ioner kaldes grudstoffets navn efterfulgt af -id (efterfulgt af -ion). 2 Således er Cl en chlorid-ion, I en iodid-ion og O en oxid-ion. (Nitrogen og phosphors ioner sammentrækkes ligeledes til nitrid og phosphid). Undergruppemetallerne kan også danne ioner, men disse følger ikke oktetreglen. For at gøre tingene værre kan nogle af undergruppemetallerne danne flere forskellige ioner. I disse tilfælde navngiver man ionen som grundstoffetsnavn, ionens ladning i romertal og endelsen -ion. De vigtigste undergruppemetallers ioner er 2 Fe : jern(ii)-ion Cu : kobber(i)-ion Ag : sølv-ion Fe Cu Au 3 : jern(iii)-ion : kobber(ii)-ion : guld-ion 2 11
13 5. Covalente forbindelser Grundstofferne i 4. til 7. hovedgruppe har en anden udvej, når de skal opfylde oktetreglen - de kan dele elektroner mellem flere atomer. erved dannes der covalente bindinger: To chlor-atomer kan gå sammen og danne molekylet Cl 2. Dette foregår som følger: vert chlor-atom har 7 elektroner i yderste skal - for overskuelighedens skyld repræsenterer vi det ene atoms elektroner med krydser, det andets med prikker: Cl Cl Disse to atomer går altså sammen i en covalent binding: Cl Cl er er fordelen for begge atomer, at de nu 'tror' at de har 8 elektroner i den yderste skal: Cl Cl er er verden, som atomet til venstre opfatter den, illustreret. Cirklen viser, at atomet har fyldt sin yderste skal ud med de 8 elektroner, og så er alt jo godt! Figuren ovenfor kaldes en elektronprikformel, og den er ganske nyttig til at illustrere covalente bindinger. Vi giver nogle flere eksempler: Molekylet Cl (saltsyre er en opløsning af gassen Cl i vand): Cl er har Cl-atomet leveret 7 elektroner, og -atomet har leveret den sidste. Umiddelbart ser det ud som om, at -atomer ikke opfylder oktetreglen, men husk, at hydrogen kommer til at ligne ædelgassen helium med bare 2 elektroner i den yderste skal. 12
14 Vand, O 2 : O Oxygen-molekylet, O 2 : O O er deler de to atomer hele 4 elektroner - man taler om en dobbeltbinding. I nitrogen-molekylet, N 2, er der tale om en tripelbinding, hvor der deles 6 elektroner: N N Endelig har vi et mere kompliceret molekyle: Ethanol, bedre kendt som sprit eller alkohol, og med formlen C C O 3 2 : C C O Som man ser, bliver disse elektronprikformler hurtigt meget komplicerede. Man indfører derfor de såkaldte stregformler. I disse er delte elektronpar erstattet af en streg mellem de to molekyler. Dobbelt- og tripel-binder symboliseres ved dobbeltog tripel-streger. Molekylerne ovenfor bliver i stregformler: Cl Cl Cl O O = O N N og for ethanol: C C O Der gælder nogle regler for stregformler: vert enkelt atom har en valens, som er antallet af streger, som går ud fra atomet. Stoffer i 4. hovedgruppe har valensen 4, 13
15 5. hovedgruppe valensen 3, 6. hovedgruppe valensen 2 og 7. hovedgruppe valensen 1. Valensen for nogle udvalgte atomer atom valens atom valens 1 O 2 F 1 S 2 Cl 1 N 3 Br 1 P 3 I 1 C 4 I en stregformel skal alle atomers streger ramme et andet atom, og hvert atom må ikke have flere streger end dets valens. En god tommelfingerregel, når man skal lave stregformler, er, at atomer med højst valens sidder i midten og skal placeres først. En anden god regel er, at C-atomerne gerne vil forbinde sig med hinanden og danne lange kæder. Når man har et stofs stregformel, så er det en smal sag at lave elektronprikformlen - husk, at hver streg svarer til et delt elektronpar. Stregformler giver mulighed for at lave rumlige molekylmodeller med et molekylbyggesæt. I dette byggesæt er hvert atom repræsenteret af en lille plastikkugle. I kuglen er der huller svarende til atomets valens. Bindingerne repræsenteres af plastikstænger. Stregformler er vigtige, fordi de fleste stoffer, især indenfor den organiske kemi, kan repræsenteres vha. stregformler. Se bare eksemplerne nedenfor. (Man inddeler kemien i den organiske kemi og den uorganiske kemi - organiske stoffer er stoffer, der indeholder kul-atomer, mens uorganiske stoffer ikke indeholder kulstof. Alle stoffer, som optræder i biokemien er organiske). O O O O O C C C C C C O Glykose (eller druesukker) 14
16 C C O C C O C C C C C O Acetylsalicylsyre (eller aspirin) O Desværre findes der molekyler, hvor man kan lave prikformler, men ikke stregformler. Eksempler herpå er følgende sammensatte ion, SO 4 2, kaldet sulfat-ionen: er er der i alt 32 elektroner, nemlig 6 fra hvert af de 5 atomer (som allt er i 6. hovedgruppe) og 2 ekstra elektroner - vi har jo en ion. Prikformlen er placeret i den firkantede parentes, netop fordi der er tale om en ion. Endelig findes der stoffer, som ikke opfylder oktetreglen, f.eks. CO (kulmonoxid eller kulilte) og NO 2. Når man skal navngive covalente forbindelser, så angiver man antallet af de forskellige slags atomer i stoffets molekylformel ved at sætte de græske talord foran grundstoffets navn. Man sætter -id på det sidste grundstof. De græske talord er 1 = mono 2 = di 3 = tri 4 = tetra 5 = penta 6 = hexa 7 = hepta 8 = octa 9 = nona 10 = deca Eksempler: SO 2 = svovldioxid SO 3 = svovltrioxid N 2 O = dinitrogenoxid NO 2 = nitrogendioxid NO = nitrogenoxid 15
17 Opgaver 5.1 Lav stregformler, og derefter elektronprikformler, for følgende stoffer: a) I b) CO 2 c) N 3 d) ClO e) O 3 f) C O 2 g) O Lav stregformler for følgende molekyler: a) F b) N 2 4 c) C3 COO d) CN e) CS Lav elektronprikformler for følgende sammensatte ioner: 3 a) N 4 b) PO 4 c) O d) ClO 3 e) CN f) I Navngiv nedenstående molekyler: a) ClO 2 b) ICl 3 c) PCl 3 d) CS 2 e) SeO 2 f) N O 2 3 g) CO h) CO 2 i) P O 2 5 j) SF 6 k) Cl vilke af stofferne opfylder ikke oktetreglen? 5.5 I denne opgave skal vi arbejde med et molekylbyggesæt. a) Lav modeller for molekylderne i opgaverne 5.1 og 5.2 b) Stoffet ozon, O 3, er temmeligt ustabilt. Byg en molekylmodel og forklar hvorfor. c) Der findes to forskellige molekyler med formlen C O 2 6. Byg modeller af begge. d) Der findes to forskellige molekyler med formlen C 3 6. Byg modeller af begge. (Vink: Tænk i trekanter) e) Lav en model af benzen: C 6 6 (Vink: I benzen sidder de 6 C-atomer i en ring med skiftevis enkeltog dobbeltbindinger) 16
18 6. Ionforbindelser Metaller har ikke mulighed for at indgå i covalente forbindelser. Betragt f.eks. natrium. vis et sådant atom skal indgå i en covalent forbindelse, så skal det dele 7 andre elektroner med andre atomer, og det er der ganske simpelt ikke plads til omkring det stakkels natriumatom. Det er derfor meget lettere at blive til en ion! For at natrium kan blive til en ion, så skal der være et andet stof, som kan optage den overskyldende elektron. Det kræver nemlig energi at rive elektronen væk fra natrium-atomet, og kun hvis et andet atom kan optage elektronen og samtidigt afgive energi, går regnskabet op! Lad os anbringe et Na-atom og et Cl-atom i nærheden af hinanden. Na-atomet vil gerne af med en elektron, og Cl vil gerne optage den. Vi får altså to ioner, nemlig Na og Cl. Nu tiltrækker modsatte ladninger hinanden, så disse to ioner vil have en tendens til at hænge sammen - vi har en ionforbindelse. Denne ionforbindelse - natriumchlorid - er i øvrigt ganske almindeligt salt. I praksis har man jo ufatteligt mange Na - og Cl -ioner samtidigt, og disse vil hænge sammen i et iongitter. Vi ser dette iongitter som et saltkrystal. En ionforbindelse er altså en forbindelse mellem en positiv og en negativ ion. I daglig, og upræcis tale, kalder man ofte ionforbindelser for salte. Et andet eksempel er forbindelsen mellem Ca og Cl. Nu danner Ca jo ionen Ca 2 under afgivelse af to elektroner, og der skal derfor være to Cl-atomer til at optage disse. I iongitteret sidder der dobbelt så mange Cl -ioner som Ca 2 -ioner, vi skal jo have et elektrisk neutral iongitter, så formlen for dette salt er CaCl 2 Et tredie eksempel er aluminiumoxid, som dannes af ionerne Al 3 og O 2. I iongitteret skal der være lige mange positive og negative ladninger, og det kan der kun være, hvis der er 2 Al 3 -ioner for hver 3 O 2 -ioner. Formlen bliver derfor Al 2 O 3. Generelt gælder, at i en ionforbindelse skal ladningen af de positive ioner ophæve ladningen af de negative ioner. Dette justeres ved antallet af de forskellige ioner. Også sammensatte ioner kan optræde. Fra sidste kapitel kender vi sulfat-ionen SO 2 4. Ionforbindelsen mellem Na og sulfat bliver Na 2SO4, fordi der skal to enkeltladede Na 'ere til at ophæve den dobbeltladede SO 4 2. Aluminiumsulfat får formlen Al 2 (SO 4 ) 3. (vorfor?) 17
19 er skriver vi ikke Al S O , men bruger i stedet parenteser. Det har den fordel, at man straks kan se, at der er tale som en sulfat-ion. Når man skal navngive ionforbindelser, så angiver man navnet for den positive ion efterfulgt af navnet for den negative ion. Ingen græske talord. De positive ioner har normalt samme navn som det tilsvarende metal. I visse tilfælde (nemlig der, hvor metallet kan optræde som ioner med forskellig slags ladning) sættes ionens ladning efter metallets navn som et romertal i parentes. Na = natrium K = kalium Ca = calcium N 4 = ammonium Fe = jern(ii) Fe = jern(iii) Den eneste sammensatte positive ion er ammonium, N 4. Den negative ion har altid et særligt navn. Ved ioner bestående af et atom er det ganske simpelt atomets navn efterfulgt af -id: Cl O = chlorid = oxid Sammensatte ioner har mere komplicerede navne: SO 3 = sulfit PO 4 = phosphat SO 4 = sulfat PO 4 = hydrogenphosphat SO 4 = hydrogensulfat PO 2 4 = dihydrogenphosphat NO 2 = nitrit O = hydroxid NO 3 = nitrat ClO 4 = chlorat CO 3 = carbonat CN = cyanid Se bag i hæftet for en udførlig liste over ioner, deres navne og ladninger. Nogle eksempler på navne er: KBr kaliumbromid Na natriumhydrid FeCl 2 jern(ii)chlorid FeCl 3 jern(iii)chlorid NaSO 4 natriumhydrogensulfat N 4NO3 ammoniumnitrat 18
20 Opgaver 6.1 Navngiv nedenstående salte. (Find først ud af, hvilke ioner, de indeholder) a) MgCl 2 b) AgNO 3 c) Li 2CO3 d) CaSO 3 e) CaSO 4 f) FePO 4 g) CaS h) CrCl 2 i) CrCl 3 j) NaClO 2 k) CuO l) Cu 2 O 6.2 Opskriv formlerne for nedenstående salte: a) magnesiumbromid b) sølvsulfid c) aluminiumsulfat d) bariumphosphat e) guldnitrat f) kaliumcyanid g) natriumhydroxid h) ammoniumcarbonat i) jern(iii)phosphat j) kobber(ii)oxid k) kobber(i)oxid l) kobber(ii)sulfat m) aluminiumcarbonat n) kaliumchlorat 6.3 Når man skal afgøre, om et stof er en covalent forbindelse eller en ionforbindelse, så er følgende en god tommelfingerregel: Stoffer, der indeholder metaller, er ionforbindelser Stoffer, der kun indeholder ikke-metaller er covalente forbindelser. Der findes dog undtagelser - især ionforbindelser indeholde ammoniumionen, N 4, kan snyde. Afgør for hvert af følgende stoffer, om de er covalente forbindelser eller ionforbindelser. Navngiv derefter stofferne: a) BaCO 3 b) Cl c) NaCl d) N 4 Cl e) NCl 3 f) BF 3 19
21 7. Reaktionsskemaer vis man tager noget ethanol, C C O 3 2, og sætter en tændstik til, så brænder det. Dette skyldes, at ethanolen reagerer med luftens oxygen, O 2, og danner vand og kuldioxid. Vi skal opsummere denne reaktion i nedenstående reaktionsskema: C C O O CO O Dette skal læses som: Ethanol reagerer med oxygen og danner kuldioxid og vand. Der er noget galt med reaktionsskemaet: På venstre side er der to C-atomer, på højre side kun ét. Tilsvarende passer antallet af - og O-atomer heller ikke. Dette kan vi reparere ved at afstemme reaktionsskemaet: Det er to C-atomer til venstre, og kun ét til højre. Pengene ville passe, hvis et molekyle ethanol brændte til to molekyler kuldioxid. Dette skriver vi som: C C O O 2CO O hvor to-tallet foran CO 2 betyder, at der er to molekyler kuldioxid. Tilsvarende har vi 6 -atomer til venstre og kun 2 til højre. Men hvad nu hvis der dannes 3 molekyler vand? C C O O 2CO 3 O Nu er det kun antallet af O'er, der ikke passer. Til venstre har vi 3, og til højre 7. Dette kan justeres på flere måder, idet O indgår i alle molekylerne. Men det er bedst kun at pille ved tallet foran O 2, da vi ellers bringer uorden i antallet af C'ere og 'ere. Bruger vi 4 O 2 -molekyler, så passer pengene: C C O 4O 2CO 3 O Vi har afstemt reaktionsskemaet! vis reaktionsskemaet indeholder ioner, så skal vi, udover antallet af de forskellige atomer, også sørge for, at den totale ladning er den samme på begge sider. Somme tider anvender man forskellige symboler, som beskriver de reagerende stoffers tilstand og reaktionens forløb. Opløser man f.eks. sukker i vand, kan dette beskrives som C O ( s) C O ( aq) er betyder s'et, at sukkeret er på fast form, mens aq'et betyder, at sukkeret er opløst i vand. Bemærk, at vand som kemisk stof ikke ingdår i reaktionen. Opløser man en ionforbindelse i vand, så opsplittes iongitteret i de enkelte ioner. Eksempelvis kan opløsningen af natriumchlorid i vand skrives som 20
IONER OG SALTE. Et stabilt elektronsystem kan natrium- og chlor-atomerne også få, hvis de reagerer kemisk med hinanden:
 IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler
 Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse:
 Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017
 EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
Torben Rosenørn. Aalborg Universitet. Campus Esbjerg
 Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
10. juni 2016 Kemi C 325
 Grundstoffer og Det Periodiske System Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Forklar hvad der forstås med begrebet grundstoffer kontra kemiske forbindelser. Atomer er placeret
Grundstoffer og Det Periodiske System Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Forklar hvad der forstås med begrebet grundstoffer kontra kemiske forbindelser. Atomer er placeret
Mundtlige eksamensopgaver
 Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
maj 2017 Kemi C 326
 Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør. Spørgsmål 1. Grundstoffer og det periodiske system
 EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør Øvelse: Opløsningsmidlers egenskaber Spørgsmål 1 Grundstoffer og det periodiske system Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne
EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør Øvelse: Opløsningsmidlers egenskaber Spørgsmål 1 Grundstoffer og det periodiske system Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne
Eksamensspørgsmål Kemi C, 2015, Kec124 (NB).
 Eksamensspørgsmål Kemi C, 2015, Kec124 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2015, Kec124 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, spændingsrækken
Syrer, baser og salte
 Syrer, baser og salte Navn: Indholdsfortegnelse: Ion begrebet... 2 Ætsning af Mg bånd med forskellige opløsninger... 5 Elektrolyse af forskellige opløsninger... 7 Påvisning af ioner i forskellige opløsninger
Syrer, baser og salte Navn: Indholdsfortegnelse: Ion begrebet... 2 Ætsning af Mg bånd med forskellige opløsninger... 5 Elektrolyse af forskellige opløsninger... 7 Påvisning af ioner i forskellige opløsninger
Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse 1 Stoffers blandbarhed og det periodiske system 2 Stoffers blandbarhed og elektronparbindingen 3 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse 1 Stoffers blandbarhed og det periodiske system 2 Stoffers blandbarhed og elektronparbindingen 3 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Opgave: Du skal udfylde de manglende felter ud fra den information der er givet
 pgave 1a.01 Brug af det periodiske system pgave: Du skal udfylde de manglende felter ud fra den information der er givet Eks: I rubrik 1 kendte vi grundstof nummeret (nr. 11). Ved brug af det periodiske
pgave 1a.01 Brug af det periodiske system pgave: Du skal udfylde de manglende felter ud fra den information der er givet Eks: I rubrik 1 kendte vi grundstof nummeret (nr. 11). Ved brug af det periodiske
Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på:
 1. Molekyler Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på: Elektronparbinding (= kovalent binding) Oktetreglen/ædelgasreglen Polaritet Hydrofile og hydrofobe grupper Navngivning af
1. Molekyler Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på: Elektronparbinding (= kovalent binding) Oktetreglen/ædelgasreglen Polaritet Hydrofile og hydrofobe grupper Navngivning af
Med forbehold for censors kommentarer. Eksamensspørgsmål Kemi C, 2014, Kec223 (NB).
 Med forbehold for censors kommentarer Eksamensspørgsmål Kemi C, 2014, Kec223 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer
Med forbehold for censors kommentarer Eksamensspørgsmål Kemi C, 2014, Kec223 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer
Eksamensopgaverne offentliggøres selvfølgelig med det forbehold, at censor kan komme med ændringsforslag.
 VUC Århus, 17. maj. 2011 Kære alle kursister på holdene ke02da1c (kemi C flex, helårsholdet) og ke05da1c (kemi C flex, halvårsholdet) På de næste mange sider vil I kunne se Jeres kommende eksamensopgaver
VUC Århus, 17. maj. 2011 Kære alle kursister på holdene ke02da1c (kemi C flex, helårsholdet) og ke05da1c (kemi C flex, halvårsholdet) På de næste mange sider vil I kunne se Jeres kommende eksamensopgaver
Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron. En hydron er en H +
 Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron En hydron er en H + Ved en syrebasereaktion overføres der en hydron fra en syre til en base En syre indeholder
Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron En hydron er en H + Ved en syrebasereaktion overføres der en hydron fra en syre til en base En syre indeholder
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
1. Kovalent binding herunder eksperimentet Undersøgelse af stoffers opløselighed.
 Indhold 1. Kovalent binding herunder eksperimentet Undersøgelse af stoffers opløselighed.... 2 2. Fældningsreaktioner herunder eksperimentet Saltes opløselighed i vand.... 3 3. Stofmængdekoncentration
Indhold 1. Kovalent binding herunder eksperimentet Undersøgelse af stoffers opløselighed.... 2 2. Fældningsreaktioner herunder eksperimentet Saltes opløselighed i vand.... 3 3. Stofmængdekoncentration
Atomer er betegnelsen for de kemisk mindste dele af grundstofferne.
 Atomets opbygning Atomer er betegnelsen for de kemisk mindste dele af grundstofferne. Guldatomet (kemiske betegnelse: Au) er f.eks. det mindst stykke metal, der stadig bærer navnet guld, det kan ikke yderlige
Atomets opbygning Atomer er betegnelsen for de kemisk mindste dele af grundstofferne. Guldatomet (kemiske betegnelse: Au) er f.eks. det mindst stykke metal, der stadig bærer navnet guld, det kan ikke yderlige
Eksamensopgaver. NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL
 Eksamensopgaver NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL Liste over eksamensøvelser 1. Opløsningsmidlers egenskaber 2. Fældningsreaktioner 3. Påvisning af proteiner 4. Fremstilling af
Eksamensopgaver NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL Liste over eksamensøvelser 1. Opløsningsmidlers egenskaber 2. Fældningsreaktioner 3. Påvisning af proteiner 4. Fremstilling af
Atomets bestanddele. Indledning. Atomer. Atomets bestanddele
 Atomets bestanddele Indledning Mennesket har i tusinder af år interesseret sig for, hvordan forskellige stoffer er sammensat I oldtiden mente man, at alle stoffer kunne deles i blot fire elementer eller
Atomets bestanddele Indledning Mennesket har i tusinder af år interesseret sig for, hvordan forskellige stoffer er sammensat I oldtiden mente man, at alle stoffer kunne deles i blot fire elementer eller
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug-dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi C Mohammed
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug-dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi C Mohammed
Lim mellem atomerne Ny Prisma Fysik og kemi 8. Skole: Navn: Klasse:
 Lim mellem atomerne Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: Opgave 1 Her ser du en modeltegning af et atom. Hvilket atom forestiller modellen? Der er 5 svarmuligheder. Sæt et kryds. Et oxygenatom
Lim mellem atomerne Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: Opgave 1 Her ser du en modeltegning af et atom. Hvilket atom forestiller modellen? Der er 5 svarmuligheder. Sæt et kryds. Et oxygenatom
Atomets opbygning. Keminote 2010
 Atomets opbygning Oprindelig forestillede man sig, at atomet var en lille kugle, som ikke kunne deles i mindre dele. Ordet atom kommer af det græske ord atomos, som betyder udelelig. Fra slutningen af
Atomets opbygning Oprindelig forestillede man sig, at atomet var en lille kugle, som ikke kunne deles i mindre dele. Ordet atom kommer af det græske ord atomos, som betyder udelelig. Fra slutningen af
Densitet (også kendt som massefylde og vægtfylde) hvor
 Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Eksamensspørgsmål Kemi C, 2016, Kec225 (KSD).
 Eksamensspørgsmål Kemi C, 2016, Kec225 (KSD). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, ph 5 Redoxreaktioner,
Eksamensspørgsmål Kemi C, 2016, Kec225 (KSD). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, ph 5 Redoxreaktioner,
3HCl + Al AlCl3 + 3H
 For at du kan løse denne opgave, og få helt styr på det med reaktionsligninger, er du nødt til at lave forløbet om Ion-bindinger først. Hvis du er færdig med det forløb, så kan du bare fortsætte. Har du
For at du kan løse denne opgave, og få helt styr på det med reaktionsligninger, er du nødt til at lave forløbet om Ion-bindinger først. Hvis du er færdig med det forløb, så kan du bare fortsætte. Har du
Eksamensspørgsma l kemi C, 2015, kec324 (CHT)
 Oversigt Sp. 1 og 2 Ioner og Ionforbindelser Sp. 3, 4 og 5 Molekylforbindelser Sp. 6 Kemisk mængdeberegning Sp. 7 Koncentration i en opløsning Sp. 8 og 9 Organisk kemi Sp. 10 og 11 Syrer og baser Sp. 12
Oversigt Sp. 1 og 2 Ioner og Ionforbindelser Sp. 3, 4 og 5 Molekylforbindelser Sp. 6 Kemisk mængdeberegning Sp. 7 Koncentration i en opløsning Sp. 8 og 9 Organisk kemi Sp. 10 og 11 Syrer og baser Sp. 12
Rapport over Fældningsreaktioner
 Rapport over Fældningsreaktioner Formål: at undersøge, hvilke salte der dannes ud fra forskellige fældningsreaktioner, og efterfølgende at undersøge hvilke af disse salte, der er tungtopløselige og hvilke,
Rapport over Fældningsreaktioner Formål: at undersøge, hvilke salte der dannes ud fra forskellige fældningsreaktioner, og efterfølgende at undersøge hvilke af disse salte, der er tungtopløselige og hvilke,
Salte, Syre og Baser
 Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation
 Overskrifter til kemispørgsmål, Kemi C 2012 1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation 2. Grundstoffer i mennesket
Overskrifter til kemispørgsmål, Kemi C 2012 1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation 2. Grundstoffer i mennesket
KORT SUMMARISK GENNEMGANG AF KEMIEN 2013.
 COPYRIGHT NIELS NORDHOLT 2000-2013 S. 1 KORT SUMMARISK GENNEMGANG AF KEMIEN 2013. Sætning, reaktion eller kort forsøgsbeskrivelse Ved en fysisk forandring omdannes stoffer ikke til andre stoffer. Ved en
COPYRIGHT NIELS NORDHOLT 2000-2013 S. 1 KORT SUMMARISK GENNEMGANG AF KEMIEN 2013. Sætning, reaktion eller kort forsøgsbeskrivelse Ved en fysisk forandring omdannes stoffer ikke til andre stoffer. Ved en
Syrer, baser og salte
 Molekyler Atomer danner molekyler (kovalente bindinger) ved at dele deres elektroner i yderste elektronskal. Dette sker for at opnå en stabil tilstand. En stabil tilstand er når molekylerne på nogle tidspunkter
Molekyler Atomer danner molekyler (kovalente bindinger) ved at dele deres elektroner i yderste elektronskal. Dette sker for at opnå en stabil tilstand. En stabil tilstand er når molekylerne på nogle tidspunkter
Forord. Undervisere kan bruge arket ved først at kontakte pierre@naae.dk og få et skriftligt tilsagn.
 Forord Dette hjælpeark til mol og molberegninger er lavet af til brug på Nørre Åby Efterskole. Man er som studerende/elev meget velkommen til at hente og bruge arket. Undervisere kan bruge arket ved først
Forord Dette hjælpeark til mol og molberegninger er lavet af til brug på Nørre Åby Efterskole. Man er som studerende/elev meget velkommen til at hente og bruge arket. Undervisere kan bruge arket ved først
Opgave. Navn Kemi opgaver Klasse Side 1 af 7. Hvad kaldes elementarpartiklerne, angiv deres ladning
 Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Spørgsmål 1. Øvelse: Kobber plus dibrom. Teori: Atomers opbygning.
 Spørgsmål 1. Øvelse: Kobber plus dibrom. Atomers opbygning. Atomets struktur. Det periodiske system. Betydning af hovedgrupperne. Ædelgassernes elektronstruktur i den yderste skal. Dannelse af ioner og
Spørgsmål 1. Øvelse: Kobber plus dibrom. Atomers opbygning. Atomets struktur. Det periodiske system. Betydning af hovedgrupperne. Ædelgassernes elektronstruktur i den yderste skal. Dannelse af ioner og
Molekyler & Mere Godt Kemi
 Molekyler & Mere Godt Kemi Elektronparbindinger Molekylgeometri Elektronegativitet Ethanol Buchminster Fulleren Carbondioid Asbest influenza vaccine Diamant Indhold. 1. Molekyler og Kovalente Bindinger....
Molekyler & Mere Godt Kemi Elektronparbindinger Molekylgeometri Elektronegativitet Ethanol Buchminster Fulleren Carbondioid Asbest influenza vaccine Diamant Indhold. 1. Molekyler og Kovalente Bindinger....
Grundstoffer og det periodiske system
 Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
1 Ioner og ionforbindelser
 1 Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes, så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
1 Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes, så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
Opgaver til: 3. Kemiske bindingstyper
 Opgaver til: 3. Kemiske bindingstyper 1. Udfyld følgende skema ved afkrydsning (du må gerne bruge Det Periodiske System som hjælp). STOF SALT MOLE- STOF SALT MOLE- H 2 O NH 3 HBr H 2 KBr NO 2 Na CaO CO
Opgaver til: 3. Kemiske bindingstyper 1. Udfyld følgende skema ved afkrydsning (du må gerne bruge Det Periodiske System som hjælp). STOF SALT MOLE- STOF SALT MOLE- H 2 O NH 3 HBr H 2 KBr NO 2 Na CaO CO
1 Atomets opbygning. Du skal fortælle om det periodiske system og atomets opbygning. Inddrag eksperimentet Reaktionen mellem kobber og dibrom.
 1 Atomets opbygning Du skal fortælle om det periodiske system og atomets opbygning. Inddrag eksperimentet Reaktionen mellem kobber og dibrom. Kernepartikler og elektronstruktur Periodisk system - hovedgrupper
1 Atomets opbygning Du skal fortælle om det periodiske system og atomets opbygning. Inddrag eksperimentet Reaktionen mellem kobber og dibrom. Kernepartikler og elektronstruktur Periodisk system - hovedgrupper
Test din viden E-forløb
 OPGAVE E8 Test din viden E-forløb Har du styr på E-forløbets kernestof? Nu har du lært en masse om spændingsrækken og redoxreaktioner. Ved at lave opgaverne nedenfor finder du ud af, om der er nogle områder,
OPGAVE E8 Test din viden E-forløb Har du styr på E-forløbets kernestof? Nu har du lært en masse om spændingsrækken og redoxreaktioner. Ved at lave opgaverne nedenfor finder du ud af, om der er nogle områder,
BASISKEMI C. Facit HELGE MYGIND OLE VESTERLUND NIEL SEN VIBEKE A XEL SEN HAASE & SØNS FORLAG
 BASISKEMI C ELGE MYGIND OLE VESTERLUND NIEL SEN VIBEKE A XEL SEN Facit AASE & SØNS FORLAG elge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C. Facit forfatterne og aase & Søns Forlag as
BASISKEMI C ELGE MYGIND OLE VESTERLUND NIEL SEN VIBEKE A XEL SEN Facit AASE & SØNS FORLAG elge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C. Facit forfatterne og aase & Søns Forlag as
Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse:
 Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse: Opgave 1 Et metal er kendetegnet ved, at nogle af metallets elektroner danner en elektrongas. Her er en række udsagn om, hvad et
Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse: Opgave 1 Et metal er kendetegnet ved, at nogle af metallets elektroner danner en elektrongas. Her er en række udsagn om, hvad et
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug 2014- dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold Flex-kemi C Kemi C Mohammed
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug 2014- dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold Flex-kemi C Kemi C Mohammed
Eksamensspørgsmål til kecu eksamen tirsdag d. 3. juni og onsdag d. 4. juni 2014
 Eksamensspørgsmål til kecu eksamen tirsdag d. 3. juni og onsdag d. 4. juni 2014 Spørgsmål 1. og 15. Ionforbindelser og fældningsreaktioner, herunder øvelsen Saltes opløselighed i vand 2. og 16. Det periodiske
Eksamensspørgsmål til kecu eksamen tirsdag d. 3. juni og onsdag d. 4. juni 2014 Spørgsmål 1. og 15. Ionforbindelser og fældningsreaktioner, herunder øvelsen Saltes opløselighed i vand 2. og 16. Det periodiske
Eksamensspørgsmål. Spørgsmål : Atomer og bindinger (Hvilken type stof?) Spørgsmål : Ionforbindelser (Saltes opløselighed i vand
 Eksamensspørgsmål KemiC (17KeC80) Med forbehold for censors godkendelse Oversigt Spørgsmål 1 + 14: Atomer og bindinger (Hvilken type stof?) Spørgsmål 2 + 15: Ionforbindelser (Saltes opløselighed i vand
Eksamensspørgsmål KemiC (17KeC80) Med forbehold for censors godkendelse Oversigt Spørgsmål 1 + 14: Atomer og bindinger (Hvilken type stof?) Spørgsmål 2 + 15: Ionforbindelser (Saltes opløselighed i vand
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2019, eksamen maj/juni 2019 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2019, eksamen maj/juni 2019 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Vikar-Guide. Den elektriske ladning af en elektron er -1 elementarladning, og den elektriske ladning af protonen er +1 elementarladning.
 Vikar-Guide Fag: Klasse: OpgaveSæt: Fysik/Kemi 9. klasse Atomernes opbygning 1. Fælles gennemgang: Eleverne skal løse opgaverne i små grupper på 2-3 personer. De skal bruge deres grundbog, og alternativt
Vikar-Guide Fag: Klasse: OpgaveSæt: Fysik/Kemi 9. klasse Atomernes opbygning 1. Fælles gennemgang: Eleverne skal løse opgaverne i små grupper på 2-3 personer. De skal bruge deres grundbog, og alternativt
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2018, eksamen maj/juni 2018 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2018, eksamen maj/juni 2018 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Spørgsmål 1. Øvelse: Kobber plus dibrom. Teori: Atomers opbygning.
 Spørgsmål 1. Øvelse: Kobber plus dibrom. Atomers opbygning. Atomets struktur. Det periodiske system. Betydning af hovedgrupperne. Ædelgassernes elektronstruktur i den yderste skal. Dannelse af salte og
Spørgsmål 1. Øvelse: Kobber plus dibrom. Atomers opbygning. Atomets struktur. Det periodiske system. Betydning af hovedgrupperne. Ædelgassernes elektronstruktur i den yderste skal. Dannelse af salte og
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Efterårssemester 2018, eksamen december 2018 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Efterårssemester 2018, eksamen december 2018 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas
 Eksamensspørgsmål revideret 7/6 NW 1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas Bilag: Det periodisk system. Du skal fortælle om atomets opbygning, om isotoper og naturligvis om begrebet
Eksamensspørgsmål revideret 7/6 NW 1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas Bilag: Det periodisk system. Du skal fortælle om atomets opbygning, om isotoper og naturligvis om begrebet
Anvendt kemi 1 ekstraspørgsmål. Koncentration
 Anvendt kemi 1 ekstraspørgsmål Koncentration Til et kemiforsøg skal der fremstilles en række opløsninger af letopløselige salte. Udregn for hver af de følgende opløsninger, hvor mange gram af det aktuelle
Anvendt kemi 1 ekstraspørgsmål Koncentration Til et kemiforsøg skal der fremstilles en række opløsninger af letopløselige salte. Udregn for hver af de følgende opløsninger, hvor mange gram af det aktuelle
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Fredericia HF og VUC Uddannelse Fag og niveau Lærer(e) Hold HF Kemi C Thomas Nielsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Fredericia HF og VUC Uddannelse Fag og niveau Lærer(e) Hold HF Kemi C Thomas Nielsen
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Flammefarver Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen af et atom
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Flammefarver Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen af et atom
Spørgsmål 1 Den kemiske reaktion
 Spørgsmål 1 Den kemiske reaktion Du skal gennemgå eksperimentet Fyrfadslys inddrag gerne dine forsøgsresultater og vurder om de understøtter modellen reaktionskemaet. Du skal endvidere give eksempler på
Spørgsmål 1 Den kemiske reaktion Du skal gennemgå eksperimentet Fyrfadslys inddrag gerne dine forsøgsresultater og vurder om de understøtter modellen reaktionskemaet. Du skal endvidere give eksempler på
Navn Kemi opgaver Klasse 9. b Side 1 af 9. Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen sammen?
 Klasse 9. b Side 1 af 9 Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Klasse 9. b Side 1 af 9 Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Du skal også komme ind på øvelsen Saltes opløselighed i vand.
 1. Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
1. Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2013 Institution Fredericia VUC Uddannelse Fag og niveau Lærer(e) Hold Hf Kemi C Thomas Nielsen 1kec13e
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2013 Institution Fredericia VUC Uddannelse Fag og niveau Lærer(e) Hold Hf Kemi C Thomas Nielsen 1kec13e
Eksamensspørgsmål 2c ke, juni Fag: Kemi C-niveau. Censor: Andreas Andersen, Skanderborg Gymnasium
 Eksamensspørgsmål 2c ke, juni 2016 Fag: Kemi C-niveau Censor: Andreas Andersen, Skanderborg Gymnasium Eksaminator: Jeanette Olofsson, Ikast-Brande Gymnasium 1. Bindingstyper og tilstandsformer under inddragelse
Eksamensspørgsmål 2c ke, juni 2016 Fag: Kemi C-niveau Censor: Andreas Andersen, Skanderborg Gymnasium Eksaminator: Jeanette Olofsson, Ikast-Brande Gymnasium 1. Bindingstyper og tilstandsformer under inddragelse
Kemiske bindinger. Præsentation: Niveau: 8. klasse. Varighed: 7 lektioner
 Kemiske bindinger Niveau: 8. klasse Varighed: 7 lektioner Præsentation: Forløbet Kemiske bindinger omhandler ionbindinger, kovalente bindinger, metalbindinger, polære kovalente bindinger, hydrogenbindinger
Kemiske bindinger Niveau: 8. klasse Varighed: 7 lektioner Præsentation: Forløbet Kemiske bindinger omhandler ionbindinger, kovalente bindinger, metalbindinger, polære kovalente bindinger, hydrogenbindinger
NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10
 NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10 Elevens navn: CPR-nr.: Skole: Klasse: Tilsynsførendes navn: 1 Tilstandsformer Tilstandsformer Opgave 1.1 Alle stoffer har 3 tilstandsformer.
NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10 Elevens navn: CPR-nr.: Skole: Klasse: Tilsynsførendes navn: 1 Tilstandsformer Tilstandsformer Opgave 1.1 Alle stoffer har 3 tilstandsformer.
Naturfag for skov- og gartnerholdet
 Naturfag for skov- og gartnerholdet Grundlæggende kemi -Gennemgang af forskellige stoffers egenskaber og anvendelighed indenfor gartneri, anlægsgartneri og skovbrug 1 www.ucholstebro.dk. Døesvej 70 76.
Naturfag for skov- og gartnerholdet Grundlæggende kemi -Gennemgang af forskellige stoffers egenskaber og anvendelighed indenfor gartneri, anlægsgartneri og skovbrug 1 www.ucholstebro.dk. Døesvej 70 76.
Der er noget i luften Ny Prisma Fysik og kemi 9 - kapitel 6 Skole: Navn: Klasse:
 Der er noget i luften Ny Prisma Fysik og kemi 9 - kapitel 6 Skole: Navn: Klasse: Opgave 1 Gasserne nitrogen, oxygen og kuldioxid er de gasser i Jordens atmosfære, der er vigtigst for livet. Angiv hvilke
Der er noget i luften Ny Prisma Fysik og kemi 9 - kapitel 6 Skole: Navn: Klasse: Opgave 1 Gasserne nitrogen, oxygen og kuldioxid er de gasser i Jordens atmosfære, der er vigtigst for livet. Angiv hvilke
DET PERIODISKE SYSTEM
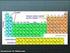 DET PERIODISKE SYSTEM Tilpasset efter Chemistry It s Elemental! Præsentation fra the American Chemical Society, Aug. 2009 http://portal.acs.org/portal/publicwebsite/education/outreach/ncw/studentseducators/cnbp_023211
DET PERIODISKE SYSTEM Tilpasset efter Chemistry It s Elemental! Præsentation fra the American Chemical Society, Aug. 2009 http://portal.acs.org/portal/publicwebsite/education/outreach/ncw/studentseducators/cnbp_023211
Alkohol Ingrid Jespersens Gymnasieskole 2007
 Alkohol Ingrid Jespersens Gymnasieskole 007 Ethanols fysiske egenskaber Kogepunkt 78,5 o C På side 8 i Alkohol også vises Frysepunkt -114, o C opskriften på et forsøg til bestemmelse af Massefylde 0,789
Alkohol Ingrid Jespersens Gymnasieskole 007 Ethanols fysiske egenskaber Kogepunkt 78,5 o C På side 8 i Alkohol også vises Frysepunkt -114, o C opskriften på et forsøg til bestemmelse af Massefylde 0,789
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin januar 2017 Institution HF & VUC København Syd Uddannelse Fag og niveau Lærer(e) Hold e-learningskemi C Kemi
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin januar 2017 Institution HF & VUC København Syd Uddannelse Fag og niveau Lærer(e) Hold e-learningskemi C Kemi
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Lærer(e) Hold Termin hvori undervisningen afsluttes: maj-juni 2014 Marie
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Lærer(e) Hold Termin hvori undervisningen afsluttes: maj-juni 2014 Marie
Opgave 1.1 1 KemiForlaget
 Opgave 1.1 Byg et monosaccharid Kulhydrat-molekylerne består af tre forskellige atomer : arbon, (sorte); ydrogen, (hvide), og Oxygen,O (røde). 1. Lav en ring af 5 -atomer og et O-atom. 2. Byg en gruppe
Opgave 1.1 Byg et monosaccharid Kulhydrat-molekylerne består af tre forskellige atomer : arbon, (sorte); ydrogen, (hvide), og Oxygen,O (røde). 1. Lav en ring af 5 -atomer og et O-atom. 2. Byg en gruppe
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2017, eksamen maj-juni 2017 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2017, eksamen maj-juni 2017 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Oversigt med forklaring over forskellige begreber
 Oversigt med forklaring over forskellige begreber fra www.michaelfynsk.dk Til dette dokument tilhører en mappe med filer bl.a..exe-,.pdf- og.jpg-filer. Side 1 af 19 Indholdsfortegnelse Brintbinding (hydrogenbinding)
Oversigt med forklaring over forskellige begreber fra www.michaelfynsk.dk Til dette dokument tilhører en mappe med filer bl.a..exe-,.pdf- og.jpg-filer. Side 1 af 19 Indholdsfortegnelse Brintbinding (hydrogenbinding)
Syre-base titreringer
 Syre-base titreringer Titrering: Er en analytisk metode til bestemmelse af mængden af et stof (A) i et kendt volumen af en opløsning. Metode: Et kendt volumen af opløsningen der indeholder A udtages. En
Syre-base titreringer Titrering: Er en analytisk metode til bestemmelse af mængden af et stof (A) i et kendt volumen af en opløsning. Metode: Et kendt volumen af opløsningen der indeholder A udtages. En
Helge Mygind Ole Vesterlund Niel sen Vibeke A xelsen. Notatark
 BASISKEMI C Helge Mygind Ole Vesterlund Niel sen Vibeke A xelsen Notatark HAAse & Søns forlag Helge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C. Notatark forfatterne og Haase & Søns Forlag
BASISKEMI C Helge Mygind Ole Vesterlund Niel sen Vibeke A xelsen Notatark HAAse & Søns forlag Helge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C. Notatark forfatterne og Haase & Søns Forlag
1. BESTEMMELSE AF KRYSTALVAND I KRYSTALSODA
 1. BESTEMMELSE AF KRYSTALVAND I KRYSTALSODA Formålet med denne øvelse er at bestemme indholdet af krystalvand i krystalsoda, som har den kemiske formel Na 2 CO 3 xh 2 O. Teori: En del ionforbindelser (salte)
1. BESTEMMELSE AF KRYSTALVAND I KRYSTALSODA Formålet med denne øvelse er at bestemme indholdet af krystalvand i krystalsoda, som har den kemiske formel Na 2 CO 3 xh 2 O. Teori: En del ionforbindelser (salte)
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Efterårssemester 2017, eksamen december 2017 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Efterårssemester 2017, eksamen december 2017 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Termin maj-juni 2013 Institution Uddannelse Fag og niveau Lærer(e) Hold Favrskov Gymnasium stx Kemi C Ruth Bluhm 2s Oversigt over gennemførte undervisningsforløb Titel 1 Grundstoffernes
Undervisningsbeskrivelse Termin maj-juni 2013 Institution Uddannelse Fag og niveau Lærer(e) Hold Favrskov Gymnasium stx Kemi C Ruth Bluhm 2s Oversigt over gennemførte undervisningsforløb Titel 1 Grundstoffernes
1. Skalmodellen, periodesystemet og kemisk binding. Øvelse: Kaliumnitrats opløselighed i vand
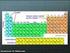 Mundtlig eksamen kemi C, 10. juni 2016 Hold: 2f ke. Antal elever til eksamen: 1 Lærer: Jørgen Mogensen 1. Skalmodellen, periodesystemet og kemisk binding. Øvelse: Kaliumnitrats opløselighed i vand Gør
Mundtlig eksamen kemi C, 10. juni 2016 Hold: 2f ke. Antal elever til eksamen: 1 Lærer: Jørgen Mogensen 1. Skalmodellen, periodesystemet og kemisk binding. Øvelse: Kaliumnitrats opløselighed i vand Gør
OPGAVER OM DANNELSE AF IONER. OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal.
 OPGAVE 3.1 OPGAVER OM DANNELSE AF IONER OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal. b. Angiv derefter hvor mange elektroner atomet skal optage
OPGAVE 3.1 OPGAVER OM DANNELSE AF IONER OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal. b. Angiv derefter hvor mange elektroner atomet skal optage
Spørgsmål 1 Carbonhydrider
 Nedenstående spørgsmål er med forbehold for censors godkendelse Spørgsmål 1 Carbonhydrider Der ønskes en gennemgang af udvalgte carbonhydriders opbygning og kemiske egenskaber. Du skal inddrage øvelsen:
Nedenstående spørgsmål er med forbehold for censors godkendelse Spørgsmål 1 Carbonhydrider Der ønskes en gennemgang af udvalgte carbonhydriders opbygning og kemiske egenskaber. Du skal inddrage øvelsen:
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Aurum KEMI FOR GYMNASIET 2 KIM RONGSTED KRISTIANSEN GUNNAR CEDERBERG
 Aurum KEMI FOR GYMNASIET 2 KIM RONGSTED KRISTIANSEN GUNNAR CEDERBERG Opgave 4.8 Brug tabellen over styrkeeksponenter til at finde pk S og pk B for følgende amfolytter, og afgør i hvert tilfælde, om amfolytten
Aurum KEMI FOR GYMNASIET 2 KIM RONGSTED KRISTIANSEN GUNNAR CEDERBERG Opgave 4.8 Brug tabellen over styrkeeksponenter til at finde pk S og pk B for følgende amfolytter, og afgør i hvert tilfælde, om amfolytten
KEMI C. Videooversigt
 KEMI C Videooversigt Afstemning og mængdeberegning... 2 Atomer og det periodiske system... 2 Forsøgsfilm... 2 Ioner og salte... 3 Molekyler... 3 Opløsninger og tilstandsformer... 3 Organisk kemi... 3 Redoxreaktioner...
KEMI C Videooversigt Afstemning og mængdeberegning... 2 Atomer og det periodiske system... 2 Forsøgsfilm... 2 Ioner og salte... 3 Molekyler... 3 Opløsninger og tilstandsformer... 3 Organisk kemi... 3 Redoxreaktioner...
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2019 Institution Den Jydske Haandværkerskole Uddannelse Fag og niveau Lærer(e) Hold EUX Kemi C Katya
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2019 Institution Den Jydske Haandværkerskole Uddannelse Fag og niveau Lærer(e) Hold EUX Kemi C Katya
Opgaver til: 6. Syrer og baser
 Opgaver til: 6. Syrer og baser 1. Færdiggør følgende syre-basereaktioner: a) HNO 3 + H 2 O b) H 2 SO 4 + H 2 O c) HNO 3 + NH 3 d) SO 2-3 + H 2O e) PO 3-4 + H 2O f) H 3 PO 4 + H 2 O g) O 2- + H 2 O h) CO
Opgaver til: 6. Syrer og baser 1. Færdiggør følgende syre-basereaktioner: a) HNO 3 + H 2 O b) H 2 SO 4 + H 2 O c) HNO 3 + NH 3 d) SO 2-3 + H 2O e) PO 3-4 + H 2O f) H 3 PO 4 + H 2 O g) O 2- + H 2 O h) CO
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Diana Christensen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Diana Christensen
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 10/11 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Flemming Madsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 10/11 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Flemming Madsen
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Skoleår 2015-2016, eksamen maj-juni 2016 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e) Hold
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Skoleår 2015-2016, eksamen maj-juni 2016 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e) Hold
Natriumchlorid... 62 Ioner... 63 Ionbinding... 66 Fleratomioner i knogler og tænder... 69 Ionforbindelser opløst i vand... 71 Opløselighed i vand...
 Natriumchlorid... 62 Ioner.... 63 Ionbinding... 66 Fleratomioner i knogler og tænder... 69 Ionforbindelser opløst i vand... 71 Opløselighed i vand.... 72 Saltes opløselighed i vand... 73 Fældningsreaktioner...
Natriumchlorid... 62 Ioner.... 63 Ionbinding... 66 Fleratomioner i knogler og tænder... 69 Ionforbindelser opløst i vand... 71 Opløselighed i vand.... 72 Saltes opløselighed i vand... 73 Fældningsreaktioner...
Spørgsmål 1 Den kemiske reaktion
 Spørgsmål 1 Den kemiske reaktion Med udgangspunkt i eksperimentet Fyrfadslys ønskes der en gennemgang af modellen reaktionskemaet. Du skal endvidere inddrage forskellige typer af kemiske reaktioner i din
Spørgsmål 1 Den kemiske reaktion Med udgangspunkt i eksperimentet Fyrfadslys ønskes der en gennemgang af modellen reaktionskemaet. Du skal endvidere inddrage forskellige typer af kemiske reaktioner i din
Eksamensspørgsmål til kecu eksamen sommer Spørgsmål
 Eksamensspørgsmål til kecu eksamen sommer 2019 Spørgsmål 1. og 18. Det periodiske system - ioner, herunder øvelsen Afbrænding af Mg 2. og 19. Ionforbindelser og fældningsreaktioner, herunder øvelsen Rensning
Eksamensspørgsmål til kecu eksamen sommer 2019 Spørgsmål 1. og 18. Det periodiske system - ioner, herunder øvelsen Afbrænding af Mg 2. og 19. Ionforbindelser og fældningsreaktioner, herunder øvelsen Rensning
Undervisningsbeskrivelse for STX 1m Kemi B
 Undervisningsbeskrivelse for STX 1m Kemi B Termin Afslutning i juni skoleår 15/16 Institution Marie Kruses Skole Uddannelse Fag og niveau Lærer(e) Hold STX Kemi B Hasse Bonde Rasmussen 1mKe Denne undervisningsbeskrivelse
Undervisningsbeskrivelse for STX 1m Kemi B Termin Afslutning i juni skoleår 15/16 Institution Marie Kruses Skole Uddannelse Fag og niveau Lærer(e) Hold STX Kemi B Hasse Bonde Rasmussen 1mKe Denne undervisningsbeskrivelse
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2019 Institution Den Jydske Haandværkerskole Uddannelse Fag og niveau Lærer(e) Hold EUX Kemi C Katya
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Juni 2019 Institution Den Jydske Haandværkerskole Uddannelse Fag og niveau Lærer(e) Hold EUX Kemi C Katya
1. OPVARMNING AF NATRIUMHYDROGENCARBONAT
 1. OPVARMNING AF NATRIUMHYDROGENCARBONAT At undersøge hvilken kemisk reaktion, der finder sted ved opvarmning af natriumhydrogencarbonat. Natriumhydrogencarbonat (natron) har formlen NaHCO 3 og er et fast
1. OPVARMNING AF NATRIUMHYDROGENCARBONAT At undersøge hvilken kemisk reaktion, der finder sted ved opvarmning af natriumhydrogencarbonat. Natriumhydrogencarbonat (natron) har formlen NaHCO 3 og er et fast
Test din viden D-forløb
 Test din viden D-forløb Har du styr på D-forløbets kernestof? Nu har du lært en masse om syrer og baser, ph-beregning og syre-basetitrering. Ved at lave opgaverne nedenfor finder du ud af, om der er nogle
Test din viden D-forløb Har du styr på D-forløbets kernestof? Nu har du lært en masse om syrer og baser, ph-beregning og syre-basetitrering. Ved at lave opgaverne nedenfor finder du ud af, om der er nogle
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2017 Institution Herning Hf og VUC Uddannelse Fag og niveau Lærer(e) Hold HFe Kemi C Nis Bærentsen
