Atomer, Elektroner & Andet Godt Kemi
|
|
|
- Ludvig Jessen
- 8 år siden
- Visninger:
Transkript
1 Atomer, Elektroner & Andet Godt Kemi Det Periodiske System Kemiske Forbindelser Reaktionsskemaer Alt levende og den materielle verden udgøres af stof, som kan omdannes ved kemiske reaktioner. Kemikeren udforsker og beskriver stoffets egenskaber og betingelserne for, at stofferne reagerer. Kemi spiller en stor rolle indenfor forståelse og udvikling af bl.a. bioteknologi, nanoteknologi, nye materialer, lægemidler og fødevareproduktion. Kemisk forskning spiller en afgørende rolle for det enkelte menneskes tilværelse og samfundets teknologiske og samfundsmæssige udvikling, og kemisk forskning har stor betydning for udvikling af bæredygtig teknologi. Kemisk viden og kreativitet finder positiv anvendelse til gavn for mennesker og natur. Observation Uhensigtsmæssig anvendelse af kemisk viden kan påvirke sundhed og miljø negativt. Model Teori Kemisk viden og forståelse udvikles gennem vekselvirkning mellem Observation & eksperimenter på den ene side, og modeller og teori på den anden. Eksperimenter
2 Indhold.. Atomet - alle tings moder.... Atomet bliver det mindst mulige!.... Thomson s Rosinbolle.... Planetmodellen..... Stakkels Einstein.... Elementarpartikler Skalmodellen Elektronkonfiguration Det Periodiske System.... Orbitaler Kemiske Tegnsprog Kemiske Reaktioner.... Reaktionsskemaer..... Tilstandsformer..... Formler og tilstandsformer.... Atomet - alle tings moder. For over 00 år siden begyndte vi mennesker at lede efter naturlige forklaringer på, hvad virkeligheden er opbygget af. Ifølge en af de tidligste ideer, er alt stof opbygget af fire elementer vand, jord, luft og ild. Faktisk ikke en helt tåbelig ide. Når træ brænder kan man jo se at Flammer, dvs. ild, forlader træet. Røg, dvs. en slags luft, forlader træet. ILD Træet tørrer, dvs. vand forlader træet, inden det brænder. LUFT Varm Tør JORD Efter forbrændingen er der kun aske, dvs., jord, tilbage. Fugtig VAND Kold Træ er altså tilsyneladende sammensat af fire elementer, og stof kan altså ifølge denne model omdannes til et andet stof ved at ændre på forholdet mellem dem. Fx skulle det så være muligt at fremstille guld af mindre kostbare stoffer. Og at i det mindste metalomdannelse var muligt - det kunne man observere. Blå vitriol er et krystallinsk stof som findes i naturen. Det er opløseligt i vand og når jern behandles med en vandig opløsning af blå vitriol, blev jernet omdannet til kobber. Forklaringen passede med tidens naturfilosofi, men har ikke hold i virkeligheden. Observationen er korrekt, men den rigtige forklaring kræver kendskab til elektroner og redoxkemi - et emne vi kommer til senere. Nå, det er historien om atomet vi skal i gang med.. Atomet bliver det mindst mulige! Ca. 00 f.kr. Antik atomisme - Empedokles og Demokrit Stof består af uforgængelige mindstedele eller byggestene - atomer. 80 Daltons atomteori og love for kemiske reaktioner. Atomer hørende til et bestemt grundstof er fuldstændig ens i enhver henseende alt stof består af atomer som er små udelelige partikler et grundstofs atomer er allesammen fuldstændig ens i enhver henseende og har ens egenskaber, f.eks. samme masse et grundstofs atomer kan ikke omdannes til et andet grundstofs atomer et grundstofs atomer er allesammen forskellige fra et andet stofs atomer kemiske forbindelser er et resultat af kombinationer af atomer af forskellige grundstoffer
3 . Thomson s Rosinbolle. One hundred years ago, amidst glowing glass tubes and the hum of electricity, the British physicist J.J. Thomson was venturing into the interior of the atom. At the Cavendish Laboratory at Cambridge University, Thomson was experimenting with currents of electricity inside empty glass tubes. Den dag (i 897) fandt Thomson elektronen - den elementarpartikel som limer kemiske forbindelser sammen. Og det var faktisk lidt af en bedrift - han fandt nemlig elektronen inde i atomet som man jo i tusinder af år havde troet var den mindste partikel!!! Thomsons atommodel kaldes "plumpudding-modellen" eller "rosinbollemodellen", hvor rosinerne repræsenterer negative ladninger i en positiv rumladning (dejen). Atomet er jo elektrisk neutralt, og når det indeholder negativ ladning, må det indeholde en lige så stor positiv ladning.. Planetmodellen. I 9 kom den moderne atomteori til forståelsen af, at massen i atomet ikke er jævnt fordelt, men koncentreret i kernen. De omkringliggende elektroner udgør under % af atomets samlede masse. Dette rystede rosinbollemodellen, hvor de negative elektroner er rosinerne i den positive dej. En ny opfattelse af atomet blev formuleret som en "planetmodel", hvor den tunge kerne er Solen, og elektronerne er de omkredsende planeter. Den engelske fysiker Ernst Rutherford opdagede planetmodelstrukturen ved at skyde tunge partikler mod et guldfolie.. Stakkels Einstein. I 9 modtog Niels Bohr (88-9) Nobelprisen i fysik for den atommodel, han havde lavet på baggrund af Rutherfords eksperimenter i 9. Det revolutionerende i modellen var, at elektronerne bevægede sig i faste baner. Bohr kunne ikke forklare, hvorfor elektronerne var i disse baner. I 90'erne og 0'erne udviklede andre fysikere Bohr's model til kvantemekanikken som siger at No longer did tiny particles have a definite position and speed. On the contrary, the more accurately you determined the particle's position, the less accurately you could determine its speed, and vice versa. Hvorfor så stakkels Einstein? Jo, Einstein brød sig overhovedet ikke om Bohrs model for hydrogen-atomet og kvantemekanikken. Einstein fandt dette utilfredsstillende og syntes, at kvantemekanikken ikke var perfekt. Han mente, at der manglede noget i beskrivelse, så tilfældigheden blev elimineret. Uenighed om Bohr's model kom til udtryk i følgende dialog mellem Bohr og Einstein Albert Einstein "Jeg tror ikke, at Gud spiller med terninger om universet." Niels Bohr "Lad være at fortælle Gud, hvad han gør og ikke gør". Bohr var hovedmanden bag den såkaldte "Københavnerfortolkning", der siger, at vi ikke kan sige, hvordan kvantevirkeligheden er, men blot hvordan vi kan beskrive den, som vi ser den. Vi må stille os tilfredse med, at beskrivelsen af kvantemekanikken indeholder tilfældigheder. Det siger ikke noget om, om verden grundlæggende er tilfældig, men kun noget om vores beskrivelse af den. Niels Bohr Elektronerne bevæger sig i faste baner om kernen i afstande svarende til bestemte energitilstande (kvantetilstand). Elektronernes kvantetilstande beskrives af den gren af fysikken som kaldes kvantemekanik.
4 . Elementarpartikler. Eksperimenter viste altså at atomet er opbygget af tre partikler - atomet er derfor ikke det mindst mulige. Da man antog at der ikke fandtes mindre partikler end disse tre, blev de benævnt elementarpartikler. Elementarpartiklernes egenskaber Proton Neutron Elektron Ladning +e 0 -e +,0. -9 C 0 -,0. -9 C Masse,007 u,0087 u,9. - u,7. -7 kg, kg 9,. - kg Elektronen er en negativt ladet elementarpartikel - den bevæger sig omkring kernen og har ladningen (elementarladningen ). Dens masse og størrelse er meget mindre end protonens og neutronens. Protonen blev opdaget i 88 af Goldstein og Wien (producerede stråler med positiv elektrisk ladning) men blev egentlig først erkendt som en del af atomkernen af Rutherford i perioden Neutronen blev opdaget af Chadwick i 9. Hovedsageligt fordi man var i stand til at måle masserne af atomkerner forholdsvis præcist, og masserne passede ikke sammen med antallet af protoner. Den opdagelse fik Werner Heisenberger (tysk fysiker) til at foreslå at atomkernen består af positivt ladede protoner og elektrisk neutrale neutroner. 7. Skalmodellen. Kvantemekaniken er en matematisk beskrivelse som angiver hvor sandsynligheden for at finde elektronerne er størst. Det viser sig at elektronerne befinder sig i en række skaller rundt om atomkernerne, og danner elektronskyer. Man kan sige at elektronskyerne repræsenterer de områder hvor sandsynligheden for at fine den elektron som svarer til skyens energiniveau er størst. Elektronerne bevæger sig ikke fra en sky til en anden uden videre, men bliver på det energiniveau som svarer til dens egen energi. 8. Elektronkonfiguration. Eller elektronstrukturen, er elektronernes fordeling omkring atomkernen. Man skal ikke forestille sig at opbygningen af atomet ser sådan ud - det er bare en bekvem model for beskrivelsen af et atoms opbygning. Skallerne i figuren svarer til energiniveauer i atomet, og de betegnes K, L, M, N, O, P etc. Niveauet nærmest kernen er det laveste energiniveau - figuren skitserer altså de fire laveste energiniveauer. Skallerne er desuden nummereret, og det har vist sig at det maksimale antal elektroner der er plads til i en skal, er
5 Max. antal elektroner i skal nr. n = n K-skal n = Højst elektroner L-skal n = Højst 8 elektroner M-skal n = Højst 8 elektroner N-skal n = Højst elektroner Man skriver elektronstrukturen for et atom således Na(,8, Elektronkonfiguationen er angivet i det periodiske system. 9. Det Periodiske System. Et grundstof er et kemisk stof, der udelukkende består af atomer med samme atomnummer (dvs. har samme antal protoner i kernen) for eksempel jern, der udelukkende består af jernatomer Fe, eller brom, der i ren form udelukkende består af molekyler med formlen Br. Vand derimod er en kemisk forbindelse bestående af molekyler, der er sammensat af flere forskellige atomer - et iltatom O og to brintatomer H (det giver i alt H O), så vand er ikke et grundstof. Atomer af samme grundstof, der indeholder forskellige antal af neutroner, kaldes for grundstoffets isotoper. Man kender 8 forskellige grundstoffer som alle har deres eget, unikke, kemiske symbol, der er gældende over hele verden, uanset hvad grundstoffet hedder på det enkelte sprog. Jern har symbolet Fe, også på dansk, og Natrium har symbolet Na, også i de engelsksprogede lande, hvor Na hedder "sodium". De tidligste forsøg på at ordne og gruppere grundstofferne blev gjort uden nogen viden om atomernes struktur og opbygning. Den tyske kemiker Johann Wolfgang Döbereiner forsøgte at finde en sammenhæng mellem forskellige grundstoffers atomvægt og deres kemiske egenskaber, og i 80'erne fandt han flere grupper af tre lignende grundstoffer, hvor et af stofferne kemisk var en mellemting mellem de to andre og havde en atomvægt, som lå midt imellem de to andres. Han kaldte disse grupper for triader. Da nye og mere rigtige oplysninger kom frem i 80'erne blev flere forskellige forskere interesserede i nye sammenhænge mellem atomvægt og kemiske egenskaber. I 8 opstillede den britiske kemiker John Alexander Reina Newlands en tabel med ud af de dengang kendte grundstoffer ordnet efter stigende atomvægt. Tabellen viste, at stoffer med lignende egenskaber gik igen med en periode på 7 eller stoffer, omtrent som oktaver i musikken. Endelig, i 89, sammenstillede russeren Dmitrij Mendelejev og tyskeren Lothar Meyer uafhængigt af hinanden tabeller med horisontale (vandrette) perioder og vertikale (lodrette) grupper på samme måde som vi nu er vant til at vise systemet. Meyer publicerede dog først sine resultater i 870. Mendelejevs tabel havde huller til yderligere grundstoffer, som ingen af de dengang kendte stoffer passede ind i. Hans idéer fik derfor stor opmærksomhed, da det i 87 opdagede stof gallium passede ind i et af disse huller. Da også stoffet strontium, som opdagedes i 879, og germanium, opdaget i 88, passede i mønsteret blev systemet bredt accepteret blandt andre videnskabsmænd. Det periodiske system er et system, der ordner de ikke-ioniserede grundstof-atomer efter antallet af protoner i kernen og antallet af elektroner i de yderste elektronskaller (egentlig orbitaler). Det periodiske system er inddelt i grupper (lodrette kolonner) og perioder (vandrette rækker). I hovedgrupperne (I, II, III, IV, V, VI, VII, VIII), er antallet af elektroner i den yderste skal lig med gruppenummeret. Dette er den vigtigste inddeling i det periodiske system. De kemiske egenskaber er hovedsagelig bestemt af den yderste elektron, og atomer med samme antal elektroner i yderste skal, ligner hinanden mht. både kemiske og fysiske egenskaber. Perioderne svarer til skalnummeret på den yderste skal som indeholder mindst én elektron. Selvom vandrette naboatomer ikke har samme antal elektroner i yderste skal, ligner de alligevel hinanden på nogle punkter.
6 Grundstoffernes periodiske system Gruppe I II IIIa IVa Va VIa VIIa VIIIa Ia IIa III IV V VI VII VIII Periode H He * Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Li Na K Rb Be Mg Ca Sr B Al Sc Y C Si Ti Zr N P V Nb O S Cr Mo F Cl Mn Tc Ne Ar Fe Ru Co Rh Ni Pd Cu Ag Zn Cd Ga In Ge Sn As Sb Se Te Br I Kr Xe 7 87 Fr 88 Ra * * Rf Db Sg 7 Bh 8 Hs 9 Mt Ds Rg Uub Uut Uuq Uup Uuh 7 Uus 8 Uuo Lanthanider * 7 La Actinider * 89 * Ac 8 9 Ce Pr 90 9 Th Pa 0 Nd 9 U Pm Sm Eu Gd Tb Np Pu Am Cm Bk Dy 98 Cf 7 Ho 8 Er 9 Tm 70 Yb 7 Lu 99 0 Es Fm Md No Lr Baggrundsfarverne afspejler hvilken kemisk serie grundstoffet tilhører Alkalimetaller Jordalkalimetaller Lanthanider Actinider Undergruppemetaller Andre metaller Halvmetaller Ikke-metaller Halogener Ædelgasser Ædelgasserne eller de ædle gasser (oprindeligt kaldt inerte gasser) udgør en kemisk serie bestående af grundstofferne i gruppe VIII i det periodiske system, d.v.s. grundstofferne helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe) og radon (Rn). Navnet ædelgas bunder i det faktum, at disse gasser, ligesom det gængse syn på "ædelhed", blot "sidder" uden at gøre noget, og undlader at reagere med de "almindelige" grundstoffer. Ædelgasserne blev tidligere kaldt for de inerte gasser ("ikke-reaktive gasser"), men dette udtryk er ikke længere helt korrekt, da man har vist, at nogle af ædelgasserne kan indgå i kemiske reaktioner. Netop på grund af ædelgassernes manglende reaktivitet blev deres eksistens først opdaget, da eksistensen af helium blev udledt hypotetisk ud fra en spektrografisk analyse af solen og senere bevist, da helium blev isoleret af William Ramsay. Ædelgasserne er de eneste grundstoffer, der optræder i naturen som frie enkeltatomer; alle andre grundstoffer optræder som molekyler eller ioner (for eksempel brommolekylet Br eller bromidionen Br - ). Ædelgasserne har alle otte elektroner i den yderste elektronskal og har svært ved at danne kemiske forbindelser. Tilsyneladende er et grundstof mest stabilt når det indeholder otte elektroner i den yderste skal (bortset fra H og He som kun kan have to elektroner i den yderste skal). Denne observation førte til en simpel tommelfingerregel (oktetreglen) for dannelse af kemiske forbindelser Atomer forsøger at danne kemiske forbindelser på en sådan måde at de hver har otte elektroner i den yderste skal, svarende til elektronkonfigurationen for en ædelgas. Molekyler og ioner er altså mest stabile når de har otte elektroner i den yderste skal. Ifølge oktetreglen dannes kemiske bindinger ved at atomer modtager eller afgiver elektroner og danner ioner, eller deler elektroner i elektronparbindinger (kovalente eller molekylbindinger). Oktetreglen kan bruges ved forbindelser mellem hovedgruppegrundstofferne. Det kemiske fællestræk for alkalimetallerne er, at de har én elektron i deres yderste skal svarende til hovedgruppe nummer I. Da atomer generelt "foretrækker" at have den yderste elektronskal fyldt op med elektroner ligesom ædelgasserne har det, er alkalimetallerne meget "ivrige" efter at slippe af med den enlige
7 elektron i den yderste skal og blive til en positiv ion. Sker det, er den yderste elektronskal "tømt" for elektroner, så nu fremtræder den fyldte, næst-yderste elektronskal som alkalimetal-atomets "nye" yderste elektronskal. Neutralt atom Li (,) Na (,8,) K (,8,8,) Ion Li + () Na + (,8) K + (,8,8) Reaktionsskemaet kan skrives Na Na + + e - Denne "iver" efter at komme af med elektronen i den yderste elektronskal gør alkalimetallerne meget reaktionsvillige; man finder dem aldrig som rent eller "frit" metal i naturen, men altid i kemiske forbindelser sammen med andre stoffer. Hvis man opbevarer et alkalimetal omgivet af almindelig atmosfærisk luft, iltes det meget hurtigt for at undgå dette opbevares alkalimetaller nedsænket i mineralsk olie, så luften ikke kan få adgang til metallet. Alkalimetaller reagerer også med vand, og danner derved gasformig brint samt et stærkt basisk hydroxid Betegnelsen "alkalimetaller" kommer af alkalisk, som er et ældre danske ord for basisk; alkalimetaller er "basiske metaller". Alkalimetallernes reaktioner med vand bliver mere voldsomme jo længere nede i det periodiske systems perioder alkalimetallet står Lithium får ganske langsomt et "overtræk" af bittesmå brintbobler, natrium og kalium "bruser" omtrent som man kender det fra brusetabletter, mens rubidium og cæsium eksploderer så snart de kommer i kontakt med vand! Selv om brint (hydrogen) også står i første hovedgruppe, kategoriseres dette grundstof som et ikke-metal. Det skyldes at brint på væsentlige punkter opfører sig anderledes end de andre grundstoffer i hovedgruppe Brint findes frit i naturen (især ude i verdensrummet), og danner molekyler "i par"; H noget som ingen af de øvrige hovedgruppe -stoffer kan. Men under ekstremt højt tryk, som man finder det dybt inde i planeten Jupiter, optræder brint som et metallisk stof, med kemiske egenskaber der "passer ind" i mønsteret for de øvrige alkalimetaller. Grundstofferne i hovedgruppe II kaldes Jordalkalimetaller. De kemiske stoffer i denne gruppe skaber normalt ioner med ladningen +. Forklar dette. Halogenerne (af græsk; "saltdannere"), er en kemisk serie af grundstoffer i det periodiske system, som omfatter hovedgruppe VII Fluor (F), Chlor (Cl), Brom (Br), Iod (I) og Astat (At). Dertil vil man muligvis i fremtiden kunne syntetisere enkelte atomer af et sjette grundstof, ununseptium, som formodentlig vil have kemiske egenskaber der kategoriserer det som et halogen. Halogener er stærkt reaktionsvillige stoffer, som bl.a. kan reagere med metaller og derved danne salte deraf navnet "saltdanner". Eksempelvis er det stof som de fleste forbinder med ordet "salt", nemlig natriumklorid, en kemisk forbindelse af halogenet chlor, og metallet natrium. I ren form og under normale tryk- og temperaturforhold optræder halogenerne som gasser af molekyler med to atomer i hver F Cl Br I At 7
8 Halogener mangler alle én elektron i deres yderste elektronskal for at opnå den blandt atomer "eftertragtede", helt fyldte yderste elektronskal Halogenerne er meget "ivrige" efter at skaffe sig en ekstra elektron, typisk ved at indgå i kemiske forbindelser med andre stoffer. Neutralt atom F (,7) Cl (,8,7) Br (,8,8,7) Ion F - (,8) Cl - (,8,8) Br - (,8,8,8) Reaktionsskemaet kan skrives Cl + e - Cl - Men da halogenerne kun findes som diatomige molekyler, er det mere korrekt at skrive Cl + e - Cl - Halogener kan gå i forbindelse med brint, og danner derved nogle ganske stærke syrer; flussyre (HI), saltsyre (HCl), bromsyre (HBr) og jodsyre (HI). Atomerne i hovedgruppe VI, laver helst ioner med ladningen -. Forklar dette.. Orbitaler. Kvantetal er ifølge Gads Fagleksikon Kemi (fremragende bog, men det har jeg vist allerede nævnt), "tal der karakteriserer en elektrons tilstand i elektronstrukturen omkring en atomkerne".. Hovedkvantetal = skalnummer, angiver hovedenerginiveauet for elektronen.. Bikvantetal = orbitalnummer, angiver orbitalens form (elektronskyens form/udstrækning).. Magnetisk kvantetal man kan forestille sig at elektronerne har en magnetisk nordpol og sydpol. Det magnetiske kvantetal angiver om nordpolen vender op eller ned.. Spinkvantetal her kan man forestille sig elektronerne som roterende magneter og spinkvantetallet angiver da omdrejningsretningen. Det er naturligvis meget korte forklaringer, men den rigtige forklaring hører til på den anden side af Kemi A. For elektroner i atomer gælder der følgende Elektroner vil gerne være sammen og. Men der kan ikke være mere end elektroner i én orbital. Ingen elektroner vil have samme kombination af kvantetal (Pauli-Princippet). Her kan du se en selektion af orbitalers fysiske form. Hvis det ikke er nok, kan du prøve dette link til Grand Orbital Table, hvor du også kan finde et program til at beregne og tegne dine egne orbitaler. 8
9 Derfor underinddeles p,d og f orbitalerne så der er p-orbitaler med ialt. = elektroner d-orbitaler med ialt. = elektroner 7 f-orbitaler med ialt 7. = elektroner Skallerne indeholder derfor K s orbital med højest elektroner L s og p orbital med højest + = 8 elektroner M s, p og d orbital med højest + + = 8 elektroner N s, p, d og f orbital med højest = elektroner Grundstof Atomnummer H He Li Be B C N O F K L M Antal elektroner i skal N s p d f s p d f s P d f s p d f s p d f s p d f s p d F Ne Na Mg Al Si P S Cl 7 Ar 8 K Ca Se Br 9 0 Kr Rb Sr Te I 7 8 O P 7 Q Xe Cs Ba Po At 8 8 Rn 8 Fr Ra Hver gang en orbital fyldes op med elektroner, vil atomerne forsøge at få det størst mulige antal uparrede elektroner (Hund's Regel). Dvs., først når orbitalen er fyldt halvt op, dannes der elektronpar. Man opskriver nu elektronkonfigurationen for et atom som vist her Br(s s p s p d s p ).. Kemiske Tegnsprog. Alt stof er opbygget af knap 0 forskellige atomer som symboliseres vha. bogstaver, f.eks. => I det periodiske system er alle grundstoffer opskrevet som enkeltatomer. Et atom er "den mindste del et stof der kan eksistere", ifølge Gads Fagleksikon Kemi*. En del grundstoffer findes ikke som enkelte atomer i naturen - de vil gerne bindes sammen i molekyler H = Hydrogen Ar = Argon C = Carbon O = Oxygen S = Svovl Cl = Chlor Na = Natrium Fe = jern Au = Guld 9
10 Et molekyle "består af det mindste antal ens eller forskellige atomer i en kemisk forbindelse". Molekylformlen angiver det mindste antal af hvert atom som indgår i den kemiske forbindelse, fx => H = Hydrogenmolekyle P = Fosformolekyle O = Oxygenmolekyle S 8 = Svovlmolekyle HCl = Hydrogenchlorid NO = Nitrogenoxid H O = Vand CO = carbondioxid En kemisk formel læses oxygenmolekyle O oxygenatomer hydrogenmolekyler H *= hydrogenatomer vandmolekyler H O oxygenatome *= hydrogenatomer Et oxygenmolekyle består af oxygenatomer To hydrogenmolekyler består af hydrogenatomer hver og der er ialt hydrogenatomer. vandmolekyler består hver af hydrogenatomer og oxygenatomer. Der er ialt hydrogenatomer og oxygenatomer i vandmolekyler. Tallet foran formlen fortæller altså hvor mange enheder der er af et stof, og tallet i nederste højre hjørne af stofsymbolet angiver hvor mange af netop det atom der indgår i én formelenhed.. Kemiske Reaktioner. hydrogenmolekyler reagerer med et oxygenmolekyle og danner vandmolekyler som vist til højre => Kemiske reaktioner beskrives vha. reaktionsskemaer H + H + O H O + H O + som normalt trækkes sammen til H + O H O Reaktionsskemaet fortæller Hvilke molekyler reagerer (reaktanter H og O ) Hvilke molekyler bliver dannet (produkter H O) Hvor meget af hver reaktant forbruges ( H og O ) Hvor meget af hvert produkt dannes ( H O) Tallene foran molekylsymbolet angiver antallet af molekyler som indgår i reaktionen. Hvis kun et molekyle (eller atom) indgår, skrives det ikke. Disse tal kaldes reaktionsskemaets koefficienter. og med symboler + Pilen kaldes en reaktionspil og angiver at reaktanterne omdannes til produkter og at reaktionen forløber fra venstre mod højre Reaktanter Produkter. Reaktionsskemaer. Reaktionsskemaet angiver altså hvilke stoffer der indgår i en reaktion, og kan angive i hvilket forhold stofferne reagerer - nemlig når reaktionsskemaet er afstemt. Eksempel på afstemning af reaktionsskema - hydrogen og oxygen reagerer og danner vand.. Hvilke stoffer indgår og hvad er de korrekte formler for disse stoffer o Hydrogen = H o Oxygen = O o Vand = H O
11 Kemiske grundlove Ved en kemisk reaktion kan der ikke forsvinde atomer eller dannes nye atomer - stofmængden er bevaret under en kemisk reaktion. Antallet af hver slags atomer som indgår i en reaktion, er det samme før og efter reaktionen Den samlede masse er den samme før og efter en reaktion Og desuden er summen af ladningerne den samme før og efter en reaktion, hvis der indgår ioner i en reaktion. Dvs. at hvis vi ved Hvilke stoffer der reagerer (reaktanter) Hvilke stoffer der dannes (produkter) Hvor mange reaktantatomer (eller molekyler) der indgår i en reaktion så kan vi regne ud hvor mange produktatomer og produktmolekyler der dannes. Eksemplet til højre illustrerer en nem metode til at holde styr på alle atomer og molekyler - eksemplet er simpelt og det kan godt være at du har overblik over alle atomerne, men øv dig alligevel på at bruge metoden. Det er en god rutine hvis reaktionen bliver mere kompliceret.. Opskriv reaktanterne på venstre side og produkterne på højre side af en reaktionspil, og lav et skema under reaktionsskemaet, med hver type atom som indgår.. Tæl antalllet af hvert atomtype på begge sider af reaktionspilen. H + O H O H 0 O 0. I dette tilfælde er der H-atomer og O-atomer på reaktantsiden.. På produktsiden skal der kun bruges O-atom.. For at få antallet til at passe ganger man antallet af H 0 molekyler med. H + O H O H 0. = O 0. = 7. Nu passer antallet af O-atomer på begge sider, men der er for mange H-atomer på produktsiden. For at få overensstemmelse, må vi derfor gange antallet af H molekyler på venstre side med H + O H O H. = 0. = O 0. = 8. Der er nu lige mange af hver slags atomer på begge sider af reaktionspilen, og reaktionsskemaet angiver nu at hydrogenmolekyler reagerer med oxygenmolekyle og danner vandmolekyler. 9. Tallene foran molekylsymbolerne kaldes koefficienterne, og forholdet mellem dem angiver i hvilket forhold stoffer reagerer med hinanden Forholdet mellem koefficienterne er => H, O og H O reagerer med hinanden i forhold.. Tilstandsformer. Gasfase Et enkelt vandmolekyle i gasfasen, består af hydrogen og et oxygenmolekyle bundet sammen af kovalente bindinger. De enkelte molekyler er langt fra hinanden - meget længere end bindingslængderne mellem H og O atomerne. Der er ingen vekselvirkning mellem molekylerne som derfor opfører sig som en ideal gas.
12 Flydende fase I den flydende fase er molekylerne så tæt på hinanden at de påvirker hinanden. Pga. elektronegativitetsforskellen er H atomet (med den laveste elektronegativitet) lidt mere positivt ladet end oxygenatomet. Molekylerne vil derfor orientere sig sådan at H- atomerne peger mod O- atomerne i nabomolekyler. Fast fase I den faste fase er moleylerne endnu tættere på hinanden, og bevæger sig ikke ret meget (vibrerer). Molekylerne har lagt sig i et -dimensionelt mønster (gitter) som er bestemt af ladningsforskydningen i molekylerne.??? Diagrammet herover viser vands tilstandsform ved forskellige temperaturer, og desuden er angivet navnene på de processer som fører fra én tilstand (eller fase) til en anden. Forklar hvad der sker under hver af processerne angivet med pile. Forklar ligeledes den indbyrdes temperaturbeliggenhed af de tre tilstandsformer i diagrammet. De tilstandsformer af hhv. H O og NaCl er illustreret på Fronter. Chime skal være installeret for at bruge websiderne.
13 . Formler og tilstandsformer. Kemiske forbindelser kan være faste, flydende og gasformige og når et fast stof opløses i vand, siges saltet at være på vandig form. Et stofs tilstandsform angives efter stoffets formel, med følgende betegnelser Vandige opløsninger er egentlig ikke en tilstandsform da opløsningerne er flydende og egentlig burde betegnes (l), men der er ikke tale om et rent stof og det er derfor vedtaget at angive at et stof er opløst i vand, med betegnelsen (aq) efter formlen. (s) (l) (g) s = solidus, solid, fast stof. Eks. NaCl(s) er fast NaCl. l = liquidus, liquid, flydende stof. Eks. PbBr (l) er flydende PbBr. g = gas. Eks. I (g) er I gas (eller damp). Opløsning af fast salt, NaCl i vand skrives derfor NaCl(s) + H O(l) Na + (aq) + Cl - (aq) (aq) aq = aqua, aqueous, vandig opløsning. Eks. AgNO (aq) er en vandig opløsning af AgNO.
DET PERIODISKE SYSTEM
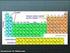 DET PERIODISKE SYSTEM Tilpasset efter Chemistry It s Elemental! Præsentation fra the American Chemical Society, Aug. 2009 http://portal.acs.org/portal/publicwebsite/education/outreach/ncw/studentseducators/cnbp_023211
DET PERIODISKE SYSTEM Tilpasset efter Chemistry It s Elemental! Præsentation fra the American Chemical Society, Aug. 2009 http://portal.acs.org/portal/publicwebsite/education/outreach/ncw/studentseducators/cnbp_023211
Atomets bestanddele. Indledning. Atomer. Atomets bestanddele
 Atomets bestanddele Indledning Mennesket har i tusinder af år interesseret sig for, hvordan forskellige stoffer er sammensat I oldtiden mente man, at alle stoffer kunne deles i blot fire elementer eller
Atomets bestanddele Indledning Mennesket har i tusinder af år interesseret sig for, hvordan forskellige stoffer er sammensat I oldtiden mente man, at alle stoffer kunne deles i blot fire elementer eller
Atomer er betegnelsen for de kemisk mindste dele af grundstofferne.
 Atomets opbygning Atomer er betegnelsen for de kemisk mindste dele af grundstofferne. Guldatomet (kemiske betegnelse: Au) er f.eks. det mindst stykke metal, der stadig bærer navnet guld, det kan ikke yderlige
Atomets opbygning Atomer er betegnelsen for de kemisk mindste dele af grundstofferne. Guldatomet (kemiske betegnelse: Au) er f.eks. det mindst stykke metal, der stadig bærer navnet guld, det kan ikke yderlige
IONER OG SALTE. Et stabilt elektronsystem kan natrium- og chlor-atomerne også få, hvis de reagerer kemisk med hinanden:
 IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler
 Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
Sporgrundstof definition:
 Forelæsning Sporgrundstoffer: fordeling, substitution og klassifikation Forelæsning: Hvad er et sporgrundstof? Grundstoffers elektronkonfiguration og radius Det Periodiske System Goldschmidts regler for
Forelæsning Sporgrundstoffer: fordeling, substitution og klassifikation Forelæsning: Hvad er et sporgrundstof? Grundstoffers elektronkonfiguration og radius Det Periodiske System Goldschmidts regler for
Lim mellem atomerne Ny Prisma Fysik og kemi 8. Skole: Navn: Klasse:
 Lim mellem atomerne Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: Opgave 1 Her ser du en modeltegning af et atom. Hvilket atom forestiller modellen? Der er 5 svarmuligheder. Sæt et kryds. Et oxygenatom
Lim mellem atomerne Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: Opgave 1 Her ser du en modeltegning af et atom. Hvilket atom forestiller modellen? Der er 5 svarmuligheder. Sæt et kryds. Et oxygenatom
Skriftlig prøve i kursus 26173/F14 Side 1 af 15 UORGANISK KEMI Torsdag den 22. maj 2014
 Skriftlig prøve i kursus 26173/F14 Side 1 af 15 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for He, Se, Cr 3+ og F. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Skriftlig prøve i kursus 26173/F14 Side 1 af 15 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for He, Se, Cr 3+ og F. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Opgaver i atomer. c) Aflæs atommassen for Mg i det periodiske system eller på de udskrevne ark, og skriv det ned.
 Opgaver i atomer Opgave 1 Tegn atomerne af nedenstående grundstoffer på samme måde, som det er vist for andre atomer i timen. Angiv protoner med plusser. Vedrørende elektroner: Husk, at der maksimalt kan
Opgaver i atomer Opgave 1 Tegn atomerne af nedenstående grundstoffer på samme måde, som det er vist for andre atomer i timen. Angiv protoner med plusser. Vedrørende elektroner: Husk, at der maksimalt kan
maj 2017 Kemi C 326
 Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Folkeskolens afgangsprøve Maj-juni 2006 Fysik / kemi - Facitliste
 Folkeskolens afgangsprøve Maj-juni 2006 1/25 Fk5 Opgave 1 / 20 (Opgaven tæller 5 %) I den atommodel, vi anvender i skolen, er et atom normalt opbygget af 3 forskellige partikler: elektroner, neutroner
Folkeskolens afgangsprøve Maj-juni 2006 1/25 Fk5 Opgave 1 / 20 (Opgaven tæller 5 %) I den atommodel, vi anvender i skolen, er et atom normalt opbygget af 3 forskellige partikler: elektroner, neutroner
Vikar-Guide. Den elektriske ladning af en elektron er -1 elementarladning, og den elektriske ladning af protonen er +1 elementarladning.
 Vikar-Guide Fag: Klasse: OpgaveSæt: Fysik/Kemi 9. klasse Atomernes opbygning 1. Fælles gennemgang: Eleverne skal løse opgaverne i små grupper på 2-3 personer. De skal bruge deres grundbog, og alternativt
Vikar-Guide Fag: Klasse: OpgaveSæt: Fysik/Kemi 9. klasse Atomernes opbygning 1. Fælles gennemgang: Eleverne skal løse opgaverne i små grupper på 2-3 personer. De skal bruge deres grundbog, og alternativt
Skriftlig prøve i kursus 26173/E15 Side 1 af 14 UORGANISK KEMI Fredag den 18. december 2015
 Skriftlig prøve i kursus 26173/E15 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for C, P, Zn 2+ og I. 2% 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Skriftlig prøve i kursus 26173/E15 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for C, P, Zn 2+ og I. 2% 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Naturfag for skov- og gartnerholdet
 Naturfag for skov- og gartnerholdet Grundlæggende kemi -Gennemgang af forskellige stoffers egenskaber og anvendelighed indenfor gartneri, anlægsgartneri og skovbrug 1 www.ucholstebro.dk. Døesvej 70 76.
Naturfag for skov- og gartnerholdet Grundlæggende kemi -Gennemgang af forskellige stoffers egenskaber og anvendelighed indenfor gartneri, anlægsgartneri og skovbrug 1 www.ucholstebro.dk. Døesvej 70 76.
Skriftlig prøve i kursus 26173/E14 Side 1 af 14 UORGANISK KEMI Fredag den 19. december 2014
 Skriftlig prøve i kursus 26173/E14 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for O, Al, Fe 3+ og Br. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Skriftlig prøve i kursus 26173/E14 Side 1 af 14 Opgave 1. Molekylorbitalteori 1.1 Angiv elektronkonfigurationer for O, Al, Fe 3+ og Br. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for
Opgave: Du skal udfylde de manglende felter ud fra den information der er givet
 pgave 1a.01 Brug af det periodiske system pgave: Du skal udfylde de manglende felter ud fra den information der er givet Eks: I rubrik 1 kendte vi grundstof nummeret (nr. 11). Ved brug af det periodiske
pgave 1a.01 Brug af det periodiske system pgave: Du skal udfylde de manglende felter ud fra den information der er givet Eks: I rubrik 1 kendte vi grundstof nummeret (nr. 11). Ved brug af det periodiske
Molekyler & Mere Godt Kemi
 Molekyler & Mere Godt Kemi Elektronparbindinger Molekylgeometri Elektronegativitet Ethanol Buchminster Fulleren Carbondioid Asbest influenza vaccine Diamant Indhold. 1. Molekyler og Kovalente Bindinger....
Molekyler & Mere Godt Kemi Elektronparbindinger Molekylgeometri Elektronegativitet Ethanol Buchminster Fulleren Carbondioid Asbest influenza vaccine Diamant Indhold. 1. Molekyler og Kovalente Bindinger....
Opgave. Navn Kemi opgaver Klasse Side 1 af 7. Hvad kaldes elementarpartiklerne, angiv deres ladning
 Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
10. juni 2016 Kemi C 325
 Grundstoffer og Det Periodiske System Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Forklar hvad der forstås med begrebet grundstoffer kontra kemiske forbindelser. Atomer er placeret
Grundstoffer og Det Periodiske System Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Forklar hvad der forstås med begrebet grundstoffer kontra kemiske forbindelser. Atomer er placeret
Navn Kemi opgaver Klasse 9. b Side 1 af 9. Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen sammen?
 Klasse 9. b Side 1 af 9 Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Klasse 9. b Side 1 af 9 Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Mundtlige eksamensopgaver
 Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse 1 Stoffers blandbarhed og det periodiske system 2 Stoffers blandbarhed og elektronparbindingen 3 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2017, Kec126 (NB). Med forbehold for censors godkendelse 1 Stoffers blandbarhed og det periodiske system 2 Stoffers blandbarhed og elektronparbindingen 3 Redoxreaktioner, spændingsrækken
Forelæsning 8. Stabile isotoper. Iltisotoper anvendt i paleoklimastudier, magmadannelse, termometri, vand-bjergart reaktion.
 Forelæsning: Hvad er stabile isotoper? Forelæsning 8 Stabile isotoper Fraktionering af stabile isotoper Iltisotoper Termometri Vand-bjergart reaktion Øvelse: Iltisotoper anvendt i paleoklimastudier, magmadannelse,
Forelæsning: Hvad er stabile isotoper? Forelæsning 8 Stabile isotoper Fraktionering af stabile isotoper Iltisotoper Termometri Vand-bjergart reaktion Øvelse: Iltisotoper anvendt i paleoklimastudier, magmadannelse,
Guldbog Kemi C Copyright 2016 af Mira Backes og Christian Bøgelund.
 Guldbog Kemi C Copyright 2016 af Mira Backes og Christian Bøgelund. Alle rettigheder forbeholdes. Mekanisk, fotografisk eller elektronisk gengivelse af denne bog eller dele heraf er uden forfatternes skriftlige
Guldbog Kemi C Copyright 2016 af Mira Backes og Christian Bøgelund. Alle rettigheder forbeholdes. Mekanisk, fotografisk eller elektronisk gengivelse af denne bog eller dele heraf er uden forfatternes skriftlige
Eksamensspørgsmål Kemi C, 2015, Kec124 (NB).
 Eksamensspørgsmål Kemi C, 2015, Kec124 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, spændingsrækken
Eksamensspørgsmål Kemi C, 2015, Kec124 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, spændingsrækken
Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron. En hydron er en H +
 Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron En hydron er en H + Ved en syrebasereaktion overføres der en hydron fra en syre til en base En syre indeholder
Definition af base (Brøndsted): En base er et molekyle eller en jon, der kan optage en hydron En hydron er en H + Ved en syrebasereaktion overføres der en hydron fra en syre til en base En syre indeholder
OPGAVER OM DANNELSE AF IONER. OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal.
 OPGAVE 3.1 OPGAVER OM DANNELSE AF IONER OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal. b. Angiv derefter hvor mange elektroner atomet skal optage
OPGAVE 3.1 OPGAVER OM DANNELSE AF IONER OPGAVE 3.1.A a. For hvert af grundstofferne herunder, skal du angive fordelingen af elektroner i hver skal. b. Angiv derefter hvor mange elektroner atomet skal optage
Intra- og intermolekylære bindinger.
 Intra- og intermolekylære bindinger. Dipol-Dipol bindinger Londonbindinger ydrogen bindinger ydrofil ydrofob 1. Tilstandsformer... 1 2. Dipol-dipolbindinger... 2 3. Londonbindinger... 2 4. ydrogenbindinger....
Intra- og intermolekylære bindinger. Dipol-Dipol bindinger Londonbindinger ydrogen bindinger ydrofil ydrofob 1. Tilstandsformer... 1 2. Dipol-dipolbindinger... 2 3. Londonbindinger... 2 4. ydrogenbindinger....
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Med forbehold for censors kommentarer. Eksamensspørgsmål Kemi C, 2014, Kec223 (NB).
 Med forbehold for censors kommentarer Eksamensspørgsmål Kemi C, 2014, Kec223 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer
Med forbehold for censors kommentarer Eksamensspørgsmål Kemi C, 2014, Kec223 (NB). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer
Torben Rosenørn. Aalborg Universitet. Campus Esbjerg
 Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
Skriftlig prøve i kursus 26173/E12 Side 1 af 14 UORGANISK KEMI Tirsdag den 18. december 2012
 Skriftlig prøve i kursus 26173/E12 Side 1 af 14 Opgave 1. 1.1 Angiv elektronkonfigurationer for N, Al 3+, Mn og Zn 2+. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for Ne 2. 4 % b) Angiv
Skriftlig prøve i kursus 26173/E12 Side 1 af 14 Opgave 1. 1.1 Angiv elektronkonfigurationer for N, Al 3+, Mn og Zn 2+. 1.2 Molekylorbitalteori. a) Skitser molekylorbitaldiagrammet for Ne 2. 4 % b) Angiv
3HCl + Al AlCl3 + 3H
 For at du kan løse denne opgave, og få helt styr på det med reaktionsligninger, er du nødt til at lave forløbet om Ion-bindinger først. Hvis du er færdig med det forløb, så kan du bare fortsætte. Har du
For at du kan løse denne opgave, og få helt styr på det med reaktionsligninger, er du nødt til at lave forløbet om Ion-bindinger først. Hvis du er færdig med det forløb, så kan du bare fortsætte. Har du
Salte, Syre og Baser
 Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
Big Bang og universets skabelse (af Jeanette Hansen, Toftlund Skole)
 Big Bang og universets skabelse (af Jeanette Hansen, Toftlund Skole) Har du nogensinde tænkt på, hvordan jorden, solen og hele universet er skabt? Det er måske et af de vigtigste spørgsmål, man forsøger
Big Bang og universets skabelse (af Jeanette Hansen, Toftlund Skole) Har du nogensinde tænkt på, hvordan jorden, solen og hele universet er skabt? Det er måske et af de vigtigste spørgsmål, man forsøger
Atomets opbygning. Keminote 2010
 Atomets opbygning Oprindelig forestillede man sig, at atomet var en lille kugle, som ikke kunne deles i mindre dele. Ordet atom kommer af det græske ord atomos, som betyder udelelig. Fra slutningen af
Atomets opbygning Oprindelig forestillede man sig, at atomet var en lille kugle, som ikke kunne deles i mindre dele. Ordet atom kommer af det græske ord atomos, som betyder udelelig. Fra slutningen af
Fysikforløb nr. 6. Atomfysik
 Fysikforløb nr. 6. Atomfysik I uge 8 begynder vi på atomfysik. Derfor får du dette kompendie, så du i god tid, kan begynde, at forberede dig på emnet. Ideen med dette kompendie er også, at du her får en
Fysikforløb nr. 6. Atomfysik I uge 8 begynder vi på atomfysik. Derfor får du dette kompendie, så du i god tid, kan begynde, at forberede dig på emnet. Ideen med dette kompendie er også, at du her får en
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017
 EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold
 Københavns Universitet Saxkøbing, Vintermøde Roedyrkning: Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold Søren Husted, 5 Februar, 2019 Agenda: 9:35 10:15 De essentielle næringsstoffer og roedyrkning
Københavns Universitet Saxkøbing, Vintermøde Roedyrkning: Mikronæringsstoffer og Roedyrkning - vækst og sukkerindhold Søren Husted, 5 Februar, 2019 Agenda: 9:35 10:15 De essentielle næringsstoffer og roedyrkning
Nr. 6-2007 Grundstoffernes historie Fag: Fysik A/B/C Udarbejdet af: Michael Bjerring Christiansen, Århus Statsgymnasium, november 2008
 Nr. 6-007 Grundstoffernes historie Fag: Fysik A/B/C Udarbejdet af: Michael Bjerring Christiansen, Århus Statsgymnasium, november 008 Spørgsmål til artiklen. Hvilket grundstof, mente Hans Bethe, var det
Nr. 6-007 Grundstoffernes historie Fag: Fysik A/B/C Udarbejdet af: Michael Bjerring Christiansen, Århus Statsgymnasium, november 008 Spørgsmål til artiklen. Hvilket grundstof, mente Hans Bethe, var det
NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10
 NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10 Elevens navn: CPR-nr.: Skole: Klasse: Tilsynsførendes navn: 1 Tilstandsformer Tilstandsformer Opgave 1.1 Alle stoffer har 3 tilstandsformer.
NATURFAG Fysik/kemi Folkeskolens afsluttende prøver Terminsprøve 2009/10 Elevens navn: CPR-nr.: Skole: Klasse: Tilsynsførendes navn: 1 Tilstandsformer Tilstandsformer Opgave 1.1 Alle stoffer har 3 tilstandsformer.
Oversigt med forklaring over forskellige begreber
 Oversigt med forklaring over forskellige begreber fra www.michaelfynsk.dk Til dette dokument tilhører en mappe med filer bl.a..exe-,.pdf- og.jpg-filer. Side 1 af 19 Indholdsfortegnelse Brintbinding (hydrogenbinding)
Oversigt med forklaring over forskellige begreber fra www.michaelfynsk.dk Til dette dokument tilhører en mappe med filer bl.a..exe-,.pdf- og.jpg-filer. Side 1 af 19 Indholdsfortegnelse Brintbinding (hydrogenbinding)
Grundstoffer og det periodiske system
 Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Forløbet består af 5 fagtekster, 19 opgaver og 4 aktiviteter. Derudover er der Videnstjek.
 Atommodeller Niveau: 9. klasse Varighed: 8 lektioner Præsentation: I forløbet Atommodeller arbejdes der med udviklingen af atommodeller fra Daltons atomteori fra begyndesen af det 1800-tallet over Niels
Atommodeller Niveau: 9. klasse Varighed: 8 lektioner Præsentation: I forløbet Atommodeller arbejdes der med udviklingen af atommodeller fra Daltons atomteori fra begyndesen af det 1800-tallet over Niels
En lille verden Ny Prisma Fysik og kemi 8. Skole: Navn: Klasse:
 En lille verden Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: For at løse nogle af opgaverne skal du benytte Nuklidtabel A og B på kopiark 6.4 og 6.5 i Kopimappe B, Ny Prisma 8. Opgave 1 Et atom består
En lille verden Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: For at løse nogle af opgaverne skal du benytte Nuklidtabel A og B på kopiark 6.4 og 6.5 i Kopimappe B, Ny Prisma 8. Opgave 1 Et atom består
Kemiske bindinger. Præsentation: Niveau: 8. klasse. Varighed: 7 lektioner
 Kemiske bindinger Niveau: 8. klasse Varighed: 7 lektioner Præsentation: Forløbet Kemiske bindinger omhandler ionbindinger, kovalente bindinger, metalbindinger, polære kovalente bindinger, hydrogenbindinger
Kemiske bindinger Niveau: 8. klasse Varighed: 7 lektioner Præsentation: Forløbet Kemiske bindinger omhandler ionbindinger, kovalente bindinger, metalbindinger, polære kovalente bindinger, hydrogenbindinger
Test din viden E-forløb
 OPGAVE E8 Test din viden E-forløb Har du styr på E-forløbets kernestof? Nu har du lært en masse om spændingsrækken og redoxreaktioner. Ved at lave opgaverne nedenfor finder du ud af, om der er nogle områder,
OPGAVE E8 Test din viden E-forløb Har du styr på E-forløbets kernestof? Nu har du lært en masse om spændingsrækken og redoxreaktioner. Ved at lave opgaverne nedenfor finder du ud af, om der er nogle områder,
I forløbet Atomet arbejdes med atomets opbygning. Forløbet består af 5 fagtekster, 31 opgaver og 8 aktiviteter. Derudover er der Videnstjek.
 Atomet Niveau: 8. klasse Varighed: 5 lektioner Præsentation: I forløbet Atomet arbejdes med atomets opbygning. Forløbet består af 5 fagtekster, 31 opgaver og 8 aktiviteter. Derudover er der Videnstjek.
Atomet Niveau: 8. klasse Varighed: 5 lektioner Præsentation: I forløbet Atomet arbejdes med atomets opbygning. Forløbet består af 5 fagtekster, 31 opgaver og 8 aktiviteter. Derudover er der Videnstjek.
Densitet (også kendt som massefylde og vægtfylde) hvor
 Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Fysik og kemi i 8. klasse
 Fysik og kemi i 8. klasse Teori til fysik- og kemiøvelserne ligger på nettet: fysik8.dk Udgivet af: Beskrivelser af elevforsøg Undervisningsforløb om atomfysik, mål & vægt, hverdagskemi, sæbe, metaller,
Fysik og kemi i 8. klasse Teori til fysik- og kemiøvelserne ligger på nettet: fysik8.dk Udgivet af: Beskrivelser af elevforsøg Undervisningsforløb om atomfysik, mål & vægt, hverdagskemi, sæbe, metaller,
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Platin komplekser i kampen mod kræft. Koordinationskemi i aktion. cis-ptcl 2 (NH 3 ) 2. Essentiel, nyttig eller toxisk. Hvad der faktisk skete
 Platin komplekser i kampen mod kræft et eksempel på Koordinationskemi i aktion Pt DNA DK 1 Har som den eneste vundet Tour de France syv gange (fra 1999 til 2005) Lance Armstrong blev vist født på en cykel
Platin komplekser i kampen mod kræft et eksempel på Koordinationskemi i aktion Pt DNA DK 1 Har som den eneste vundet Tour de France syv gange (fra 1999 til 2005) Lance Armstrong blev vist født på en cykel
Eksamensopgaverne offentliggøres selvfølgelig med det forbehold, at censor kan komme med ændringsforslag.
 VUC Århus, 17. maj. 2011 Kære alle kursister på holdene ke02da1c (kemi C flex, helårsholdet) og ke05da1c (kemi C flex, halvårsholdet) På de næste mange sider vil I kunne se Jeres kommende eksamensopgaver
VUC Århus, 17. maj. 2011 Kære alle kursister på holdene ke02da1c (kemi C flex, helårsholdet) og ke05da1c (kemi C flex, halvårsholdet) På de næste mange sider vil I kunne se Jeres kommende eksamensopgaver
Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse:
 Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse: Opgave 1 Et metal er kendetegnet ved, at nogle af metallets elektroner danner en elektrongas. Her er en række udsagn om, hvad et
Jordens skatte Ny Prisma Fysik og kemi 9 - kapitel 3 Skole: Navn: Klasse: Opgave 1 Et metal er kendetegnet ved, at nogle af metallets elektroner danner en elektrongas. Her er en række udsagn om, hvad et
Spørgsmål 1 Den kemiske reaktion
 Spørgsmål 1 Den kemiske reaktion Du skal gennemgå eksperimentet Fyrfadslys inddrag gerne dine forsøgsresultater og vurder om de understøtter modellen reaktionskemaet. Du skal endvidere give eksempler på
Spørgsmål 1 Den kemiske reaktion Du skal gennemgå eksperimentet Fyrfadslys inddrag gerne dine forsøgsresultater og vurder om de understøtter modellen reaktionskemaet. Du skal endvidere give eksempler på
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Efterårssemester 2018, eksamen december 2018 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Efterårssemester 2018, eksamen december 2018 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Spørgsmål 1. Øvelse: Kobber plus dibrom. Teori: Atomers opbygning.
 Spørgsmål 1. Øvelse: Kobber plus dibrom. Atomers opbygning. Atomets struktur. Det periodiske system. Betydning af hovedgrupperne. Ædelgassernes elektronstruktur i den yderste skal. Dannelse af ioner og
Spørgsmål 1. Øvelse: Kobber plus dibrom. Atomers opbygning. Atomets struktur. Det periodiske system. Betydning af hovedgrupperne. Ædelgassernes elektronstruktur i den yderste skal. Dannelse af ioner og
1. Skalmodellen, periodesystemet og kemisk binding. Øvelse: Kaliumnitrats opløselighed i vand
 Mundtlig eksamen kemi C, 10. juni 2016 Hold: 2f ke. Antal elever til eksamen: 1 Lærer: Jørgen Mogensen 1. Skalmodellen, periodesystemet og kemisk binding. Øvelse: Kaliumnitrats opløselighed i vand Gør
Mundtlig eksamen kemi C, 10. juni 2016 Hold: 2f ke. Antal elever til eksamen: 1 Lærer: Jørgen Mogensen 1. Skalmodellen, periodesystemet og kemisk binding. Øvelse: Kaliumnitrats opløselighed i vand Gør
Geokemisk differentiation af Jorden oversigt
 Forelæsning: Hvordan dannes magma Hvor dannes magma Forelæsning 9 Dannelse af magma Øvelse: Tryk og grad af opsmeltning; Sjældne jordarter (REE) som indikator for opsmeltningsbetingelser Hawai i F9 1 Geokemisk
Forelæsning: Hvordan dannes magma Hvor dannes magma Forelæsning 9 Dannelse af magma Øvelse: Tryk og grad af opsmeltning; Sjældne jordarter (REE) som indikator for opsmeltningsbetingelser Hawai i F9 1 Geokemisk
Atomers elektronstruktur I
 Noget om: Kvalitativ beskrivelse af molekylære bindinger Hans Jørgen Aagaard Jensen Kemisk Institut, Syddansk Universitet E-mail: hjj@chem.sdu.dk 8. februar 2000 Orbitaler Kvalitativ beskrivelse af molekylære
Noget om: Kvalitativ beskrivelse af molekylære bindinger Hans Jørgen Aagaard Jensen Kemisk Institut, Syddansk Universitet E-mail: hjj@chem.sdu.dk 8. februar 2000 Orbitaler Kvalitativ beskrivelse af molekylære
basiskemi C Helge Mygind Ole Vesterlund nielsen Vibeke Axelsen HAAse & søns forlag
 basiskemi C Helge Mygind Ole Vesterlund nielsen Vibeke Axelsen HAAse & søns forlag Helge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C forfatterne og Haase & Søns Forlag as 2010 Typografisk
basiskemi C Helge Mygind Ole Vesterlund nielsen Vibeke Axelsen HAAse & søns forlag Helge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C forfatterne og Haase & Søns Forlag as 2010 Typografisk
1 Atomets opbygning. Du skal fortælle om det periodiske system og atomets opbygning. Inddrag eksperimentet Reaktionen mellem kobber og dibrom.
 1 Atomets opbygning Du skal fortælle om det periodiske system og atomets opbygning. Inddrag eksperimentet Reaktionen mellem kobber og dibrom. Kernepartikler og elektronstruktur Periodisk system - hovedgrupper
1 Atomets opbygning Du skal fortælle om det periodiske system og atomets opbygning. Inddrag eksperimentet Reaktionen mellem kobber og dibrom. Kernepartikler og elektronstruktur Periodisk system - hovedgrupper
Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på:
 1. Molekyler Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på: Elektronparbinding (= kovalent binding) Oktetreglen/ædelgasreglen Polaritet Hydrofile og hydrofobe grupper Navngivning af
1. Molekyler Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på: Elektronparbinding (= kovalent binding) Oktetreglen/ædelgasreglen Polaritet Hydrofile og hydrofobe grupper Navngivning af
m: masse i masseprocent : indhold i volumenprocent : indhold
 Kemisk formelsamling (C-niveau s kernestof samt en del formler, der hører hjemme på Kemi B ) Mængdeberegninger m: masse M: molar masse n : stofmængde : volumen ρ : densitet (massetæthed) c : koncentration
Kemisk formelsamling (C-niveau s kernestof samt en del formler, der hører hjemme på Kemi B ) Mængdeberegninger m: masse M: molar masse n : stofmængde : volumen ρ : densitet (massetæthed) c : koncentration
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2019, eksamen maj/juni 2019 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2019, eksamen maj/juni 2019 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør. Spørgsmål 1. Grundstoffer og det periodiske system
 EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør Øvelse: Opløsningsmidlers egenskaber Spørgsmål 1 Grundstoffer og det periodiske system Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne
EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør Øvelse: Opløsningsmidlers egenskaber Spørgsmål 1 Grundstoffer og det periodiske system Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne
1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation
 Overskrifter til kemispørgsmål, Kemi C 2012 1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation 2. Grundstoffer i mennesket
Overskrifter til kemispørgsmål, Kemi C 2012 1. Grundstoffer i mennesket og opbygningen af grundstoffernes periodesystem, herunder gennemgang af eksperimentet: Neutralisation 2. Grundstoffer i mennesket
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2013 Institution Fredericia VUC Uddannelse Fag og niveau Lærer(e) Hold Hf Kemi C Thomas Nielsen 1kec13e
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2013 Institution Fredericia VUC Uddannelse Fag og niveau Lærer(e) Hold Hf Kemi C Thomas Nielsen 1kec13e
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse:
 Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
SDU og DR. Sådan virker en atombombe... men hvorfor er den så kraftig? + + Atom-model: - -
 SDU og DR Sådan virker en atombombe... men hvorfor er den så kraftig? Atom-model: - - - + + - + + + + + - - - Hvad er et atom? Alt omkring dig er bygget op af atomer. Alligevel kan du ikke se et enkelt
SDU og DR Sådan virker en atombombe... men hvorfor er den så kraftig? Atom-model: - - - + + - + + + + + - - - Hvad er et atom? Alt omkring dig er bygget op af atomer. Alligevel kan du ikke se et enkelt
reduktion oxidation Reduktion optagelse af elektroner Oxidation afgivelse af elektroner
 8. Redoxreaktioner reduktion oxidation Reduktion optagelse af elektroner Oxidation afgivelse af elektroner (Hel eller delvis) Der er grundlæggende 4 væsentlige kemiske reaktioner: 1. Udfældning af tungtopløselige
8. Redoxreaktioner reduktion oxidation Reduktion optagelse af elektroner Oxidation afgivelse af elektroner (Hel eller delvis) Der er grundlæggende 4 væsentlige kemiske reaktioner: 1. Udfældning af tungtopløselige
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2017, eksamen maj-juni 2017 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2017, eksamen maj-juni 2017 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas
 Eksamensspørgsmål revideret 7/6 NW 1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas Bilag: Det periodisk system. Du skal fortælle om atomets opbygning, om isotoper og naturligvis om begrebet
Eksamensspørgsmål revideret 7/6 NW 1. Atomteorien - samt øvelsen: Best af molarmasse for lightergas Bilag: Det periodisk system. Du skal fortælle om atomets opbygning, om isotoper og naturligvis om begrebet
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2018, eksamen maj/juni 2018 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Forårssemester 2018, eksamen maj/juni 2018 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Efterårssemester 2017, eksamen december 2017 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Efterårssemester 2017, eksamen december 2017 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e)
Oxidationstal og elektronparbindinger December 2015
 idationstal og elektronparbindinger December 2015 idationstal og elektronparbindinger I redokemi findes en række simple regler, som gør det muligt at bestemme oidationstal for et atom i en kemisk forbindelse,
idationstal og elektronparbindinger December 2015 idationstal og elektronparbindinger I redokemi findes en række simple regler, som gør det muligt at bestemme oidationstal for et atom i en kemisk forbindelse,
Eksamensspørgsmål Kemi C, 2016, Kec225 (KSD).
 Eksamensspørgsmål Kemi C, 2016, Kec225 (KSD). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, ph 5 Redoxreaktioner,
Eksamensspørgsmål Kemi C, 2016, Kec225 (KSD). 1 Molekylmodeller og det periodiske system 2 Molekylmodeller og elektronparbindingen 3 Molekylmodeller og organiske stoffer 4 Redoxreaktioner, ph 5 Redoxreaktioner,
Forløbet består af 7 fagtekster, 12 opgaver, tip en 12 er, 5 praktiske aktiviteter, flere kemi-sudokuer og en mindre skriftlig elevopgave.
 Atomer og molekyler Niveau: 7. klasse Varighed: 7 lektioner Præsentation: I forløbet Atomer og molekyler arbejdes der med helt grundlæggende kemiske begreber omkring stofopbygning, derfor bør temaet placeres
Atomer og molekyler Niveau: 7. klasse Varighed: 7 lektioner Præsentation: I forløbet Atomer og molekyler arbejdes der med helt grundlæggende kemiske begreber omkring stofopbygning, derfor bør temaet placeres
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Folkeskolens afgangsprøve Maj 2006 Fysik / kemi - Facitliste
 Folkeskolens afgangsprøve Maj 2006 1/26 Fk4 Opgave 1 / 20 (Opgaven tæller 5 %) I sin kemibog ser Per denne tegning, som er en model. Hvad forestiller tegningen? Der er 6 svarmuligheder. Sæt 1 kryds Et
Folkeskolens afgangsprøve Maj 2006 1/26 Fk4 Opgave 1 / 20 (Opgaven tæller 5 %) I sin kemibog ser Per denne tegning, som er en model. Hvad forestiller tegningen? Der er 6 svarmuligheder. Sæt 1 kryds Et
Eksamensopgaver. NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL
 Eksamensopgaver NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL Liste over eksamensøvelser 1. Opløsningsmidlers egenskaber 2. Fældningsreaktioner 3. Påvisning af proteiner 4. Fremstilling af
Eksamensopgaver NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL Liste over eksamensøvelser 1. Opløsningsmidlers egenskaber 2. Fældningsreaktioner 3. Påvisning af proteiner 4. Fremstilling af
Du skal også komme ind på øvelsen Saltes opløselighed i vand.
 1. Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
1. Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
Mol og molarmasse. Mol. Molarmassen. Molarmassen for atomer
 Mol og molarmasse Mol 1 u = 1,66. 10-24 g og dermed også 1 g = 6,02. 10 23 u. Da massen af én nukleon er meget tæt på 1 u er der 6,02. 10 23 nukleoner i en stofmængde på 1 g. Dette tal kaldes 1 mol 1 mol
Mol og molarmasse Mol 1 u = 1,66. 10-24 g og dermed også 1 g = 6,02. 10 23 u. Da massen af én nukleon er meget tæt på 1 u er der 6,02. 10 23 nukleoner i en stofmængde på 1 g. Dette tal kaldes 1 mol 1 mol
Årsplan i Fysik 7.klasse. 2018/2019 Abdiaziz Farah
 Årsplan i Fysik 7.klasse. 2018/2019 Abdiaziz Farah Klassen arbejder med 7 hovedemner: 1) Vi arbejder med fysik og kemi 2) Stofs egenskaber 3) Grundstoffer og kemiske forbindelser 4) luft 5) Lyd og Lys
Årsplan i Fysik 7.klasse. 2018/2019 Abdiaziz Farah Klassen arbejder med 7 hovedemner: 1) Vi arbejder med fysik og kemi 2) Stofs egenskaber 3) Grundstoffer og kemiske forbindelser 4) luft 5) Lyd og Lys
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug-dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi C Mohammed
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug-dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold HF enkeltfag Kemi C Mohammed
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Flammefarver Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen af et atom
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Flammefarver Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen af et atom
1 Ioner og ionforbindelser
 1 Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes, så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
1 Ioner og ionforbindelser Du skal fortælle om, hvordan ioner kan dannes, så de får samme elektronstruktur som ædelgasser, og hvordan ionforbindelser (salte) dannes ud fra positive og negative ioner. Du
Brombærsolcellen - introduktion
 #0 Brombærsolcellen - introduktion Solceller i lommeregneren, solceller på hustagene, solceller til mobiltelefonen eller solceller til den bærbare computer midt ude i regnskoven- Solcellen har i mange
#0 Brombærsolcellen - introduktion Solceller i lommeregneren, solceller på hustagene, solceller til mobiltelefonen eller solceller til den bærbare computer midt ude i regnskoven- Solcellen har i mange
BASISKEMI C. Facit HELGE MYGIND OLE VESTERLUND NIEL SEN VIBEKE A XEL SEN HAASE & SØNS FORLAG
 BASISKEMI C ELGE MYGIND OLE VESTERLUND NIEL SEN VIBEKE A XEL SEN Facit AASE & SØNS FORLAG elge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C. Facit forfatterne og aase & Søns Forlag as
BASISKEMI C ELGE MYGIND OLE VESTERLUND NIEL SEN VIBEKE A XEL SEN Facit AASE & SØNS FORLAG elge Mygind, Ole Vesterlund Nielsen og Vibeke Axelsen: Basiskemi C. Facit forfatterne og aase & Søns Forlag as
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Skoleår 2015-2016, eksamen maj-juni 2016 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e) Hold
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Skoleår 2015-2016, eksamen maj-juni 2016 Institution Kolding Hf & VUC Uddannelse Fag og niveau Lærer(e) Hold
Relativ massefylde. H3bli0102 Aalborg tekniske skole. Relativ massefylde H3bli0102 1
 Relativ massefylde H3bli0102 Aalborg tekniske skole Relativ massefylde H3bli0102 1 Indholdsfortegnelse Indholdsfortegnelse... Side 1 Formål... Side 2 Forsøget... Side 2- side 4 Konklusion... Side 4- side
Relativ massefylde H3bli0102 Aalborg tekniske skole Relativ massefylde H3bli0102 1 Indholdsfortegnelse Indholdsfortegnelse... Side 1 Formål... Side 2 Forsøget... Side 2- side 4 Konklusion... Side 4- side
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Flammefarver Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen af et atom
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Flammefarver Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen af et atom
Atomare elektroners kvantetilstande
 Stoffers opbygning og egenskaber 4 Side 1 af 12 Sidste gang: Naturens byggesten, elementarpartikler. Elektroner bevæger sig ikke i fastlagte baner, men er i stedet kendetegnet ved opholdssandsynligheder/
Stoffers opbygning og egenskaber 4 Side 1 af 12 Sidste gang: Naturens byggesten, elementarpartikler. Elektroner bevæger sig ikke i fastlagte baner, men er i stedet kendetegnet ved opholdssandsynligheder/
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Fredericia HF og VUC Uddannelse Fag og niveau Lærer(e) Hold HF Kemi C Thomas Nielsen
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Maj-juni 2015 Institution Fredericia HF og VUC Uddannelse Fag og niveau Lærer(e) Hold HF Kemi C Thomas Nielsen
Atomer og kvantefysik
 PB/2x Febr. 2005 Atomer og kvantefysik af Per Brønserud Indhold: Kvantemekanik og atommodeller side 1 Elektronens bindingsenergier... 9 Appendiks I: Bølgefunktioner 12 Appendiks II: Prikdiagrammer af orbitaler
PB/2x Febr. 2005 Atomer og kvantefysik af Per Brønserud Indhold: Kvantemekanik og atommodeller side 1 Elektronens bindingsenergier... 9 Appendiks I: Bølgefunktioner 12 Appendiks II: Prikdiagrammer af orbitaler
Test din viden A-forløb
 Test din viden A-forløb Har du styr på A-forløbets kernestof? Nu har du lært en masse om ionforbindelser, molekylforbindelser og mængdeberegninger. Ved at lave opgaverne nedenfor finder du ud af, om der
Test din viden A-forløb Har du styr på A-forløbets kernestof? Nu har du lært en masse om ionforbindelser, molekylforbindelser og mængdeberegninger. Ved at lave opgaverne nedenfor finder du ud af, om der
Eksamensspørgsmål. Spørgsmål : Atomer og bindinger (Hvilken type stof?) Spørgsmål : Ionforbindelser (Saltes opløselighed i vand
 Eksamensspørgsmål KemiC (17KeC80) Med forbehold for censors godkendelse Oversigt Spørgsmål 1 + 14: Atomer og bindinger (Hvilken type stof?) Spørgsmål 2 + 15: Ionforbindelser (Saltes opløselighed i vand
Eksamensspørgsmål KemiC (17KeC80) Med forbehold for censors godkendelse Oversigt Spørgsmål 1 + 14: Atomer og bindinger (Hvilken type stof?) Spørgsmål 2 + 15: Ionforbindelser (Saltes opløselighed i vand
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug 2014- dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold Flex-kemi C Kemi C Mohammed
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug 2014- dec 2014 Institution VUC Hvidovre Uddannelse Fag og niveau Lærer(e) Hold Flex-kemi C Kemi C Mohammed
Læringsmål i fysik - 9. Klasse
 Læringsmål i fysik - 9. Klasse Salte, syrer og baser Jeg ved salt er et stof der er opbygget af ioner. Jeg ved at Ioner i salt sidder i et fast mønster, et iongitter Jeg kan vise og forklare at salt, der
Læringsmål i fysik - 9. Klasse Salte, syrer og baser Jeg ved salt er et stof der er opbygget af ioner. Jeg ved at Ioner i salt sidder i et fast mønster, et iongitter Jeg kan vise og forklare at salt, der
Eksperimentelle øvelser, øvelse nummer 3 : Røntgenstråling målt med Ge-detektor
 Modtaget dato: (forbeholdt instruktor) Godkendt: Dato: Underskrift: Eksperimentelle øvelser, øvelse nummer 3 : Røntgenstråling målt med Ge-detektor Kristian Jerslev, Kristian Mads Egeris Nielsen, Mathias
Modtaget dato: (forbeholdt instruktor) Godkendt: Dato: Underskrift: Eksperimentelle øvelser, øvelse nummer 3 : Røntgenstråling målt med Ge-detektor Kristian Jerslev, Kristian Mads Egeris Nielsen, Mathias
