NV2: Salt og saltvand
|
|
|
- Oscar Frederiksen
- 8 år siden
- Visninger:
Transkript
1 NV2: Salt og saltvand Modulfordeling 1b Modul Fag /lokale Delemne Materiale (*) Eksperimentelt 24/9 3.modul 27/9 2.modul 28/9 3.modul + 4.modul 1/10 3.modul 4/10 1.modul + 2.modul 11/10 1.modul 11/10 2.modul 22/10 3.modul 25/10 2.modul Fysik A300 Kemi A300 Forsøg Deletimer Fysik B225 Kemi A300 Biologi B424 Forsøg Deletimer Fysik B225 Kemi A300 Fysik B328 Kemi B328 Biologi A201 Biologi B328 Massefylde, masse- og volumenprocent Atomer, ioner og salte Lineær sammenhæng Opslag 42 (øverst) Sand og salt Planteceller. Vand i planter Densitet for saltvand. Koncentation af salt i havvand. Opslag: 2, 8, 24 Note: s. 2-4 Atomer, ioner og salte Note:s Opslag: 23, 25, 49 Note Note: Opslag: 35 Note Opslag: 24, 26 Resultatbehandling Opslag: 38, 39, 41 Resultatbehandling Opslag: 38, 39, 41 Planteceller i mikroskop. Osmose. Note Opslag: 14, 23 Resultatbehandling Opslag: 38, 39, 41, 45 Kontrolleret eksperiment 2 (note s. 2-3) Eksempel 2 (note s. 3-4) Fysik: Saltkoncentration og densitet (note s.5) Kemi: Introduktion til laboratoriearbejde (små demo), Sand og salt Bestemmelse af vandfordampning fra potteplante (pelargonie) Fysik: Bestemmelse af saltkonc. ud fra densitetsmåling (note s.6) Bestemmelse af densitet (note s.7) Kemi: Bestemmelse af NaCl-indhold v.hj.a. titrering. (note s.13-14) Osmose i vandpest (demo) (note s.19) Osmoseforsøg med kartofler (note s.20) Afslutning af Osmoseforsøg med kartofler (*) Henvisningerne til opslag er henvisninger til bogen Naturvidenskabeligt Grundforløb af Hans Marker m.fl., Forlaget Malling Beck Indholdsfortegnelse Fysik: Om hypotese, verifikation og falsifikation 2 Forsøg: saltkoncentration og densitet 5 Forsøg: densitet for saltvand 6 Kemi Atomets opbygning 9 Arbejdet i kemilaboratoriet (små demonstrationsforsøg) 11 Forsøg: Sand og salt 12 Forsøg: Bestemmelse af saltkoncentration ved titrering 13 Biologi Cellen 15 Vands betydning for planter 16 Forsøg: Vandfordampning fra potteplante 18 Forsøg: Osmose i vandpest (demonstrationsforsøg) 19 Forsøg: Osmoseforsøg med kartofler 20 Denne note er udarbejdet til forløb 2 i naturvidenskabeligt grundforløb på Odense Katedralskole efteråret Per Pedersen og Poul Hedegaard NV2: Salt og saltvand Odense Katedralskole 2007 Side 1 af 20
2 Om hypotese, verifikation og falsifikation Du skal arbejde videre med iagttagelser, dataindsamling og -bearbejdning, og du skal opstille hypoteser, og ved hjælp af eksperimentelle undersøgelser bekræfte (verificere) eller afkræfte (falsificere) disse hypoteser. Nogle af hypoteserne skal du opstille på baggrund af hverdagserfaringer, andre på baggrund af datamateriale, som du selv eller andre har indsamlet. Og hele forløbet skal give dig et indtryk af, hvordan forskellige naturvidenskabelige arbejdsmetoder inddrages i arbejdet, når man skal undersøge fænomener i naturen. Se også opslag 2 i Naturvidenskabeligt grundforløb Vi starter med to eksempler, hvor det første bygger på hverdagserfaringer, det andet på data, som du finder på internettet. Eksempel 1 En hverdagserfaring: en skoletaske med mange bøger føles tungere end en skoletaske med færre bøger. Vi plejer at sige, at det er tyngdekraften, der trækker i skoletasken, og tyngdekraften trækker mest i tasken med de mange bøger. Ud fra denne hverdagserfaring kan man fremsætter en hypotese: Der er sammenhæng mellem massen af skoletasken og tyngdekraften på skoletasken Spørgsmålet er så, om hypotesen kan bekræftes (verificeres) eller afkræftes (falsificeres). For at afgøre det, skal du gennemføre et kontrolleret eksperiment. Hermed menes et eksperiment, hvor der er så få størrelser som muligt, der kan variere, og hvor du forsøger at finde ud af, om der er en sammenhæng i den måde, størrelserne varierer på. Det er lettest at finde en eventuel sammenhæng, hvis der kun er én uafhængig variabel (nemlig den størrelse, du bestemmer værdien af), og en afhængig variabel (den størrelse, der forandrer sig, når du ændrer værdien af den uafhængige variabel). Undervejs i det kontrollerede eksperiment kan du måske forbedre hypotesen. Hypotesens ord Der er sammenhæng mellem masse og tyngdekraft er jo ikke særlig præcis. Der står fx ikke noget om, hvilken sammenhæng der kunne være. Og hverdagserfaringens føles tungere er heller ikke nogen særlig præcis beskrivelse. Kontrolleret eksperiment 1 I det kontrollerede eksperiment skal du forsøge at bestemme, hvor tung skoletasken skal være. For at gøre det, må du bestemme massen af skoletasken (ved at veje skoletasken med bøger på en vægt), og måle den dertil svarende tyngdekraft. Der er bare et praktisk problem: du kan godt bestemme massen af skoletaske+bøger præcist (fx ved at sætte skoletasken med bøgerne på en badevægt), men du kan ikke måle tyngdekraften, fordi skolen ikke har Newtonmetre, der går op til 100N eller mere Kan du så ikke undersøge, om der er sammenhæng mellem masse og tyngdekraft? Jo. Men nu må du gøre det ved at lave en model, og derefter overføre modellens resultater til skoletasken med bøgerne. Kontrolleret eksperiment 2 Gennemfør et eksperiment, hvor du 1) undersøger om der virkelig er en sammenhæng mellem masse og tyngdekraft, og hvor du 2) prøver at finde ud af, hvilken sammenhæng der er. NV2: Salt og saltvand Odense Katedralskole 2007 Side 2 af 20
3 Du skal bruge et stativ, et Newtonmeter, lodder med forskellig masse, samt en krog til at hænge lodderne op i. Bestem sammenhørende værdier af massen (af krog+lodder) og tyngdekraften på krog+lodder. Overvej, hvilken af de to størrelser (masse eller tyngdekraft) der er den uafhængige variabel og hvilken der er den afhængige variabel. Skriv måleresultaterne ind i et skema i stil med dette: m / kg 0 F T / N 0 Bemærk, at det første sæt af sammenhørende værdier (massen 0 kg og tyngdekraften 0 N) er et måleresultat, der skal med i tabellen og bruges i den videre databehandling. Newtonmeteret viser jo 0 N, når der ikke er hængt lodder op i det. Tegn en graf på mm-papir. Den uafhængige variabel på 1.aksen (x-aksen) og den afhængige variabel på 2.aksen (y-aksen). Forklar ud fra grafen, om der er en pæn sammenhæng mellem masse og tyngdekraft. Hvis der er en pæn sammenhæng, fx en lineær sammenhæng, har du fået bekræftet din hypotese, idet du har påvist, at der er sammenhæng mellem massen af krog+lodder og tyngdekraften på krog+ lodder. Og du kan endda forbedre hypotesen, og formulere den således: Der er lineær sammenhæng mellem massen af krog+lodder og tyngdekraften på krog+lodder. Det er dog ikke noget endegyldigt bevis for, at der er lineær sammenhæng mellem masse og tyngdekraft. Men det er et godt udgangspunkt for flere eksperimenter (udført af andre personer i andre lokaler og med andet apparatur). Jo flere eksperimenter der viser det samme, jo mere overbevist bliver vi om, at hypotesen er en god forklaring på sammenhængen mellem masse og tyngdekraft. Og så kan vi vende tilbage til problemet med skoletasken med bøgerne. Flere bøger større masse større tyngdekraft tasken føles tungere. Eksempel 2 På DMIs hjemmeside, kunne man indtil juni 2007 bl.a. finde en række målinger af havtemperatur, saltholdighed og massefylde. Saltholdighed og massefylde er dagligsprogets navne for de naturvidenskabelige begreber saltkoncentration og densitet. I resten af eksempel 2 bruger vi samme ord som DMI, men vender tilbage til de naturvidenskabelige navne i de efterfølgende afsnit. Gå ind på klik på fanebladet Danmark, og klik på Havobservationer i den menu, der er til venstre på fanebladet. Så kommer der en side, hvor du kan aflæse vandtemperaturen forskellige steder langs Danmarks kyster. Desværre kan du ikke mere finde saltholdighed og massefylde, men din lærer har udskrifter, du kan bruge og aflæse fra. Du skal altså ikke aflæse vandtemperaturerne på kortet hos DMI. I stedet skal du bruge kortet til at finde navnene for de forskellige observationssteder. NV2: Salt og saltvand Odense Katedralskole 2007 Side 3 af 20
4 Lav et skema med vandtemperatur, saltholdighed og massefylde. Noget i stil med dette: Sted Esbjerg Hanstholm Hirtshals Frederikshavn Tejn Vandtemperatur [ C] Saltholdighed [ ] Massefylde [kg/m 3 ] Du har nu indsamlet og systematiseret måledata for vandtemperatur, saltholdighed og massefylde forskellige steder ved de danske kyster. Opgaven er nu at undersøge, om der er sammenhæng mellem nogle af de målte størrelser. Du kan altså lave tre hypoteser: Hypotese 1 Der er sammenhæng mellem vandtemperatur og saltholdighed *) Hypotese 2 Der er sammenhæng mellem vandtemperatur og massefylde *) Hypotese 3 Der er sammenhæng mellem saltholdighed og massefylde *) Spørgsmålet er så, hvilken/hvilke hypoteser der kan bekræftes (verificeres) eller afkræftes (falsificeres). For at afgøre det, kan du lave tre koordinatsystemer, med - vandtemperatur og saltholdighed på vandret og lodret akse (hypotese 1) - vandtemperatur og massefylde på vandret og lodret akse (hypotese 2) - saltholdighed og massefylde på vandret og lodret akse (hypotese 3) Vælg enheder på 1.aksen (den vandrette akse) og 2.aksen (den lodrette akse), så du får målingerne til at fylde så meget som muligt på papiret. Undersøg om du i et eller flere af koordinatsystemerne kan se en sammenhæng mellem den størrelse, du har afbildet på den vandrette og den lodrette akse. Fx en ret linje eller en blødt forløbende kurve gennem punkterne. Hvis du kan det, har du påvist, at der er sammenhæng mellem de to størrelser, du har afbildet på 1.aksen og 2.aksen i koordinatsystemet, og så har du fået bekræftet den tilsvarende hypotese. Hypotesen er verificeret. Hvis du ikke kan se en sammenhæng, fx fordi punkterne bare ligger hulter til bulter i koordinatsystemet, så har du tilsvarende afkræftet hypotesen om sammenhæng, og så er den hypotese falsificeret. *) Din hypotese omtaler sammenhængen mellem to størrelser, men i dine data fra DMI er der tre størrelser, der kan være sammenhæng imellem. Når du undersøger en hypotese, hvor der kun indgår to størrelser, hvordan kan/skal du så sikre dig, at den tredje størrelse ingen betydning har (eller at den kun har minimal betydning)? Og har du gjort det? Denne kontrol, som du er nødt til at udføre, kaldes også variabelkontrol. NV2: Salt og saltvand Odense Katedralskole 2007 Side 4 af 20
5 Forsøg: Saltkoncentration og densitet Vi skal nu definere, hvad vi forstår ved saltholdighed. Ordet som saltholdighed eller saltindhold er dagligsprog, hvor vi i naturvidenskaben foretrækker mere præcise ord, i dette tilfælde saltkoncentration. Saltkoncentrationen i en vandprøve angives i procent, dvs. at den angiver massen af opløst salt i procent af vandprøvens masse: masse af salt Saltkoncentration = 100% eller vandprøven s masse Saltkoncentrationen er en masseprocent. m p = m vandprøve 100% Regneeksempel 1 3g Der er opløst 3g salt i 200g vand. Så er saltkoncentrationen p = 100% = 1,5% 200 g Regneeksempel 2 Saltkoncentrationen i en vandprøve er 3,4%. I en vandprøve på 500g er der 500 g 3,4% = 17g salt. Forsøg: Sammenhæng mellem densitet og koncentrationsangivelse Når saltkoncentrationen af havvand angives til 3,5% mener vi, at der at der er 35 g salt pr g havvand. Man kunne også have angivet saltkoncentrationer som antal gram salt pr ml saltvand eller antal gram salt pr ml ferskvand. I dette forsøg skal vi undersøge sammenhængen mellem saltopløsningens koncentration og densitet. Vi ser på tre forskellige saltopløsninger: 1) 20 g salt opløses i vand så blandingen vejer 100 g (saltkoncentration 20%) 2) 20 g salt opløses i vand så blandingen fylder 100 ml 3) 20 g salt opløses i 100 ml demineraliseret vand For hver af de tre opløsninger bestemmes masse og volumen, så vi kan beregne densiteten. 1) Massefylde af en opløsning, hvor 20 g salt opløses i 100 g saltvand. Kom ca. 70 ml demineraliseret vand i et bægerglas. Tilsæt 20g salt, og opløs saltet ved hjælp af magnetomrører. Når saltet er opløst, hældes opløsningen over i et 100 ml måleglas, og der tilsættes demineraliseret vand indtil vægten viser 100 g. Aflæs volumen af saltvandet. 2) Massefylde af en opløsning, hvor 20 g salt opløses i 100 ml saltvand. Kom ca. 70 ml demineraliseret vand i et bægerglas. Tilsæt 20g salt, og opløs saltet ved hjælp af magnetomrører. Når saltet er opløst, hældes opløsningen over i et 100 ml måleglas, og der tilsættes demineraliseret vand indtil volumen er 100 ml. Aflæs massen af saltvandet. 3) Massefylde af en opløsning, hvor 20 g salt opløses i 100 ml demineraliseret vand. Fyld præcis 100 ml demineraliseret vand i et måleglas. Hæld ca. 70 ml af vandet i et bægerglas. Tilsæt 20g salt, og opløs saltet ved hjælp af magnetomrører. Når saltet er opløst, hældes opløsningen over i 100 ml-måleglasset. Aflæs massen og volumen af saltvandet. Udfyld skemaet med de aflæste værdier, og beregn i hvert tilfælde massefylden af saltvandet. 20 g salt i 100 g saltvand 20 g salt opløses i 100 ml saltvand 20 g salt opløses i 100 ml demineraliseret vand m / g 100 V / ml 100 / g/ml salt Kommenter resultatet. NV2: Salt og saltvand Odense Katedralskole 2007 Side 5 af 20
6 Bestemmelse af saltkoncentration ud fra densitetsmålinger Formål At bestemme koncentrationen af salt i en opløsning ved at bestemme densiteten for saltopløsningen. Metode Princippet i forsøg og databehandling er følgende: 1) Først skal du bestemme densiteten af nogle saltopløsninger med kendt koncentrationen af NaCl, fx 0%, 2%, 4% og 6%.. 2) Dernæst skal du ud fra de målinger du netop har udført finde en sammenhæng mellem saltkoncentration og densitet for de kendte opløsninger. 3) Til sidst skal du finde densiteten for en opløsning, hvis saltkoncentration du ikke kender, og bruge den sammenhæng, du fandt i punkt 2, til at bestemme saltkoncentrationen i den ukendte saltopløsning. Bestemmelsen af densitet for en væske er beskrevet i opslag 24 i Naturvidenskabeligt grundforløb. På de næste to sider i dette hæfte følger en mere udførlig vejledning. Databehandlingen er i generelle vendinger beskrevet i opslag 42 og 38 i Naturvidenskabeligt grundforløb. Herunder følger en kort vejledning, der er tilpasset forsøget med bestemmelse af koncentration ud fra densitetsmålinger. Skriv de fundne densiteter ind i en tabel i Excel: Saltkoncentration / % ukendt Densitet / g/ml Lav en graf (XY-punkt, uden linjer mellem punkterne) ud fra de 4 resultater for de kendte saltkoncentrationer. Tilføj tendenslinje. Husk at få ligning og R 2 -værdi vist. Grafen kommer til at se ca. således ud En kurve (eller linje) som den viste kaldes en standardkurve eller en kalibreringskurve. Nu skal du ud fra densiteten for saltopløsningen med den ukendte koncentration bestemme opløsningens koncentration. Lad os sige, at du har bestemt densiteten til 1,022g/mL. Så kan du finde saltkoncentrationen ved at bruge ligningen for tendenslinjen, y = 0,0062x + 0,9996, og finde den x-værdi der hører til y-værdien 1,022g/mL. Opgave Brug tendenslinjen fra figuren herover, og vis ved beregning, at saltprocenten for en opløsning med densitet 1,022g/mL er 3,6%. Konklusion Beskriv, hvad forsøget har vist (Blev de forskellige grafer rette linjer? Ligger punkterne pænt i forhold til de rette linjer? Kunne du bestemme den ukendte saltkoncentration, og hvilken værdi fik du? Stemmer værdien med den tabelværdi, læreren har givet dig? Kan du sammenligne den kemiske og den fysiske målemetode?) Fejlkilder Lav en liste over de fejlkilder, der er i forsøget. Prøv at vurdere, hvilke fejlkilder der har størst betydning, og skriv dem først. NV2: Salt og saltvand Odense Katedralskole 2007 Side 6 af 20
7 Bestemmelse af densitet Udstyr Måleglas, 100 ml Vægt Ferskvand, saltvand med forskellige saltkoncentrationer (2%, 4%, 6% og en ukendt saltprocent). Teori Et stofs densitet er defineret som masse massefylde = eller ρ = rumfang Enheden for densitet er kg/m 3. Vi vil dog måle massen i g og rumfanget i ml, og dermed angive densiteten i g/ml. I stedet for ordet densitet bruges også ordet massefylde. Se i øvrigt Naturvideskabeligt grundforløb opslag 8 og 24. Fremgangsmåde Forsøgene med de forskellige saltopløsninger laves på samme måde. 1 Sæt det tomme og tørre måleglas på vægten, og tryk på Tarer-knappen, så vægten viser 0g. Nu har du aflæst den første masse. Hvilket volumen svarer det til? Skriv værdierne af V og m ind i skemaet. 2 Hæld ca. 10 ml væske i måleglasset. Prøv ikke på at ramme præcist 10,0 ml. Det er nemlig sværere at ramme en målestreg præcist end at aflæse præcist. Pas på at der ikke kommer væske på måleglassets sider, da disse dråber jo ikke vil blive aflæst i væskens rumfang. 2 Væskens rumfang V aflæses mest præcist ved at aflæse, som vist på figuren til højre. Aflæs ved væskens underkant, og skriv værdien i skemaet. 3 Aflæs væskens masse m på vægten, og skriv værdien i skemaet. 4 Hæld yderligere ca. 10 ml af væsken i måleglasset, aflæs V og m, og skriv værdierne i skemaet. 5 Fortsæt således, idet du efter hver måling tilsætter ca. 10 ml af væsken og aflæser V og m. Fortsæt indtil du har 7-9 målinger. Forsøget gentages med de øvrige opløsninger. Forsøgsresultater For hvert forsøg laves et skema som dette: V / ml m / g 0 m V Databehandling Lav et koordinatsystem, hvor volumen indtegnes på den vandrette akse og massen indtegnes på den lodrette akse. Lad 2cm på den vandrette akse svare til 10mL, og 2cm på den lodrette akse svare til 10g. Indtegn punkterne. Marker de målte punkter tydeligt, enten med eller med. NV2: Salt og saltvand Odense Katedralskole 2007 Side 7 af 20
8 De afsatte punkter vil sikkert ikke ligge præcist på en ret linie, men du skal tegne den bedst mulige rette linie mellem punkterne. Det gør du ved sørge for, at der ligger ca. lige mange punkter over og under linjen. På den måde bliver din linje en slags gennemsnit af alle målingerne. Bestem nu linjens hældningskoefficient ud fra to punkter P 1 og P 2, med koordinatsæt (x 1,y 1 ) og (x 2,y 2 ). Vælg to punkter, der ligger langt fra hinanden. Det gør usikkerheden mindre, når afstanden mellem punkterne er stor. Vælg punkter, der ligger på linien, og helst punkter, der ligger præcist i skæringspunkter på mm-papiret. Så kan du aflæse præcist, også med decimaler. Brug aldrig målesæt fra skemaet. Du kan jo ikke være sikker på, at de målte punkter ligger præcist på den linje, du har tegnet! Men det gør de to punkter, du selv har udvalgt. Bestem hældningskoefficienten for linjen ud fra de to punkters koordinatsæt: y y ρ = = x x 2 2 y 1 x 1 Hermed har du bestemt væskens densitet. På grafen herover aflæses (x 1,y 1 )=(18.5,20) og (x 2,y 2 )=(75.5,80). Heraf fås væskens densitet til y 80g 20g ρ = = = x 75.5mL 18.5mL 60g 57mL = g ml Lav også databehandlingen i Excel. Følg opskriften i Naturvidenskabeligt grundforløb, opslag 38. Indtast først de målte værdier af volumen og masse, og lav dernæst et diagram ud fra de målte værdier af volumen og masse. Sørg for, at den uafhængige variabel bruges som x-koordinat, og at den afhængige variabel bruges som y-koordinat, og husk at lave diagrammet som et XY-punkt-diagram uden linjer fra punkt til punkt. Tilføj tendenslinje, og sørg for at få vist tendenslinjens forskrift og R 2 -værdi. Sammenlign den densitet du fandt ud fra linjen på mm-papir med den værdi, du finder ud fra tendenslinjen. Konklusion Hvilke konklusioner kan du drage? (Er der sammenhæng mellem volumen og masse? Hvilken sammenhæng er der? Ligger punkterne pænt i forhold til linjen/kurven? Kan du forklare hvorfor enkelte punkter evt. ikke ligger på linjen/kurven? Ud fra hver linje/kurve har du bestemt opløsningens densitet. Kan du se, om de værdier du har bestemt, er fornuftige er der fx sammenhæng mellem saltkoncentration og den densitet?) Fejlkilder Lav en liste over de fejlkilder, der er i forsøget. Prøv at vurdere, hvilke fejlkilder der har størst betydning, og skriv dem først. NV2: Salt og saltvand Odense Katedralskole 2007 Side 8 af 20
9 Atomets opbygning Atomet består af en kerne, som indeholder positivt ladede protoner (p + ) og neutrale neutroner (n). Udenom findes kernen de negativt ladede elektroner (e - ). Antallet af protoner angiver atomets nummer atomer (Z). I elektrisk neutrale atomer er antallet af protoner lig antallet af elektroner. Nukleontallet (A) er det samlede antal protoner og neutroner i kernen: A= Z+ N. For et bestemt atom kan antallet af nukleoner variere, vi taler om forskellige isotoper. Sammen med det kemiske symbol angiver man atomnummeret (Z) og nukleontallet (A): A Z X Hydrogen-atomet H Helium-atomet 2 He Oxygen-atomet H Natrium-atomet 11 Na Elektronerne befinder sig i bestemte afstande fra kerne i de såkaldte skaller. Det maksimale antal 2 elektroner i skal nr. n kan beregnes af formlen 2 n. Men ingen atomer kan have mere end 8 elektroner i den yderste skal. Grundstoffer Grundstoffer er stoffer, der kun indeholder én slags atomer. I naturen findes der ca. 92 forskellige grundstoffer, mens man i øjeblikket kender ca. 20 kunstigt fremstillede grundstoffer. Det periodiske system er et katalog over alle kendte grundstoffer, hvor stofferne er opstillet efter deres kemiske egenskaber. Det periodiske system er ordnet i hovedgrupper, undergrupper og perioder. Der er 8 hovedgrupper, som indeholder fra 1-8 elektroner i yderste skal. Grundstofferne inddeles i metaller (de fleste) og ikke-metaller, samt en mellemting, der kaldes halvmetaller. Når atomerne bindes sammen i kemiske forbindelser sker det fordi alle atomer forsøger at få 8 elektroner (evt. 2 elektroner) i den yderste skal (oktetreglen eller ædelgasreglen). Der findes et utal af kemiske forbindelser, som vi groft taget vil inddele i to grupper nemlig salte og molekyler. Salte er sammensat af positive metalioner og negative ikke-metalioner, de forskellige ladede ioner tiltrækker hinanden og opbygger meget store krystaller, f.eks. Natriumchlorid (kogesalt), NaCl Molekyler består af ikke-metaller bundet sammen af fælles elektronpar i små selvstændige neutrale enheder, f.eks. Oxygen (ilt): O 2 Vand: H 2 O Kuldioxid: CO 2 Ioner og salte Atomer som ikke har 8 elektroner (evt. 2 elektroner) i den yderste skal, vil forsøge at opnå dette ved enten at optage manglende elektroner eller ved at afgive overskydende elektroner. Herved danner atomerne elektrisk ladede ioner. Atomer har det ligesom kvinder, de bliver positive når de taber sig, og negative når de tager på. Som eksempel kan vi se på reaktionen mellem et natriumatom og et chloratom. NV2: Salt og saltvand Odense Katedralskole 2007 Side 9 af 20
10 Den elektron som natriumatomet har for meget afgives til chloratomet. Fjernes en elektron fra natriumatomet fås en positiv ladet ion: Na Na + + e - Det neutrale chloratom optager en elektron og bliver derved negativt ladet: Cl + e - Cl - Na + og Cl - vil på grund af deres forskellige ladning binde sig til hinanden og danne stoffet NaCl, bindingen kaldes for en ionbinding. Generelt vil metalatomer danne positive ioner, mens ikke-metaller danner negative ioner. Eksempler på ioner: Positive ioner (metalioner) Negative ioner (ikke-metal-ioner) Na + natriumion Cl - chloridion Ca 2+ calciumion O 2- oxidion Ag + sølvion F - flouridion Mg 2+ magnesiumion 2- CO 3 carbonation (sammensat ion) - NO 3 nitration (sammensat ion) Ionbindinger dannes mellem positive metalioner og negative ikke-metal-ioner. De forskelligt ladede ioner tiltrækker hinanden, og der opbygges et salt (krystal). Ionerne i et salt er organiseret i et iongitter. I iongitteret er hver ion omgivet af et antal ioner med modsat ladning. Forholdet mellem antallet af positivt og negativt ladede ioner i iongitteret er altid sådan, at den samlede ladning bliver nul, f.eks NaCl (Na + og Cl - ) og Na 2 CO 3 ( to Na + ioner hver gang der er en carbonation CO 3 2- ). Opgave Opskriv ionforbindelser mellem 1 sølvionen og oxidion, 2 magnesiumionen og chloridionen, 3 natriumionen og oxidion. 4 aluminiumionen og oxidion NV2: Salt og saltvand Odense Katedralskole 2007 Side 10 af 20
11 Arbejdet i kemilaboratoriet Kemikemikalier kan være både sundhedsskadelige, brandfarlige eller ætsende. Det er derfor vigtigt at være opmærksom på sikkerhed og risiko og opfør dig fornuftigt, når du laver kemiske forsøg. Her følger en række gode råd og regler for færdsel i laboratoriet: Brug beskyttelsesbriller, når du arbejder med ætsende stoffer. Undgå at få kemikalier på hænderne. Husk at vaske hænder efter et kemiforsøg. Det er forbudt at spise og drikke i kemilokalet. Arbejde med brændbare og flygtige væsker foregår under udsugning. Undgå spild af kemikalier (bord, gulv, vægte eller andet apparatur). Sker det, skal det fjernes omgående. Hvis du knuser glasvarer skal de omgående fejes op og hældes i spand med glasaffald. Hæld aldrig kemikalier tilbage i på flasken eller i kemikaliebøtten. Du kan beskytte dit tøj ved at bruge et forklæde. Spørg din lærer hvis du er i tvivl om hvorledes kemikalieaffald skal håndteres (hældes i vasken, affaldsdunke, skraldespand eller på særlige beholdere). Husk at rydde op efter dig ved Kemikalier kan være farlige (små demonstrationsforsøg) Flygtige og brandfarlige væsker: I 4 digler hældes henholdsvis 2 ml vand, ethanol, acetone og heptan. Diglerne vejes og anbringes under udsug 1-1½ time. Derefter vejes diglerne igen og massen af fordampet væske bestemmes. Stof Masse (start) Masse (slut) Fordampning Fordampning pr. time Vand Ethanol Acetone Heptan Starttidspunkt Sluttidspunkt Forsøget afsluttes ved at antænde væskerne. Bemærk hvordan kemikalieflaskerne er mærket. Find sikkerheds- og risikosætninger for ethanol, acetone og heptan. Diskuter disse i forhold til forsøgsresultaterne. Giftige og ætsende stoffer 1 Konc. svovlsyre dryppes på et stykke tøj. Efter et par minutter skylles tøjstykket. 2 Et par dråber konc. svovlsyre dryppes på en sukkerknald. 3 Et æg slås ud i et bægerglas. Til æggehviden sættes henholdsvis 1 dråbe sølvnitrat (AgNO 3 ) og 1 dråbe bly(ii)nitrat (Pb(NO 3 ) 2 ) 4 I et reagensglas sættes lidt fedtstof (smør / margarine) og 5 ml heptan. Glasset omrystes kraftigt. Noter iagttagelser i hvert forsøg og forklar hvad der er sket. Diskuter sikkerheds- og risikosætninger for de anvendte stoffer i forhold til forsøgsresultaterne. NV2: Salt og saltvand Odense Katedralskole 2007 Side 11 af 20
12 Sand og salt Formål Formålet med denne øvelse er at blive bekendt med skolens kemilaboratorium og det udstyr, der findes her. Materialer Lille reagensglas, spatel, tragt, filtrerpapir, konisk kolbe, trefod, trådnet, bunsenbrænder, vægt med automatisk tarering (det vil sige, at den starter på 0 ved et let tryk på bjælken forrest på vægten), sand, salt, demineraliseret vand. Fremgangsmåde 1 En konisk kolbe vejes med 2 decimaler. 2 I et reagensglas afvejes ca. 0,5 g salt. (Benyt den automatiske tarering). Den nøjagtige masse af saltet med 2 decimaler noteres (teoretisk udbytte). 3 I samme reagensglas afvejes nu 0,5 g sand. (Benyt igen den automatiske tarering). Den nøjagtige masse af saltet med 2 decimaler noteres (teoretisk udbytte). 4 Et filterpapir vejes 5 Derefter rystes reagensglasset grundigt, så salt og sand blandes. 6 Så tilsættes demineraliseret vand, og reagensglasset omrystes. Der tilsættes så meget vand, at I mener, at alt saltet er opløst. 7 Filtrerpapiret, der først er vejet og foldes to gange og anbringes i tragten. 8 Reagensglassets indhold hældes nu i tragten med filtrerpapir, og væsken, der løber igennem, opsamles i en afvejet konisk kolbe. Reagensglasset skylles efter med vand, så alt sand og salt er kommet med over i tragten. Filtrerpapiret skylles efter med lidt vand. 9 Filtrerpapiret med sand tørres i varmeskab ved ca C. 10 Den koniske kolbe med saltvandsopløsningen anbringes på et trådnet på en trefod, og der opvarmes, til alt vand er fordampet. 11 Massen af salt og sand bestemmes ved vejning. Resultater massen af konisk kolbe med salt: g massen af filtrerpapir med sand: g massen af konisk kolbe g massen af filtrerpapir: g massen af salt efter adskillelse (praktisk udbytte): g massen af sand efter adskillelse (praktisk udbytte): g Resultatbehandling: 1 Beregn udbytteprocent af salt: 2 Beregn udbytteprocent af sand: 3 Kan du forklare, hvorfor udbytteprocenterne er mindre end 100 %? 4 Hvilke fejlkilder er der ved forsøget? praktisk udbytte Udbytte % = 100% teoretisk udbytte Opslag 49: Laboratoriearbejde og sikkerhed Opslag 23: Vejning. Opslag 25: Filtrering. NV2: Salt og saltvand Odense Katedralskole 2007 Side 12 af 20
13 Bestemmelse af saltkoncentration ved titrering Formål: Bestemmelse af koncentrationen af salt i en opløsning ved hjælp af titrering. Materialer: opløsninger af saltvand med koncentrationen 1%, 2%, 3%, 4%, pipette, bægerglas, magnetomrører, burette, opløsning af sølvnitrat 0,025 M, indikator (kaliumchromat). Teori: Blandes sølvnitrat med natriumchlorid vil der dannes et hvidt bundfald af sølvchlorid: NaCl (aq) + AgNO 3 (aq) AgCl(s)+ NaNO 3 (aq) Tilsætter man dråbevis sølvnitrat til en opløsning af natriumchlorid vil sølvnitraten reagere med natriumchlorid og der vil blive mindre og mindre natriumchlorid tilbage i opløsningen. Vi vil tilsætte en indikator, som kan vise, hvornår den sidste natriumchlorid uddfældes som sølvchlorid. Opløsningen vil da farves svagt rød som følge af tilsætning af indikator Fremgangsmåde: 1 Udtag 1 ml 1% saltopløsning med pipette til et bægerglas, og tilsæt herefter 5 dråber kaliumchromat (indikator). 2 Tilsæt ca. 25 ml vand til bægerglasset. Bemærk at væsken er klar og svagt gul. 3 Bægerglasset stilles på magnetomrøreren. 4 En burette fyldes med sølvnitrat og nulstilles (din lærer viser dig hvordan). NV2: Salt og saltvand Odense Katedralskole 2007 Side 13 af 20
14 5 Fra buretten tilsættes nu forsigtigt og langsomt sølvnitrat til bægerglasset. Bemærk, at der i væsken dannes et hvidt stof. 6 På et tidspunkt kan du se at opløsningen får et svagt rødt skær, men farven forsvinder igen. Når væsken lige akkurat er svag rød hele tiden stopper du tilsætningen af sølvnitrat (din lærer viser dig, hvad du skal forstå ved en svag rød farve). 7 Aflæs på buretten, hvor meget sølvnitrat du har tilsat. 8 Resultatet indføres i resultatskemaet. 9 Forsøget gentages med 2%, 3% og 4% saltopløsninger. 10 Udtag nu 2,00 ml af den ukendte opløsning, og gentag titreringen til du ser den svage røde farve. 11 Aflæs på buretten, hvor meget sølvnitrat du har tilsat. Indfør resultatet i resultatskemaet. 12 Du udveksler resultater med to andre hold. Resultater: Saltopløsning ml sølvnitrat ml sølvnitrat ml sølvnitrat ml sølvnitrat (gennemsnit) 1% 2% 3% 4% Ukendt opløsning Resultatbehandling: 1 Beregn gennemsnitsværdier af tilsat sølvnitrat. 2 I Microsoft Office Excel tegnes en graf med Saltindhold % som X-akse og Tilsat ml sølvnitrat som Y-akse. En sådan graf kaldes en standardkurve. 3 Bestem saltkoncentrationen i den ukendte opløsning, idet du ved hjælp af standardkurven finder den saltkoncentration, som svarer til det tilsatte volumen sølvnitrat. 4 Lav en liste over fejlkilder i forsøget. Opslag: 26 (titrering) Opslag: 38,39, 41 (resultatbehandling) NV2: Salt og saltvand Odense Katedralskole 2007 Side 14 af 20
15 Cellen Alle organismer består af én eller flere celler, som kan være forskellige i form og størrelse. Men den indre bygning af celler er ret ens. Plante- og dyreceller har 3 hovedkomponenter: 1) en cellemembran, der omgiver 2) cytoplasmaet med 3) cellekernen, der indeholder cellens arvemateriale. Dyrecelle: Plantecelle: 2. Cellevæg 3. Cellemembran 5. Kloroplast (Grønkorn) 8. Fedtdråber 9. Kerne 10. Kernemembran 11. Mikrotubuli ( skelet ) 13. Mitokondrie 14. Glykogen 15. Endoplasmatisk retikulum med ribosomer 16. Lysosomer 17. Kernepore 18. Kernelegeme 19. Ribosomer 21. Golgiapparat 22. Centrioler Cellemembran: Afgrænser cellen. Den er gennemtrængelig for nogle stoffer, mens andre stoffer har vanskeligt eller slet ikke kan passere den. Man siger at cellemembranen er halvgennemtrængelig (semipermeabel). Cellemembranen tillader cellen at opretholde et indre cellemiljø, som er forskelligt fra omgivelserne. Det er stoffernes størrelse, ladning og opløselighed i fedt/vand, som bestemmer deres evne til at trænge gennem membranen. Transport gennem cellemembranen: Transporten kan ske på to forskellige måder, nemlig passiv transport og aktiv transport (energikrævende). Ilt, vand og kuldioxid kan frit bevæge sig gennem membranen ved diffusion. Diffusionen drives af molekylernes egenbevægelse. Disse bevægelser betyder, at molekylerne vil spredes fra steder med høj koncentration til steder med lav koncentration (de vil søge at fordele sig jævnt). Bevægelserne foregår uden forbrug af energi. Processen kaldes passiv transport. Osmose er en form for diffusion hvor kun vand, men ikke andre stoffer, passerer en halvgennemtrængelig (semipermeabel) membran. Vandet vil søge fra den side, hvor det har højest koncentration mod den side, hvor vandets koncentration er lavere. De opløste stoffer som ikke kan passere, fx salt, forbliver hvor de er. Det betyder, at vand vil»suges«over i en saltopløsning, hvor koncentrationen af vandmolekyler jo er mindre end i rent vand. Osmose er ligesom anden diffusion en passiv transport. Da cellemembranen er en halvgennemtrængelig membran, er denne proces særdeles vigtig, når cellens vand- og saltkoncentration skal reguleres. NV2: Salt og saltvand Odense Katedralskole 2007 Side 15 af 20
16 Cytoplasma med kerne: Alle celler er væskefyldte. I denne væske svæver cellens strukturer. Forskellige molekyler har mulighed for at svømme rundt. Kerne: I kernen findes det arvelige materiale - kromosomerne (DNA). Kernemembran: Afgrænser kernen fra de øvrige strukturer i celle cytoplasma. Er gennemtrængelig for visse stoffer, ind og ud at kernen. Ribosomer: Cellens»proteinfabrikker. Proteinerne opbygges ud fra opbygningen af DNAmolekylerne. Endoplasmatisk reticulum (ER): Er et netværk af hulrum omgivet af membraner. ER sørger for at stoffer transporteres rundt i cellen. Mitokondrier: Her frigives energi fra føden ved respiration: C 6 H 12 O 6 + 6O 2 6CO H 2 O + Energi Vakuoler: Hulrum omgivet at en membran. Kan indeholde affaldsstoffer, næringsstoffer eller andet. Kan flytte sig rundt i cellen. Planteceller adskiller sig fra dyreceller ved også at indeholde grønkorn (fotosyntese), samt ved at være omgivet af en stiv cellevæg (cellulosevæg). Osmose: Vands betydning for planter Vand er en meget væsentlig bestanddel af cellers cytoplasma. Vand er det opløsningsmiddel hvori næringsstoffer optages af planter, men det er også transport- og opløsningsmiddel for organiske og uorganiske forbindelser. Vand er afgørende for langt de fleste kemiske reaktioner i cellerne, idet alle reaktionerne foregår mellem stoffer opløst i vand. Vand indgår i stofskiftereaktionerne, og i fotosynteseprocessen er det vandmolekylet, der leverer brint til at reducere CO 2 og ilt i vandmolekyler oxideres til O 2 og frigøres. For planter der lever i vand er mangel på vand normalt ikke et stort problem men hos landlevende planter er tilgængeligheden af store mængder vand helt afgørende for planters funktion. En stor del af planternes vandindhold (helt op til 90 %) findes i cellernes vakuoler og er hermed afgørende for planternes saftspænding og for plantens form og struktur. Mangel på vand vil få mange planter uden andre støttestrukturer til at hænge slapt med blade og stængler. Uden vand vil planternes fotosyntese (og dermed stofproduktion) gå i stå. På meget varme dage betyder vandets store varmeledningsevne at planterne ikke overophedes. I områder med ringe nedbør er der næsten ingen plantevækst. En ørken er et ekstremt eksempel på områder uden vand og en regnskov et eksempel hvor mængden af vand er meget stor. Man skelner mellem to typer passive vandbevægelser i planter. Den ene er osmose, der defineres som vands bevægelse fra en opløsning med højere vandkoncentration til en opløsning med lavere, over en selektiv permeabel membran. Cellemembranen er et eksempel på en selektiv permeabel membran. Den tillader fri passage (diffusion) af vand, mens opløste stoffer enten slet ikke kan passere eller passerer meget langsomt. Diffusion er individuelle molekylers bevægelse afhængig af deres energiindhold. Den anden passive vandbevægelse kaldes imbibering og skyldes en rent fysisk adsorptiom af vand til f.eks. proteiner eller stivelse. Når f.eks. karsefrø svulmer, når man vander dem, skyldes det imbibering. De opsuger så meget vand at frøskallen sprænges, hvilket er forudsætningen for at frøet efterfølgende kan spire. NV2: Salt og saltvand Odense Katedralskole 2007 Side 16 af 20
17 Planter optager store mængder vand, men kun en meget lille del tilbageholdes i planten. For hver liter vand rødderne optager, anvendes 1 ml til kemiske reaktioner i plantens celler. 10 ml bruges til celleudvidelser og de resterende 89 ml afgives som vanddamp. Vandtabet erstattes ved vandoptagelse fra jorden gennem rødderne. Rodceller indeholder mere opløst stof, de har derfor en lavere vandkoncentration end koncentrationen af vand ude i jorden. Denne forskel fører til at vand grundet osmose trænger ind i rødderne. Oppe i lyset vil solvarmen medføre en fordampning dels fra bladenes celler i overfladen dels via de mange spalteåbninger som især på bladenes underside giver forbindelse til bladets indre. Derved vil en meget større overflade danne basis for en meget større fordamningsoverflade. De celler, der afgiver vand ved fordampning trækker vand fra nabocellerne. Derfra forplanter trækket sig fra bladets overflade videre ned gennem stænglen og helt ned til roden. Der er således en sammenhængende vandfase i planten. Årsagen, til at dette kan foregå, skyldes vandmolekylers store tiltrækningskraft og forklaringen er de intermolekylære hydrogenbindinger mellem vandmolekylerne. Fænomenet kaldes også kohæsion og er en årsag til at afskårne blomster bedre er i stand til at optage vand, hvis de skæres af under vand. Så undgår man dannelse af luft i stænglen, som vil reducere den sammenhængende vandfase og dermed vandoptagelsen. Opgave: Find på nettet en figur, der viser hvordan blade er opbygget. (evt. somme hjemmeopgave) Beskriv forskellen mellem over og underside af et blad. Hvordan er spalteåbninger opbygget og hvad er særligt karakteristisk ved cellerne sammenlignet med de omkringliggende celler? Redegør for spalteåbningernes funktion i bladet med hensyn til diffusion af H 2 O, O 2 og CO 2 I lys og under forhold med god vandforsyning er planternes spalteåbninger fuldt åbne og CO 2 fra den omgivende atmosfære diffunderer ind gennem spalteåbningerne, ind i cellerne, hvor de i grønkornene bindes i organisk stof ved fotosyntesen.. Samtidig diffunderer O 2, der dannes ved fotosyntesen, ud gennem spalteåbningerne. Vandmolekyler diffunderer samtidig ud fra det fugtige indre i bladet til den oftest tørre luft, der omgiver bladet. I mørke og under tørre forhold lukker bladenes spalteåbninger helt eller delvist. Hvis det er lyst og tørt er spalteåbningerne således lukkede og planten vil ikke kunne få tilført den nødvendige CO 2. Det medfører at plantens produktion af organisk stof falder, men planten reducerer sit vandtab. Vand er et meget godt opløsningsmiddel for ioner og mange organiske forbindelser.. Denne egenskab er vigtig for vandets funktion som transportmedium for næringssalte, sukkerstoffer og hormoner mellem de forskellige planteceller og mellem rødder, stængler og blade. Det er plantens store fordampning af vand fra bladene, der sikrer en stor vandoptagelse gennem rødderne, der igen sikrer en tilstrækkelig stor optagelse af ioner (næringssalte). Det er næringssalte der sikrer tilstedeværelse af de stoffer som skal optages for at planten kan danne andet end sukker. Der skal f.eks. dannes proteiner, som forudsætter optagelse af næringssalte med nitrogen. Opgave: Opskriv formler for næringssalte med nitrogen. Transporten af stoffer i landplanter foregår i et transportsystem bestående af særlige typer celler. Samlet kaldes transportsystemet ledningsvævet og består hovedsagelig af vedkar og sikar. Vedkar transporterer vand i planten. Vedkar er opbygget af døde celler, hvor kun cellevæggen er tilbage. Sikar transporterer vand med de sukkerstoffer, der dannes ved fotosyntesen, væk fra bladene til andre dele af planten, der har brug for stof og energi til vækst, f.eks. skudspidser og blomsterdannelse eller til oplagringsknolde (kartofler er et eksempel på sådanne oplagringsknolde) NV2: Salt og saltvand Odense Katedralskole 2007 Side 17 af 20
18 Endelig har vand meget stor betydning for planters varmebalance. Når vand fordamper skal der bruges energi. Der skal bruges 2,45kJ for at fordampe 1g vand. Men der skal kun bruges 0,42kJ for at opvarme 1g vand fra 0 C til 100 C. Så der skal altså bruges 6 gange så meget energi for at fordampe et gram vand, som der skal til for at opvarme et gram vand fra 0 C til 100 C. Hvis vi forestiller os et stor bøgetræ svarer fordampningen af vand fra træet til at opvarme 10 L vand fra 0 C til 100 C. Den store energi tages fra solens opvarmning af bladene. Resultatet af vandets fordampning resulterer således i en afkøling af bladene. Et enkelt bøgeblad indeholder kun vand til 50 minutters fordampning, så det er ikke nogen god ide, at flytte træer og buske, når der er blade på. Det er nemlig ikke nemt at undgå at beskadige rødderne ved processen. Den vandmængde der bruges for at levere elektroner til fotosyntesen er minimal i forhold til fordampningen. Opgave: Udregn hvor mange gram vand, der skal bruges til dannelse af 1g glukose Bestemmelse af vandfordampning fra potteplante (pelargonie) Materialer: To pelargonie potteplanter eller lignende, to store klare plastposer, tape, vægt. Fremgangsmåde: 1. Tag to forholdsvis ens pelargonie potteplanter. Sørg for at de er godt gennemvandede. 2. Den ene plante med potte anbringes i en stor klar plastpose, som lukkes med et stykke tape. Denne plante bruges til kontrolforsøget. 3. Den anden plantes potte anbringes i en stor klar plastpose og posen lukkes tæt omkring stammen med et stykke tape. 4. De to planter med plastposer vejes og resultatet noteres i nedenstående skema. 5. Planterne vejes dagligt gennem en uge og resultaterne noteres i nedenstående skema. 6. Lav en grafisk afbildning af vejeresultaterne. Kontrolforsøg. Plante og urtepotte i plastpose. Fordampningsforsøg. Urtepotte med jord i plastpose. NV2: Salt og saltvand Odense Katedralskole 2007 Side 18 af 20
19 Resultatskema Dato Tidspunkt Kontrolforsøg Fordampningsforsøg Fordampning Beregn fordampningen, som differencen mellem de daglige vejninger af de to planter Diskussion 1. Ved at anvende Excel tegnes tre grafer, som viser vægt af Kontrolforsøg, Fordampningsforsøg samt fordampningen (y-aksen) som funktion af tiden (x-aksen). 2. Er der tale om en lineær fordampning? (forklar hvordan du afgør dette) 3. Hvad er formålet med kontrolforsøget. 4. Vurder nøjagtighed af måleresultater. 5. Hvordan kan forsøget forbedres. Osmose i vandpest (demonstrationsforsøg): Formål: At undersøge hvilken indflydelse forskellige vandkoncentrationen har på cellerne i et blad af vandpest. Materialer: Frisk skudspids af Elodea, 5% NaCl-opløsning i pipetteflaske, demineraliseret vand, mikroskop koblet til TV-skærm, dækglas, objektglas, filterpapir, pipetter. Fremgangsmåde: 1 Anbring et blad fra skudspidsen af Elodea i en dråbe vand på et objektglas under et mikroskop som er koblet til en TV-skærm. Undersøg først under svag, dernæst under stærk forstørrelse særlig et område af bladet nær midterribben. 2 Tegn en typisk celle. Angiv cellevæg, cytoplasma, kerne og grønkorn 3 Anbring et lille stykke filtrerpapir langs kanten af dækglasset til opsugning af vandet. Tilsæt saltopløsning ved at anbringe en dråbe ved den modsatte kant af dækglasset. Kontroller at vandet bevæger sig ind under dækglasset, samtidig med at vandet fjernes fra den modsatte side. Iagttag virkningen på cellerne efter nogle få øjeblikke i saltopløsningen. 4 Tegn forskellige stadier. Prøv så v.h.a. filtrerpapir at fjerne saltopløsningen, og erstat den med demineraliseret vand 5 Sug med filtrerpapir 2-3 dråber vand igennem under dækglasset for at vaske det meste af saltvandet væk. Iagttag nu cellerne nogle minutter for at konstatere, om de vender tilbage til deres oprindelige udseende. Diskussion: 1 Hvilken vej vandrede vandet gennem cellemembranen, mens bladet lå i saltvand? Hvilke iagttagelser bygger du dit svar på? 2 I hvilken retning foregik vandets bruttobevægelse, mens bladet befandt sig i demineraliseret vand? Opslag 14: Mikroskopet NV2: Salt og saltvand Odense Katedralskole 2007 Side 19 af 20
20 Osmoseforsøg med kartofler Materialer: pommes frites-jern, store kartofler, salt, demineraliseret vand, bægerglas, kniv, lineal, vægt, køkkenrulle. Fremgangsmåde: 1 Med et pommes frites-jern deles nogle kartofler. 2 Hver gruppe skærer 2 kartoffelstykker ud med sidelængden 5 cm. 3 Den samlede masse af kartoffelstykkerne bestemmes. 4 Hver gruppe fremstiller én 200 ml saltopløsning med en koncentration som angivet i nedenstående skema (fordel saltopløsningerne mellem grupperne). Diskuter hvordan I laver saltopløsningerne mest præcise. 5 Kartoffelstykkerne anbringes i saltopløsningerne. 6 Bægerglassene overdækkes med plastfilm og stilles i køleskab et par dage, hvorefter de fiskes op og vejes efter en meget mild afdrypning på et stykke køkkenrulle. 7 Grupperne udveksler resultater. 8 Vægtforskellen bestemmes. Resultater: Saltkoncentration i procent Masse af kartoffelstykker Vægtforskel ved start g ved afslutning g absolut g procentvis Når saltkoncentrationen angives til 3 % menes der, at der at der er 3g salt pr. 100g vand. Resultatbehandling: Ved at anvende Excel tegnes en graf med vægtforskellen (y-aksen) som funktion af saltkoncentrationen (x-aksen). Tendenslinien indtegnes, og grafens skæring med x-aksen angives. Hvordan kan du ved hjælp af kurven bestemme saltkoncentrationen i kartoflen? Forklar nærmere. Lav nogle små tegninger af forsøget, og forklar resultater med dine egne ord. Kan du med kendskab til ovenstående forsøgsresultater, skitsere en metode til at bestemme saltkoncentrationer i havvand? Brug din fantasi. Find en typisk plantecelle på nettet og sæt et billede af cellen ind i rapporten. Om vinteren spredes store mængder salt på veje og fortove. Hvilke problemer kan dette give træer og buske? NV2: Salt og saltvand Odense Katedralskole 2007 Side 20 af 20
Jernindhold i fødevarer bestemt ved spektrofotometri
 Bioteknologi 4, Tema 8 Forsøg www.nucleus.dk Linkadresserne fungerer pr. 1.7.2011. Forlaget tager forbehold for evt. ændringer i adresserne. Jernindhold i fødevarer bestemt ved spektrofotometri Formål
Bioteknologi 4, Tema 8 Forsøg www.nucleus.dk Linkadresserne fungerer pr. 1.7.2011. Forlaget tager forbehold for evt. ændringer i adresserne. Jernindhold i fødevarer bestemt ved spektrofotometri Formål
UNDERSØGELSE AF JORDRESPIRATION
 UNDERSØGELSE AF JORDRESPIRATION Formål 1. At bestemme omsætningen af organisk stof i jordbunden ved at måle respirationen med en kvantitative metode. 2. At undersøge respirationsstørrelsen på forskellige
UNDERSØGELSE AF JORDRESPIRATION Formål 1. At bestemme omsætningen af organisk stof i jordbunden ved at måle respirationen med en kvantitative metode. 2. At undersøge respirationsstørrelsen på forskellige
NV2: Salt og saltvand
 NV2: Salt og saltvand Modulfordeling 1b Modul Fag /lokale Delemne Materiale (*) Eksperimentelt 24/9 3.modul 27/9 2.modul 28/9 3.modul + 4.modul 1/10 3.modul 4/10 1.modul + 2.modul 11/10 1.modul 11/10 2.modul
NV2: Salt og saltvand Modulfordeling 1b Modul Fag /lokale Delemne Materiale (*) Eksperimentelt 24/9 3.modul 27/9 2.modul 28/9 3.modul + 4.modul 1/10 3.modul 4/10 1.modul + 2.modul 11/10 1.modul 11/10 2.modul
IONER OG SALTE. Et stabilt elektronsystem kan natrium- og chlor-atomerne også få, hvis de reagerer kemisk med hinanden:
 IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
IONER OG SALTE INDLEDNING Når vi i daglig tale bruger udtrykket salt, mener vi altid køkkensalt, hvis kemiske navn er natriumchlorid, NaCl. Der findes imidlertid mange andre kemiske forbindelser, som er
Projekt Vandløb 1p uge 43 og 44, 2012. Projekt Vandløb
 Projekt Vandløb Denne projektopgave markerer afslutningen på det fællesfaglige emne Vand. I skal enten individuelt eller i mindre grupper (max fire personer pr gruppe) skrive en rapport, som sammenfatter
Projekt Vandløb Denne projektopgave markerer afslutningen på det fællesfaglige emne Vand. I skal enten individuelt eller i mindre grupper (max fire personer pr gruppe) skrive en rapport, som sammenfatter
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse:
 Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
Det sure, det salte, det basiske Ny Prisma Fysik og kemi 9 - kapitel 1 Skole: Navn: Klasse: Opgave 1 Den kemiske formel for køkkensalt er NaCl. Her er en række udsagn om køkkensalt. Sæt kryds ved sandt
Oversigt med forklaring over forskellige begreber
 Oversigt med forklaring over forskellige begreber fra www.michaelfynsk.dk Til dette dokument tilhører en mappe med filer bl.a..exe-,.pdf- og.jpg-filer. Side 1 af 19 Indholdsfortegnelse Brintbinding (hydrogenbinding)
Oversigt med forklaring over forskellige begreber fra www.michaelfynsk.dk Til dette dokument tilhører en mappe med filer bl.a..exe-,.pdf- og.jpg-filer. Side 1 af 19 Indholdsfortegnelse Brintbinding (hydrogenbinding)
Salte, Syre og Baser
 Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
Salte, Syre og Baser Fysik/Kemi Rapport 4/10 2011 MO Af Lukas Rønnow Klarlund 9.y Indholdsfortegnelse: Formål s. 2 Salte og Ioner s. 3 Syrer og Baser s. 5 phværdi s. 5 Neutralisation s. 6 Kunklusion s.
KOSMOS. 7.1 Spaltning af sukker. Materialer MADENS KEMI KEMISKE STOFFER I MADEN DISACCHARIDER
 KEMISKE STOFFER I MADEN DISACCHARIDER 7.1 Spaltning af sukker I skal undersøge, hvordan sukker spaltes ved kontakt med en syre. Almindelig hvidt sukker er et disaccharid. Det kan spaltes i to monosaccharider:
KEMISKE STOFFER I MADEN DISACCHARIDER 7.1 Spaltning af sukker I skal undersøge, hvordan sukker spaltes ved kontakt med en syre. Almindelig hvidt sukker er et disaccharid. Det kan spaltes i to monosaccharider:
Isolering af DNA fra løg
 Isolering af DNA fra løg Formål: At afprøve en metode til isolering af DNA fra et levende væv. At anvende enzymer.. Indledning: Isolering af DNA fra celler er første trin i mange molekylærbiologiske undersøgelser.
Isolering af DNA fra løg Formål: At afprøve en metode til isolering af DNA fra et levende væv. At anvende enzymer.. Indledning: Isolering af DNA fra celler er første trin i mange molekylærbiologiske undersøgelser.
Kemiøvelse 2 1. Puffere
 Kemiøvelse 2 1 Puffere Øvelsens pædagogiske rammer Sammenhæng Denne øvelse er tilpasset kemiundervisningen på modul 3 ved bioanalytikeruddannelsen. Kemiundervisningen i dette modul indeholder blandt andet
Kemiøvelse 2 1 Puffere Øvelsens pædagogiske rammer Sammenhæng Denne øvelse er tilpasset kemiundervisningen på modul 3 ved bioanalytikeruddannelsen. Kemiundervisningen i dette modul indeholder blandt andet
Et fedtstofs iodtal. Problemstilling. Kapitel 2: Uorganisk kemi (iodometri) R 1 CH 2 O C R 2 O R 3. H + Br Br C C Br Br
 Et fedtstofs iodtal Kapitel 2: Uorganisk kemi (iodometri) Problemstilling Additionsreaktionen til dobbeltbindinger mellem -atomer, 8?7, kan vises ved addition af dibrom til et fedtstof. Reaktionen benyttes
Et fedtstofs iodtal Kapitel 2: Uorganisk kemi (iodometri) Problemstilling Additionsreaktionen til dobbeltbindinger mellem -atomer, 8?7, kan vises ved addition af dibrom til et fedtstof. Reaktionen benyttes
Gæringsprocessen ved fremstillingen af alkohol tager udgangspunkt i glukose molekylet (C
 Molekyler af alkohol Byg molekylerne af forskellige alkoholer, og tegn deres stregformler Byg alkoholmolekyler med 1, 2 og 3 C atomer og 1 OH gruppe. Tegn deres stregformler her og skriv navnet ved. Byg
Molekyler af alkohol Byg molekylerne af forskellige alkoholer, og tegn deres stregformler Byg alkoholmolekyler med 1, 2 og 3 C atomer og 1 OH gruppe. Tegn deres stregformler her og skriv navnet ved. Byg
Atomer er betegnelsen for de kemisk mindste dele af grundstofferne.
 Atomets opbygning Atomer er betegnelsen for de kemisk mindste dele af grundstofferne. Guldatomet (kemiske betegnelse: Au) er f.eks. det mindst stykke metal, der stadig bærer navnet guld, det kan ikke yderlige
Atomets opbygning Atomer er betegnelsen for de kemisk mindste dele af grundstofferne. Guldatomet (kemiske betegnelse: Au) er f.eks. det mindst stykke metal, der stadig bærer navnet guld, det kan ikke yderlige
Syrer, baser og salte
 Syrer, baser og salte Navn: Indholdsfortegnelse: Ion begrebet... 2 Ætsning af Mg bånd med forskellige opløsninger... 5 Elektrolyse af forskellige opløsninger... 7 Påvisning af ioner i forskellige opløsninger
Syrer, baser og salte Navn: Indholdsfortegnelse: Ion begrebet... 2 Ætsning af Mg bånd med forskellige opløsninger... 5 Elektrolyse af forskellige opløsninger... 7 Påvisning af ioner i forskellige opløsninger
Atomets bestanddele. Indledning. Atomer. Atomets bestanddele
 Atomets bestanddele Indledning Mennesket har i tusinder af år interesseret sig for, hvordan forskellige stoffer er sammensat I oldtiden mente man, at alle stoffer kunne deles i blot fire elementer eller
Atomets bestanddele Indledning Mennesket har i tusinder af år interesseret sig for, hvordan forskellige stoffer er sammensat I oldtiden mente man, at alle stoffer kunne deles i blot fire elementer eller
Exoterme og endoterme reaktioner (termometri)
 AKTIVITET 10 (FAG: KEMI) NB! Det er i denne øvelse ikke nødvendigt at udføre alle forsøgene. Vælg selv hvilke du/i vil udføre er du i tvivl så spørg. Hvis du er interesseret i at måle varmen i et af de
AKTIVITET 10 (FAG: KEMI) NB! Det er i denne øvelse ikke nødvendigt at udføre alle forsøgene. Vælg selv hvilke du/i vil udføre er du i tvivl så spørg. Hvis du er interesseret i at måle varmen i et af de
Øvelse 4.2 1/5 KemiForlaget
 KST G ERNÆRING Benthe Schou ØVELSE 4. Øvelse: Iodtal for fedtstoffer Indledning Et fedtstofs ernæringsmæssige sundhed bestemmes af hvilke fedtsyrer, der indgår i fedtstoffet. Fedtstoffets sundhed er stærkt
KST G ERNÆRING Benthe Schou ØVELSE 4. Øvelse: Iodtal for fedtstoffer Indledning Et fedtstofs ernæringsmæssige sundhed bestemmes af hvilke fedtsyrer, der indgår i fedtstoffet. Fedtstoffets sundhed er stærkt
Bestemmelse af koffein i cola
 Bestemmelse af koffein i cola 1,3,7-trimethylxanthine Koffein i læskedrikke Læs følgende links, hvor der blandt andet står nogle informationer om koffein og regler for hvor meget koffein, der må være i
Bestemmelse af koffein i cola 1,3,7-trimethylxanthine Koffein i læskedrikke Læs følgende links, hvor der blandt andet står nogle informationer om koffein og regler for hvor meget koffein, der må være i
Lineære sammenhænge. Udgave 2. 2009 Karsten Juul
 Lineære sammenhænge Udgave 2 y = 0,5x 2,5 2009 Karsten Juul Dette hæfte er en fortsættelse af hæftet "Variabelsammenhænge, 2. udgave 2009". Indhold 1. Lineære sammenhænge, ligning og graf... 1 2. Lineær
Lineære sammenhænge Udgave 2 y = 0,5x 2,5 2009 Karsten Juul Dette hæfte er en fortsættelse af hæftet "Variabelsammenhænge, 2. udgave 2009". Indhold 1. Lineære sammenhænge, ligning og graf... 1 2. Lineær
Biologisk rensning Fjern opløst organisk stof fra vand
 Spildevandscenter Avedøre Biologisk rensning Fjern opløst organisk stof fra vand Øvelse I Formål: På renseanlægget renses et mekanisk, biologisk og kemisk. I den biologiske rensning på renseanlægget benyttes
Spildevandscenter Avedøre Biologisk rensning Fjern opløst organisk stof fra vand Øvelse I Formål: På renseanlægget renses et mekanisk, biologisk og kemisk. I den biologiske rensning på renseanlægget benyttes
Undervisningsbeskrivelse for STX 2t Kemi C
 Undervisningsbeskrivelse for STX 2t Kemi C Termin Afslutning i juni skoleår 14/15 Institution Marie Kruses Skole Uddannelse Fag og niveau Lærer(e) Hold STX Kemi C Hasse Bonde Rasmussen 2t ke Denne undervisningsbeskrivelse
Undervisningsbeskrivelse for STX 2t Kemi C Termin Afslutning i juni skoleår 14/15 Institution Marie Kruses Skole Uddannelse Fag og niveau Lærer(e) Hold STX Kemi C Hasse Bonde Rasmussen 2t ke Denne undervisningsbeskrivelse
Fotosyntese og respiration
 Biologi Fotosyntese og respiration Kasper Angelo, Klasse 1.3, HTX Roskilde 16/12 2007 Formål Der uføres og analyseres nogle forsøg der kan besvare: Forbruger en grøn plante kuldioxid (CO 2), når den udsættes
Biologi Fotosyntese og respiration Kasper Angelo, Klasse 1.3, HTX Roskilde 16/12 2007 Formål Der uføres og analyseres nogle forsøg der kan besvare: Forbruger en grøn plante kuldioxid (CO 2), når den udsættes
Øvelser 10. KlasseCenter Vesthimmerland Kaj Mikkelsen
 Indholdsfortegnelse Indholdsfortegnelse... 1 Bygning af et glucosemolekyle... 2 Bygning af et poly- sakkarid.... 3 Påvisning af glukose (1)... 4 Påvisning af glucose (2)... 5 Påvisning af disakkarider....
Indholdsfortegnelse Indholdsfortegnelse... 1 Bygning af et glucosemolekyle... 2 Bygning af et poly- sakkarid.... 3 Påvisning af glukose (1)... 4 Påvisning af glucose (2)... 5 Påvisning af disakkarider....
Formål: At undersøge nogle egenskaber ved CO 2 (carbondioxid). 6 CO 2 + 6 H 2 O C 6 H 12 O 6 + 6 O 2
 ØVELSE 2.1 SMÅ FORSØG MED CO 2 At undersøge nogle egenskaber ved CO 2 (carbondioxid). Indledning: CO 2 er en vigtig gas. CO 2 (carbondioxid) er det molekyle, der er grundlaget for opbygningen af alle organiske
ØVELSE 2.1 SMÅ FORSØG MED CO 2 At undersøge nogle egenskaber ved CO 2 (carbondioxid). Indledning: CO 2 er en vigtig gas. CO 2 (carbondioxid) er det molekyle, der er grundlaget for opbygningen af alle organiske
Oliekemi - intro til organisk kemi. Fødevarekemi - organisk kemi - del af SO (Sundhed) Salte - Ioner, opløselighed, mængdeberegninger og blandinger.
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin August 2014-maj 2015 Institution Københavns tekniske Skole - Vibenhus Uddannelse Fag og niveau Lærer(e) Hold
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin August 2014-maj 2015 Institution Københavns tekniske Skole - Vibenhus Uddannelse Fag og niveau Lærer(e) Hold
Puffere. Øvelsens pædagogiske rammer. Sammenhæng. Formål. Arbejdsform: Evaluering
 1 Puffere Øvelsens pædagogiske rammer Sammenhæng Denne øvelse er tilpasset kemiundervisningen på modul 3 ved bioanalytikeruddannelsen. Kemiundervisningen i dette modul indeholder blandt andet syrebaseteori
1 Puffere Øvelsens pædagogiske rammer Sammenhæng Denne øvelse er tilpasset kemiundervisningen på modul 3 ved bioanalytikeruddannelsen. Kemiundervisningen i dette modul indeholder blandt andet syrebaseteori
Brugsvejledning for 7827.10 dialyseslange
 Brugsvejledning for 7827.10 dialyseslange 14.06.07 Aa 7827.10 1. Præsentation Dialyseslangen er 10 m lang og skal klippes i passende stykker og blødgøres med vand for at udføre forsøgene med osmose og
Brugsvejledning for 7827.10 dialyseslange 14.06.07 Aa 7827.10 1. Præsentation Dialyseslangen er 10 m lang og skal klippes i passende stykker og blødgøres med vand for at udføre forsøgene med osmose og
Lim mellem atomerne Ny Prisma Fysik og kemi 8. Skole: Navn: Klasse:
 Lim mellem atomerne Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: Opgave 1 Her ser du en modeltegning af et atom. Hvilket atom forestiller modellen? Der er 5 svarmuligheder. Sæt et kryds. Et oxygenatom
Lim mellem atomerne Ny Prisma Fysik og kemi 8 Skole: Navn: Klasse: Opgave 1 Her ser du en modeltegning af et atom. Hvilket atom forestiller modellen? Der er 5 svarmuligheder. Sæt et kryds. Et oxygenatom
Kapitel 3 Lineære sammenhænge
 Matematik C (må anvendes på Ørestad Gymnasium) Lineære sammenhænge Det sker tit, at man har flere variable, der beskriver en situation, og at der en sammenhæng mellem de variable. Enhver formel er faktisk
Matematik C (må anvendes på Ørestad Gymnasium) Lineære sammenhænge Det sker tit, at man har flere variable, der beskriver en situation, og at der en sammenhæng mellem de variable. Enhver formel er faktisk
Undervisningsbeskrivelse for STX 1m Kemi B
 Undervisningsbeskrivelse for STX 1m Kemi B Termin Afslutning i juni skoleår 14/15 Institution Marie Kruses Skole Uddannelse Fag og niveau Lærer(e) Hold STX Kemi B Hasse Bonde Rasmussen 1mKe Denne undervisningsbeskrivelse
Undervisningsbeskrivelse for STX 1m Kemi B Termin Afslutning i juni skoleår 14/15 Institution Marie Kruses Skole Uddannelse Fag og niveau Lærer(e) Hold STX Kemi B Hasse Bonde Rasmussen 1mKe Denne undervisningsbeskrivelse
1. BESTEMMELSE AF KRYSTALVAND I KRYSTALSODA
 1. BESTEMMELSE AF KRYSTALVAND I KRYSTALSODA Formålet med denne øvelse er at bestemme indholdet af krystalvand i krystalsoda, som har den kemiske formel Na 2 CO 3 xh 2 O. Teori: En del ionforbindelser (salte)
1. BESTEMMELSE AF KRYSTALVAND I KRYSTALSODA Formålet med denne øvelse er at bestemme indholdet af krystalvand i krystalsoda, som har den kemiske formel Na 2 CO 3 xh 2 O. Teori: En del ionforbindelser (salte)
Side 1 af 13. Undervisningsbeskrivelse. Stamoplysninger til brug ved prøver til gymnasiale uddannelser. Termin Aug juni 2019.
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug.2017- juni 2019 Institution Uddannelse Fag og niveau Lærer(e) Hold EUCVEST HTX Kemi B Nader Gry 1A kemi
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Aug.2017- juni 2019 Institution Uddannelse Fag og niveau Lærer(e) Hold EUCVEST HTX Kemi B Nader Gry 1A kemi
Undervisningsbeskrivelse for STX 1m Kemi B
 Undervisningsbeskrivelse for STX 1m Kemi B Termin Afslutning i juni skoleår 15/16 Institution Marie Kruses Skole Uddannelse Fag og niveau Lærer(e) Hold STX Kemi B Hasse Bonde Rasmussen 1mKe Denne undervisningsbeskrivelse
Undervisningsbeskrivelse for STX 1m Kemi B Termin Afslutning i juni skoleår 15/16 Institution Marie Kruses Skole Uddannelse Fag og niveau Lærer(e) Hold STX Kemi B Hasse Bonde Rasmussen 1mKe Denne undervisningsbeskrivelse
Kemiøvelse 2 C2.1. Puffere. Øvelsens pædagogiske rammer
 Kemiøvelse 2 C2.1 Puffere Øvelsens pædagogiske rammer Sammenhæng Denne øvelse er tilpasset kemiundervisningen på modul 3 ved bioanalytikeruddannelsen. Kemiundervisningen i dette modul indeholder blandt
Kemiøvelse 2 C2.1 Puffere Øvelsens pædagogiske rammer Sammenhæng Denne øvelse er tilpasset kemiundervisningen på modul 3 ved bioanalytikeruddannelsen. Kemiundervisningen i dette modul indeholder blandt
Densitet (også kendt som massefylde og vægtfylde) hvor
 Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
Nogle begreber: Densitet (også kendt som massefylde og vægtfylde) Molekylerne er tæt pakket: høj densitet Molekylerne er langt fra hinanden: lav densitet ρ = m V hvor ρ er densiteten m er massen Ver volumen
AFKØLING Forsøgskompendium
 AFKØLING Forsøgskompendium IBSE-forløb 2012 1 KULDEBLANDING Formålet med forsøget er at undersøge, hvorfor sneen smelter, når vi strøer salt. Og derefter at finde frysepunktet for forskellige væsker. Hvad
AFKØLING Forsøgskompendium IBSE-forløb 2012 1 KULDEBLANDING Formålet med forsøget er at undersøge, hvorfor sneen smelter, når vi strøer salt. Og derefter at finde frysepunktet for forskellige væsker. Hvad
Kvantitativ bestemmelse af reducerende sukker (glukose)
 Kvantitativ bestemmelse af reducerende sukker (glukose) Baggrund: Det viser sig at en del af de sukkerarter vi indtager med vores mad er hvad man i fagsproget kalder reducerende sukkerarter. Disse vil
Kvantitativ bestemmelse af reducerende sukker (glukose) Baggrund: Det viser sig at en del af de sukkerarter vi indtager med vores mad er hvad man i fagsproget kalder reducerende sukkerarter. Disse vil
Torben Rosenørn. Aalborg Universitet. Campus Esbjerg
 Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
Torben Rosenørn Aalborg Universitet Campus Esbjerg 1 Definition af syrer En syre er et stof som kan fraspalte en proton (H + ). H + optræder i vand sammen med et vandmolekyle (H 2 O) som H 3 O + Syrer
Banan DNA 1/6. Formål: Formålet med øvelsen er at give eleverne mulighed for at se DNA strenge med det blotte øje.
 Banan DNA Formål: Formålet med øvelsen er at give eleverne mulighed for at se DNA strenge med det blotte øje. Baggrundsviden: Om vi er mennesker, dyr eller planter, så har alle organismer DNA i deres celler.
Banan DNA Formål: Formålet med øvelsen er at give eleverne mulighed for at se DNA strenge med det blotte øje. Baggrundsviden: Om vi er mennesker, dyr eller planter, så har alle organismer DNA i deres celler.
Alkohol Ingrid Jespersens Gymnasieskole 2007
 Alkohol Ingrid Jespersens Gymnasieskole 007 Ethanols fysiske egenskaber Kogepunkt 78,5 o C På side 8 i Alkohol også vises Frysepunkt -114, o C opskriften på et forsøg til bestemmelse af Massefylde 0,789
Alkohol Ingrid Jespersens Gymnasieskole 007 Ethanols fysiske egenskaber Kogepunkt 78,5 o C På side 8 i Alkohol også vises Frysepunkt -114, o C opskriften på et forsøg til bestemmelse af Massefylde 0,789
Forsæbning af kakaosmør
 Side: 1/10 Forsæbning af kakaosmør Forfattere: Lone Berg Redaktør: Thomas Brahe Faglige temaer: Kompetenceområder: Introduktion: Formålet med denne øvelse er at bestemme kakaosmørs gennemsnitlige molare
Side: 1/10 Forsæbning af kakaosmør Forfattere: Lone Berg Redaktør: Thomas Brahe Faglige temaer: Kompetenceområder: Introduktion: Formålet med denne øvelse er at bestemme kakaosmørs gennemsnitlige molare
4. Kulstofkredsløbet (CO 2
 4. Kulstofkredsløbet (CO 2 82 1. Fakta om kulstofkredsløb 2. Kulstof på jorden 3. Kulstofstrømmene 4. Tidsfaktoren i kulstofstrømmene 5. Forvitring og vulkanisme 6. Temperaturvariationer og klimaforandringer
4. Kulstofkredsløbet (CO 2 82 1. Fakta om kulstofkredsløb 2. Kulstof på jorden 3. Kulstofstrømmene 4. Tidsfaktoren i kulstofstrømmene 5. Forvitring og vulkanisme 6. Temperaturvariationer og klimaforandringer
Bilag til Kvantitativ bestemmelse af glucose
 Bilag til Kvantitativ bestemmelse af glucose Det synlige formål med øvelsen er at lære, hvorledes man helt præcist kan bestemme små mængder af glucose i en vandig opløsning ved hjælp af målepipetter, spektrofotometer
Bilag til Kvantitativ bestemmelse af glucose Det synlige formål med øvelsen er at lære, hvorledes man helt præcist kan bestemme små mængder af glucose i en vandig opløsning ved hjælp af målepipetter, spektrofotometer
Titel: OPLØSELIGHEDEN AF KOBBER(II)SULFAT. Litteratur: Klasse: Dato: Ark 1 af. Helge Mygind, Kemi 2000 A-niveau 1, s. 290-292 8/9-2008/OV
 Fag: KEMI Journal nr. Titel: OPLØSELIGHEDEN AF KOBBER(II)SULFAT Navn: Litteratur: Klasse: Dato: Ark 1 af Helge Mygind, Kemi 2000 A-niveau 1, s. 290-292 8/9-2008/OV Formålet er at bestemme opløseligheden
Fag: KEMI Journal nr. Titel: OPLØSELIGHEDEN AF KOBBER(II)SULFAT Navn: Litteratur: Klasse: Dato: Ark 1 af Helge Mygind, Kemi 2000 A-niveau 1, s. 290-292 8/9-2008/OV Formålet er at bestemme opløseligheden
Excel tutorial om lineær regression
 Excel tutorial om lineær regression I denne tutorial skal du lære at foretage lineær regression i Microsoft Excel 2007. Det forudsættes, at læseren har været igennem det indledende om lineære funktioner.
Excel tutorial om lineær regression I denne tutorial skal du lære at foretage lineær regression i Microsoft Excel 2007. Det forudsættes, at læseren har været igennem det indledende om lineære funktioner.
1st April 2014 Task A. Alt om olivenolie. - Svarark -
 1st April 2014 Task A Alt om olivenolie - Svarark - Country and Team No. Denmark Team: Name Signature Name Signature Name Signature OPGAVE A1: Undersøgelse af fordampning Biologi - Svarark (TOTAL MARKS
1st April 2014 Task A Alt om olivenolie - Svarark - Country and Team No. Denmark Team: Name Signature Name Signature Name Signature OPGAVE A1: Undersøgelse af fordampning Biologi - Svarark (TOTAL MARKS
Kemiforsøg til teorihæftet Kemisk binding og elektrolyse Forsøg 1.
 Forsøg 1. At undersøge forskellen på rene stoffer og blandinger. 500 ml. bægerglas Magnet Tragt Filterpapir Kniv Stearinlys Sand Jernfilspåner Snit stearinlyset i småstykker med kniven, og bland stearin,
Forsøg 1. At undersøge forskellen på rene stoffer og blandinger. 500 ml. bægerglas Magnet Tragt Filterpapir Kniv Stearinlys Sand Jernfilspåner Snit stearinlyset i småstykker med kniven, og bland stearin,
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Kemi Kulhydrater og protein
 Kemi Kulhydrater og protein Formål: Formålet med forsøget er at vise hvordan man kan påvise protein, fedtstof, simple sukkerarter eller stivelse i forskellige fødevarer. Samtidig kan man få en fornemmelse
Kemi Kulhydrater og protein Formål: Formålet med forsøget er at vise hvordan man kan påvise protein, fedtstof, simple sukkerarter eller stivelse i forskellige fødevarer. Samtidig kan man få en fornemmelse
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler
 Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
Atomer består af: elektroner (negativ ladning), protoner (positiv ladning) kernepartikler neutroner (neutrale). kernepartikler Antallet af protoner i atomkernen bestemmer navnet på atomet. Det uladede
1. OPVARMNING AF NATRIUMHYDROGENCARBONAT
 1. OPVARMNING AF NATRIUMHYDROGENCARBONAT At undersøge hvilken kemisk reaktion, der finder sted ved opvarmning af natriumhydrogencarbonat. Natriumhydrogencarbonat (natron) har formlen NaHCO 3 og er et fast
1. OPVARMNING AF NATRIUMHYDROGENCARBONAT At undersøge hvilken kemisk reaktion, der finder sted ved opvarmning af natriumhydrogencarbonat. Natriumhydrogencarbonat (natron) har formlen NaHCO 3 og er et fast
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin August 2016 Januar 2017 Institution Uddannelsescenter Ringkøbing-Skjern Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin August 2016 Januar 2017 Institution Uddannelsescenter Ringkøbing-Skjern Uddannelse Fag og niveau Lærer(e)
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin August 2012-maj 2013 Institution Københavns tekniske Skole - Vibenhus Uddannelse Fag og niveau Lærer(e) Hold
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin August 2012-maj 2013 Institution Københavns tekniske Skole - Vibenhus Uddannelse Fag og niveau Lærer(e) Hold
Selvsamlende enkeltlag elevvejledning
 Nano ScienceCenter,KøbenhavnsUniversitet Selvsamlende enkeltlag elevvejledning Fremstilling af enkeltlag på sølv Formål I dette forsøg skal du undersøge, hvordan vand hæfter til en overflade af henholdsvis
Nano ScienceCenter,KøbenhavnsUniversitet Selvsamlende enkeltlag elevvejledning Fremstilling af enkeltlag på sølv Formål I dette forsøg skal du undersøge, hvordan vand hæfter til en overflade af henholdsvis
1HWWRSULP USURGXNWLRQ
 3ODQWHI\VLRORJL,QWURGXNWLRQ 1HWWRSULP USURGXNWLRQ -RUGEXQGVW\SHUýðýQ ULQJVVDOWHýðýV YDQG Når en landmand høster sine afgrøder fjerner han samtidig mineraler og næringssalte fra markjorden. Det skyldes,
3ODQWHI\VLRORJL,QWURGXNWLRQ 1HWWRSULP USURGXNWLRQ -RUGEXQGVW\SHUýðýQ ULQJVVDOWHýðýV YDQG Når en landmand høster sine afgrøder fjerner han samtidig mineraler og næringssalte fra markjorden. Det skyldes,
Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på:
 1. Molekyler Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på: Elektronparbinding (= kovalent binding) Oktetreglen/ædelgasreglen Polaritet Hydrofile og hydrofobe grupper Navngivning af
1. Molekyler Redegør for opbygningen af uorganiske molekyler. Kom bl.a. ind på: Elektronparbinding (= kovalent binding) Oktetreglen/ædelgasreglen Polaritet Hydrofile og hydrofobe grupper Navngivning af
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin August 2011-maj 2013 Institution Københavns tekniske Skole - Vibenhus Uddannelse Fag og niveau Lærer(e) Hold
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin August 2011-maj 2013 Institution Københavns tekniske Skole - Vibenhus Uddannelse Fag og niveau Lærer(e) Hold
Roskilde Tekniske Gymnasium Klasse 2,5 Kemi Jonas Kalmark, Daniel Blankenstejner & Ticho Nielsen. Organisk kemi for dummies
 Organisk kemi for dummies 1 Indholdsfortegnelse Projektets formål:... 2 Målgruppe:... 4 Resume af interviewet:... 5 Teori:... 6 forsøg:... 6 Indledning:... 6 Materialer... 7 kalier:... 8 Fremgangs måde:...
Organisk kemi for dummies 1 Indholdsfortegnelse Projektets formål:... 2 Målgruppe:... 4 Resume af interviewet:... 5 Teori:... 6 forsøg:... 6 Indledning:... 6 Materialer... 7 kalier:... 8 Fremgangs måde:...
Kemiøvelser (til eleverne)
 Fra ressourceforbandelse til grøn omstilling Kemiøvelser (til eleverne) Udviklet af Kjeld Lundgaard, kemilærer på Ingrid Jespersens Gymasieskole 1. Eksperiment: Opløselighed af lithiumchlorid Formål: Bestemme
Fra ressourceforbandelse til grøn omstilling Kemiøvelser (til eleverne) Udviklet af Kjeld Lundgaard, kemilærer på Ingrid Jespersens Gymasieskole 1. Eksperiment: Opløselighed af lithiumchlorid Formål: Bestemme
Mundtlige eksamensopgaver
 Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
Mundtlige eksamensopgaver Kemi C 3ckecmh11308 Grundstoffer og det periodiske system Øvelse: Kobber + dibrom Spørgsmål 1 Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne er ordnet
Øvelse 2 Mest mættede olier
 Øvelse 2 Mest mættede olier Formål Formålet med denne øvelse er at foretage en kvalitativ undersøgelse af mængden af dobbeltbindinger i forskellige olier for at undersøge hvilke der er mest mættede. Teori
Øvelse 2 Mest mættede olier Formål Formålet med denne øvelse er at foretage en kvalitativ undersøgelse af mængden af dobbeltbindinger i forskellige olier for at undersøge hvilke der er mest mættede. Teori
Læringsmål i fysik - 9. Klasse
 Læringsmål i fysik - 9. Klasse Salte, syrer og baser Jeg ved salt er et stof der er opbygget af ioner. Jeg ved at Ioner i salt sidder i et fast mønster, et iongitter Jeg kan vise og forklare at salt, der
Læringsmål i fysik - 9. Klasse Salte, syrer og baser Jeg ved salt er et stof der er opbygget af ioner. Jeg ved at Ioner i salt sidder i et fast mønster, et iongitter Jeg kan vise og forklare at salt, der
UNDERVISNINGSMATERIALE - fra klasse (Udskolingen)
 UNDERVISNINGSMATERIALE - fra 7. - 9. klasse (Udskolingen) Lærervejledning Lærervejledning til Fra lokum til slam om spildevandsrensning Spildevandet er en del af vandets kredsløb og en væsentlig del af
UNDERVISNINGSMATERIALE - fra 7. - 9. klasse (Udskolingen) Lærervejledning Lærervejledning til Fra lokum til slam om spildevandsrensning Spildevandet er en del af vandets kredsløb og en væsentlig del af
Dialyse og carbamidanalyse
 C.12.1 Dialyse og carbamidanalyse Formål: Ved dialyse af en vandig opløsning af proteinet albumin og det lavmolekylære stof carbamid trænes forskellige laboratorieprocedurer (afpipettering, tidtagning,
C.12.1 Dialyse og carbamidanalyse Formål: Ved dialyse af en vandig opløsning af proteinet albumin og det lavmolekylære stof carbamid trænes forskellige laboratorieprocedurer (afpipettering, tidtagning,
2UJDQLVNHýVWRIJUXSSHUýLýSODQWHIU
 3ODQWHI\VLRORJL,QWURGXNWLRQ 2UJDQLVNHýVWRIJUXSSHUýLýSODQWHIU I et plantefrø findes bl.a. anlægget til en ny plante i form af det såkaldte kimanlæg. Dette anlæg skal kunne udvikle sig til en ny plante under
3ODQWHI\VLRORJL,QWURGXNWLRQ 2UJDQLVNHýVWRIJUXSSHUýLýSODQWHIU I et plantefrø findes bl.a. anlægget til en ny plante i form af det såkaldte kimanlæg. Dette anlæg skal kunne udvikle sig til en ny plante under
Lektion 7 Funktioner og koordinatsystemer
 Lektion 7 Funktioner og koordinatsystemer Brug af grafer og koordinatsystemer Lineære funktioner Andre funktioner lignnger med ubekendte Lektion 7 Side 1 Pris i kr Matematik på Åbent VUC Brug af grafer
Lektion 7 Funktioner og koordinatsystemer Brug af grafer og koordinatsystemer Lineære funktioner Andre funktioner lignnger med ubekendte Lektion 7 Side 1 Pris i kr Matematik på Åbent VUC Brug af grafer
Science Camp for folkeskole elever
 Science Camp for folkeskole elever Outbreak Folkeskoler Hvorfor er du som du er? Dine gener sladrer Nogle er rødhårede andre har sort hår, nogle har blå øjne andre har brune øjne, nogle kan ikke tåle mælk,
Science Camp for folkeskole elever Outbreak Folkeskoler Hvorfor er du som du er? Dine gener sladrer Nogle er rødhårede andre har sort hår, nogle har blå øjne andre har brune øjne, nogle kan ikke tåle mælk,
Hvor kommer energien fra?
 Hvor kommer energien fra? Energiomsætning i kroppen. Ved at arbejde med dette hæfte vil du få mulighed for: 1. At få en forståelse af omsætningen af energi i kroppen. 2. At opstille hypoteser og efterprøve
Hvor kommer energien fra? Energiomsætning i kroppen. Ved at arbejde med dette hæfte vil du få mulighed for: 1. At få en forståelse af omsætningen af energi i kroppen. 2. At opstille hypoteser og efterprøve
PÅVISNING AF FOTOSYNTESE & RESPIRATION ELEVER: CASPER, KEVIN & LARS-EMIL. LÆRER: CHRISTIAN KROMANN. Page 1
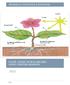 ELEVER: CASPER, KEVIN & LARS-EMIL. LÆRER: CHRISTIAN KROMANN 2012 Page 1 Teori: Når man snakker om planter så er det primært om det at de producere O 2 altså ilt. Det gør de via Fotosyntesen 6 CO 2 + 6
ELEVER: CASPER, KEVIN & LARS-EMIL. LÆRER: CHRISTIAN KROMANN 2012 Page 1 Teori: Når man snakker om planter så er det primært om det at de producere O 2 altså ilt. Det gør de via Fotosyntesen 6 CO 2 + 6
7 QNL 2PYHQGWSURSRUWLRQDOLWHW +27I\VLN. 1 Intro I hvilket af de to glas er der mest plads til vand?: Hvorfor?:
 1 Intro I hvilket af de to glas er der mest plads til vand?: Hvorfor?: Angiv de variable: Check din forventning ved at hælde lige store mængder vand i to glas med henholdsvis store og små kugler. Hvor
1 Intro I hvilket af de to glas er der mest plads til vand?: Hvorfor?: Angiv de variable: Check din forventning ved at hælde lige store mængder vand i to glas med henholdsvis store og små kugler. Hvor
Opgave. Navn Kemi opgaver Klasse Side 1 af 7. Hvad kaldes elementarpartiklerne, angiv deres ladning
 Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Klasse Side 1 af 7 Opgave Hvad kaldes elementarpartiklerne, angiv deres ladning Hvilke elementærpartikler frastøder hinanden i kernen? Hvilke elementærpartikler indeholder kærnekræfter, som holder kernen
Er dit reaktionsskema afstemt? Dvs. undersøg for hvert grundstof, om der er lige mange atomer af grundstoffet før reaktionen som efter reaktionen.
 7.12 Bagning med hjortetaksalt I skal undersøge, hvilke egenskaber bagepulveret hjortetaksalt har. Hjortetaksalt bruges i bagværk som kiks, klejner, brunkager m.m. Saltet giver en sprødhed i bagværket.
7.12 Bagning med hjortetaksalt I skal undersøge, hvilke egenskaber bagepulveret hjortetaksalt har. Hjortetaksalt bruges i bagværk som kiks, klejner, brunkager m.m. Saltet giver en sprødhed i bagværket.
maj 2017 Kemi C 326
 Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Nedenstående eksamensspørgsmål vil kunne trækkes ved eksaminationen af kursisterne på holdet KeC326. Hvis censor har indsigelser mod spørgsmålene, så kan der forekomme ændringer. Spørgsmål 1 + Spørgsmål
Opgave 1.1 1 KemiForlaget
 Opgave 1.1 Byg et monosaccharid Kulhydrat-molekylerne består af tre forskellige atomer : arbon, (sorte); ydrogen, (hvide), og Oxygen,O (røde). 1. Lav en ring af 5 -atomer og et O-atom. 2. Byg en gruppe
Opgave 1.1 Byg et monosaccharid Kulhydrat-molekylerne består af tre forskellige atomer : arbon, (sorte); ydrogen, (hvide), og Oxygen,O (røde). 1. Lav en ring af 5 -atomer og et O-atom. 2. Byg en gruppe
) ( 75,5 ( -75,5 ) ( 95,4 ( -1 ) (, 1 1. Vand, saltvand og negativt tryk. 60 LMFK-bladet, nr. 4, september 2010. Matematik. Kemi
 Vand, saltvand og negativt tryk Jens Skak-Nielsen, Marselisborg Gymnasium I bogen Viden om Vand, redigeret af Inge Kaufmann og Søren Rud Keiding, vil jeg kommentere 2 bemærkninger i henholdsvis kapitel
Vand, saltvand og negativt tryk Jens Skak-Nielsen, Marselisborg Gymnasium I bogen Viden om Vand, redigeret af Inge Kaufmann og Søren Rud Keiding, vil jeg kommentere 2 bemærkninger i henholdsvis kapitel
Grundstoffer og det periodiske system
 Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Grundstoffer og det periodiske system Gør rede for atomets opbygning. Definer; atom, grundstof, isotop, molekyle, ion. Beskriv hvorfor de enkelte grundstoffer er placeret som de er i Det Periodiske System.
Erik Vestergaard 1. Opgaver. i Lineære. funktioner. og modeller
 Erik Vestergaard www.matematikfsik.dk Opgaver i Lineære funktioner og modeller Erik Vestergaard www.matematikfsik.dk Erik Vestergaard, Haderslev. www.matematikfsik.dk Teknik. Aflæse forskrift fra graf...
Erik Vestergaard www.matematikfsik.dk Opgaver i Lineære funktioner og modeller Erik Vestergaard www.matematikfsik.dk Erik Vestergaard, Haderslev. www.matematikfsik.dk Teknik. Aflæse forskrift fra graf...
9. Øvelse: Demonstration af osmose over en cellemembran
 1. Drikkevand 9. Øvelse: Demonstration af osmose over en cellemembran Teori I spildevandsrensning er det især mikroorganismer og encellede dyr der fjerner næringssaltene. For at sådanne mikroorganismer
1. Drikkevand 9. Øvelse: Demonstration af osmose over en cellemembran Teori I spildevandsrensning er det især mikroorganismer og encellede dyr der fjerner næringssaltene. For at sådanne mikroorganismer
Der hænger 4 lodder i et fælles hul på hver side af en vægtstang. Hvad kan du sige med hensyn til ligevægt?:
 1 At skabe ligevægt Der er flere måder hvorpå man med lodder som hænger i et fælles hul på hver sin side af en vægtstang kan få den til at balancere - at være i ligevægt. Prøv dig frem og angiv hvilke
1 At skabe ligevægt Der er flere måder hvorpå man med lodder som hænger i et fælles hul på hver sin side af en vægtstang kan få den til at balancere - at være i ligevægt. Prøv dig frem og angiv hvilke
Gasser. Præsentation: Niveau: 8. klasse. Varighed: 4 lektioner
 Gasser Niveau: 8. klasse Varighed: 4 lektioner Præsentation: Forløbet Gasser er placeret i fysik-kemifokus.dk 8. klasse, men det er muligt at arbejde med forløbet både i 7. og 8. klasse. Temaet består
Gasser Niveau: 8. klasse Varighed: 4 lektioner Præsentation: Forløbet Gasser er placeret i fysik-kemifokus.dk 8. klasse, men det er muligt at arbejde med forløbet både i 7. og 8. klasse. Temaet består
Kemiøvelse 2 C2.1. Puffere. Øvelsens pædagogiske rammer
 Kemiøvelse 2 C2.1 Puffere Øvelsens pædagogiske rammer Sammenhæng Denne øvelse er tilpasset kemiundervisningen på modul 3 ved bioanalytikeruddannelsen. Kemiundervisningen i dette modul indeholder blandt
Kemiøvelse 2 C2.1 Puffere Øvelsens pædagogiske rammer Sammenhæng Denne øvelse er tilpasset kemiundervisningen på modul 3 ved bioanalytikeruddannelsen. Kemiundervisningen i dette modul indeholder blandt
Spørgsmål 1 Den kemiske reaktion
 Spørgsmål 1 Den kemiske reaktion Du skal gennemgå eksperimentet Fyrfadslys inddrag gerne dine forsøgsresultater og vurder om de understøtter modellen reaktionskemaet. Du skal endvidere give eksempler på
Spørgsmål 1 Den kemiske reaktion Du skal gennemgå eksperimentet Fyrfadslys inddrag gerne dine forsøgsresultater og vurder om de understøtter modellen reaktionskemaet. Du skal endvidere give eksempler på
Til denne udfordring kan du eksperimentere med forsøg 4.2 i kemilokalet. Forsøg 4.2 handler om kuliltens påvirkning af kroppens blod.
 Gå op i røg Hvilke konsekvenser har rygning? Udfordringen Denne udfordring handler om nogle af de skader, der sker på kroppen, hvis man ryger. Du kan arbejde med, hvordan kulilten fra cigaretter påvirker
Gå op i røg Hvilke konsekvenser har rygning? Udfordringen Denne udfordring handler om nogle af de skader, der sker på kroppen, hvis man ryger. Du kan arbejde med, hvordan kulilten fra cigaretter påvirker
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin August 2016 Maj 2018 Institution Uddannelsescenter Ringkøbing-Skjern Uddannelse Fag og niveau Lærer(e) Hold
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin August 2016 Maj 2018 Institution Uddannelsescenter Ringkøbing-Skjern Uddannelse Fag og niveau Lærer(e) Hold
Bestem en jordprøves surhedsgrad, ph-værdien, med en Rapitest.
 Jordbundsanalyse ph Bestem en jordprøves surhedsgrad, ph-værdien, med en Rapitest 31 21 - Vejledning til Rapitest Læs vejledningen fra Rapitesten: Nu er det let at forbedre sin have med den nye Rapitest
Jordbundsanalyse ph Bestem en jordprøves surhedsgrad, ph-værdien, med en Rapitest 31 21 - Vejledning til Rapitest Læs vejledningen fra Rapitesten: Nu er det let at forbedre sin have med den nye Rapitest
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Termin hvori undervisningen afsluttes: Maj/juni 2021 (denne UVB dækker kun 1.g) Institution Uddannelse Fag
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Termin hvori undervisningen afsluttes: Maj/juni 2021 (denne UVB dækker kun 1.g) Institution Uddannelse Fag
Eksponentielle sammenhænge
 Eksponentielle sammenhænge Udgave 009 Karsten Juul Dette hæfte er en fortsættelse af hæftet "Lineære sammenhænge, udgave 009" Indhold 1 Eksponentielle sammenhænge, ligning og graf 1 Procent 7 3 Hvad fortæller
Eksponentielle sammenhænge Udgave 009 Karsten Juul Dette hæfte er en fortsættelse af hæftet "Lineære sammenhænge, udgave 009" Indhold 1 Eksponentielle sammenhænge, ligning og graf 1 Procent 7 3 Hvad fortæller
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse
 Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Eksamensspørgsmål Kemi C, 2017, Kec196 (NB). Med forbehold for censors godkendelse Da nogle har deltaget i laboratoriekursus i Aarhus og andre i Esbjerg, er der henvist til øvelser de to steder fra. Man
Kemiske bindinger. Præsentation: Niveau: 8. klasse. Varighed: 7 lektioner
 Kemiske bindinger Niveau: 8. klasse Varighed: 7 lektioner Præsentation: Forløbet Kemiske bindinger omhandler ionbindinger, kovalente bindinger, metalbindinger, polære kovalente bindinger, hydrogenbindinger
Kemiske bindinger Niveau: 8. klasse Varighed: 7 lektioner Præsentation: Forløbet Kemiske bindinger omhandler ionbindinger, kovalente bindinger, metalbindinger, polære kovalente bindinger, hydrogenbindinger
TEORETISKE MÅL FOR EMNET:
 TEORETISKE MÅL FOR EMNET: Kendskab til organiske forbindelser Kende alkoholen ethanol samt enkelte andre simple alkoholer Vide, hvad der kendetegner en alkohol Vide, hvordan alkoholprocenter beregnes;
TEORETISKE MÅL FOR EMNET: Kendskab til organiske forbindelser Kende alkoholen ethanol samt enkelte andre simple alkoholer Vide, hvad der kendetegner en alkohol Vide, hvordan alkoholprocenter beregnes;
Undervisningsbeskrivelse
 Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Termin hvori undervisningen afsluttes: maj-juni 2011 Københavns Tekniske
Undervisningsbeskrivelse Stamoplysninger til brug ved prøver til gymnasiale uddannelser Termin Institution Uddannelse Fag og niveau Termin hvori undervisningen afsluttes: maj-juni 2011 Københavns Tekniske
Eksamensopgaver. NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL
 Eksamensopgaver NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL Liste over eksamensøvelser 1. Opløsningsmidlers egenskaber 2. Fældningsreaktioner 3. Påvisning af proteiner 4. Fremstilling af
Eksamensopgaver NF Kemi C DER KAN OPSTÅ ÆNDRINGER I DE ENDELIGE SPØRGSMÅL Liste over eksamensøvelser 1. Opløsningsmidlers egenskaber 2. Fældningsreaktioner 3. Påvisning af proteiner 4. Fremstilling af
Graph brugermanual til matematik C
 Graph brugermanual til matematik C Forord Efterfølgende er en guide til programmet GRAPH. Programmet kan downloades gratis fra nettet og gemmes på computeren/et usb-stik. Det betyder, det også kan anvendes
Graph brugermanual til matematik C Forord Efterfølgende er en guide til programmet GRAPH. Programmet kan downloades gratis fra nettet og gemmes på computeren/et usb-stik. Det betyder, det også kan anvendes
Grundstoffer og det periodiske system
 Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
Spørgsmål 1 Grundstoffer og det periodiske system Øvelse: Hvilket salt i hvilken beholder Gør rede for inddelingen i grupper (hovedgrupperne) og perioder i det periodiske system. Kom herunder ind på opbygningen
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017
 EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
EKSAMENSSPØRGSMÅL Kemi C maj/juni 2017 Titler på eksamensspørgsmål 1. Grundstoffer og det periodiske system 2. Spændingsrækken 3. Elektronparbindinger 4. Bindingstyper 5. Saltes opløselighed i vand 6.
Hæld 25 ml NaOH(aq) op i et bægerglas. Observer væsken. Er den gennemsigtig? Hvilke ioner er der i ionsuppen?
 Fældningsreaktion (som erstatning for titrering af saltvand) Opløs 5 g CuSO 4 i 50 ml vand Opløses saltet? Følger det teorien? Hvilke ioner er der i ionsuppen? Hæld 25 ml NaOH(aq) op i et bægerglas. Observer
Fældningsreaktion (som erstatning for titrering af saltvand) Opløs 5 g CuSO 4 i 50 ml vand Opløses saltet? Følger det teorien? Hvilke ioner er der i ionsuppen? Hæld 25 ml NaOH(aq) op i et bægerglas. Observer
Task 1. Gær til hverdag og fest. DM i Science for 1.g Finale 2015 Onsdag 25.februar 2015 kl. 14-17.
 Task 1 Gær til hverdag og fest DM i Science for 1.g Finale 2015 Onsdag 25.februar 2015 kl. 14-17. Opgave 1: Opgave 2: Opgave 3: Opgave 4: 25 point 29 point 31 point 29 point Gær kan bruges til lidt af
Task 1 Gær til hverdag og fest DM i Science for 1.g Finale 2015 Onsdag 25.februar 2015 kl. 14-17. Opgave 1: Opgave 2: Opgave 3: Opgave 4: 25 point 29 point 31 point 29 point Gær kan bruges til lidt af
EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør. Spørgsmål 1. Grundstoffer og det periodiske system
 EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør Øvelse: Opløsningsmidlers egenskaber Spørgsmål 1 Grundstoffer og det periodiske system Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne
EKSAMENSSPØRGSMÅL Kemi C december 2016 Helsingør Øvelse: Opløsningsmidlers egenskaber Spørgsmål 1 Grundstoffer og det periodiske system Forklar hvordan et atom er opbygget og hvad isotoper er. Grundstofferne
Kemiøvelse 2 C2.1. Buffere. Øvelsens pædagogiske rammer
 Kemiøvelse 2 C2.1 Buffere Øvelsens pædagogiske rammer Sammenhæng Denne øvelse er tilpasset kemiundervisningen på modul 3 ved bioanalytikeruddannelsen. Kemiundervisningen i dette modul indeholder blandt
Kemiøvelse 2 C2.1 Buffere Øvelsens pædagogiske rammer Sammenhæng Denne øvelse er tilpasset kemiundervisningen på modul 3 ved bioanalytikeruddannelsen. Kemiundervisningen i dette modul indeholder blandt
